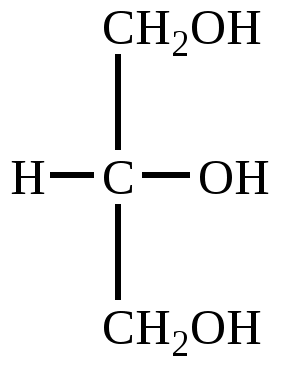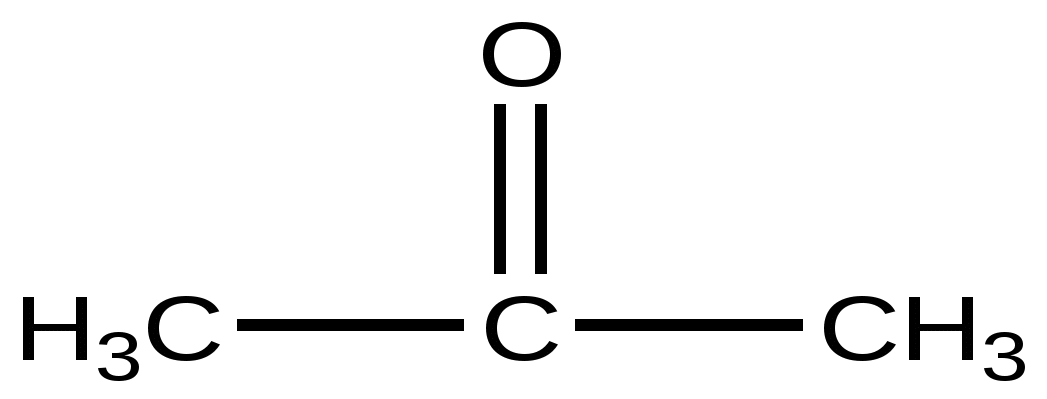Для проверки усвоения темы рекомендуем ответить на вопросы:
1. Какие химические изменения могут произойти с изделием из полиметилметакрилата при длительном нахождении его в кислой среде?
2. В процессе изготовления полимерной пломбы в зубе врач предложил пациенту надеть
на глаза светозащитные очки. Какой способ полимеризации был использован? Могла ли
находиться в составе композита для изготовления пломбы перекись бензоила? Объясните
роль этой добавки. Запишите реакцию полимеризации стирола с участием перекиси
бензоила.
В медицине долгое время применяли 6% водно-солевой раствор
поливинилпирролидона с низкой степенью полимеризации ( М 12 000 – 27 000 ) для детоксикации организма при отравлениях, инфекционных заболеваниях.
-Запишите формулу мономера N – винил -2-оксопиррола (N- винилпирролидона) и схему реакции полимеризации.
- Рассчитайте молекулярную массу мономера и определите степени полимеризации полимера по граничным величинам выше указанной молекулярной массы.
- Как вы думаете, может ли этот мономер или полимер образовать соль в кислой среде ?
4. Какая основная причина старения полимерных изделий из природного каучука? полистирола, полученного блочной полимеризацией?
5. В промышленности карбоксиэтилцеллюлозу получают взаимодействием целлюлозы с хлоруксусной кислотой. Запишите реакцию полной этерификации на примере фрагмента целлюлозы ( из двух остатков глюкозы). Какой образуется эфир: простой или сложный? Какой механизм этой реакции?
ПРИЛОЖЕНИЕ
ИСТОРИЧЕСКИЕ ДАТЫ ЗНАМЕНАТЕЛЬНЫХ ОТКРЫТИЙ В
БИООРГАНИЧЕСКОЙ ХИМИИ
( Х1Х и первая половина ХХ вв)
-
дата
|
Историческое событие
|
1811
|
К.С. Кирхгоф получил виноградный сахар( глюкозу) из крахмала
|
1815
|
Ж. Био установил существование 2лево» и « право»- вращающих растворов веществ
|
|
|
1815
|
Ф. Штромейер открыл качественную реакцию на крахмал с йодом
|
1820
|
Велер синтезировал щавелевую кислоту из неорганического соединения дициана
|
1860
|
Л. Пастер обобщил результаты исследований оптически активных веществ
|
1861
|
А.М. Бутлеров сформулировал теорию строения органических соединений
|
861
|
Й. Лошмидт предложил структурные графические формулы
|
1861
|
А.М. Бутлеров объяснил явление изомерии на основе теории строения органических соединений
|
1862
|
Э. Эрленмейер высказал идею о существовании двойной связи в этене, тройной в ацетилене
|
1864
|
А. Крум-Браун ввел изображение химических связей черточками
|
1865
|
Д.И.Менделеев заложил основу понятия « водородная связь». Изучая взаимодействие в системе « спирт- вода».
|
1862 - 1865
|
А. Кекуле предложил классификацию: « насыщенные»,
« ненасыщенные» « ароматические» соединения».
|
1866
|
М. Бертло осуществил синтез бензола тримеризацией ацетилена
|
1868
|
Г. Вихельхауз ввел понятие « валентность».
|
1868
|
К. Шерлеммер заключил, что все 4 валентности у углерода в метане равноценны
|
1869
|
В.В. Марковников развил представления о взаимодействии атомов в молекулах, сформировал правила о направлениях реакций присоединения, отщепления
|
1869
|
А. Ладенбург доказал равноценность всех атомов водорода в бензоле
|
1870
|
Ю. Либих предложил теорию действия ферментов
|
1870
|
Н. И. Любавин выдвинул теорию об аминокислотном строении белковэтене, тройной в ацетиленех, сформировал направление
|
1872
|
А. Кекуле изобразил молекулу бензола с тремя двойными связями.
|
1874
|
Я. Вант-Гофф и А. Ле Бель развили теорию о тетраэдрическом строении атома углерода в метане
|
1874
|
Я. Вант-Гофф сформулировал основные принципы кинетики химических реакций
|
1885
|
К. Лаар ввел понятие « таутомерия»
|
1886-7
|
В. Оствальд разработал теорию « кислотно- основного катализа»
|
1888
|
К. Оверс и В. Мейер предложили термин « стереохимия»
|
1889
|
С. Аррениус ввел понятие «энергия активация»
|
1890
|
Н.А. Меншуткин доказал влияние растворителя на скорость протекающей в нем химической реакции
|
1890
|
Э. Фишер разработал номенклатуру, классификацию и рациональные формулы углеводов
|
-
1892
|
На международном съезде в Женеве приняли номенклатуру органических соединений( женевская номенклатура)
|
1897
|
Дж. Томсон и независимо Э. Вихорт открыли электрон
|
1908
|
У. Рамзай высказал идею. Что электрон осуществляет связь между атомамиэтене, тройной в ацетиленех, сформировал направление
|
1908
|
И. Штарк выдвинул теорию химических связей в органических соединениях
|
1911
|
Г. Фрай предложил электронные формулы органических соединений
|
1913
|
М. боденштейн заложил основы теории цепных процессов
|
1915
|
И. Штарк ввел понятие « валентные электроны»
|
1916
|
Г. Льюис развил идею ковалентной химической связи
|
1920
|
Р. Герцог, В. Янке, М. Поляни впервые определили структуру органического вещества- целлюлозы- методом рентгеноструктурного анализа
|
1922
|
Р. Робинсон высказал идею об « электромерном» ( индуктивном) и
« мезомерном» механизмах смещения электронной плотности в органических молекулах
|
1922-3
|
И. Бренстед и Г. Льюис развили теорию кислот и оснований в приложении к органическим соединениям
|
1931
|
Э. Хюккель заложл основы квантовой химии органических соединений
|
1931
|
Ф. Хунд ввел понятия о σ - , π – связях в органических молекулах
|
1931
|
Э. Хюккель сформулировал правило ( 4п+ 2 ) для ароматических соединений
|
1932
|
Р. Малликен ввел понятие « молекулярная орбиталь».
|
1932
|
Л. Полинг предложил понятие «электроотрицательность» и шкалу э.о.
|
1933
|
Ч. Ингольд сформулировал принципы теории электронных смещений
|
1939
|
Р. Малликен ввел термин « сверхсопряжение» ( гиперконъюгация)
|
1941
|
И. Сваргольм предложил « молекулярные диаграммы» органических соединений - структурные формулы, в которых над атомами записаны знаки частичных зарядов
|
1947
|
Г. Шварценбах предложил метод определения енолов в кето-енольной смеси изомеров.
|
1951
|
Л. Полинг и Р Кори открыли вторичную структуру белка
|
1953
|
Ф. Крик и Дж. Уотсон открыли структуру ДНК- двойную спираль
|
2. СТРУКТУРНЫЕ ФОРМУЛЫ БИООРГАНИЧЕСКИХ СОЕДИНЕНИЙ
( по темам лекций)
Примечание: нижеприведенные структурные формулы биоактивных соединений не всегда отражают их истинное пространственное строение
СОПРЯЖЕННЫЕ СОЕДИНЕНИЯ
Сопряженные линейные соединения
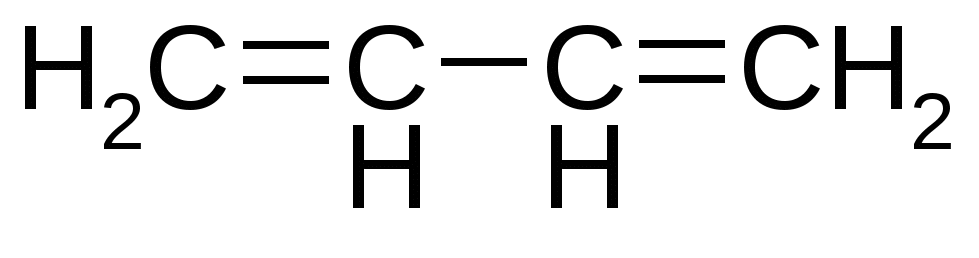
Бутадиен-1,3
|

2-Метилбутадиен-1,3 (изопрен)
|
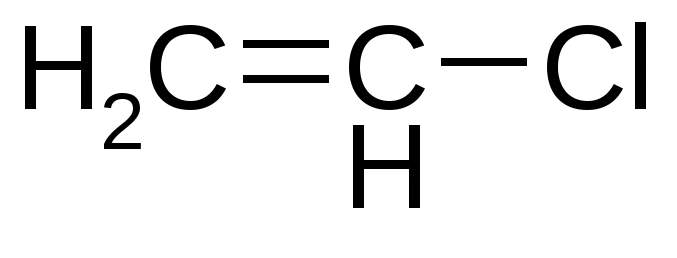
Хлорвинил
|
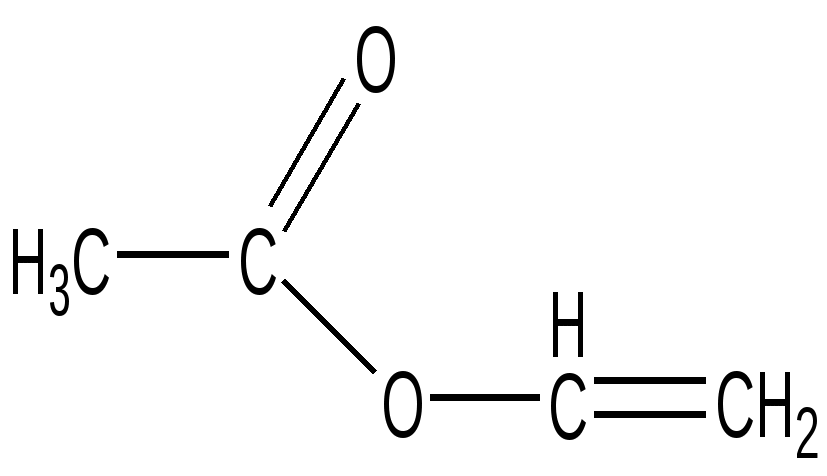
Винилацетат
|
Карбоциклические ароматические соединения

Бензол
|
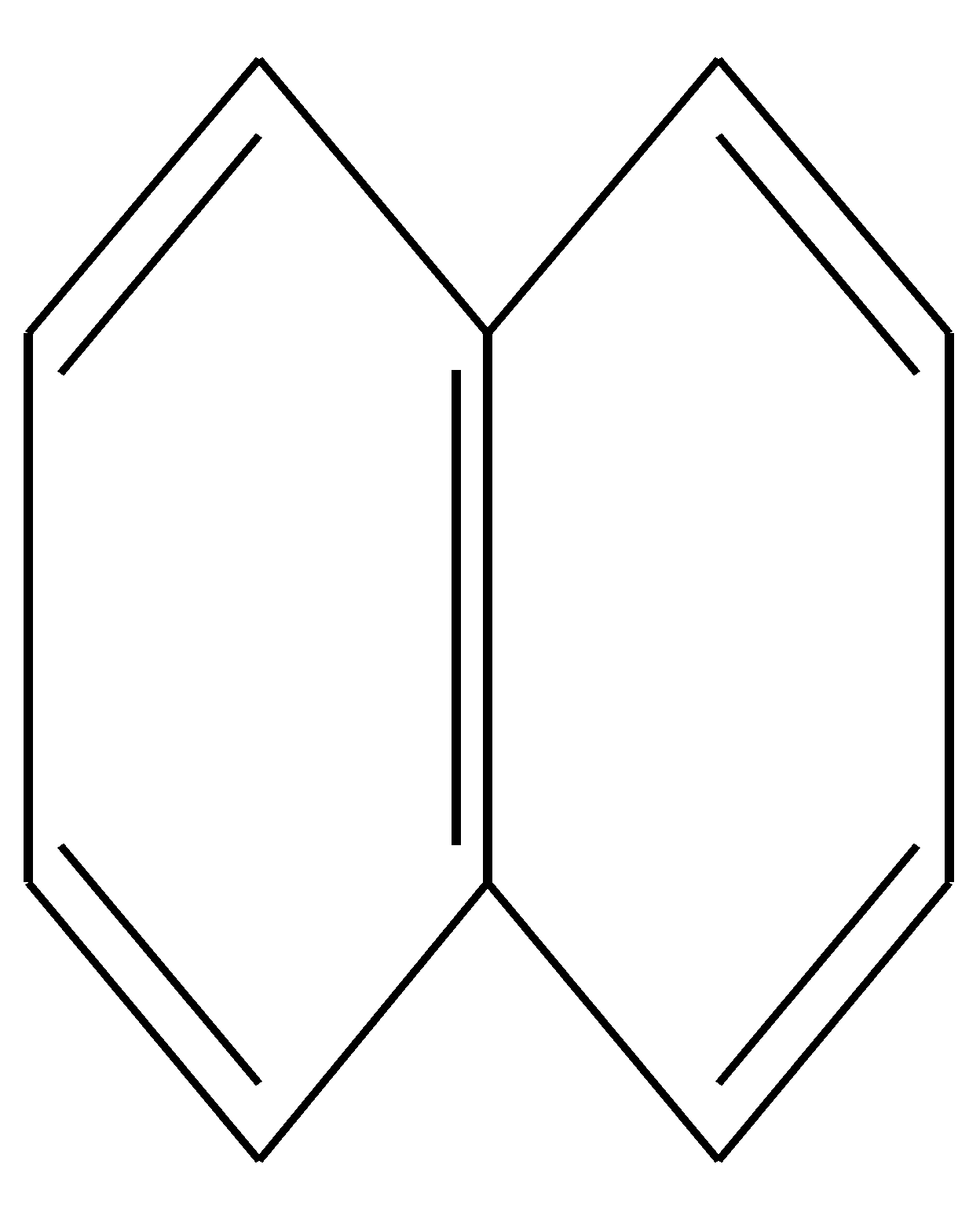
Нафталин
|
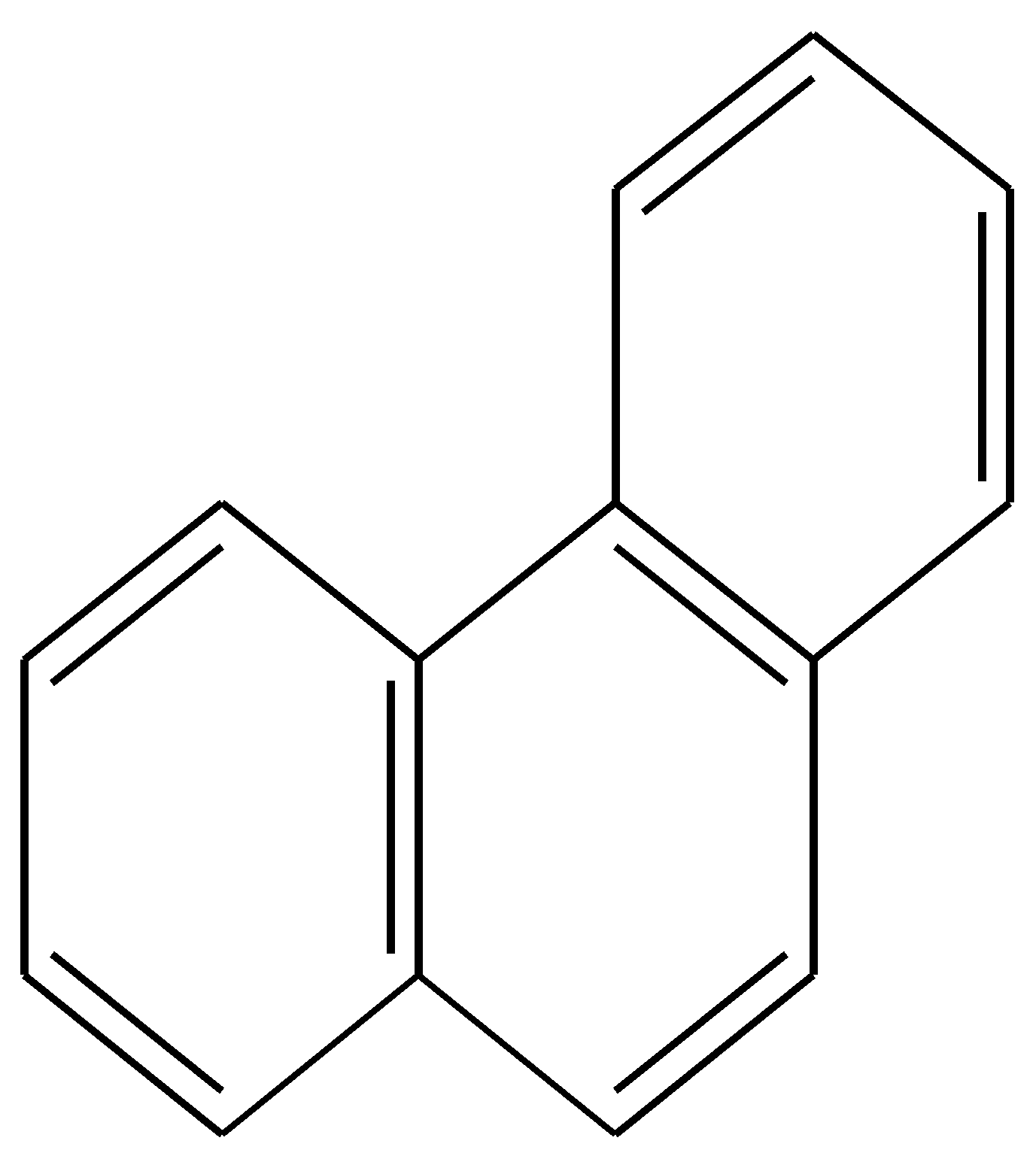
Фенантрен
|

Антрацен
|
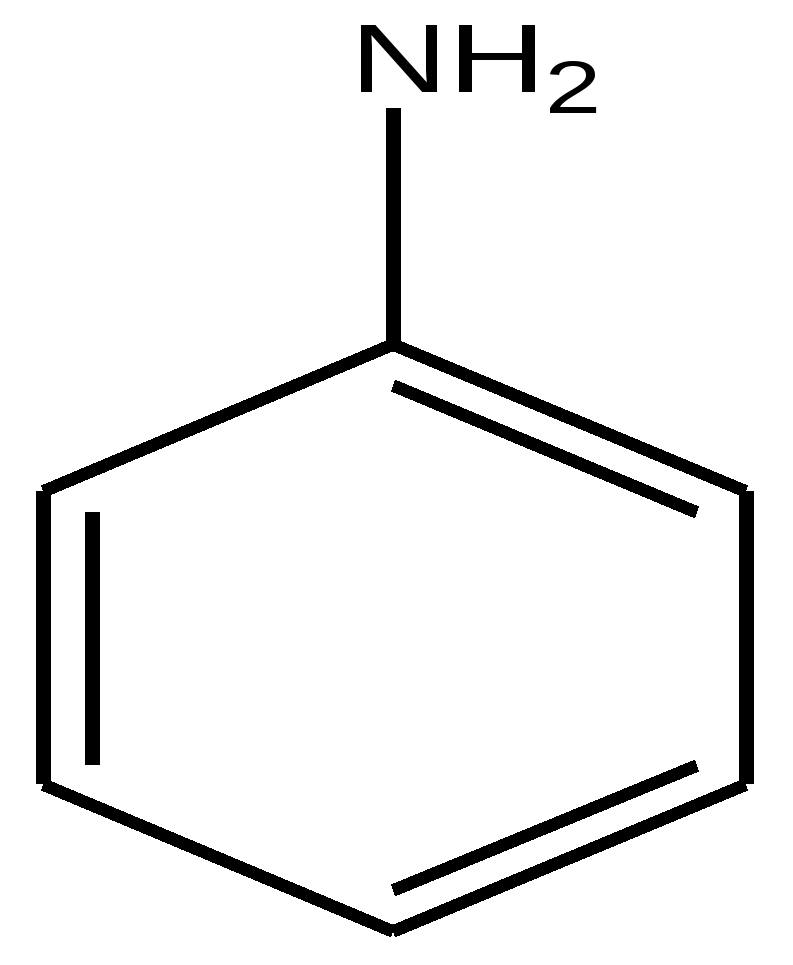
Анилин
|
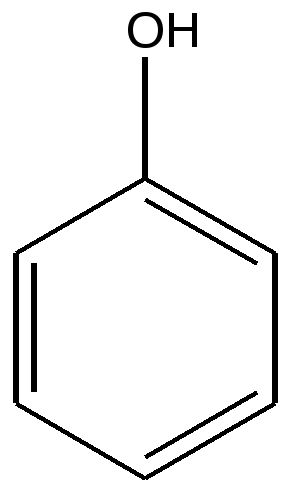
Фенол
|
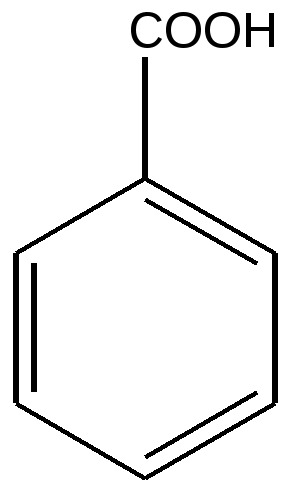
Бензойная кислота
|
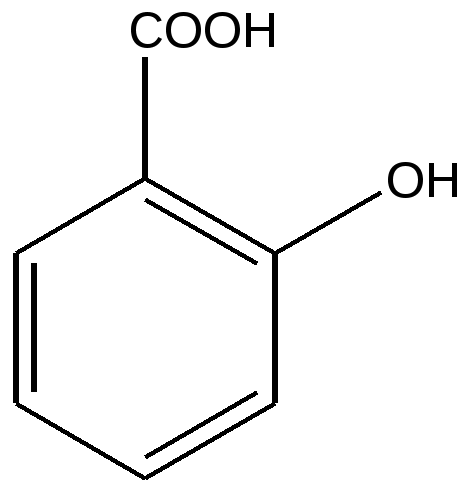
Салициловая кислота
|
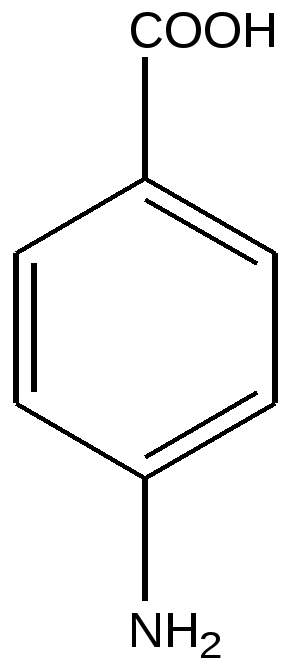
4-аминобензойная кислота
|
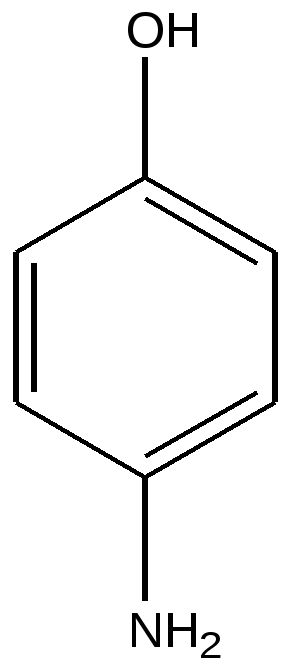
4-аминофенол
|
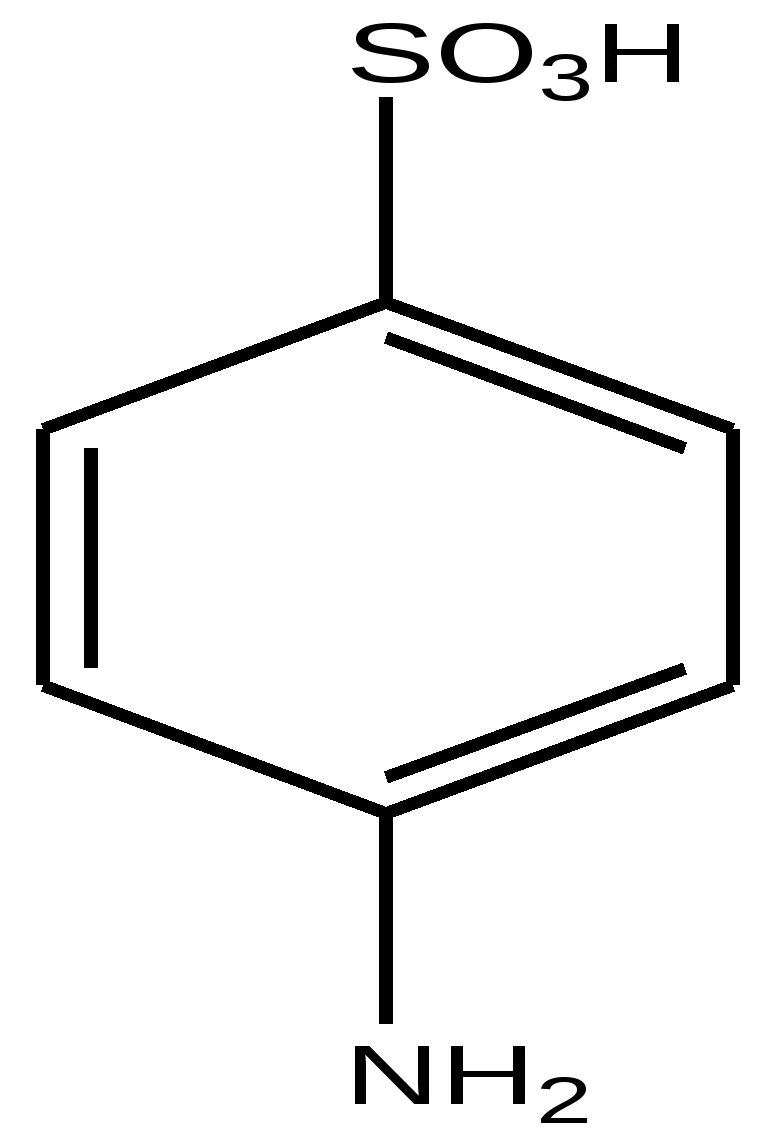
n-сульфаниловая кислота
|
|
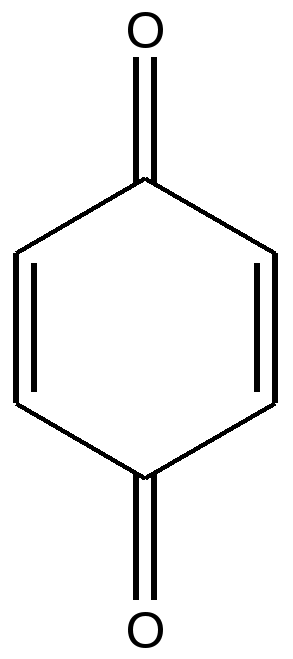
Хинон
|
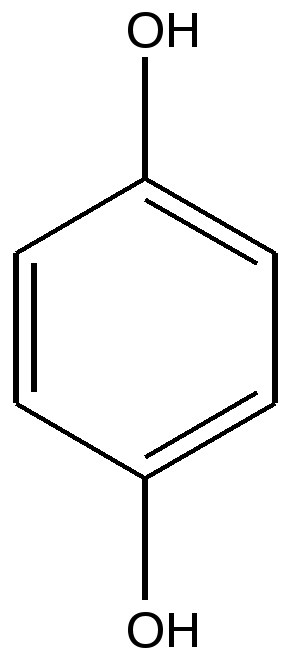
Гидрохинон
|
Гетероциклические ароматические соединения
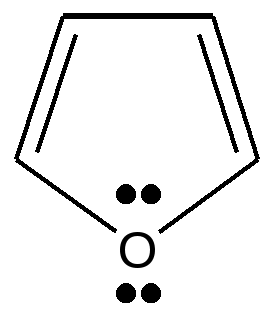
Фуран
|
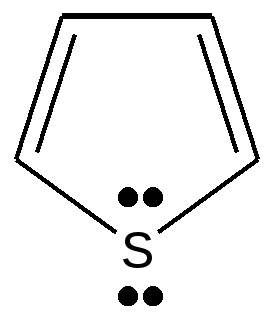
Тиофен
|
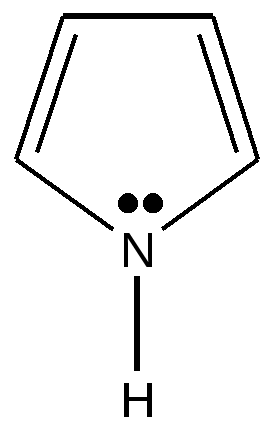
Пиррол
|
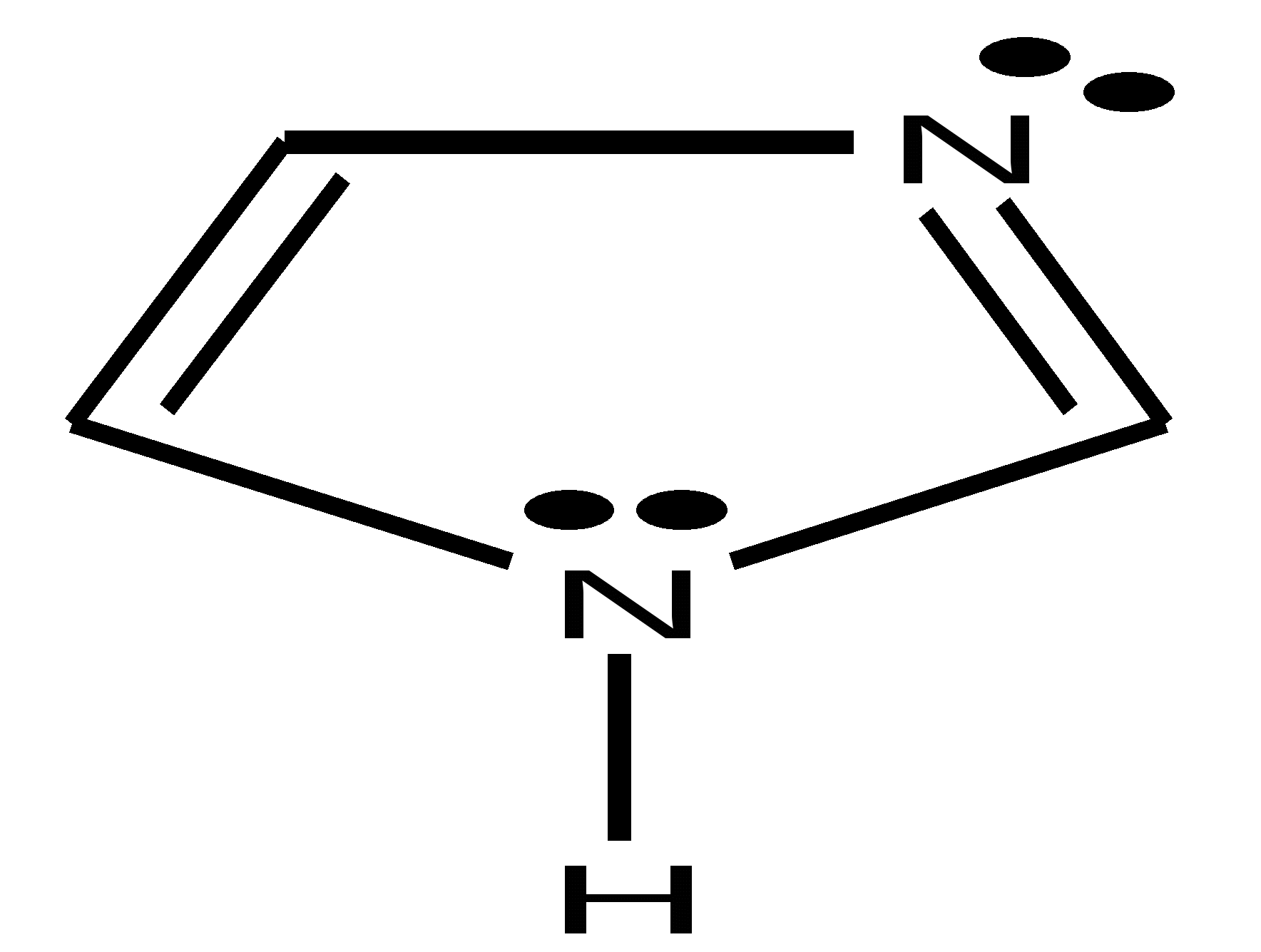
Имидазол
|
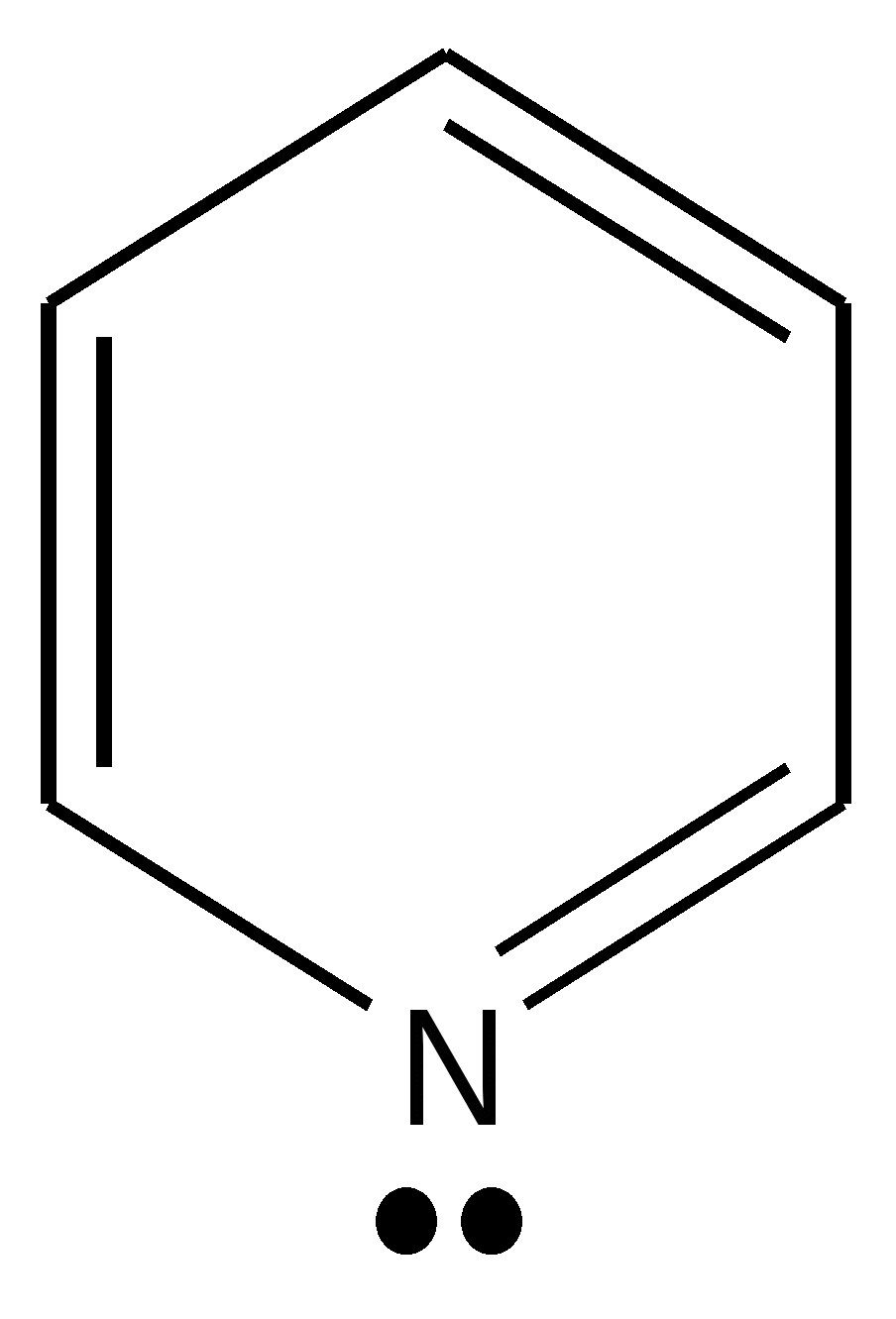
Пиридин
|
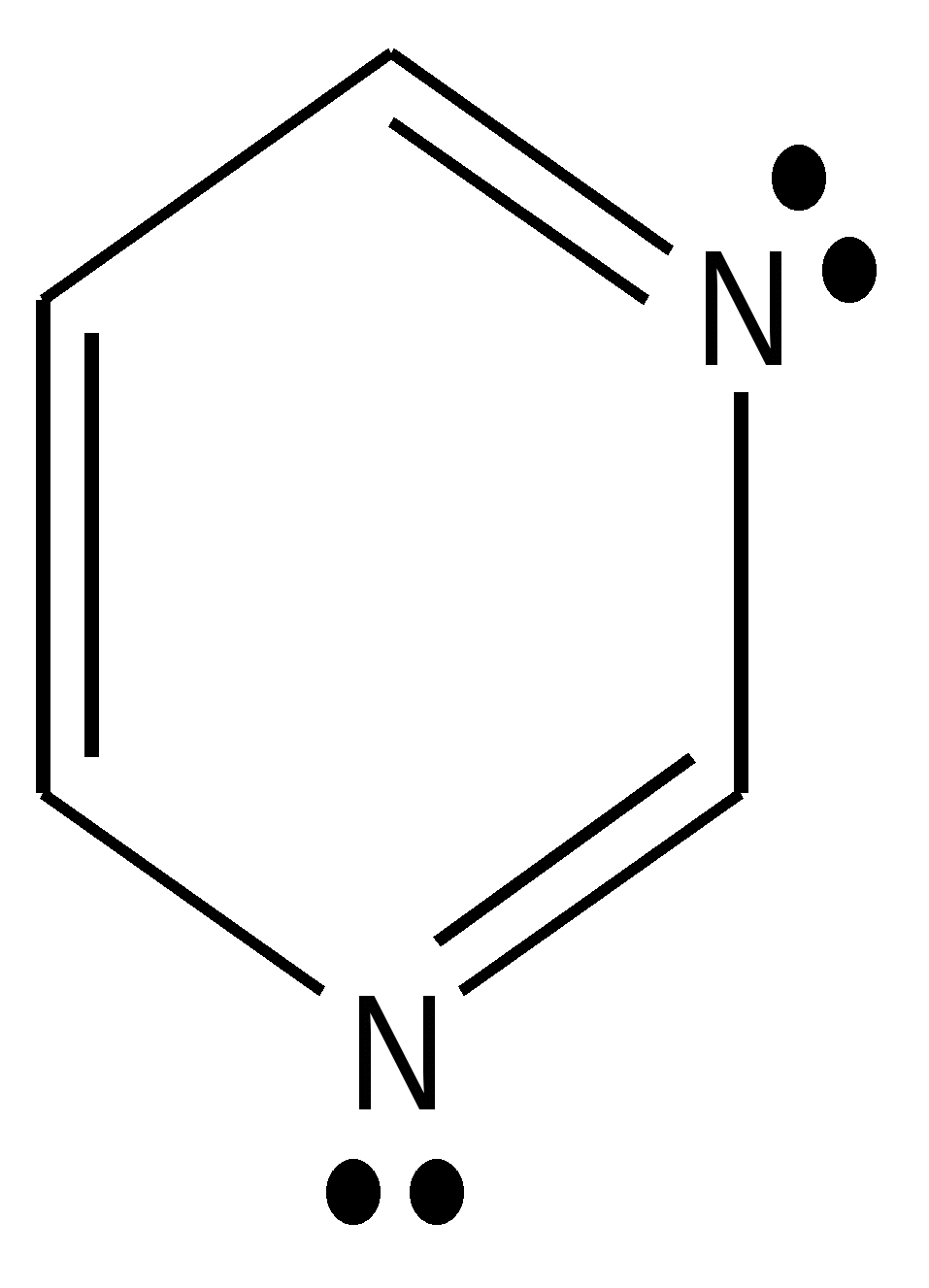
Пиримидин
|
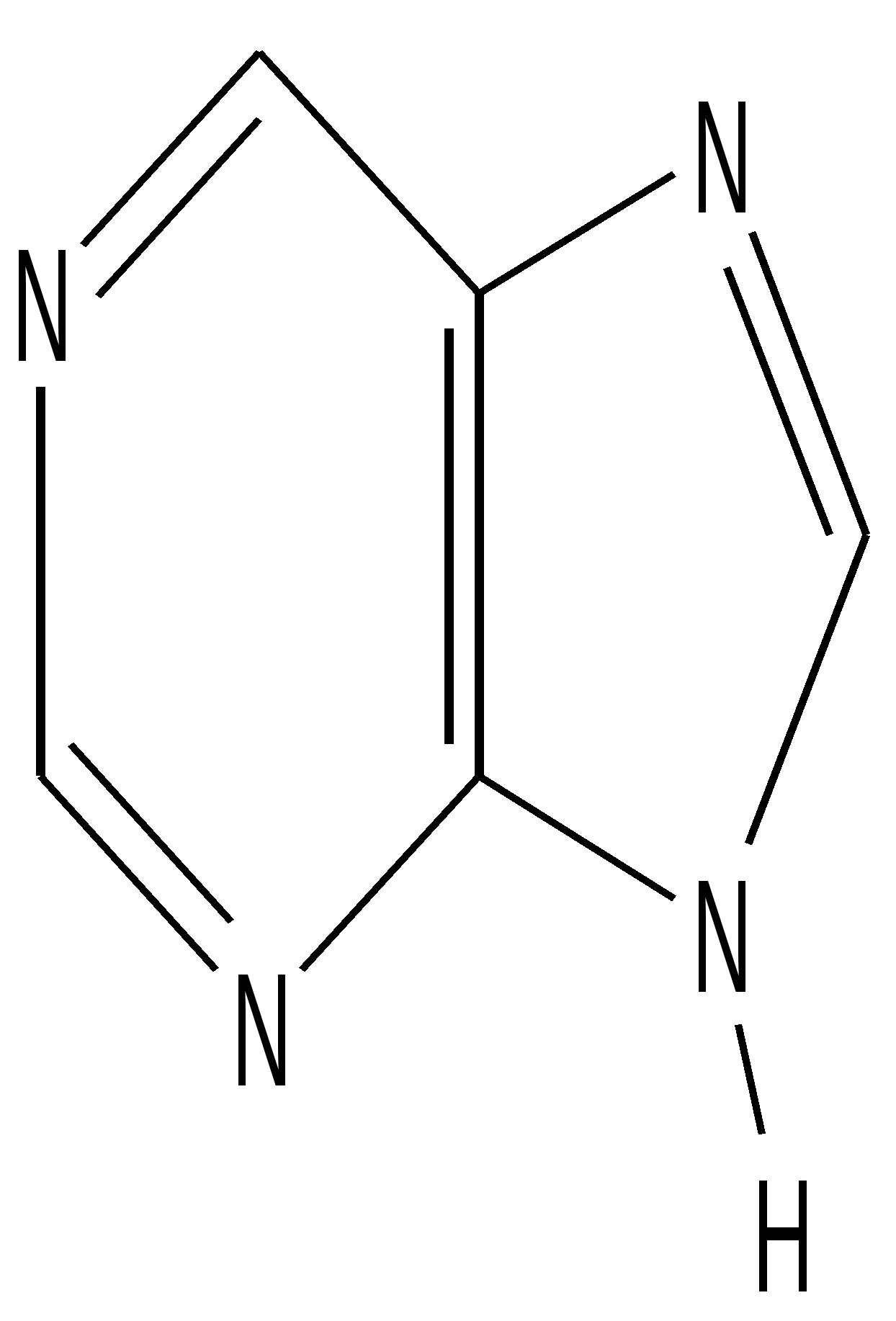
Пурин
|
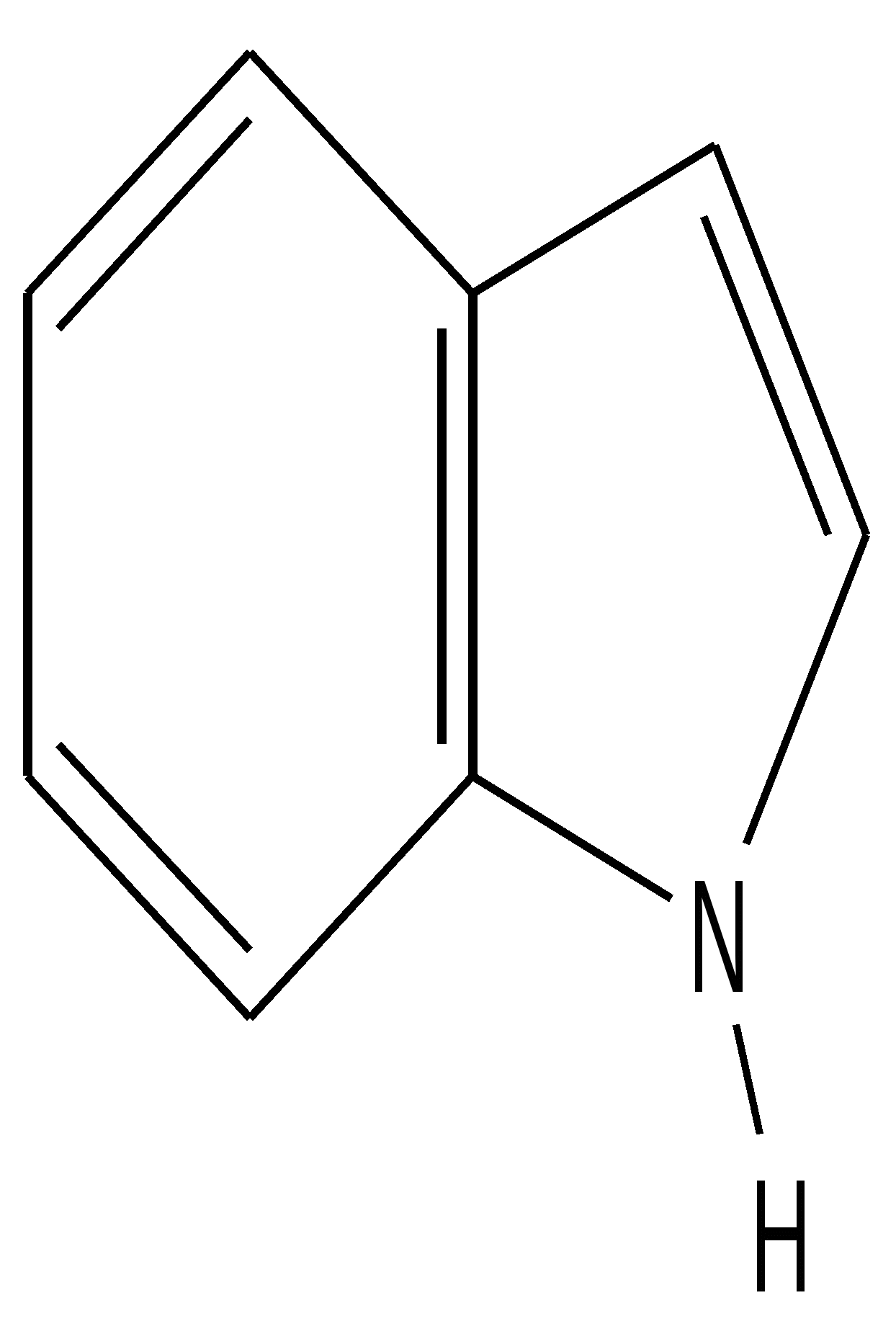
Индол
|
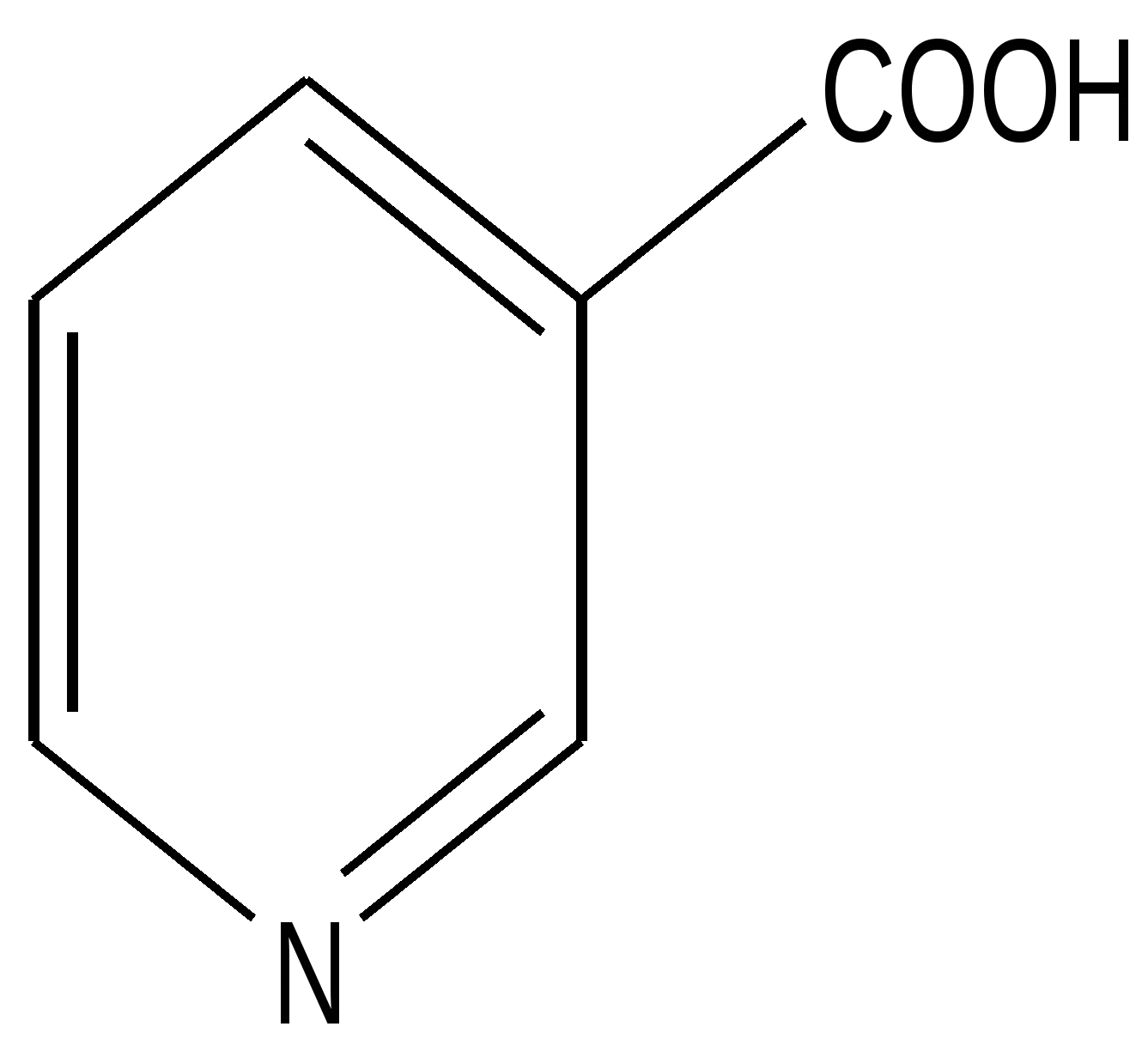
Никотиновая кислота
|
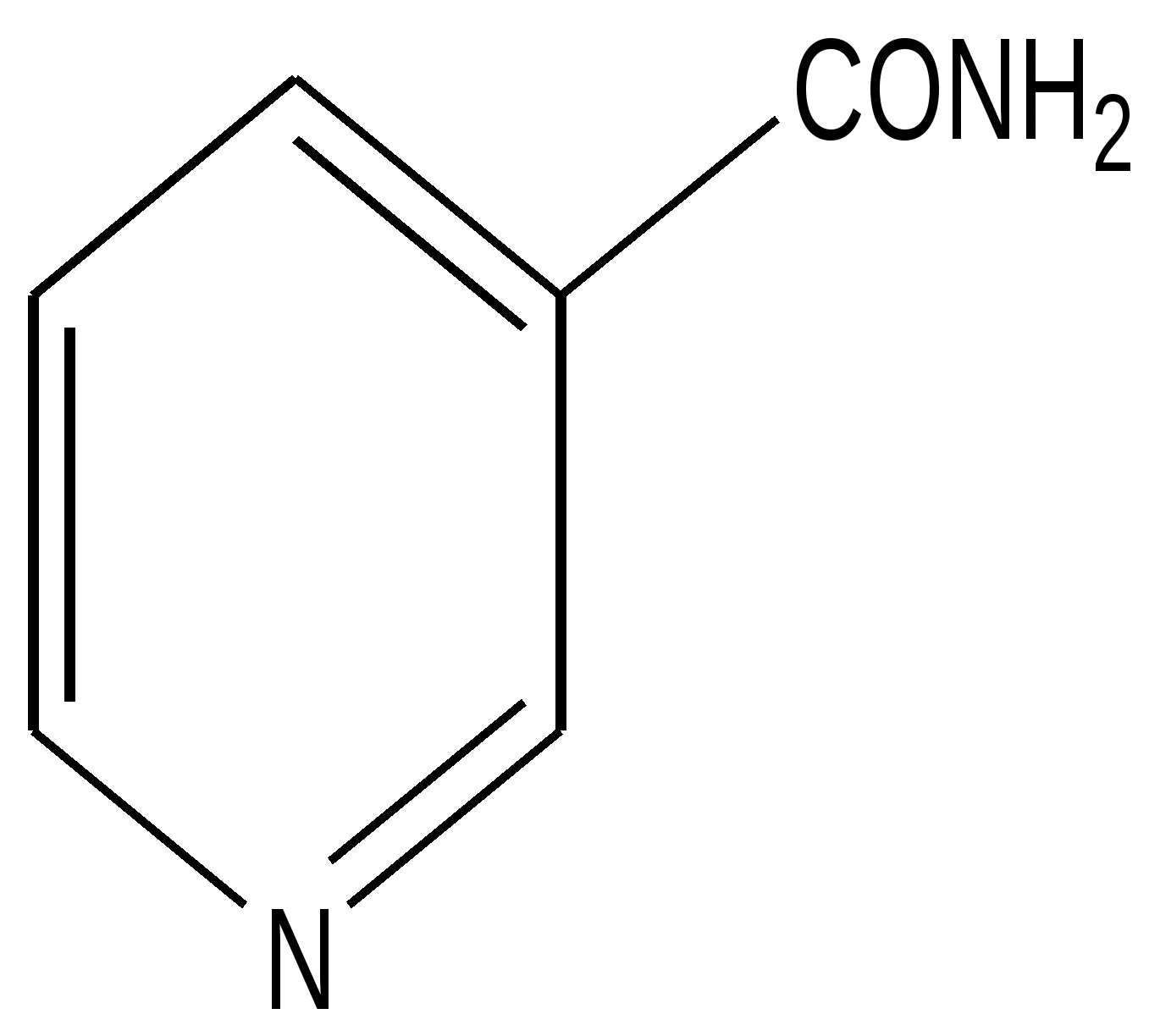
Никотинамид
|
Карбоновые кислоты (указаны тривиальные названия)
Монокарбоновые кислоты
Насыщенные кислоты
|
Ненасыщенные кислоты
|
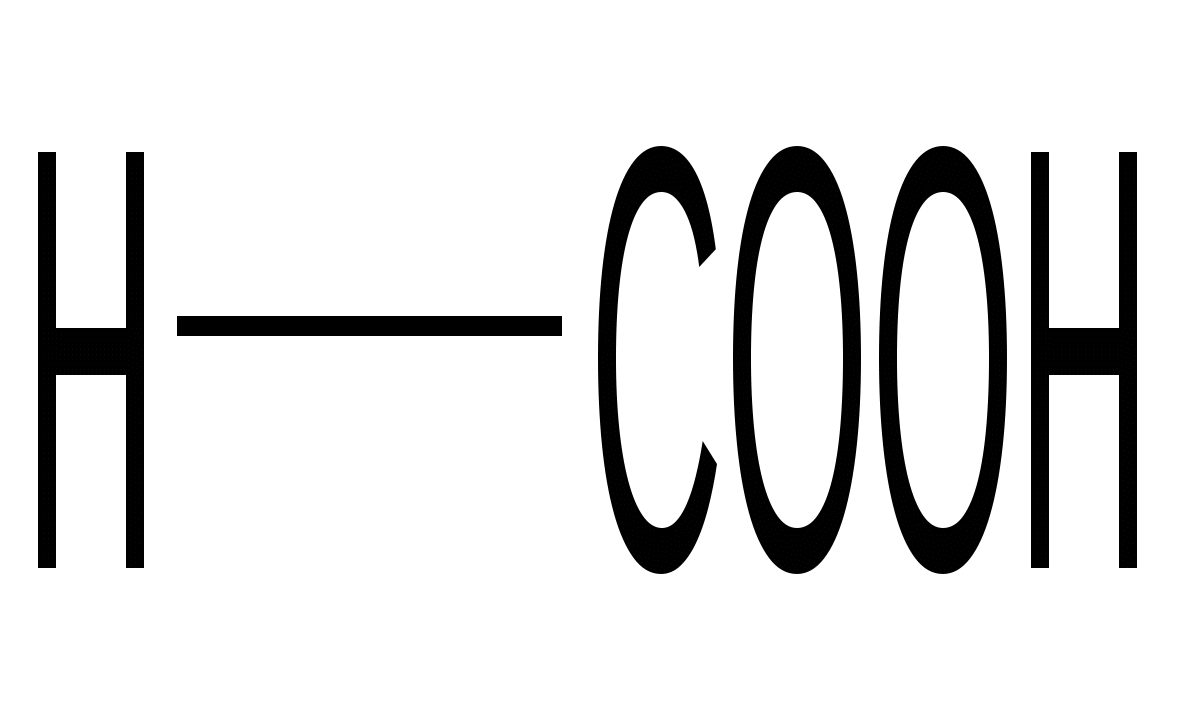
Муравьиная кислота
|
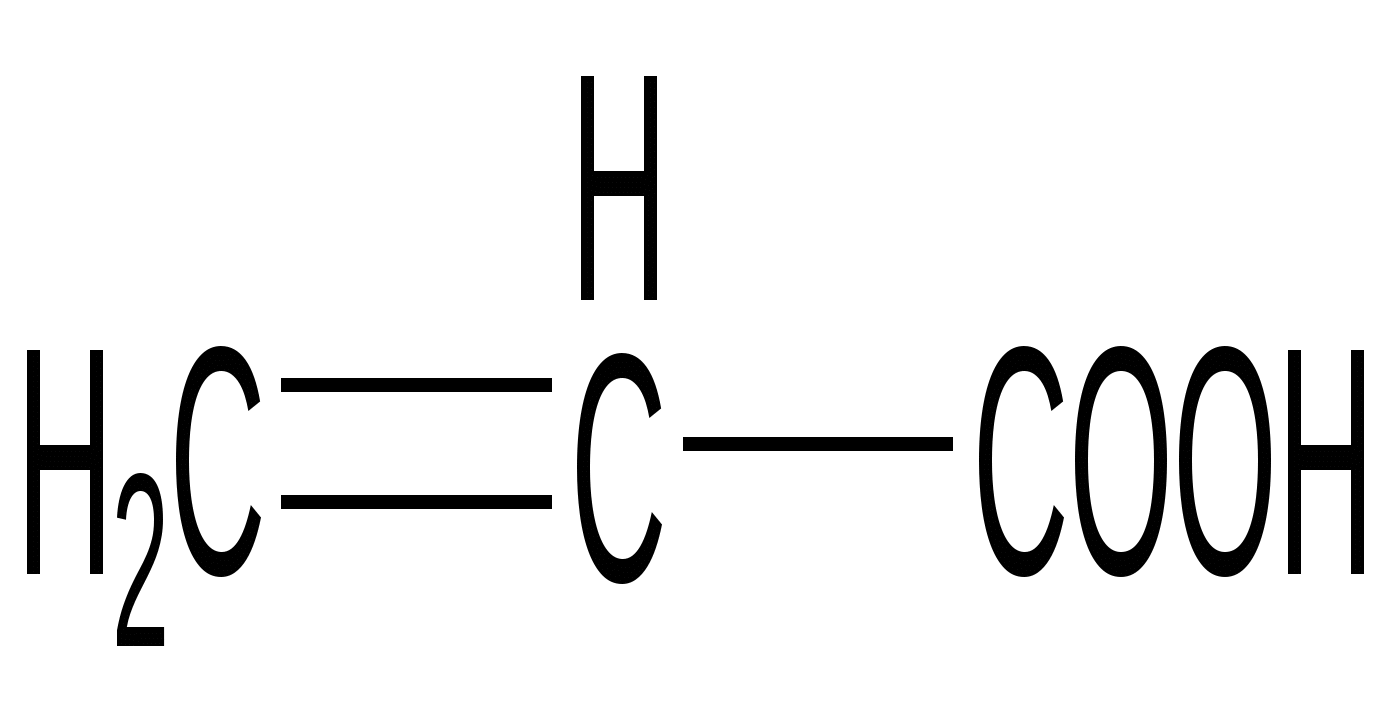
Акриловая кислота
|
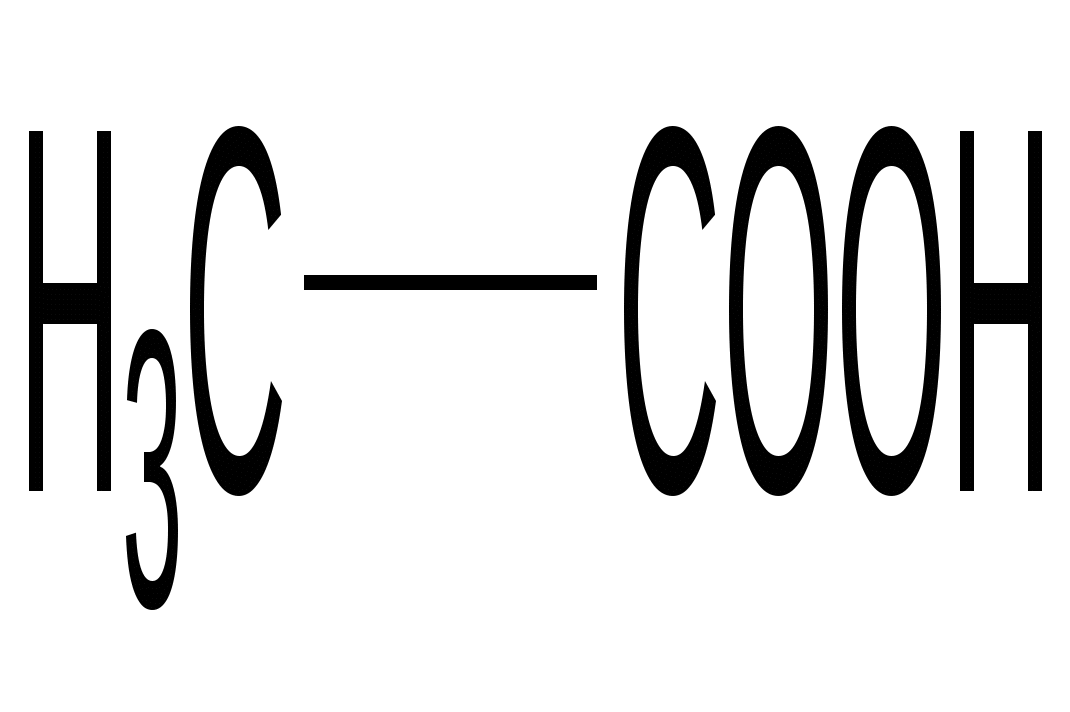
Уксусная кислота
|
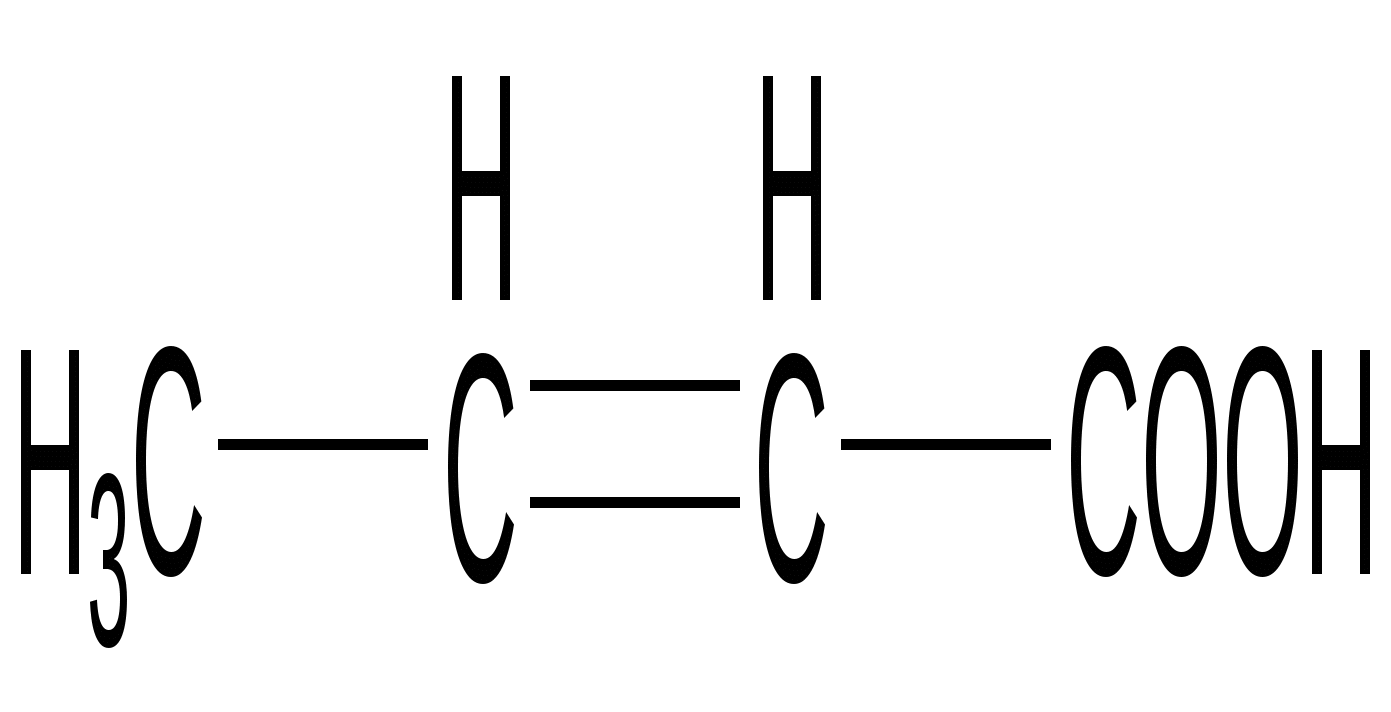
Кротоновая кислота
|
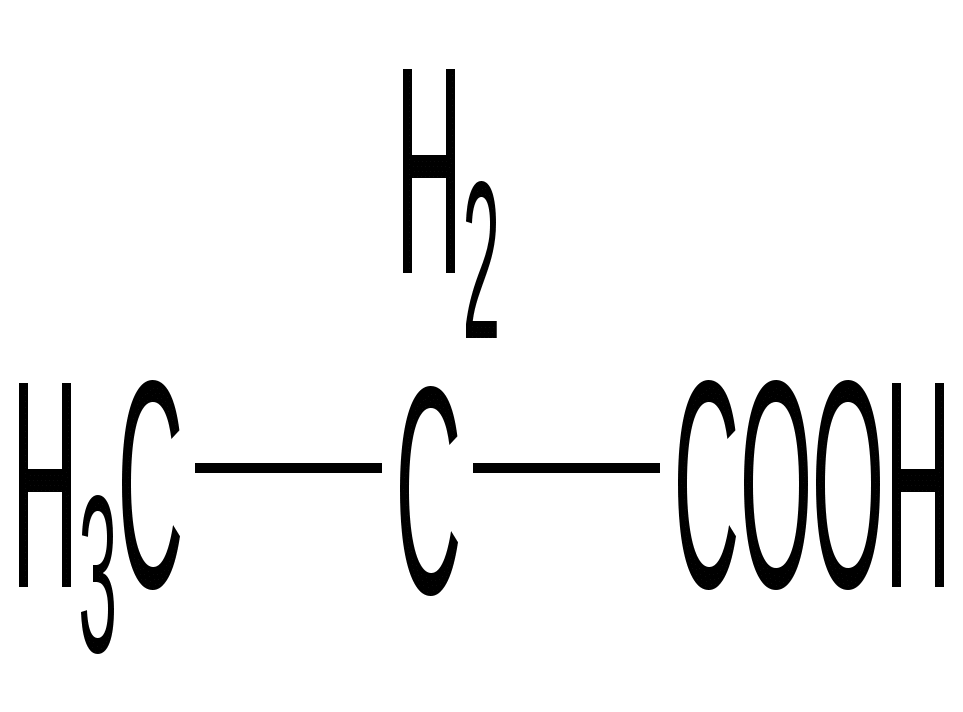
Пропионовая кислота
|
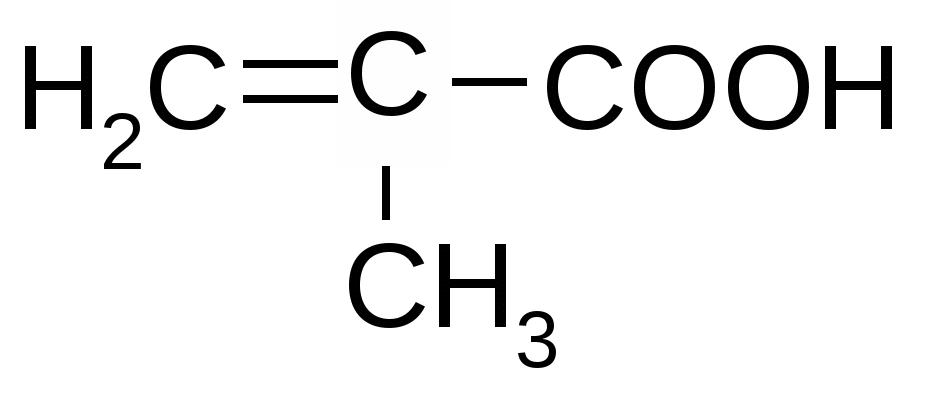
Метакриловая кислота
|
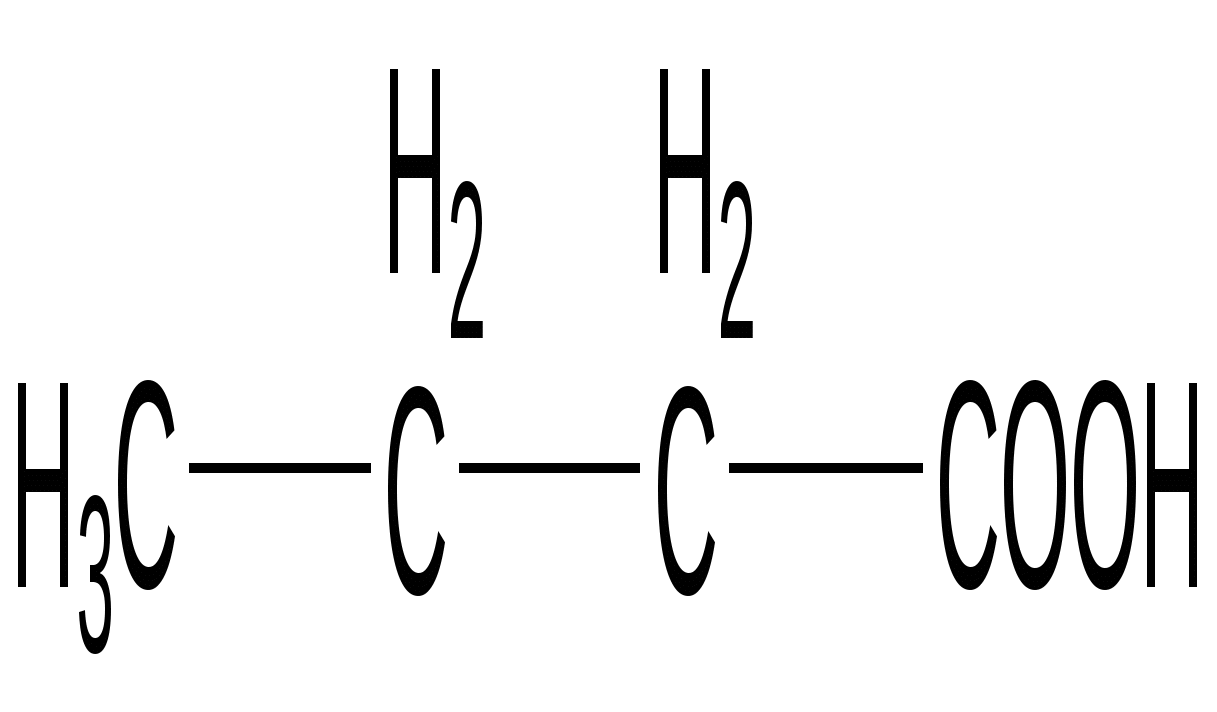
Масляная кислота
|
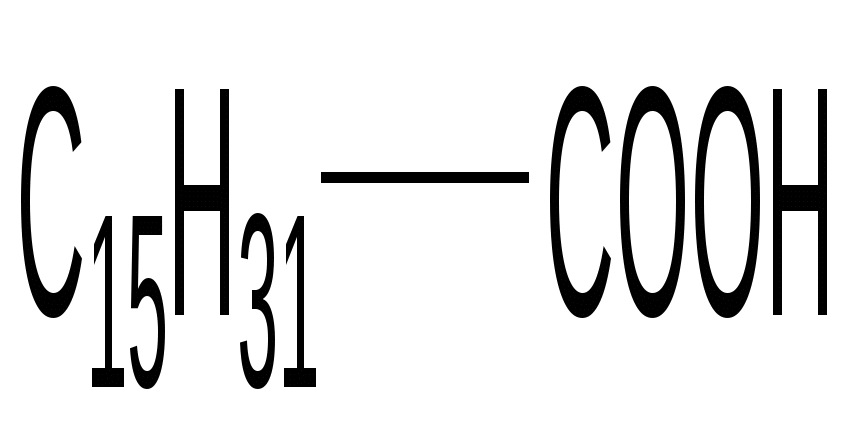
Пальмитиновая кислота
|
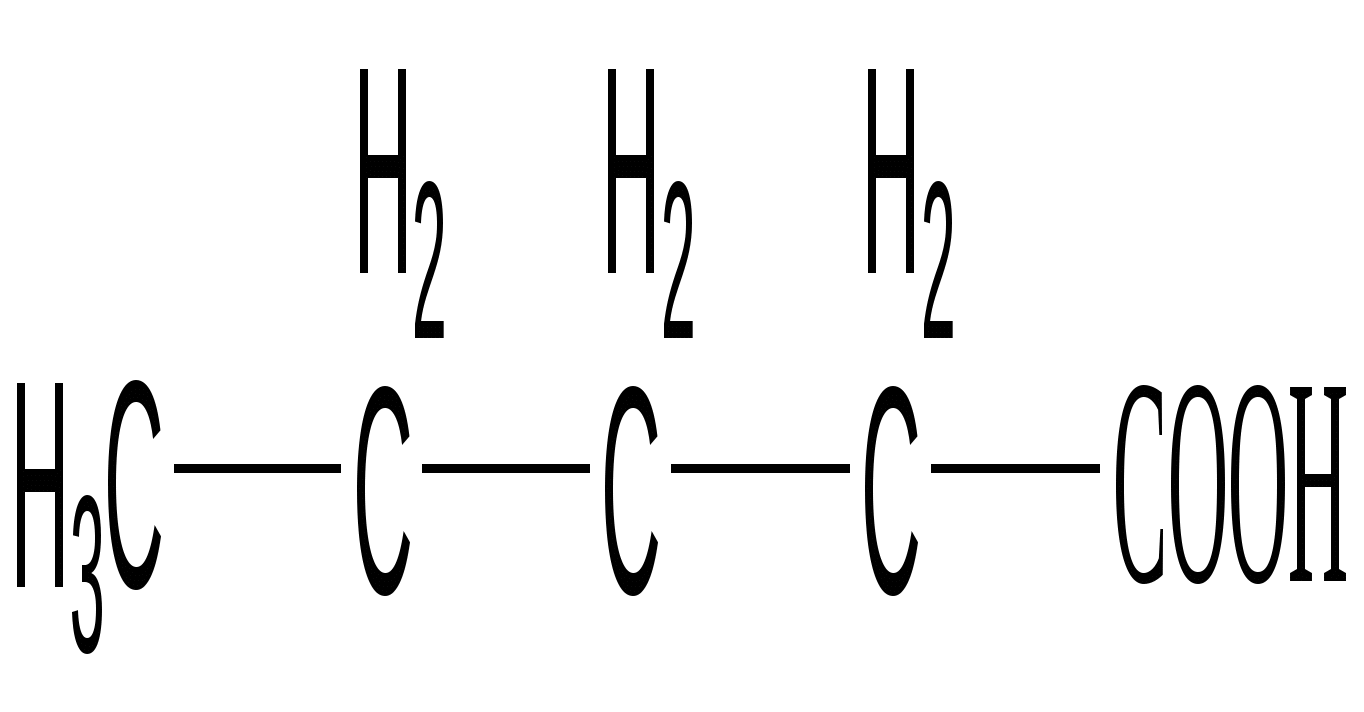
Валериановая кислота
|
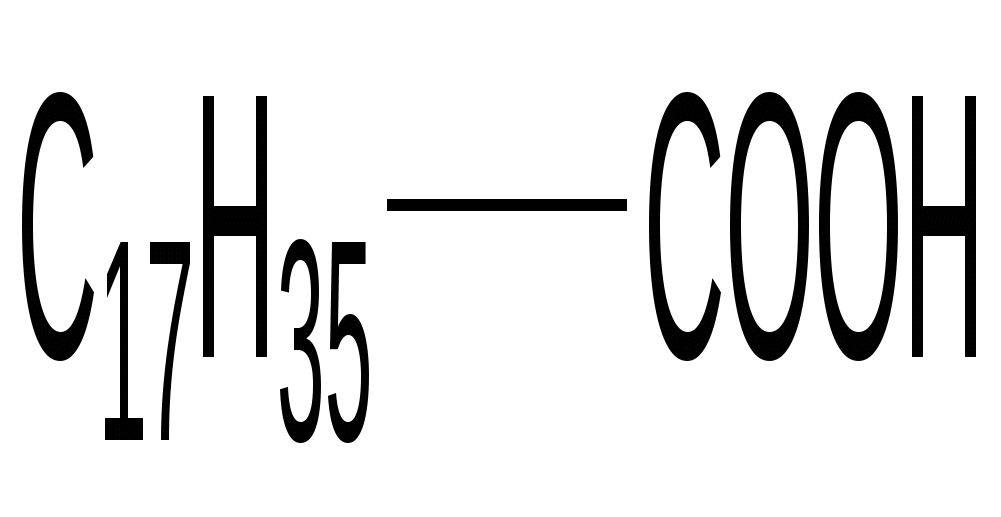
Стеариновая кислота
|
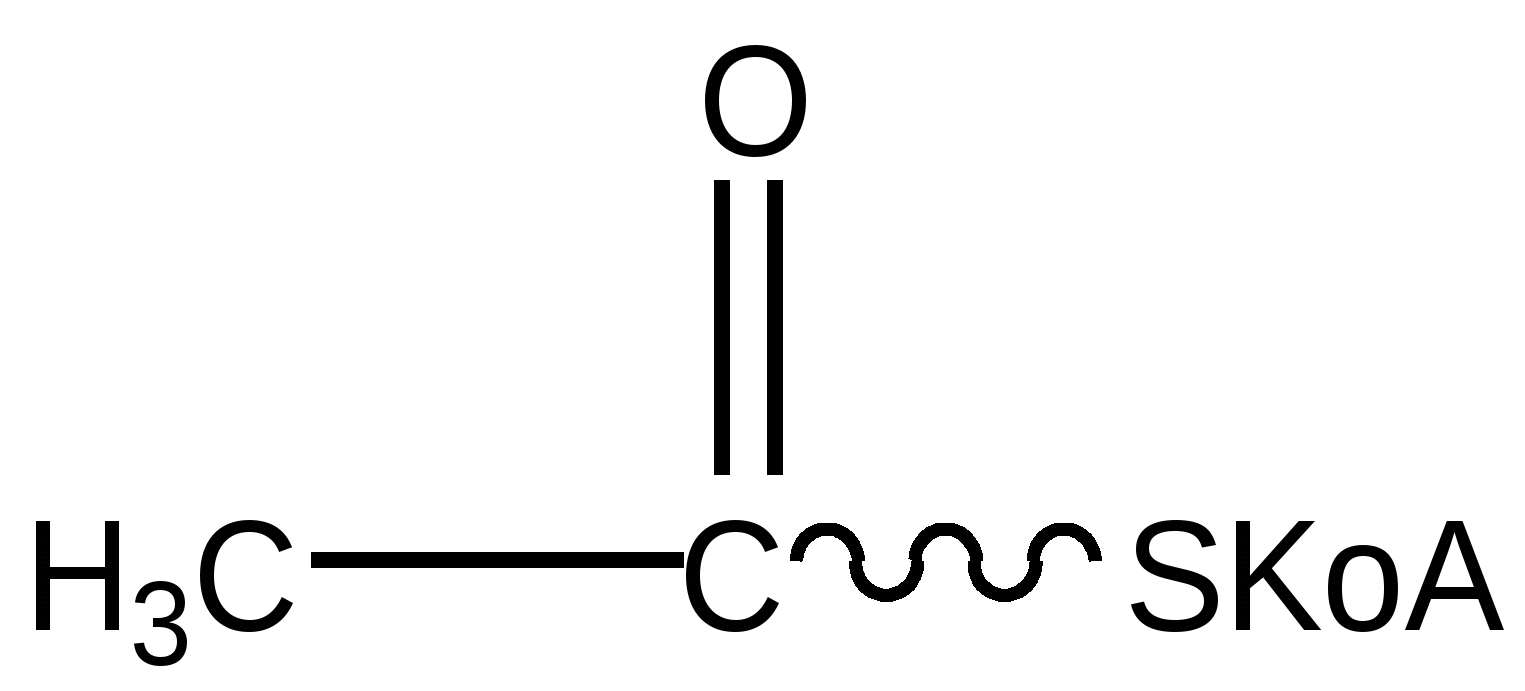
АцетилКоА
|
|
Дикарбоновые кислоты

Щавелевая кислота
|
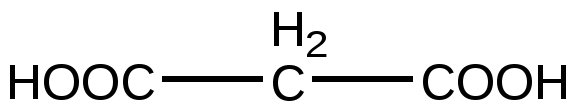
Малоновая кислота
|
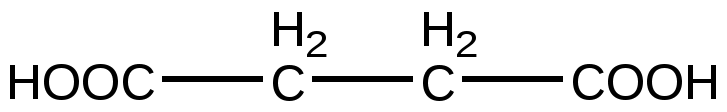
Янтарная кислота
|
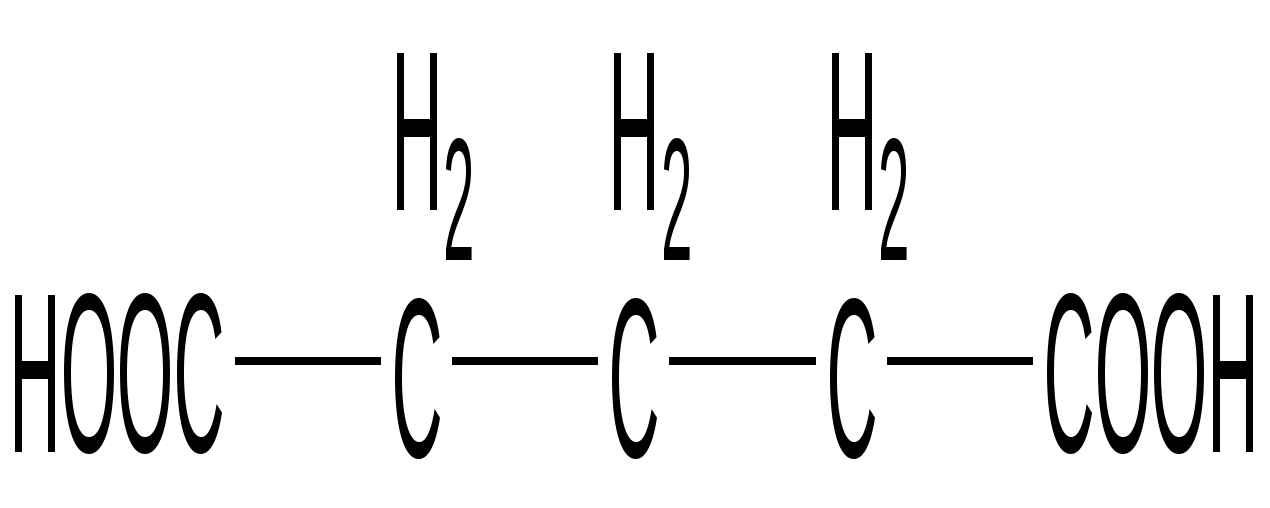
Глутаровая кислота
|
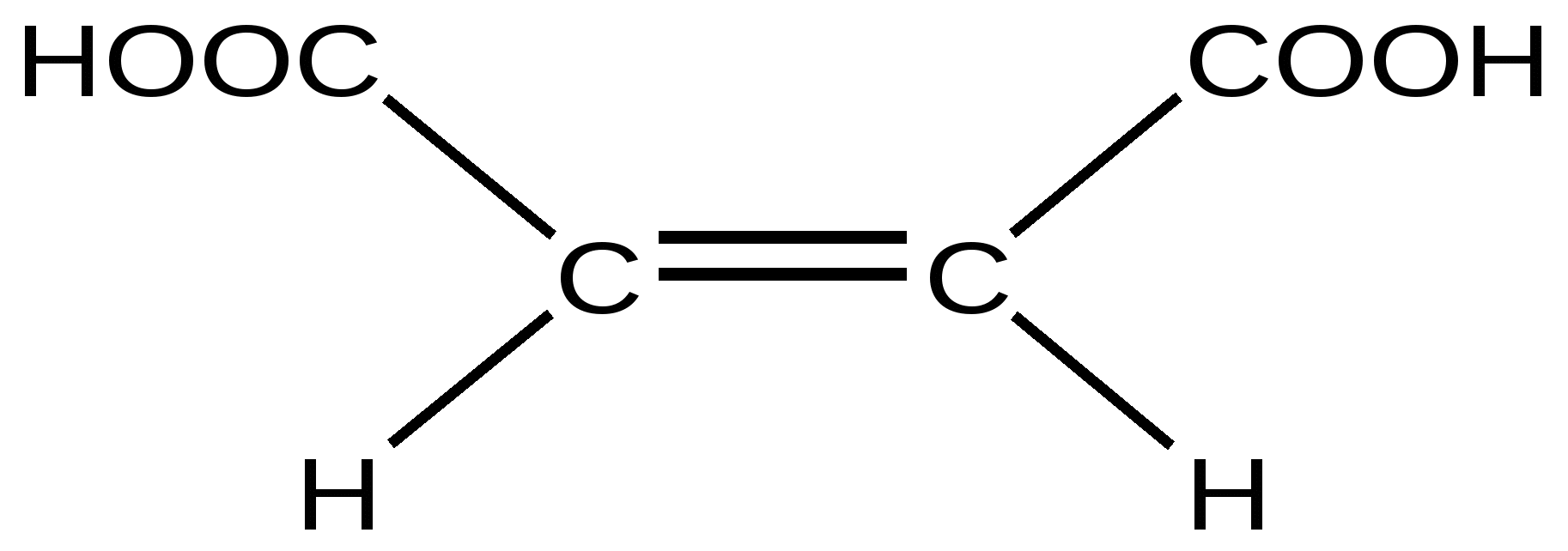
Малеиновая кислота (цис)
|
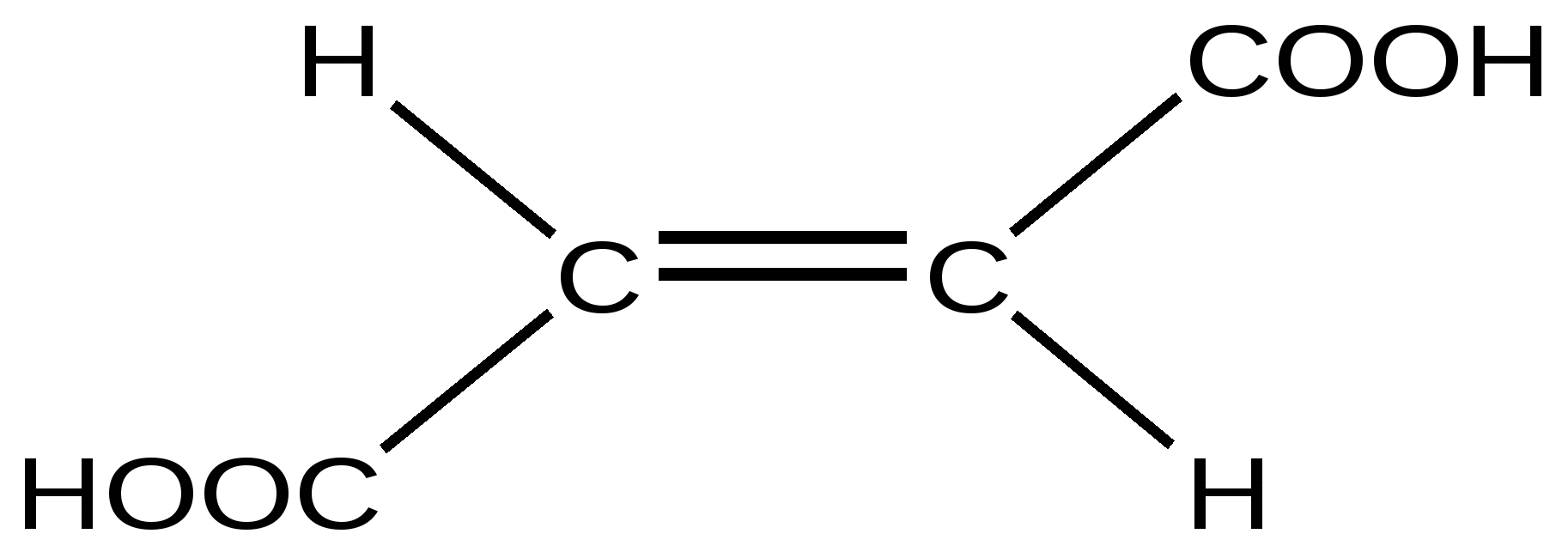
Фумаровая кислота (транс)
|
Гидроксикислоты
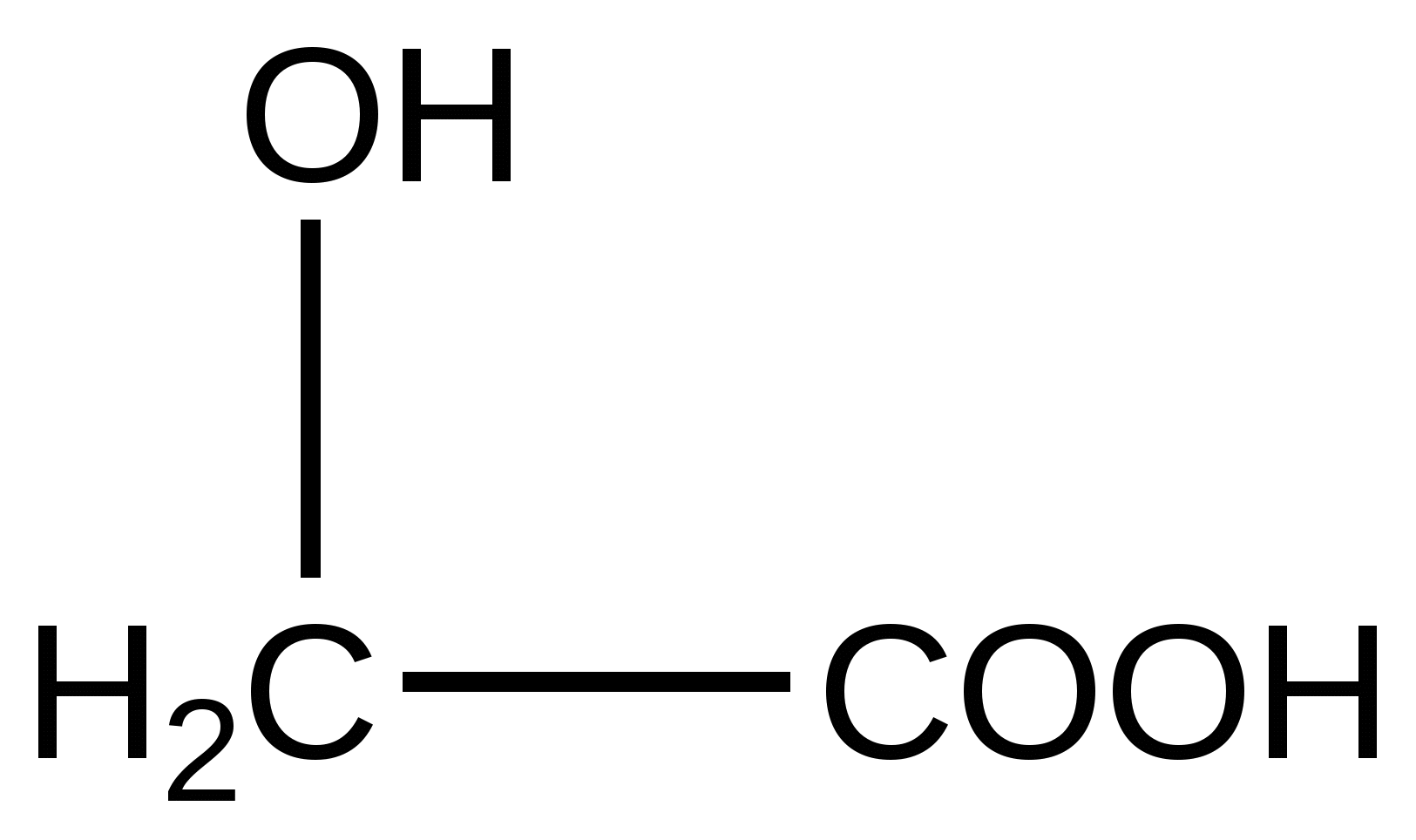
Гликолевая кислота
|
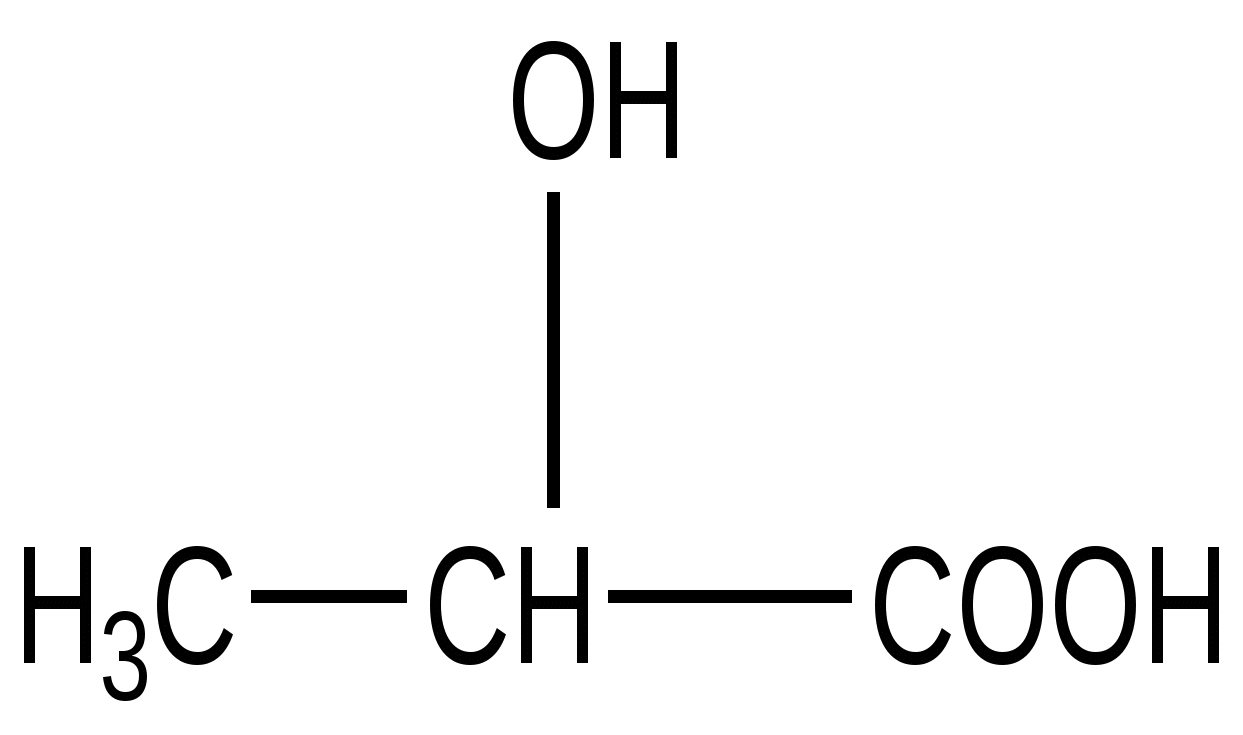
Молочная кислота
|
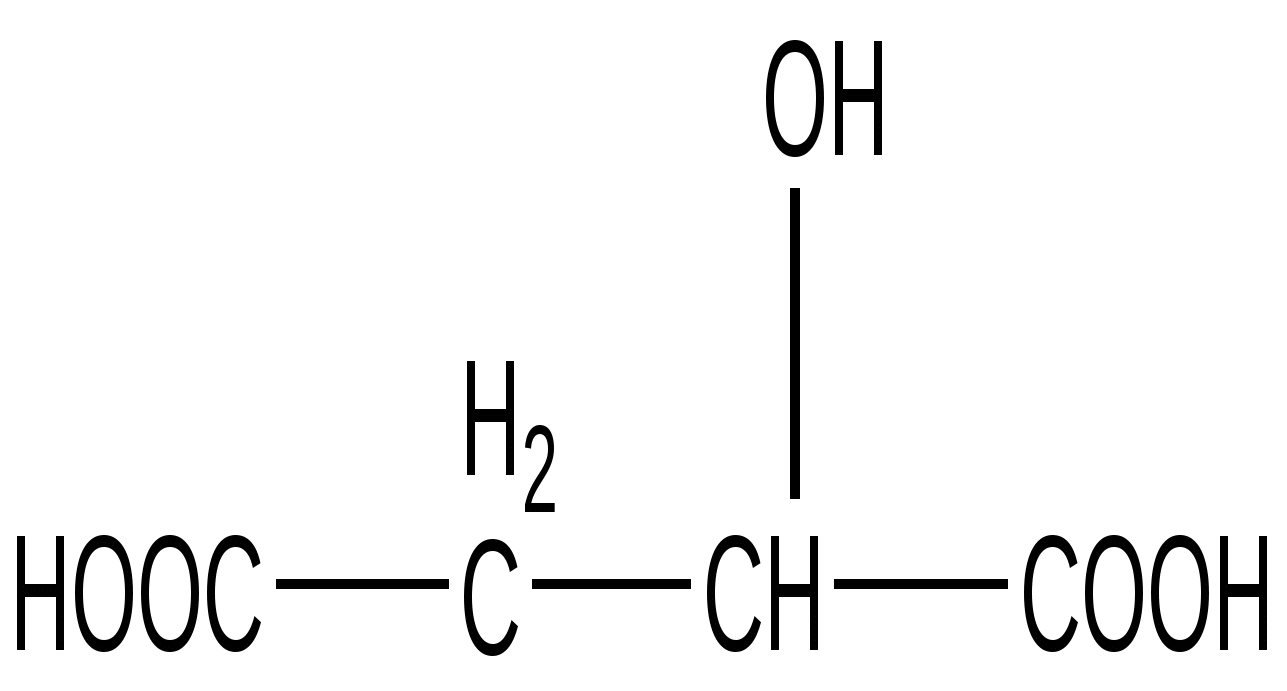
Яблочная кислота
(Малат)
|
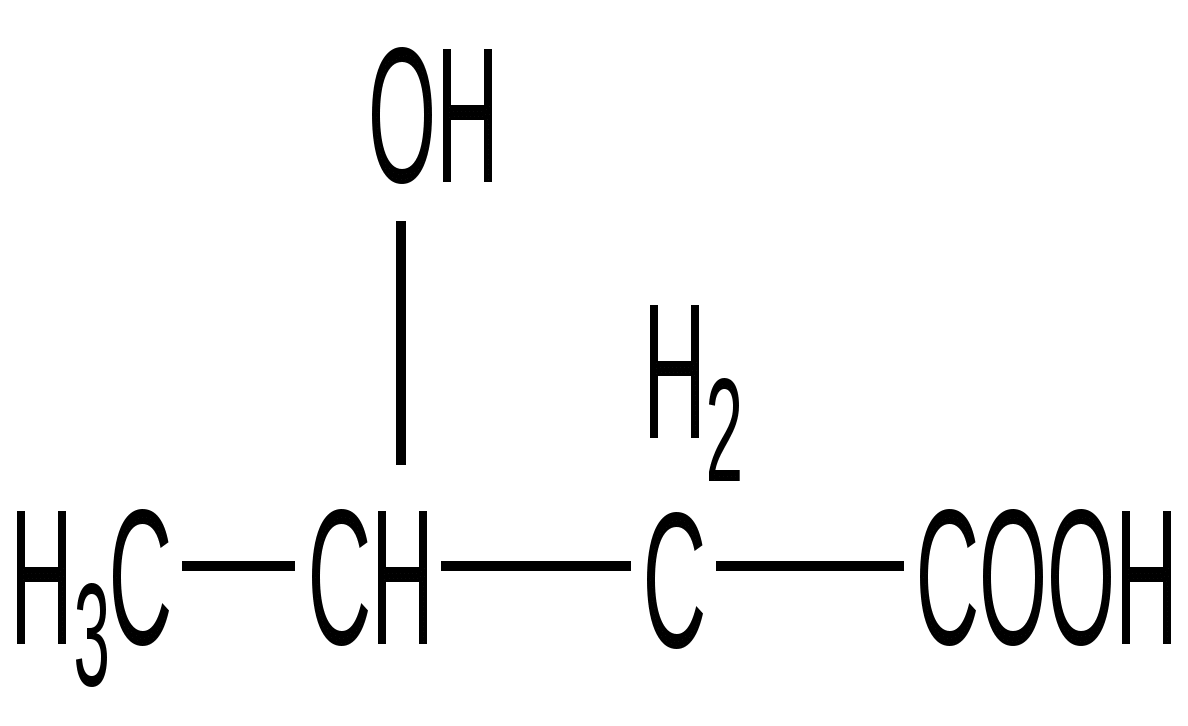
3-гидроксимасляная кислота
|
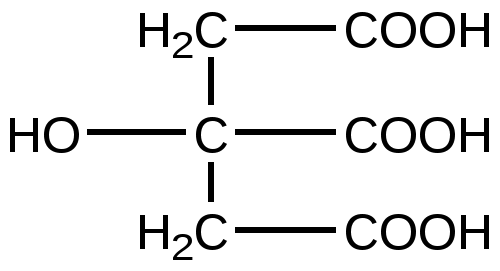
Лимонная кислота
(Цитрат)
|
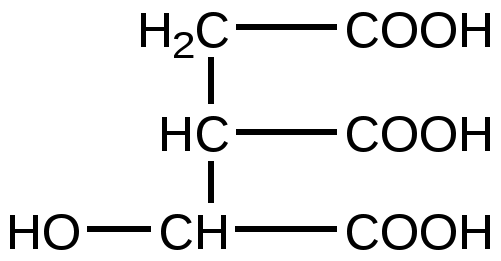
Изолимонная кислота
(Изоцитрат)
|
Оксокислоты (надо знать в двух таутомерных формах-енольной и кетоновой)
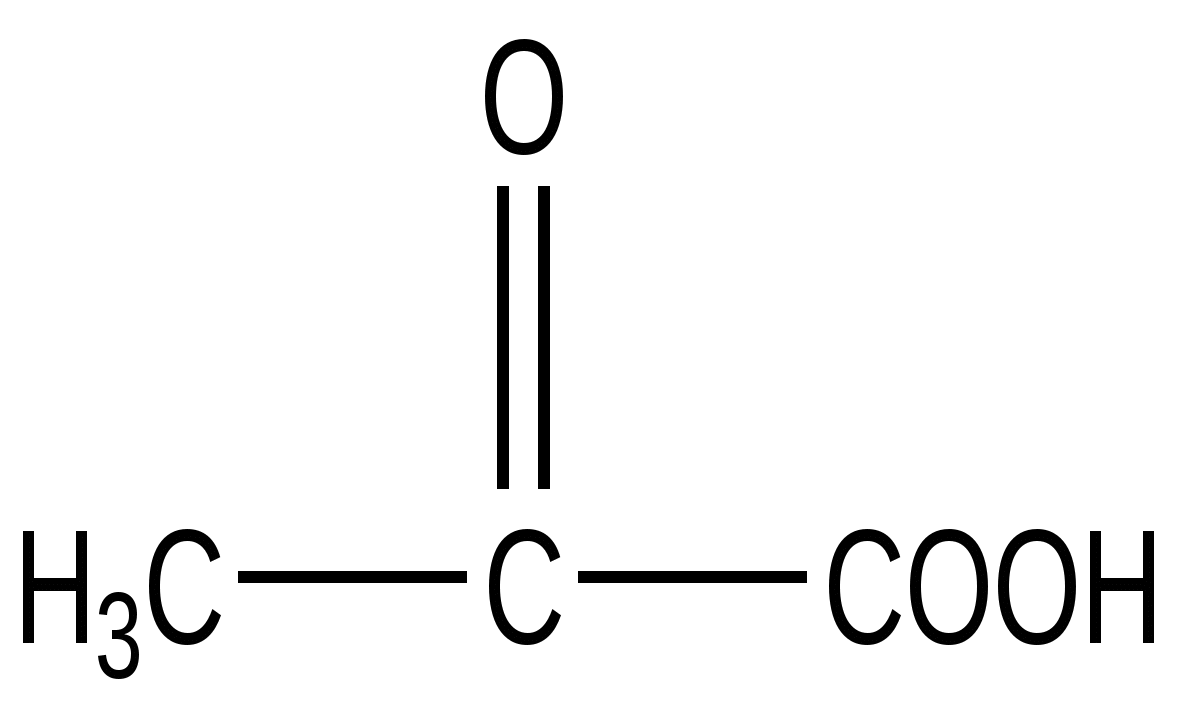
Пировиноградная кислота
(ПВК)
|
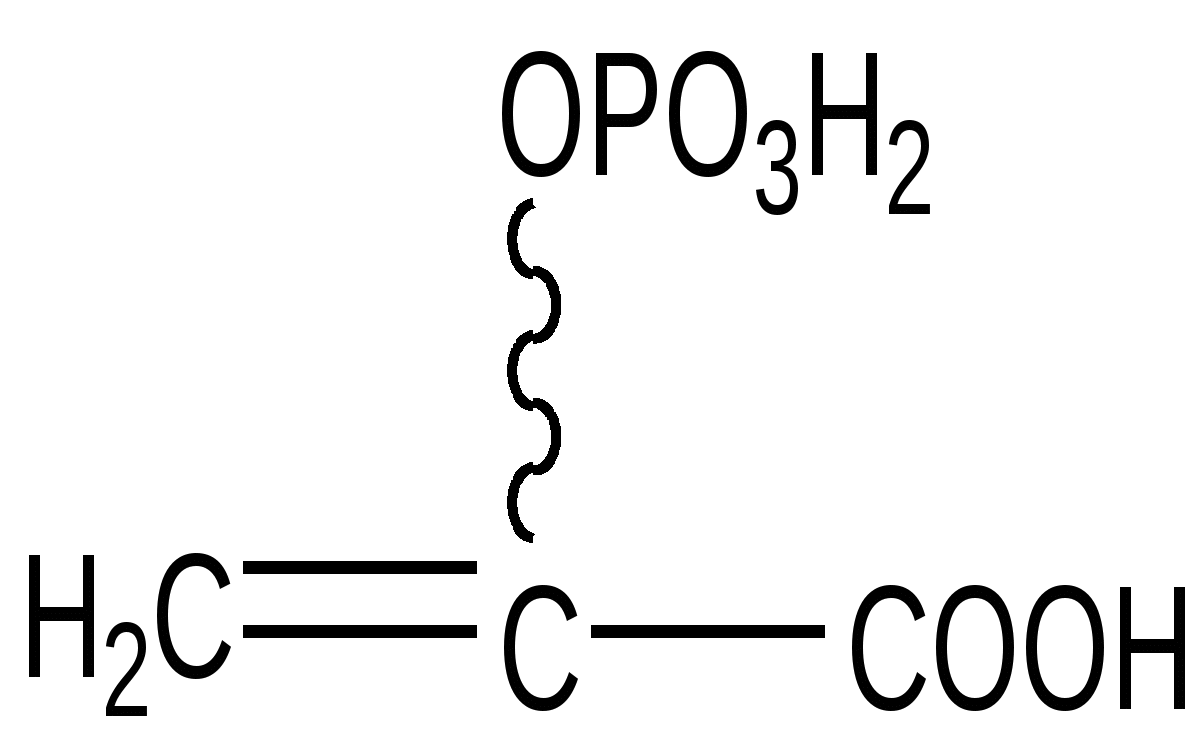
Фосфоенолпируват
(ФЕП)
|
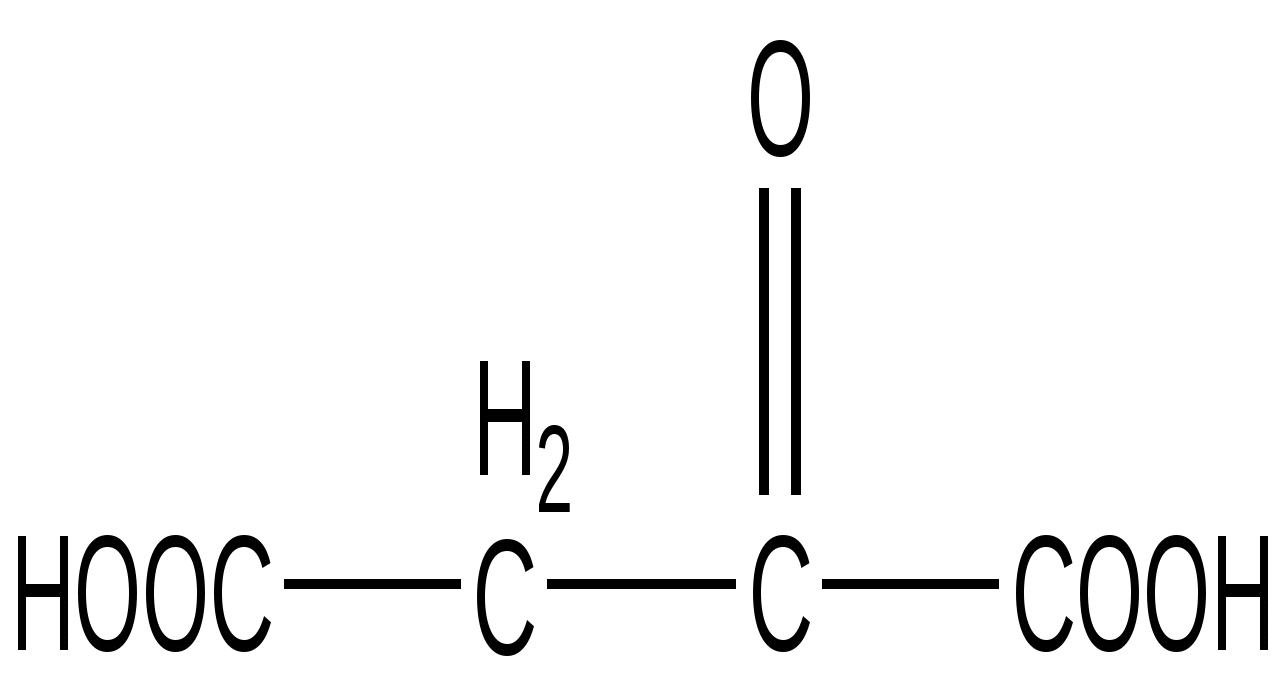
Щавелевоуксусная кислота
(ЩУК)
|
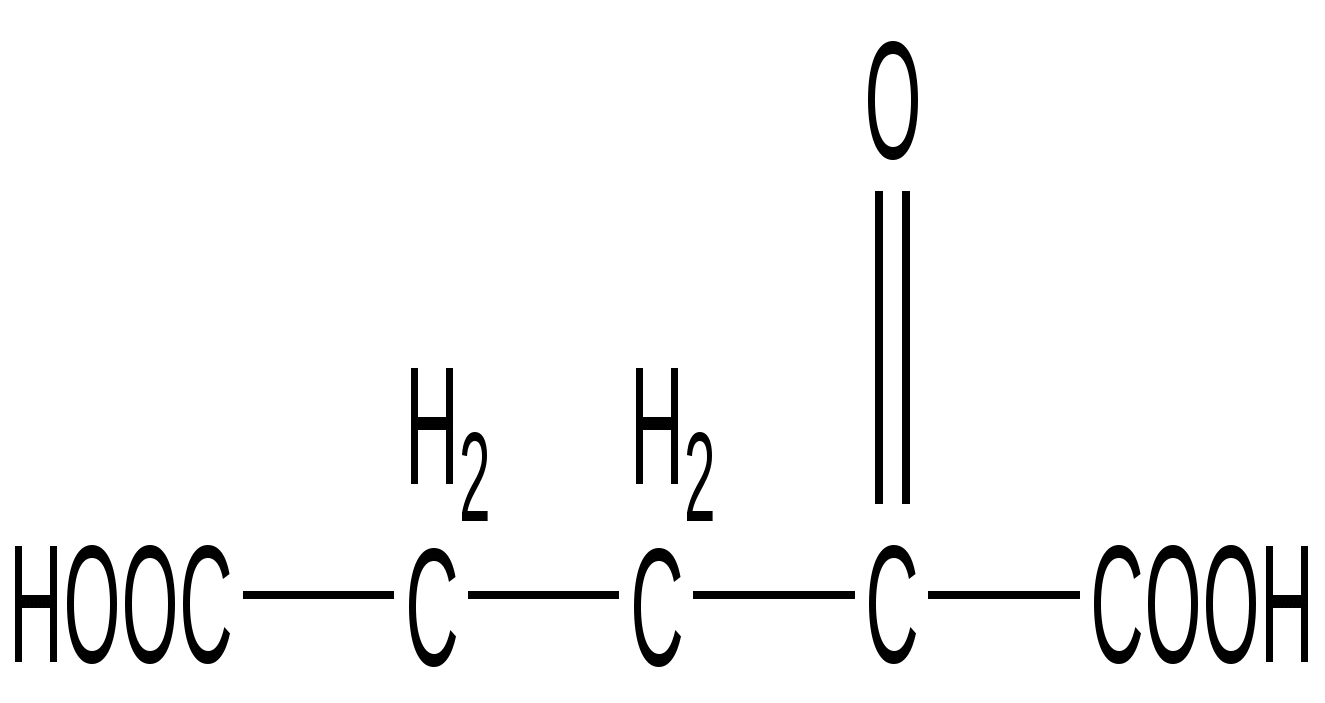
α -Кетоглутаровая кислота
(α -КГ)
|
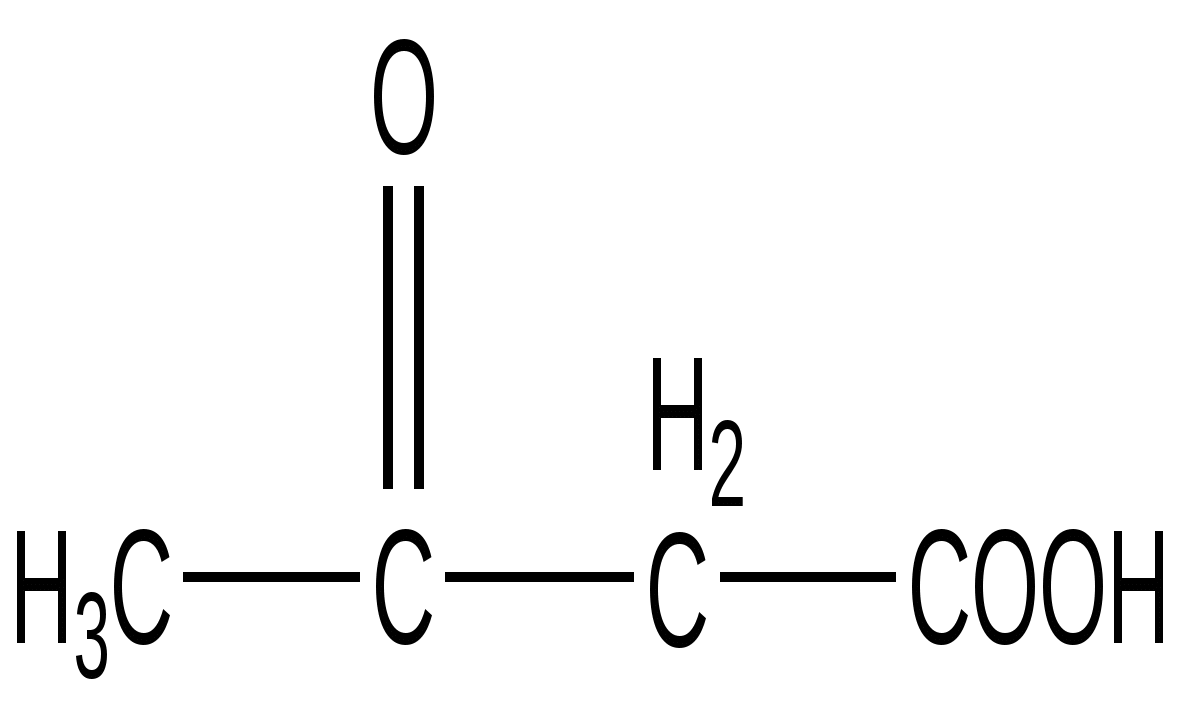
β-оксомасляная кислота
(Ацетоуксусная кислота)
|
|
ЛИПИДЫ
Ненасыщенные жирные кислоты
|

Олеиновая кислота (цис)
(18 : 1 : 9)
|
Линолевая кислота. Обозначения: (18:2: 9, 12), ∆9,12 ω 6
|
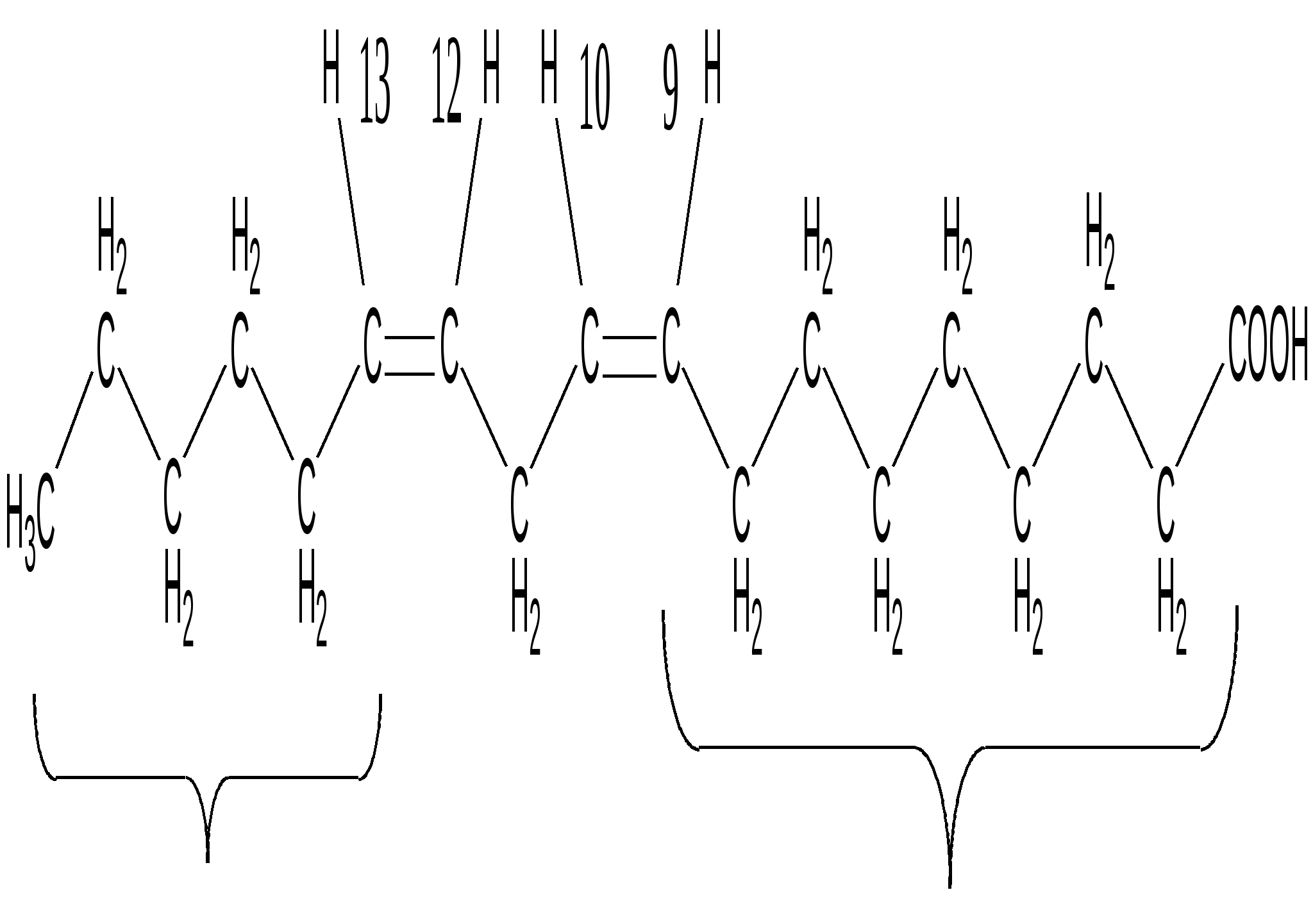
ω 6 ∆ 9
|
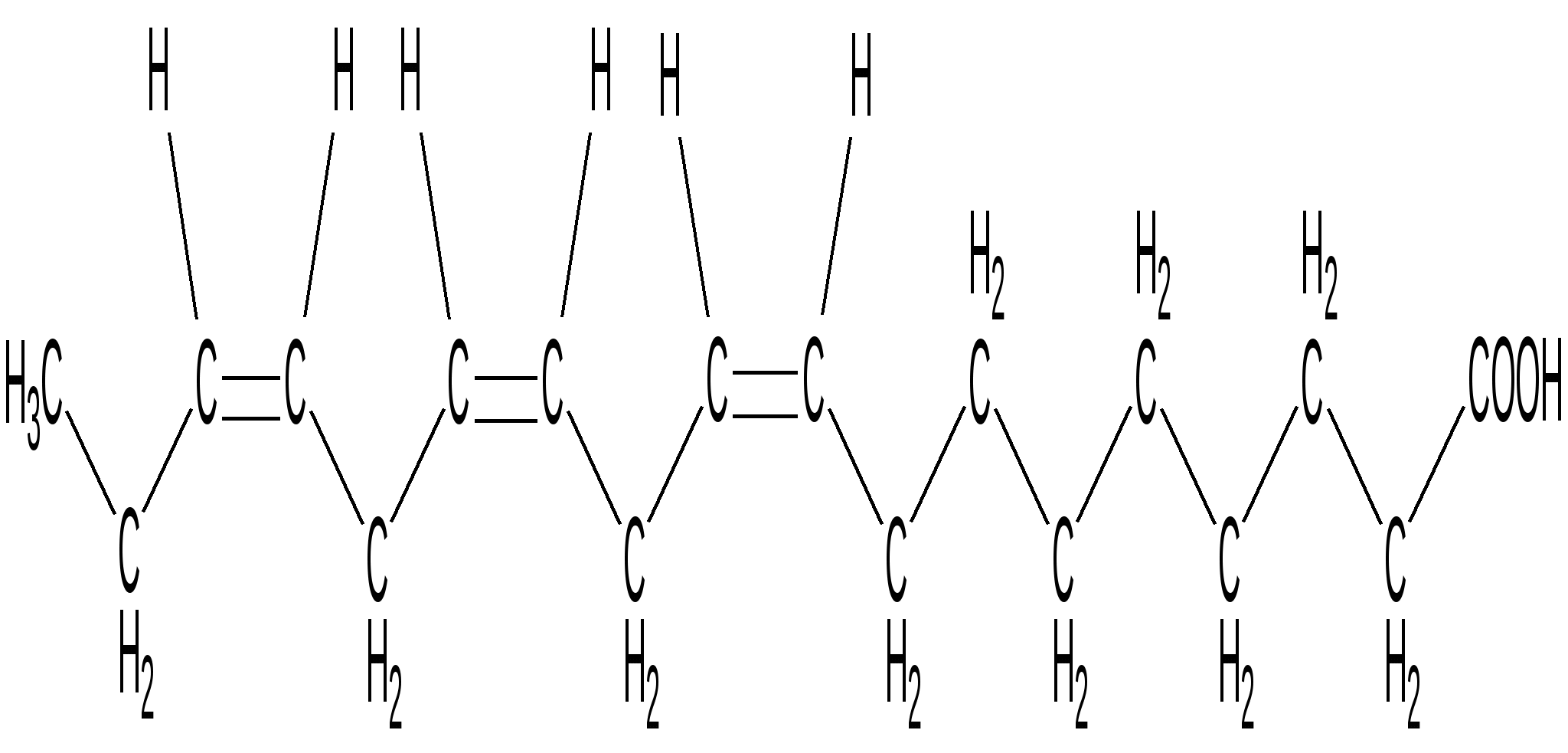
Линоленовая кислота
(18 : 3 : 9:12:15); ω-3
|
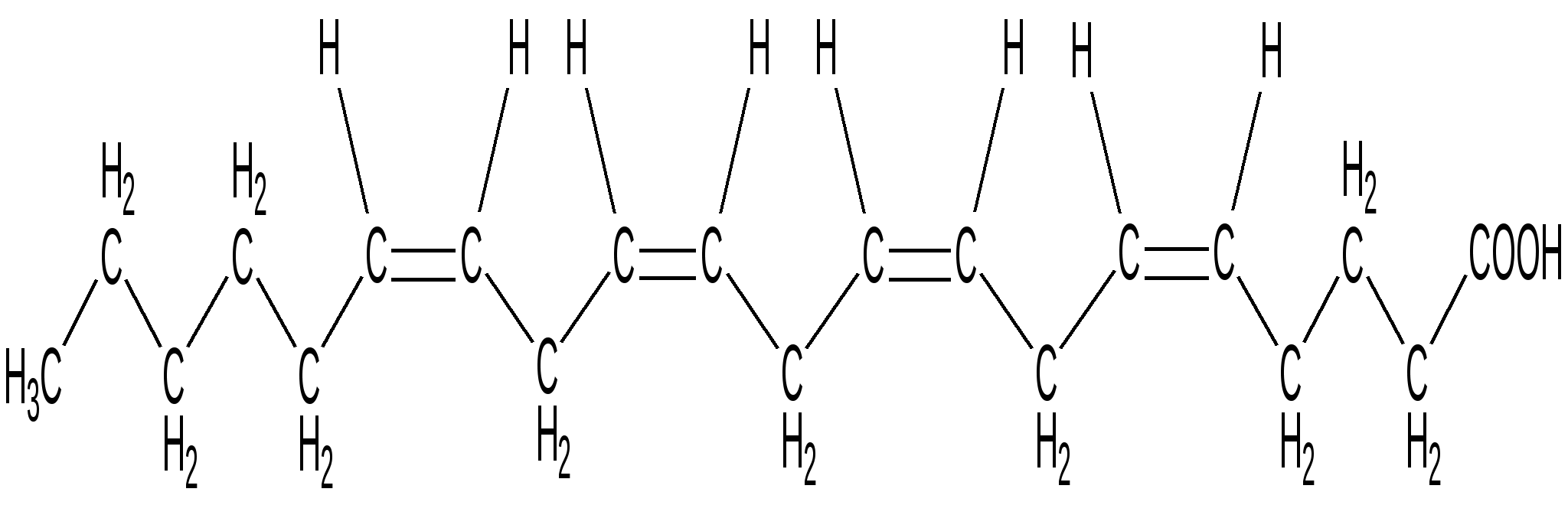
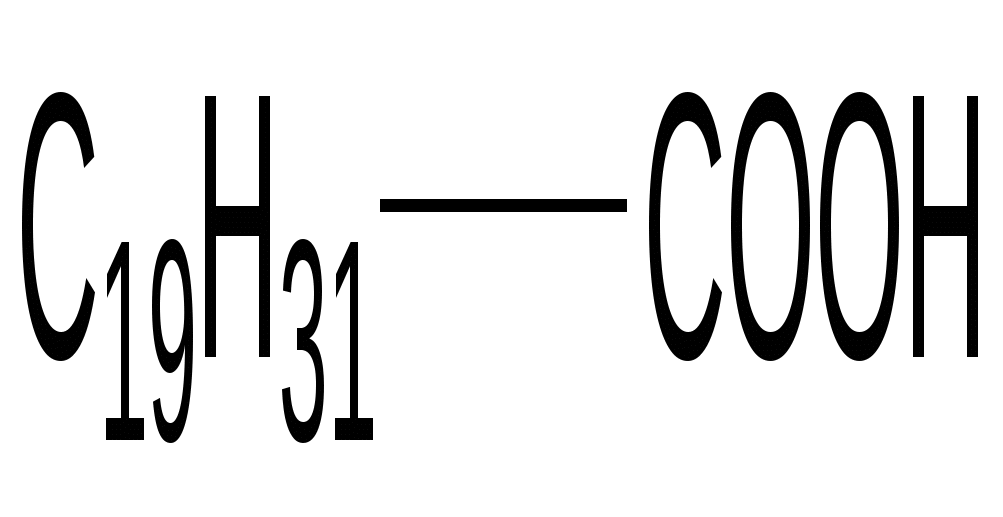
Арахидоновая кислота
(20 : 4 : 5:8:11:14) ω-6
|
Простые липиды
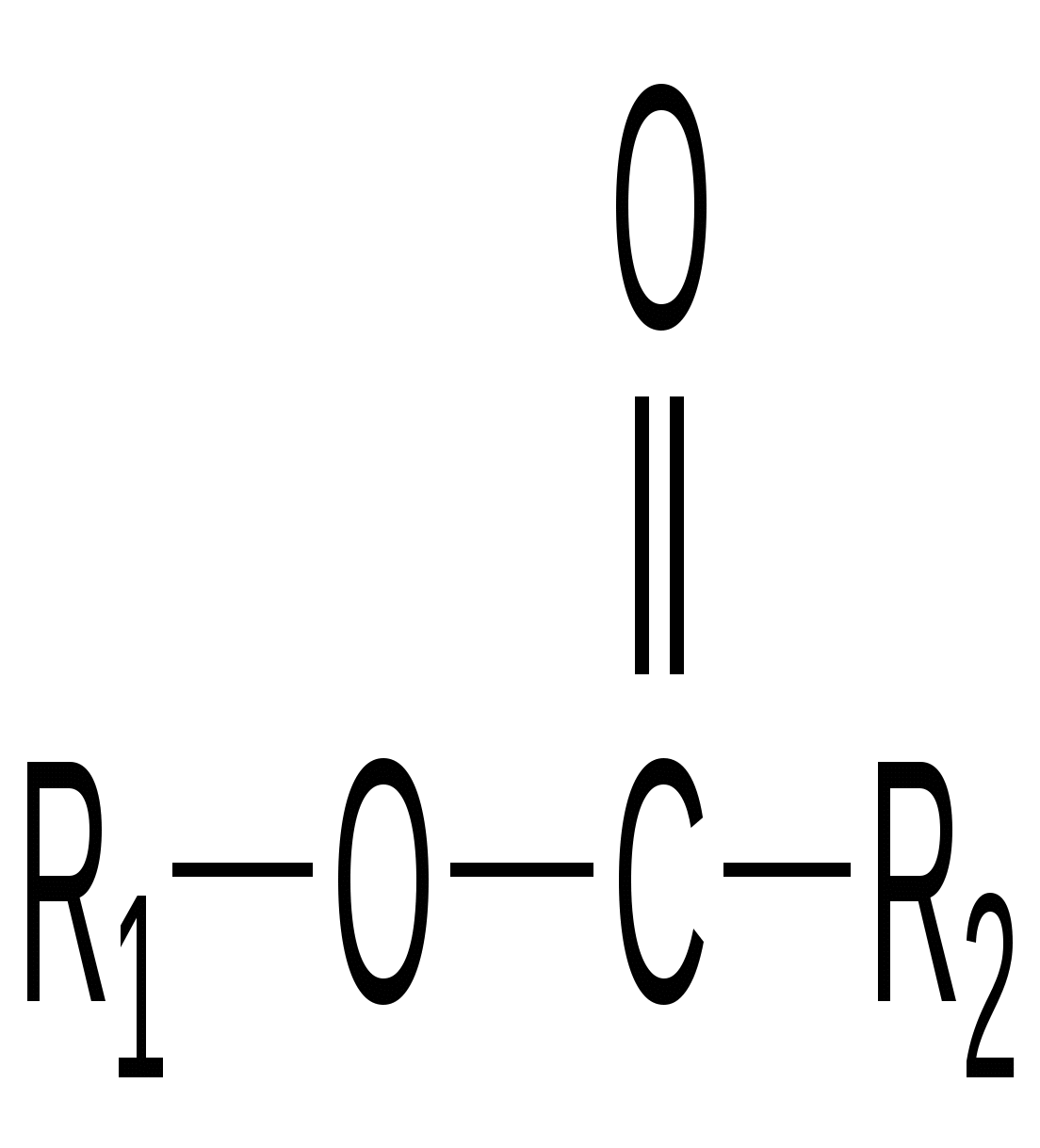
Воск
(R1 – высший спирт,
R2 – жирная кислота)
|
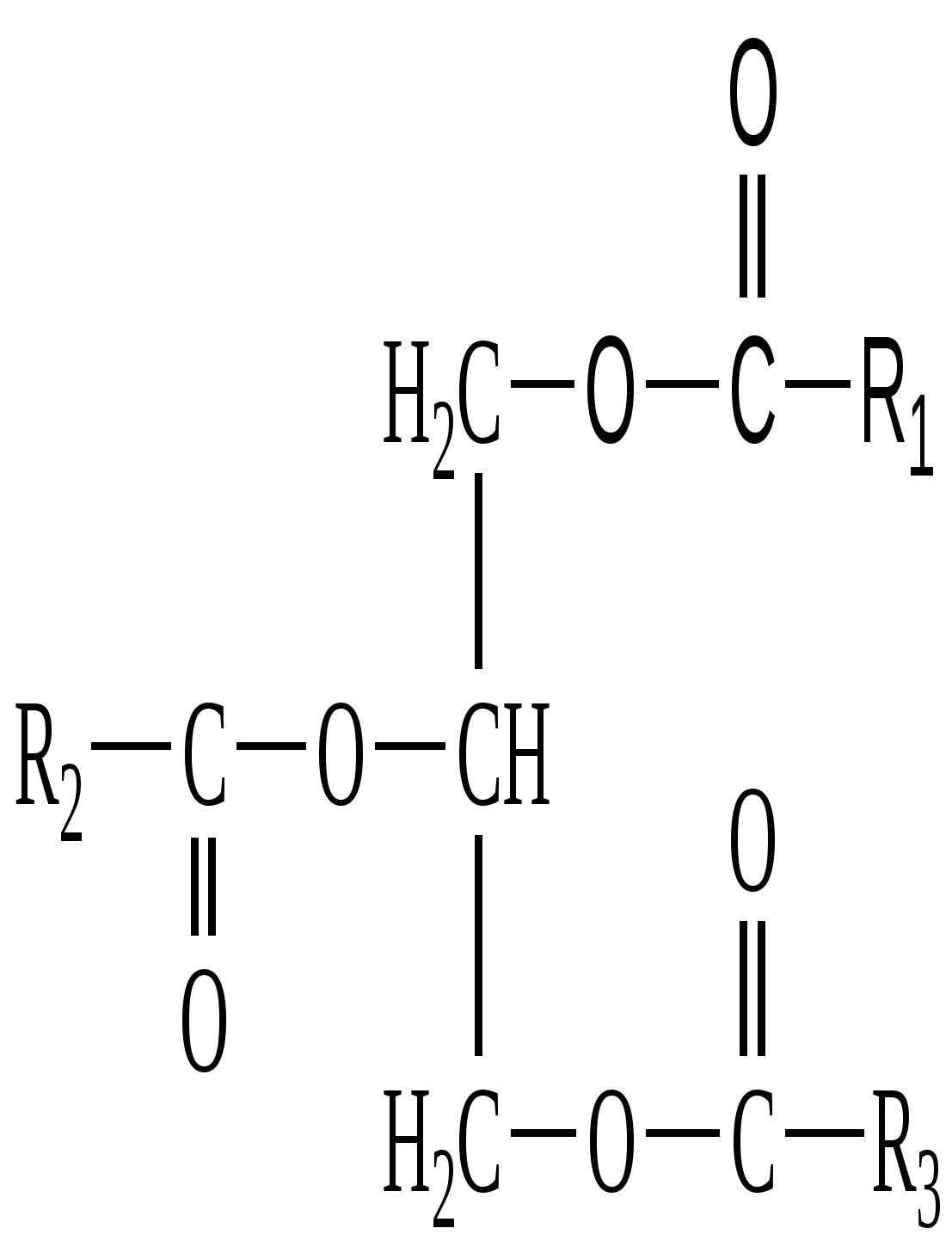
L –Триглицерид
|
Сложные липиды
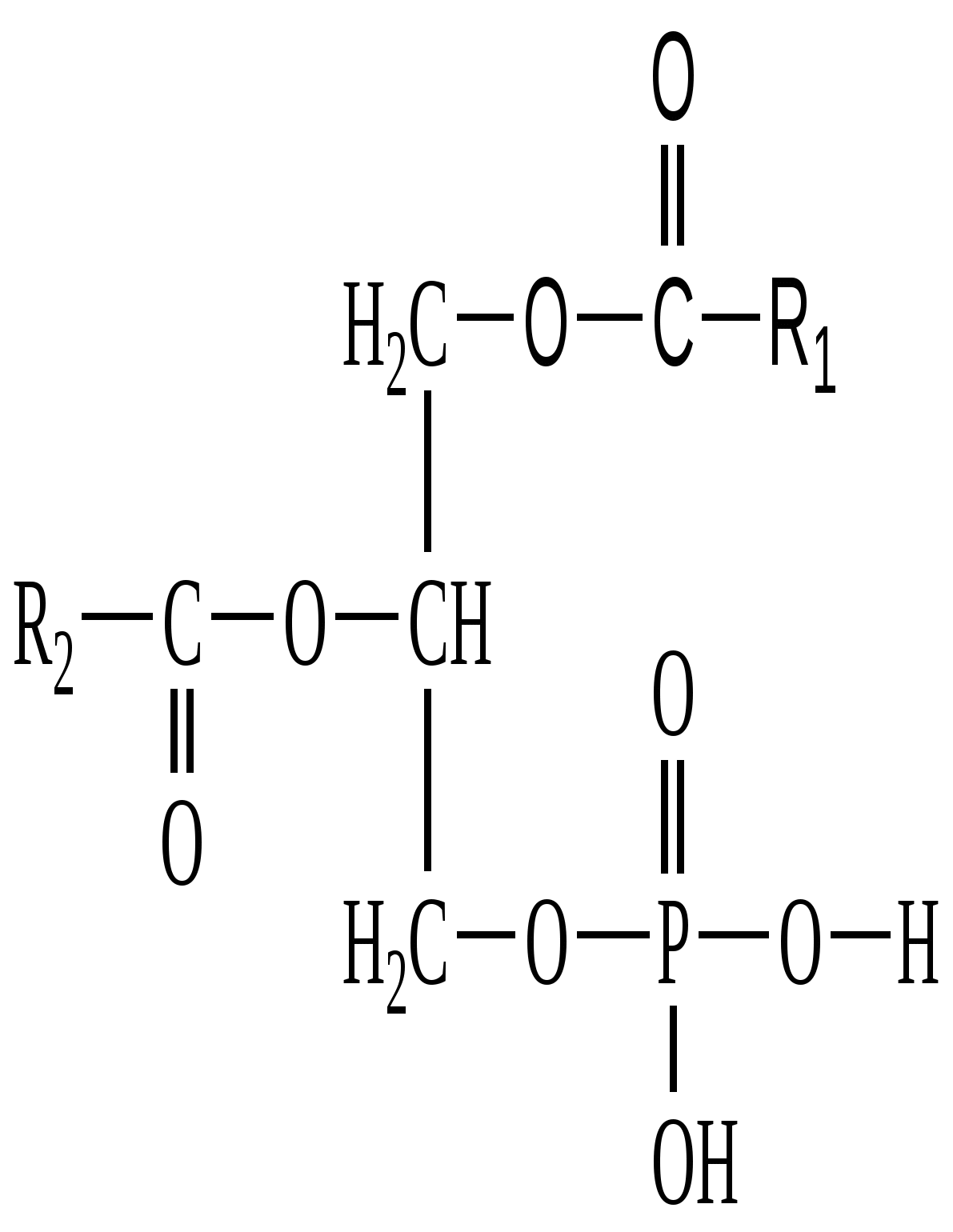
L –Фосфатидовая кислота
(фосфатидная кислота)
|
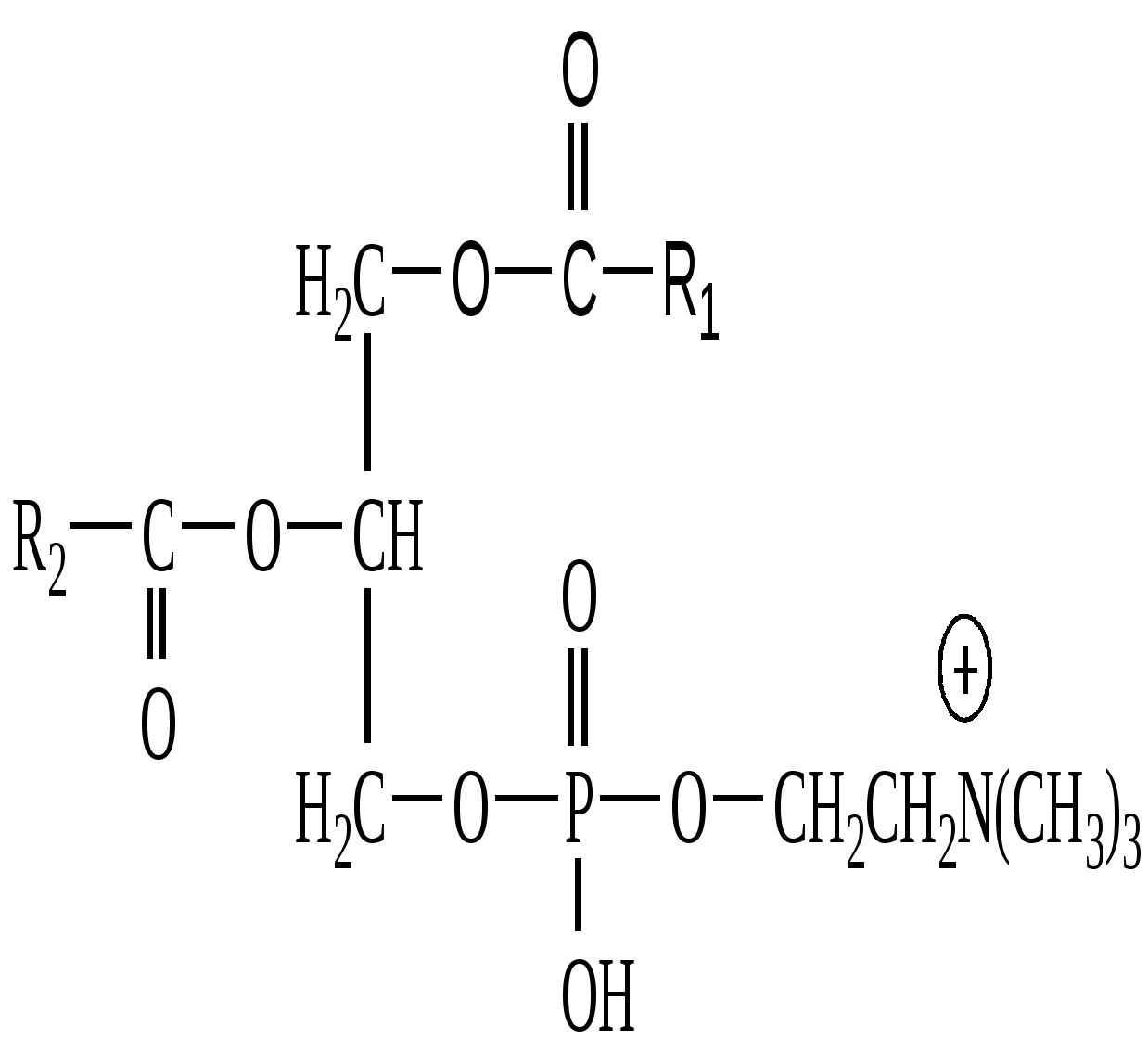
L –Фосфатидилхолин
(Лецитин)
|
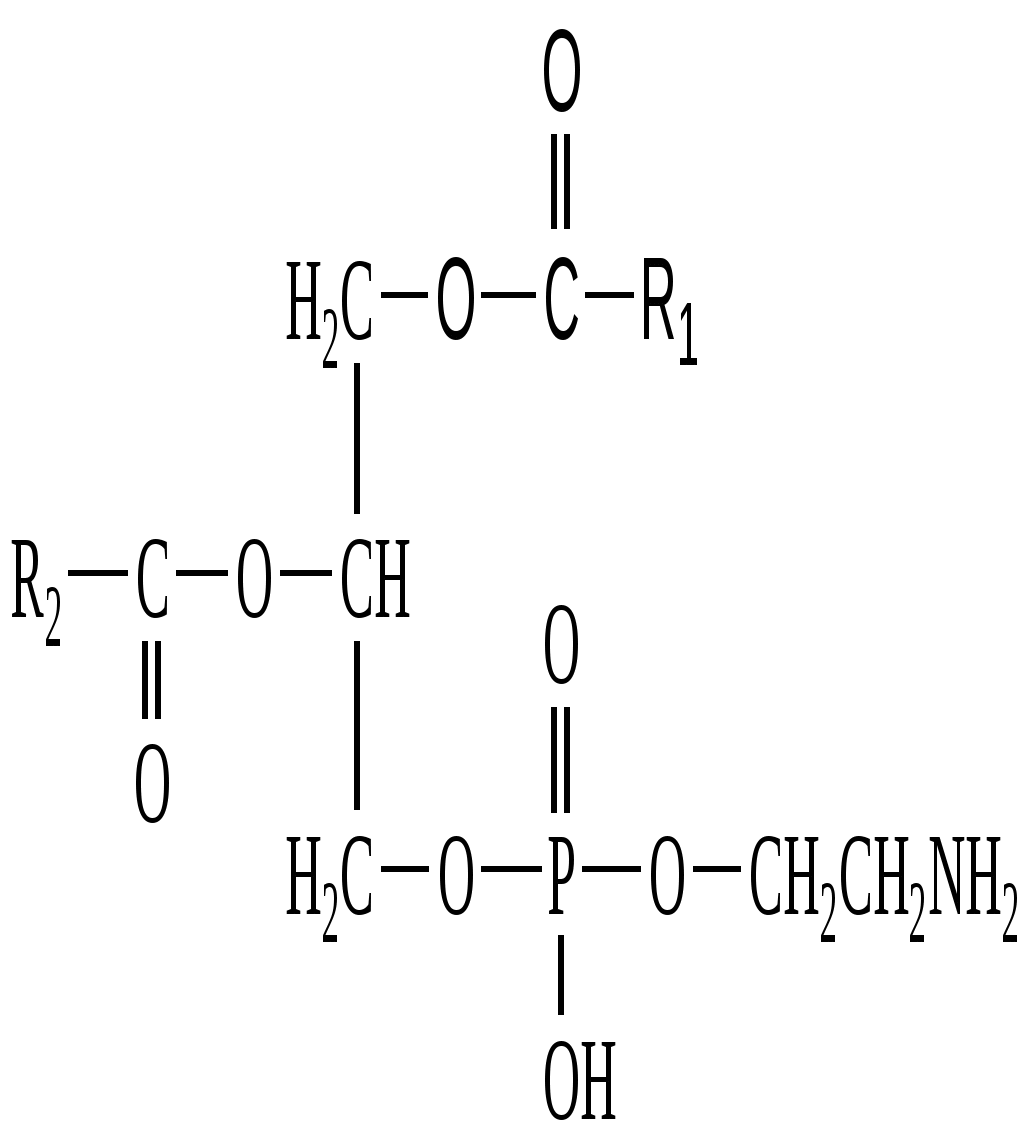
L –Фосфатидилэтаноламин
(Кефалин)
|
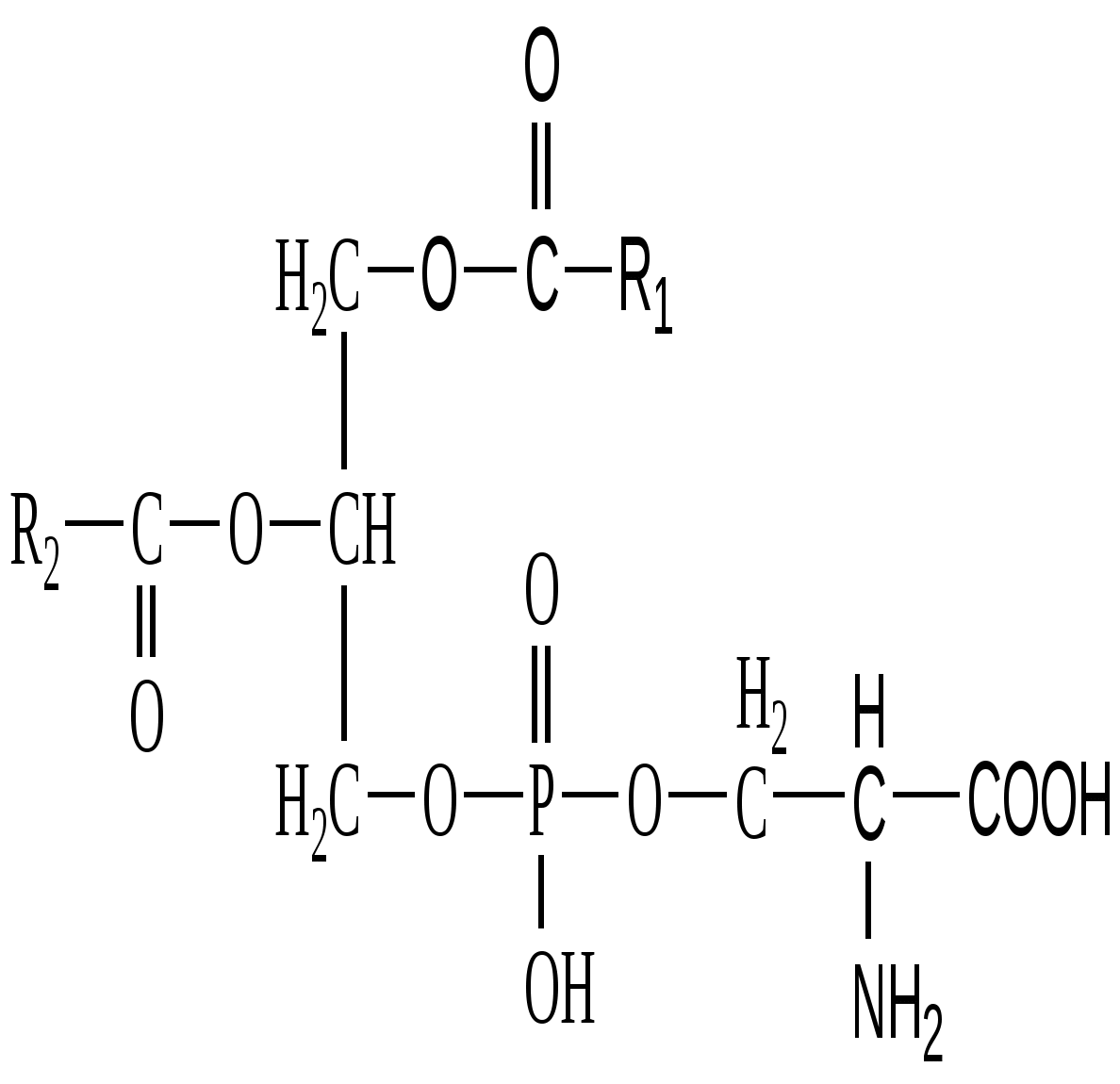
L -Фосфатидилсерин
|
Стероиды
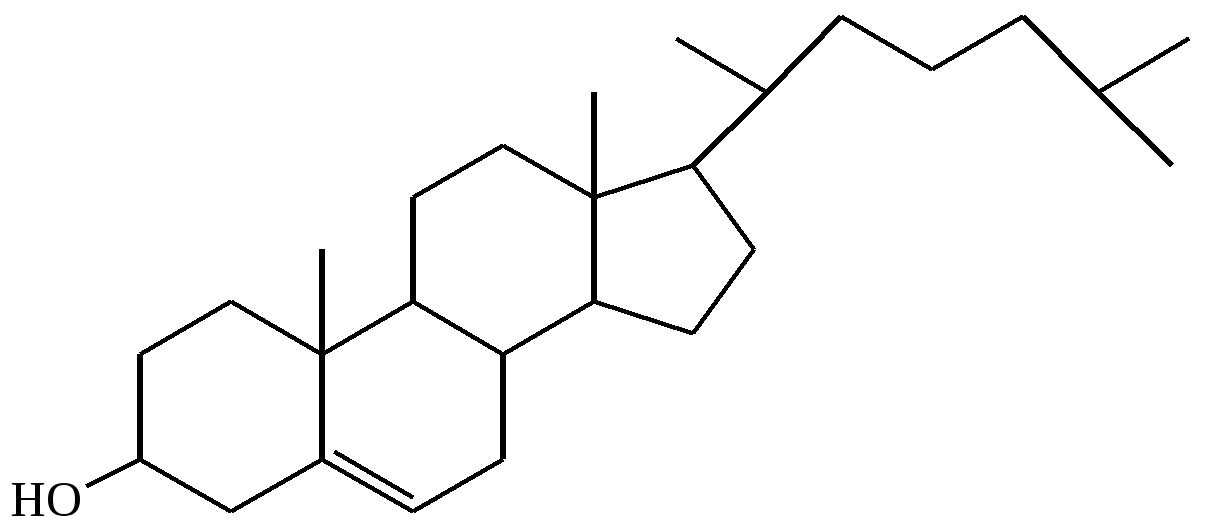
Холестерин
|
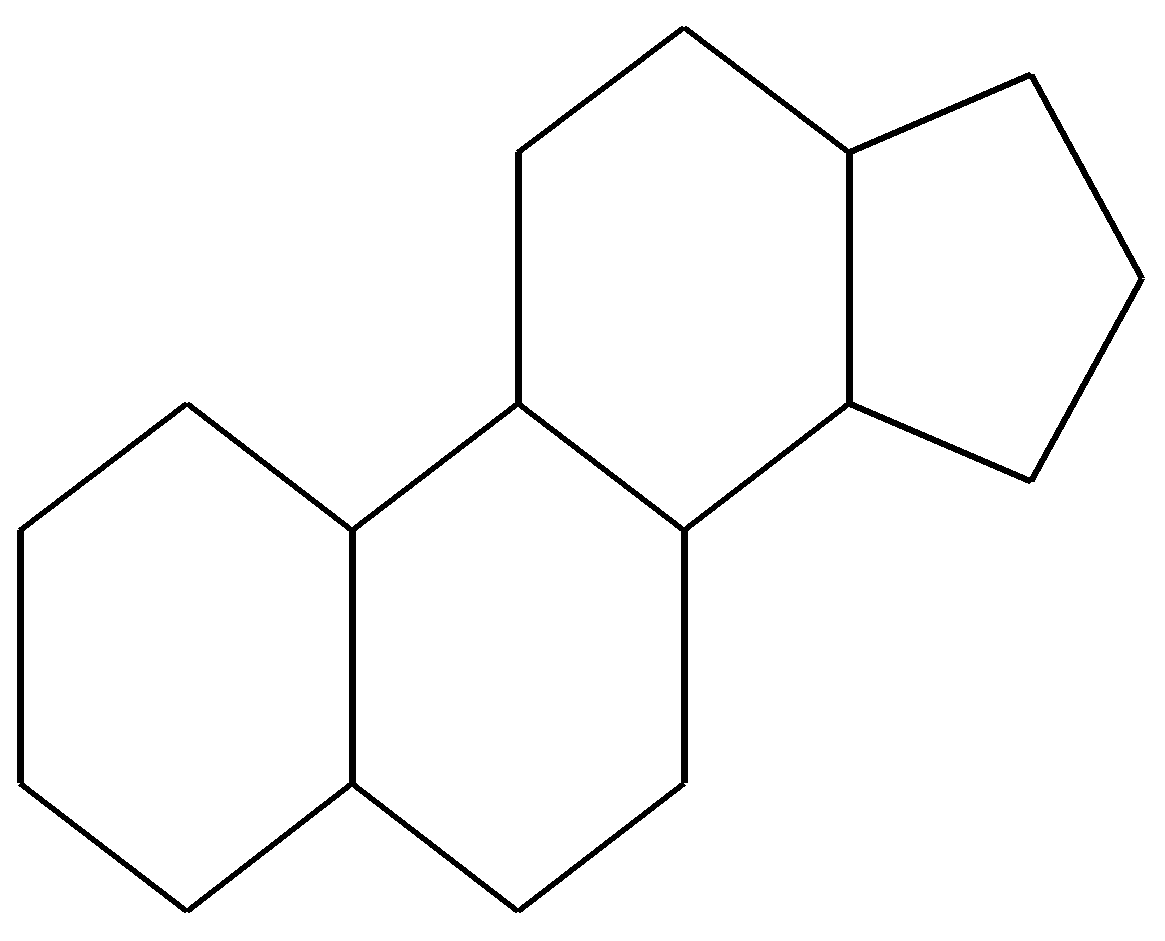
Циклопентанопергидрофенантрен – лежит в основе стероидных соединений
|
L-Аминокислоты ОРГАНИЗМА
Незаменимые аминокислоты обозначены звездочкой -*
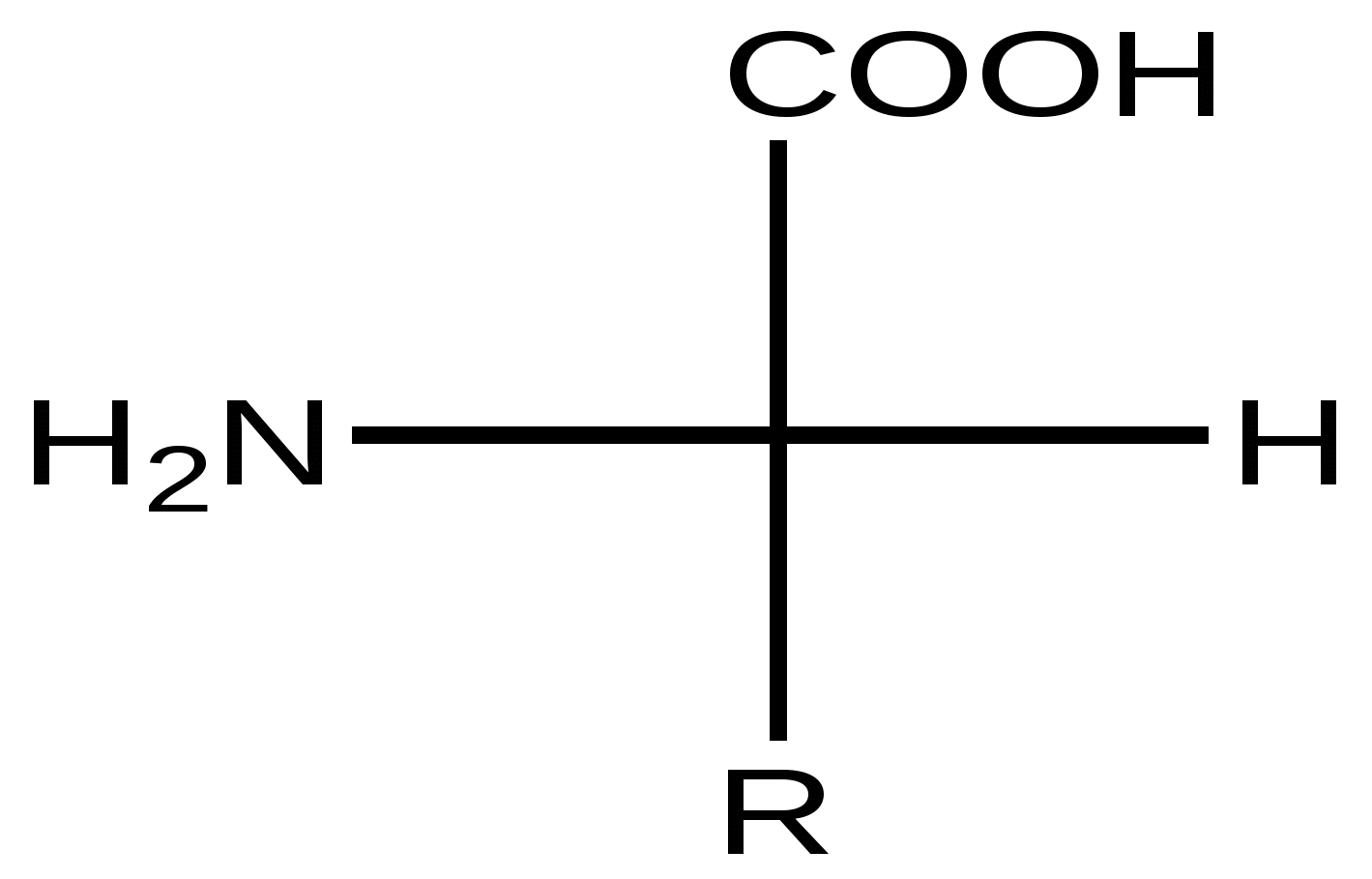
Общая формула α-L-аминокислот
в проекции Фишера
|
|
Алифатические аминокислоты
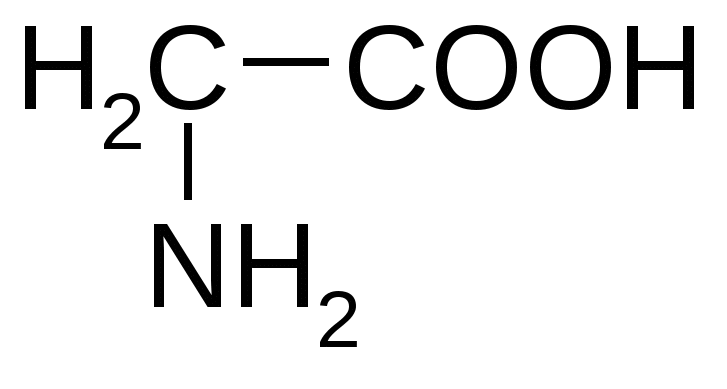
Глицин
|
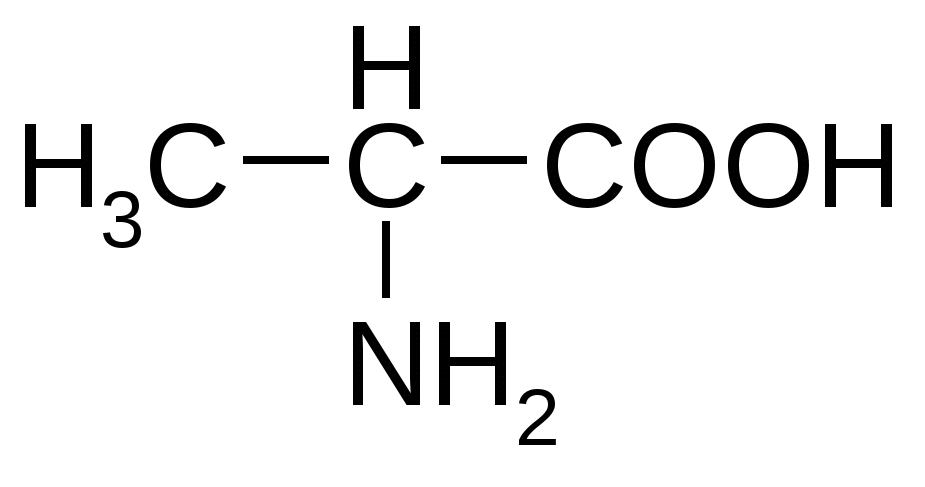
Аланин
|
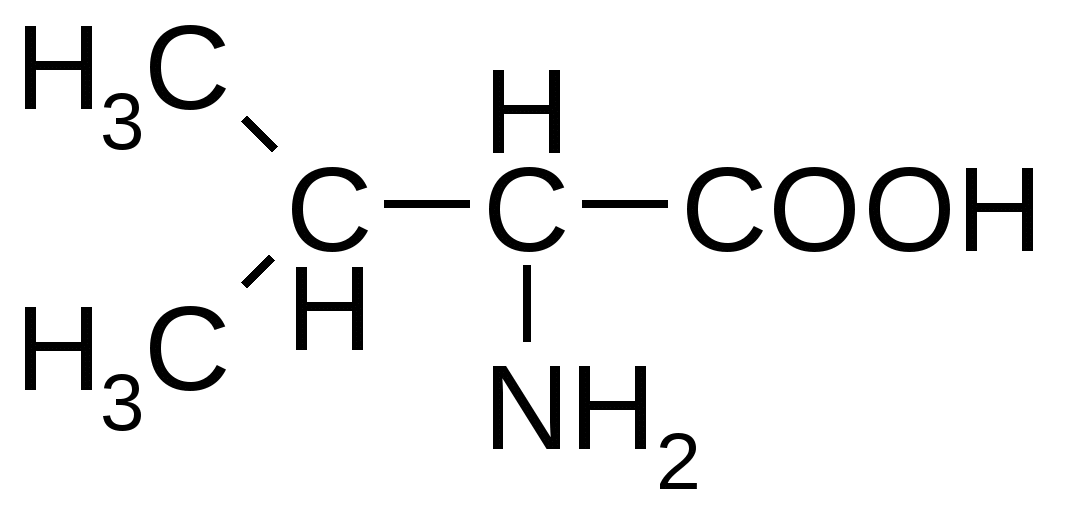
Валин*
|
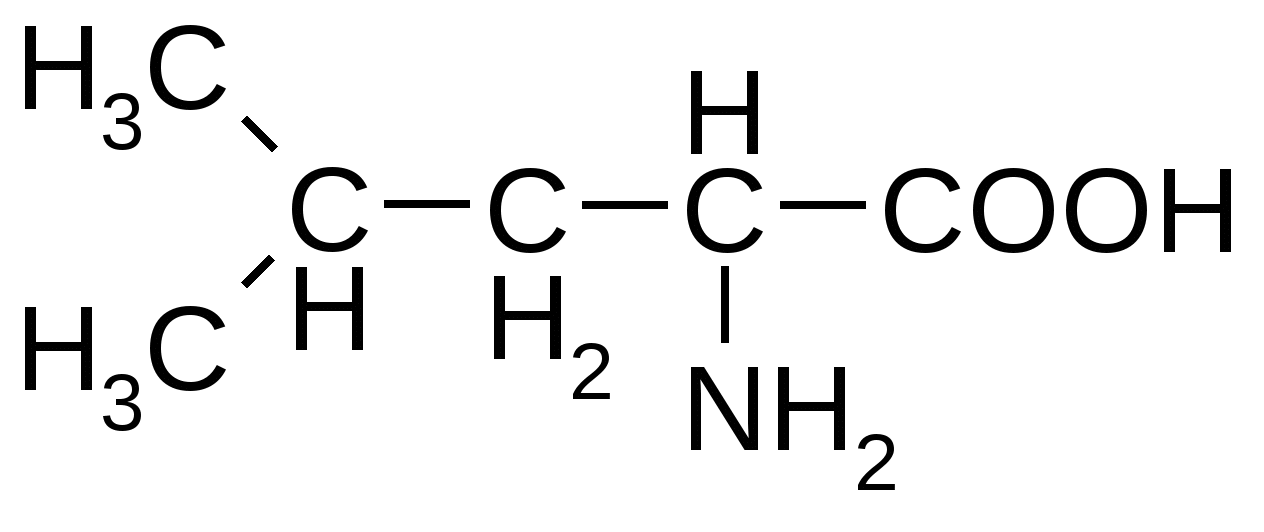
Лейцин*
|
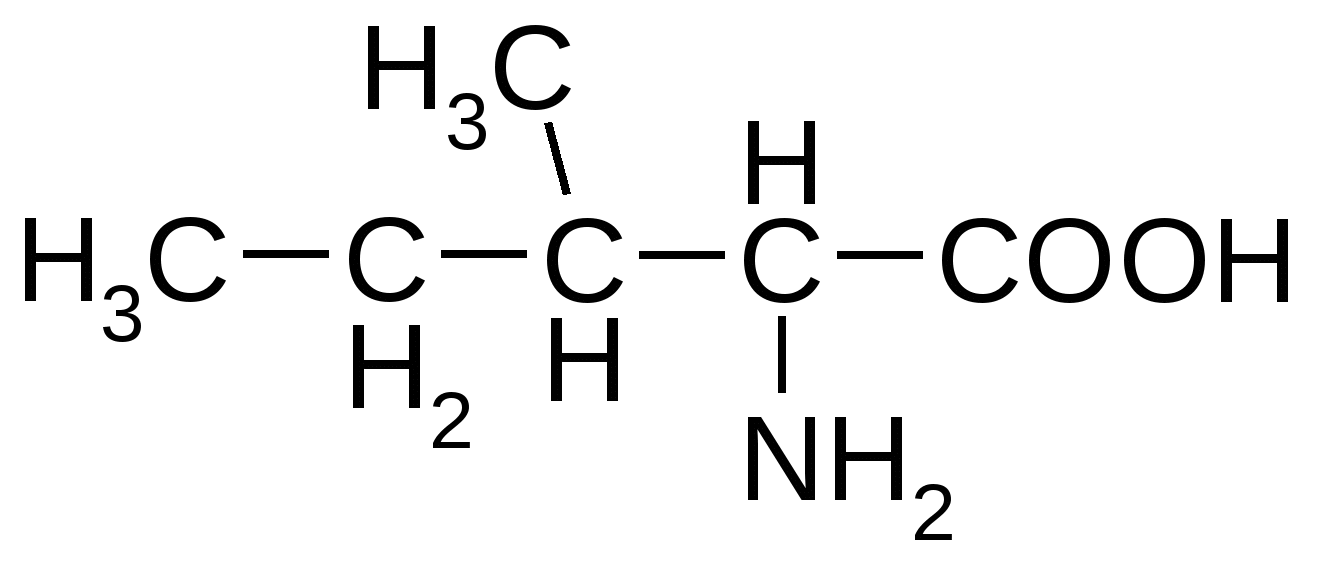
Изолейцин*
|
|
Кислые аминокислоты
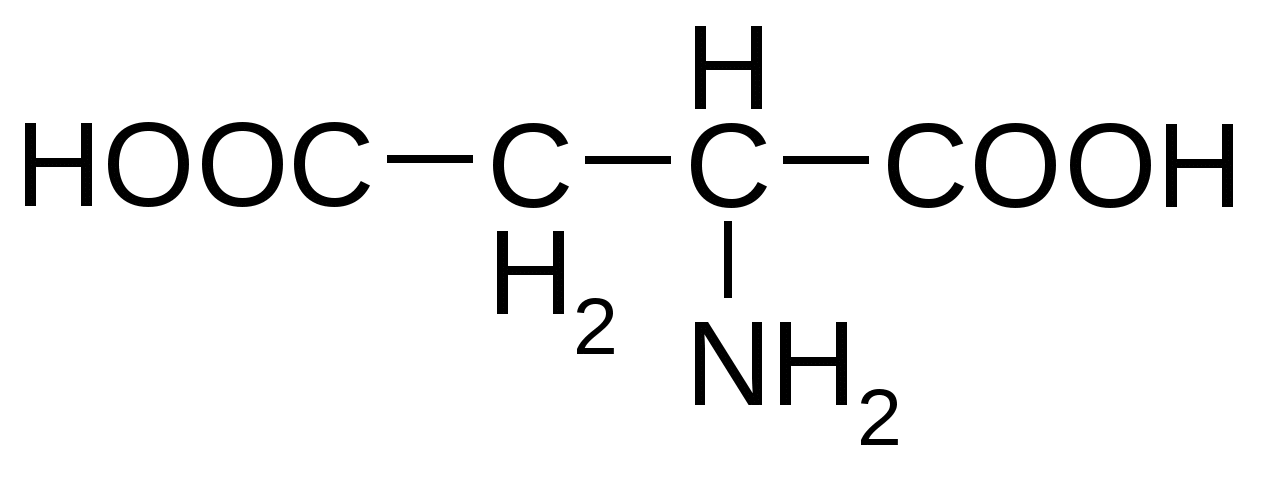
Аспарагиновая кислота
|
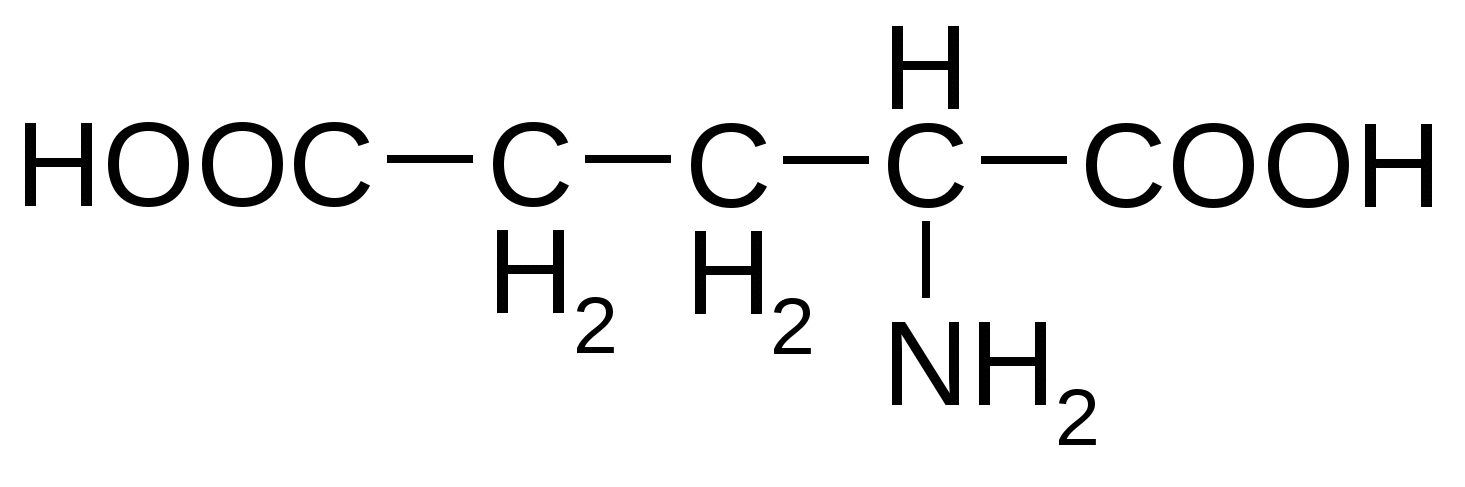
Глутаминовая кислота
|
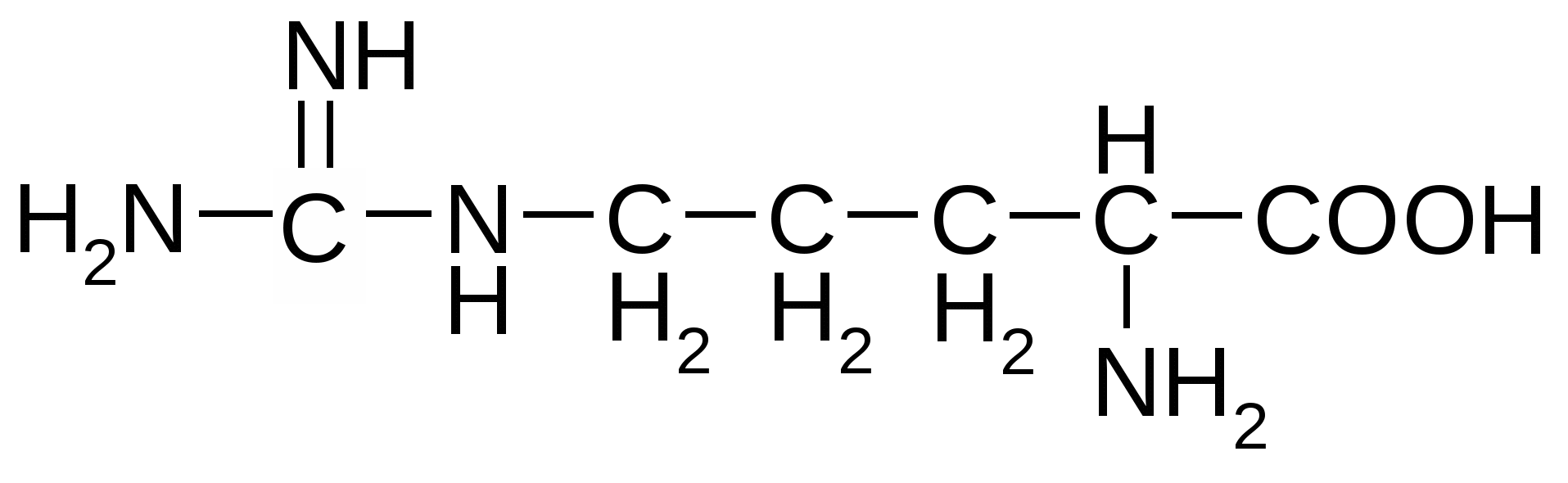
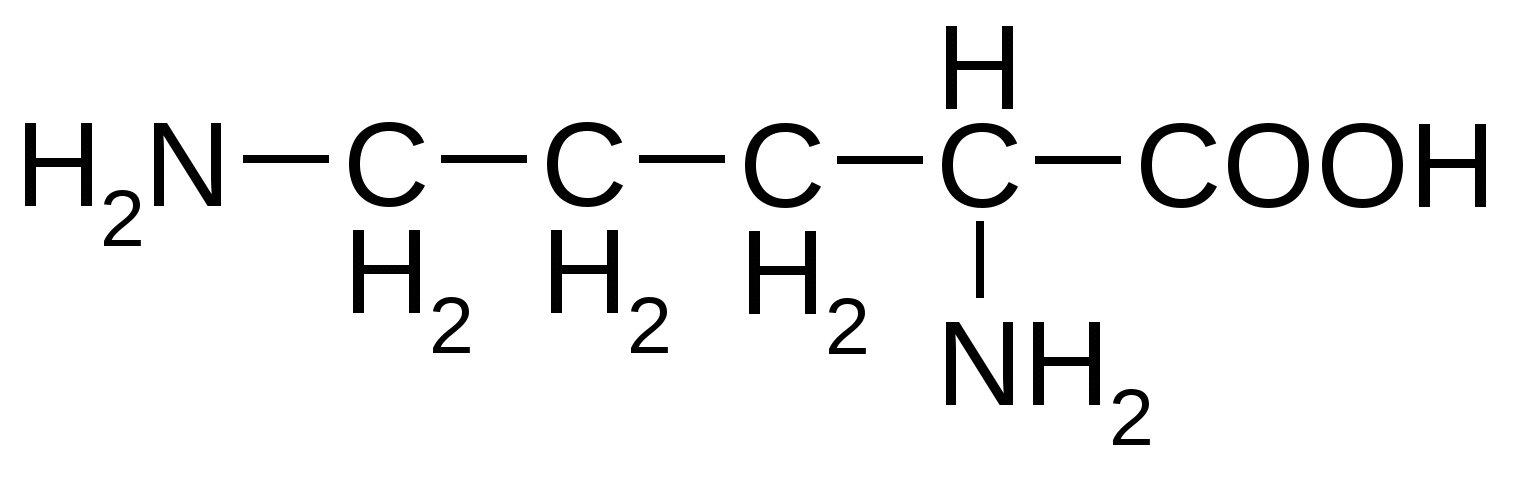
Основные аминокислоты
Аминокислоты, содержащие амидную группу
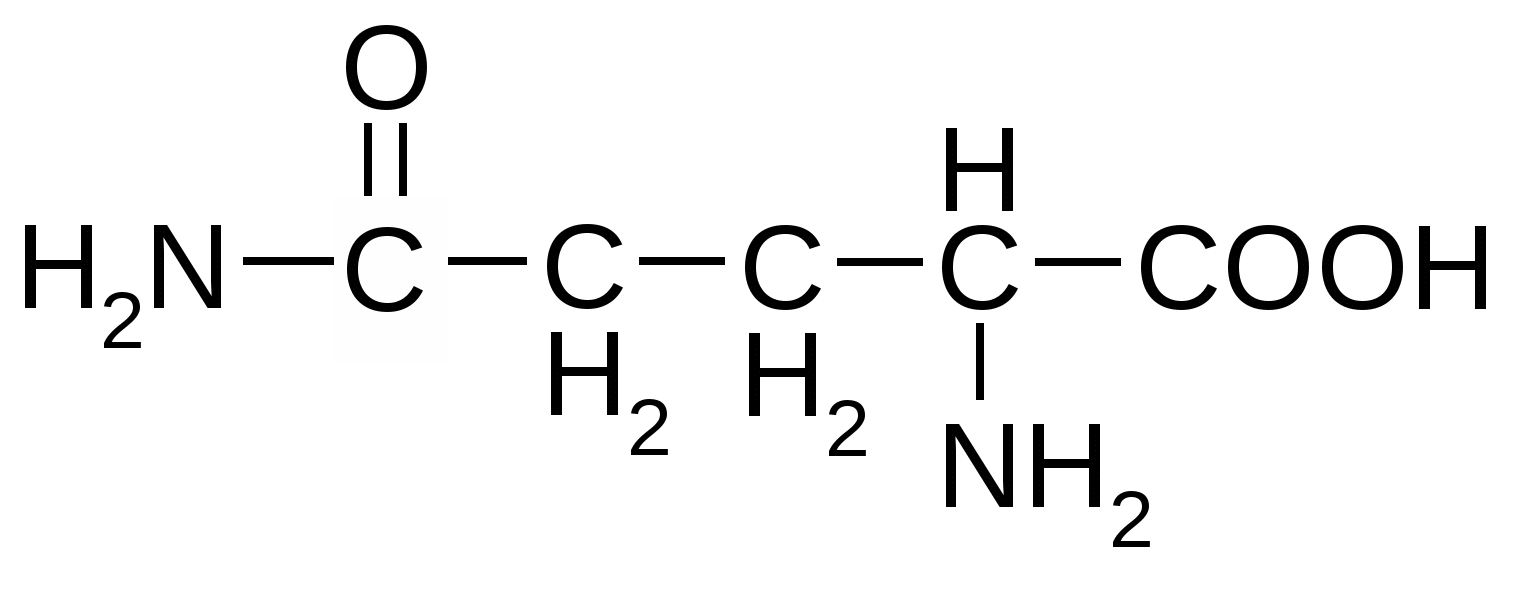
Глутамин
|
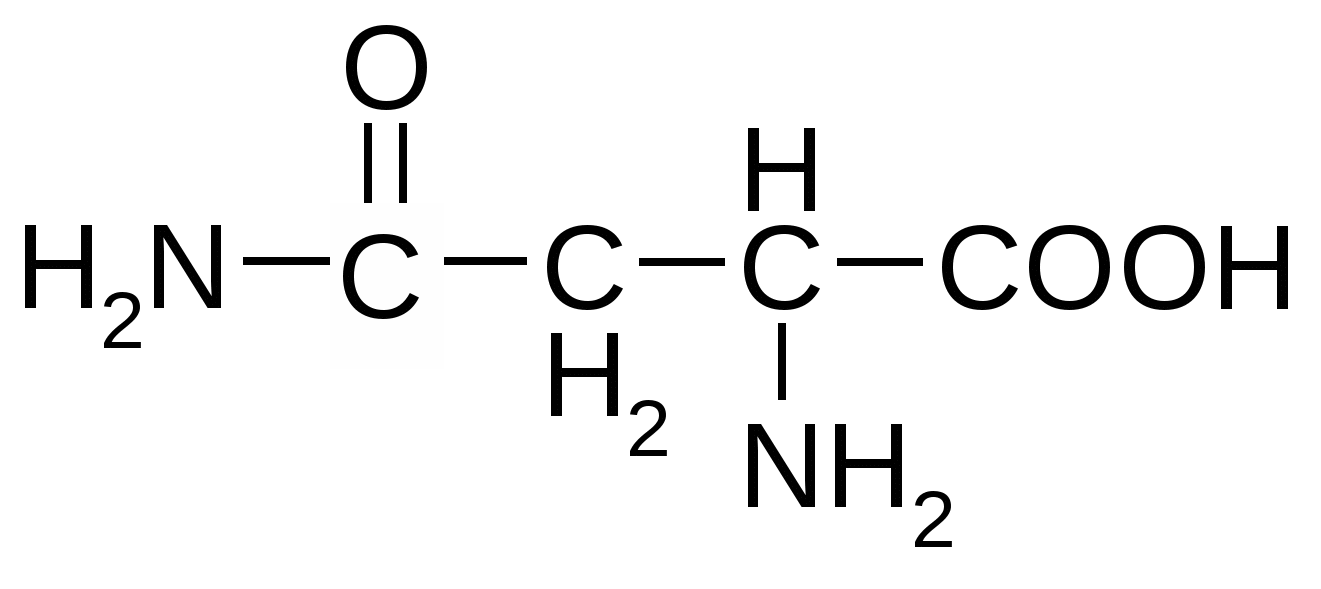
Аспарагин
|
Серусодержащие аминокислоты
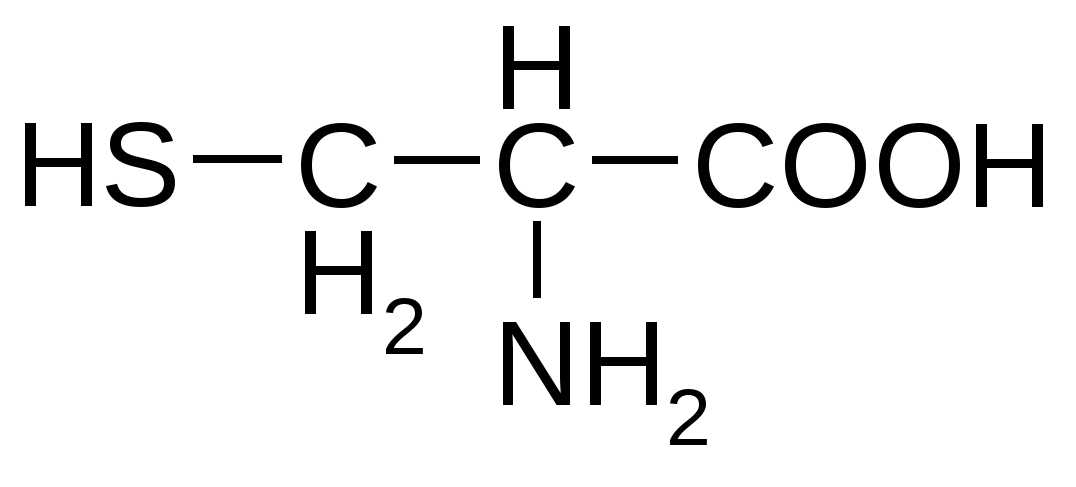
Цистеин
|
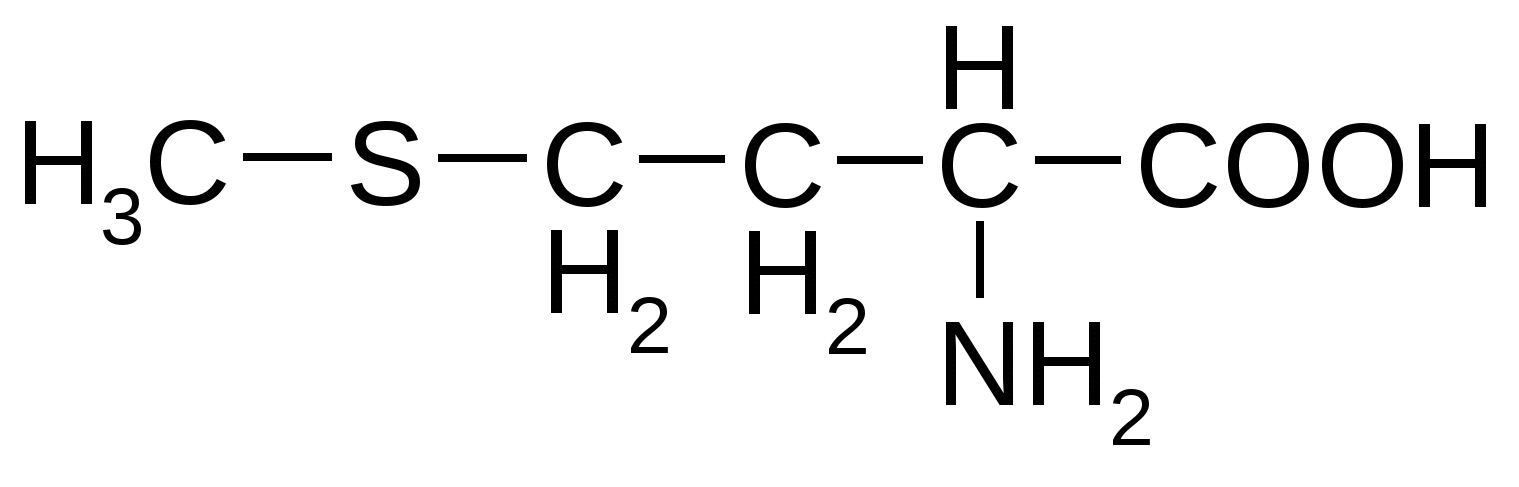
Метионин*
|
Гидроксиаминокислоты
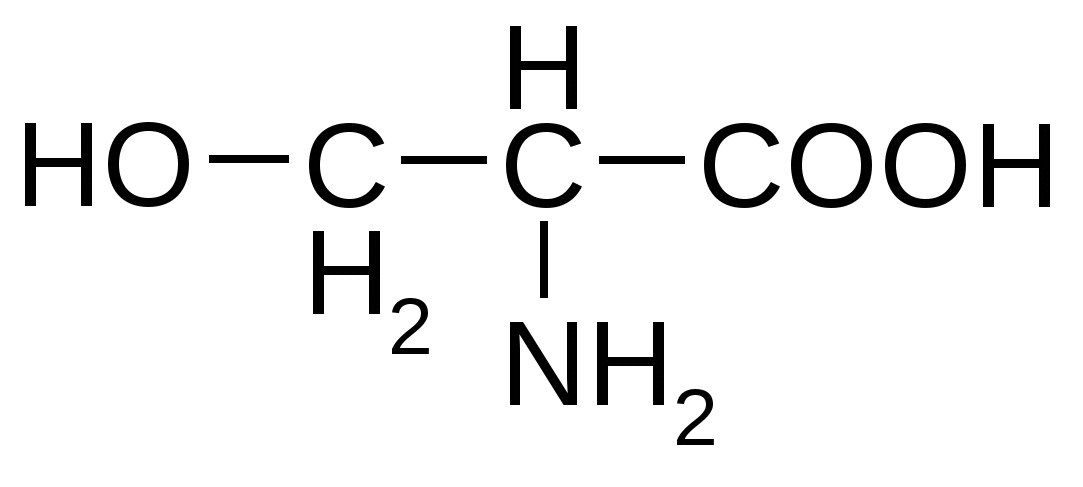
Серин
|
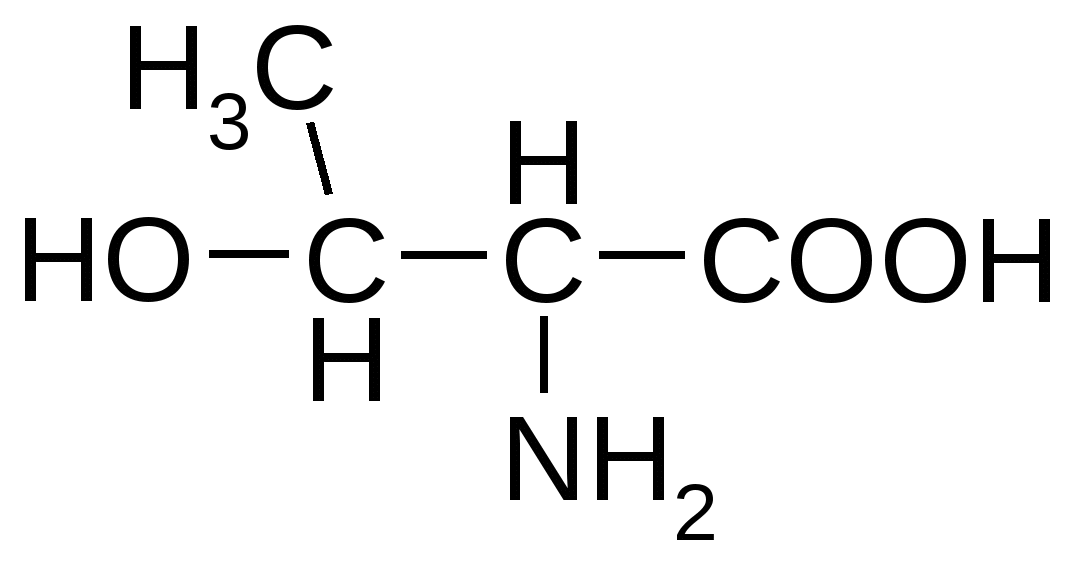
Треонин*
|
Карбоциклические ароматические аминокислоты
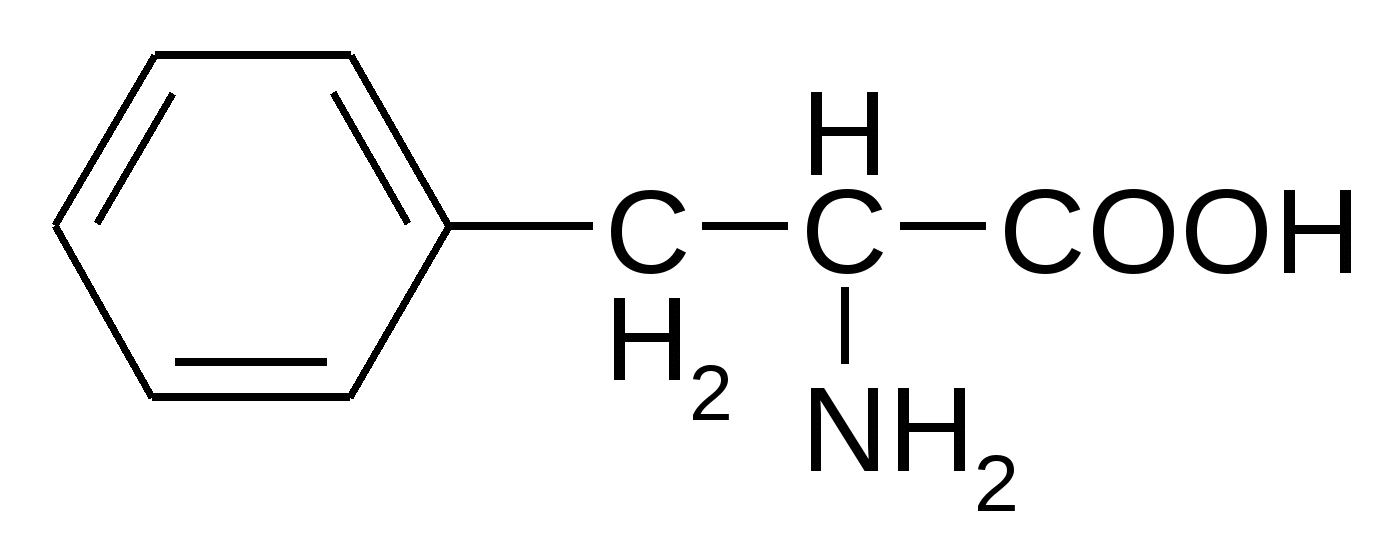
Фенилаланин*
|
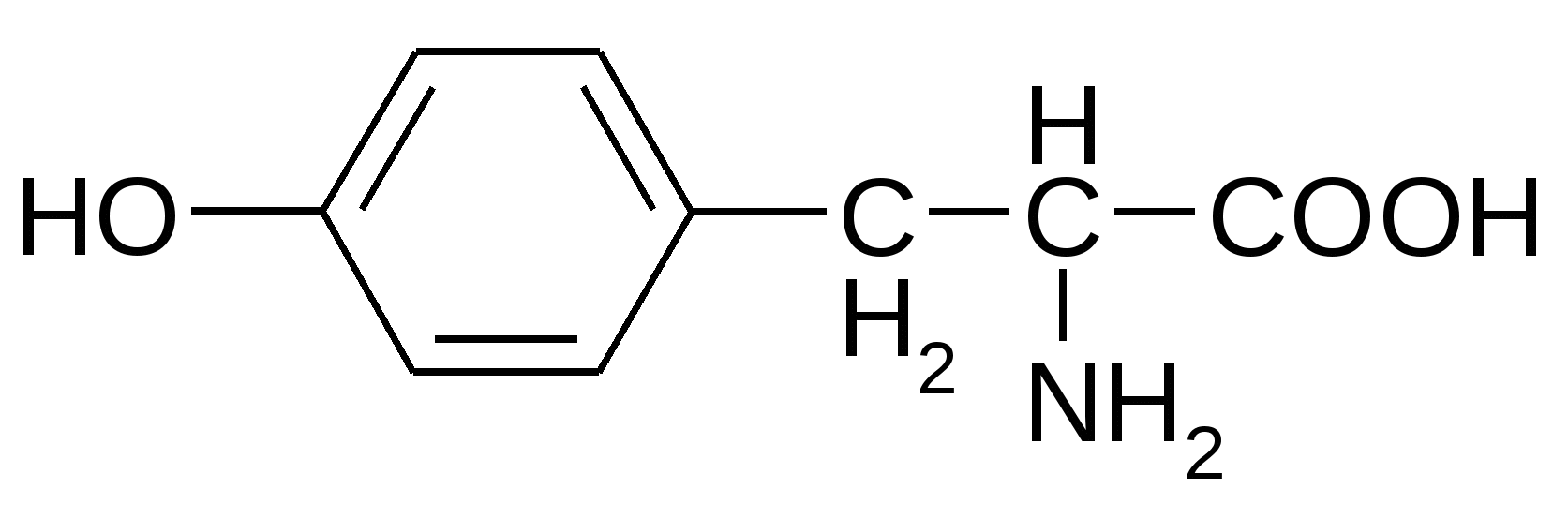
Тирозин
|
Гетероциклические ароматические аминокислоты
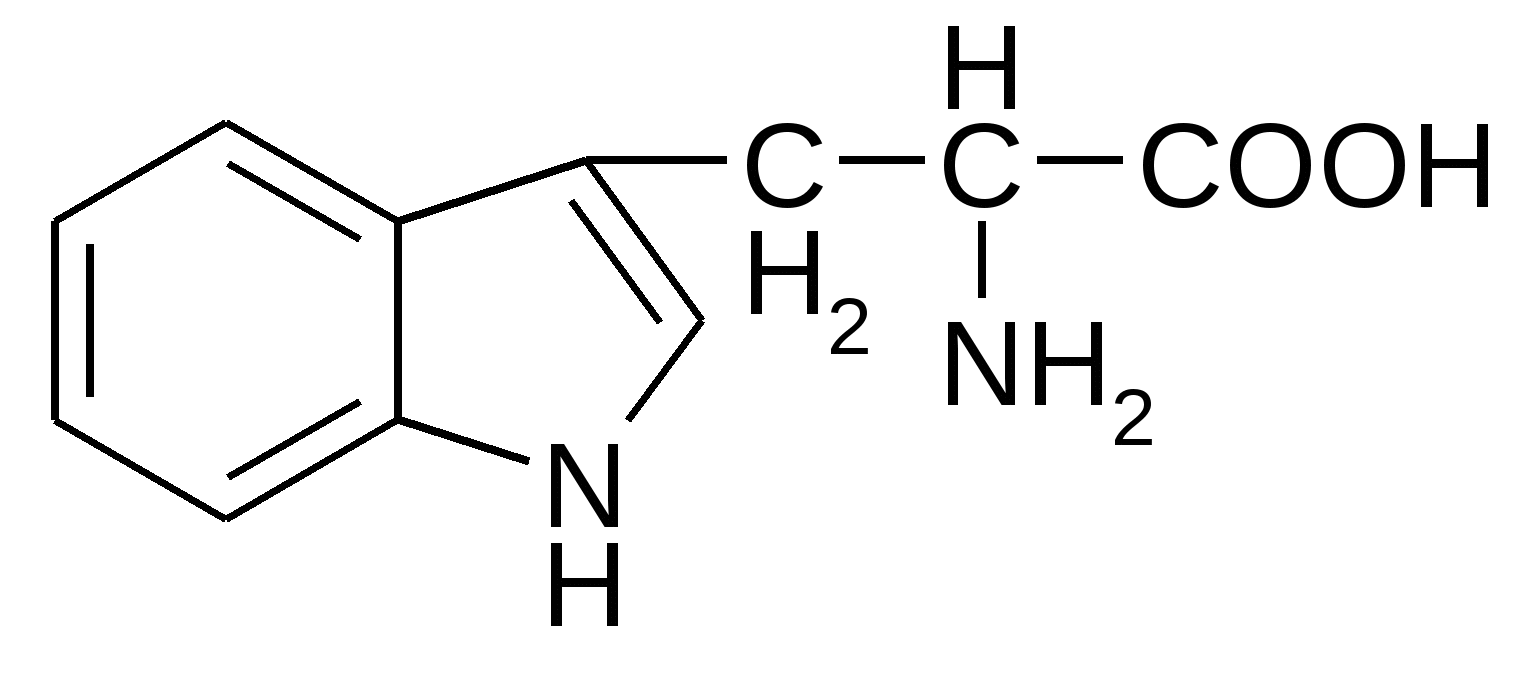 Триптофан* Триптофан*
|
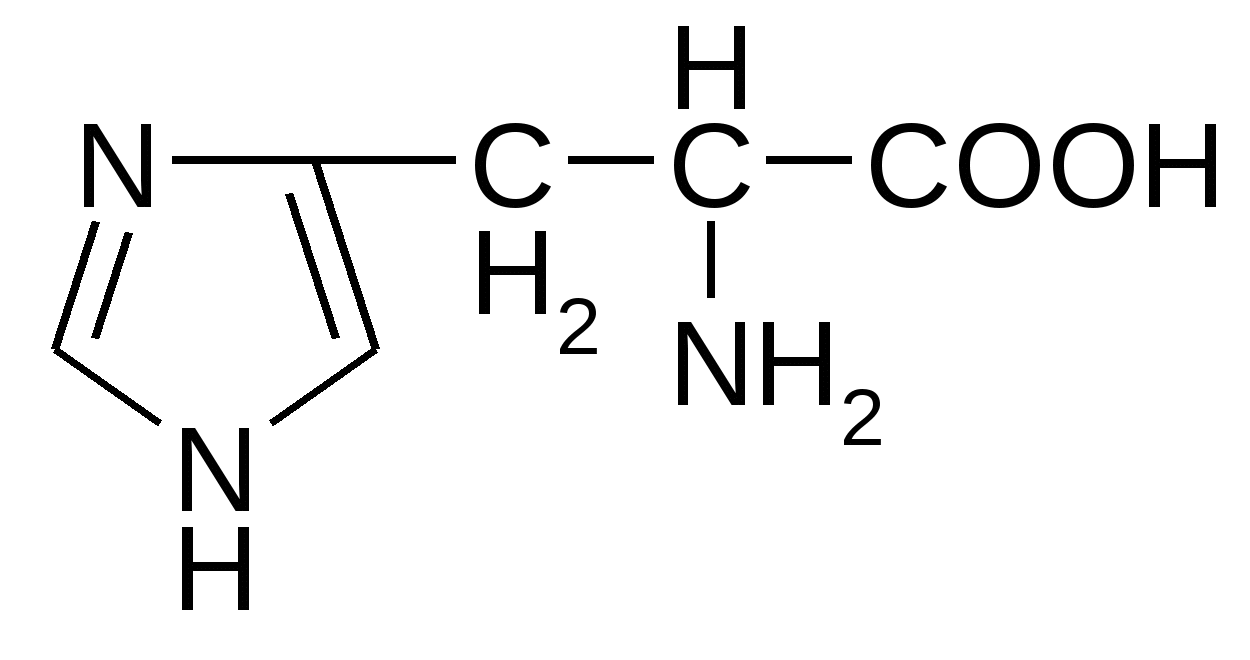
Гистидин
|
Циклические аминокислоты
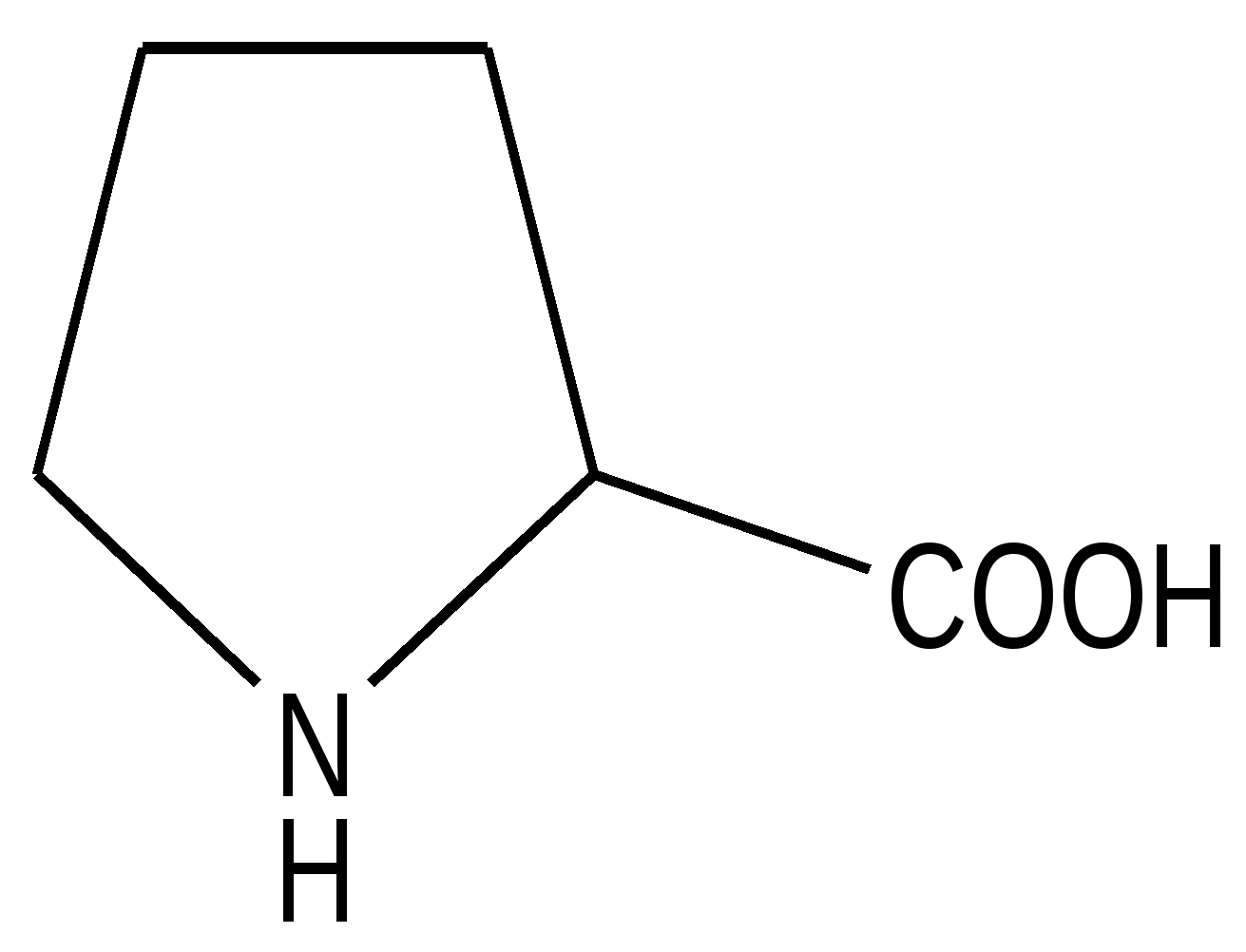
Пролин
|
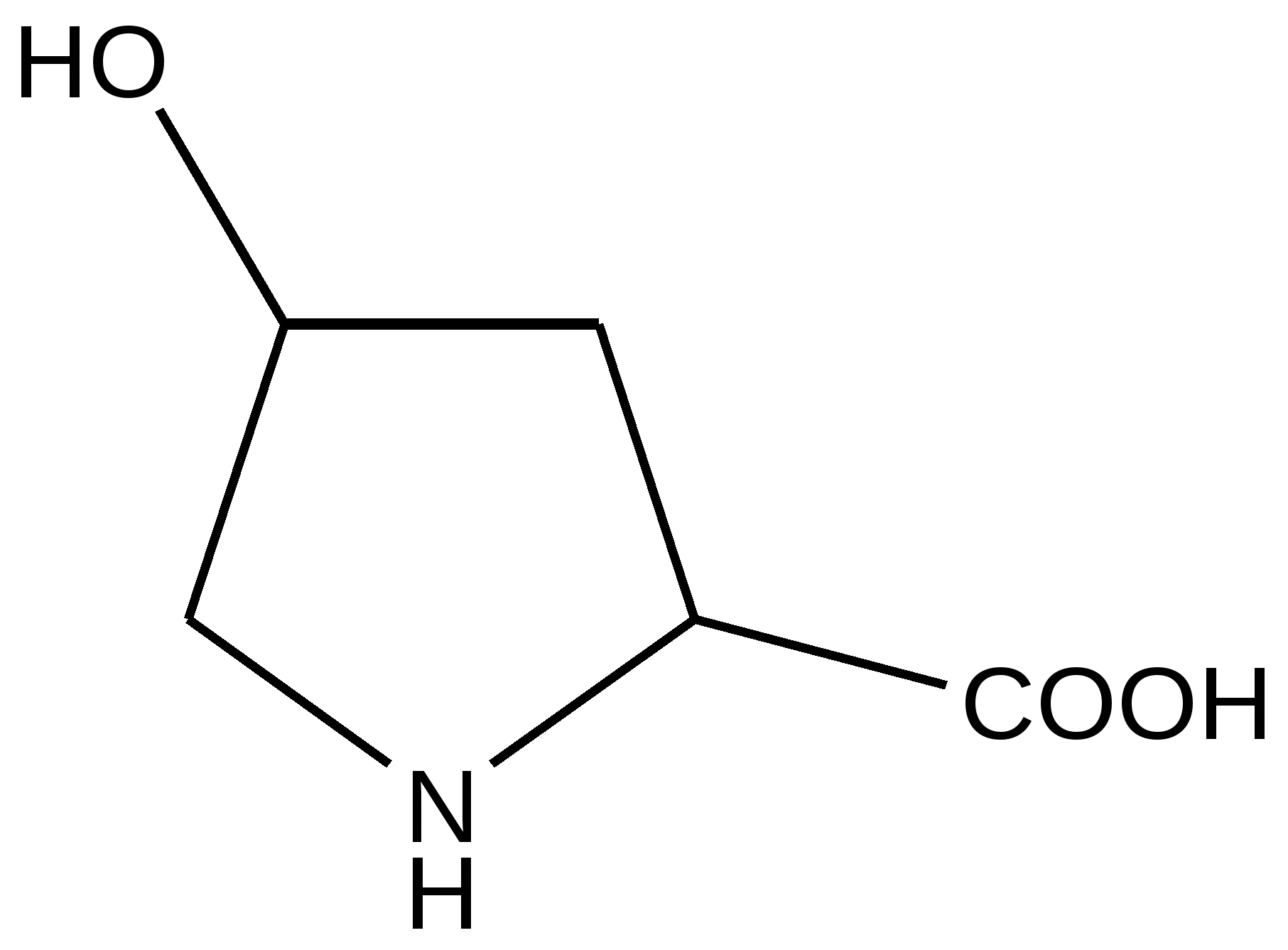
4-гидроксипролин
|
Углеводы и их производные
Моносахариды: надо знать в линейных и аномерных циклических формах и их производные – многоатомные спирты, оновые, уроновые, аровые кислоты. Понятия: аномеры, эпимеры, диастереомеры, D- , L-ряды.
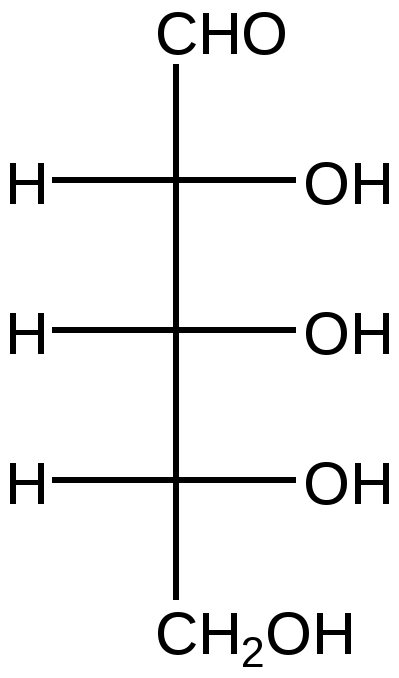
D-Рибоза
|
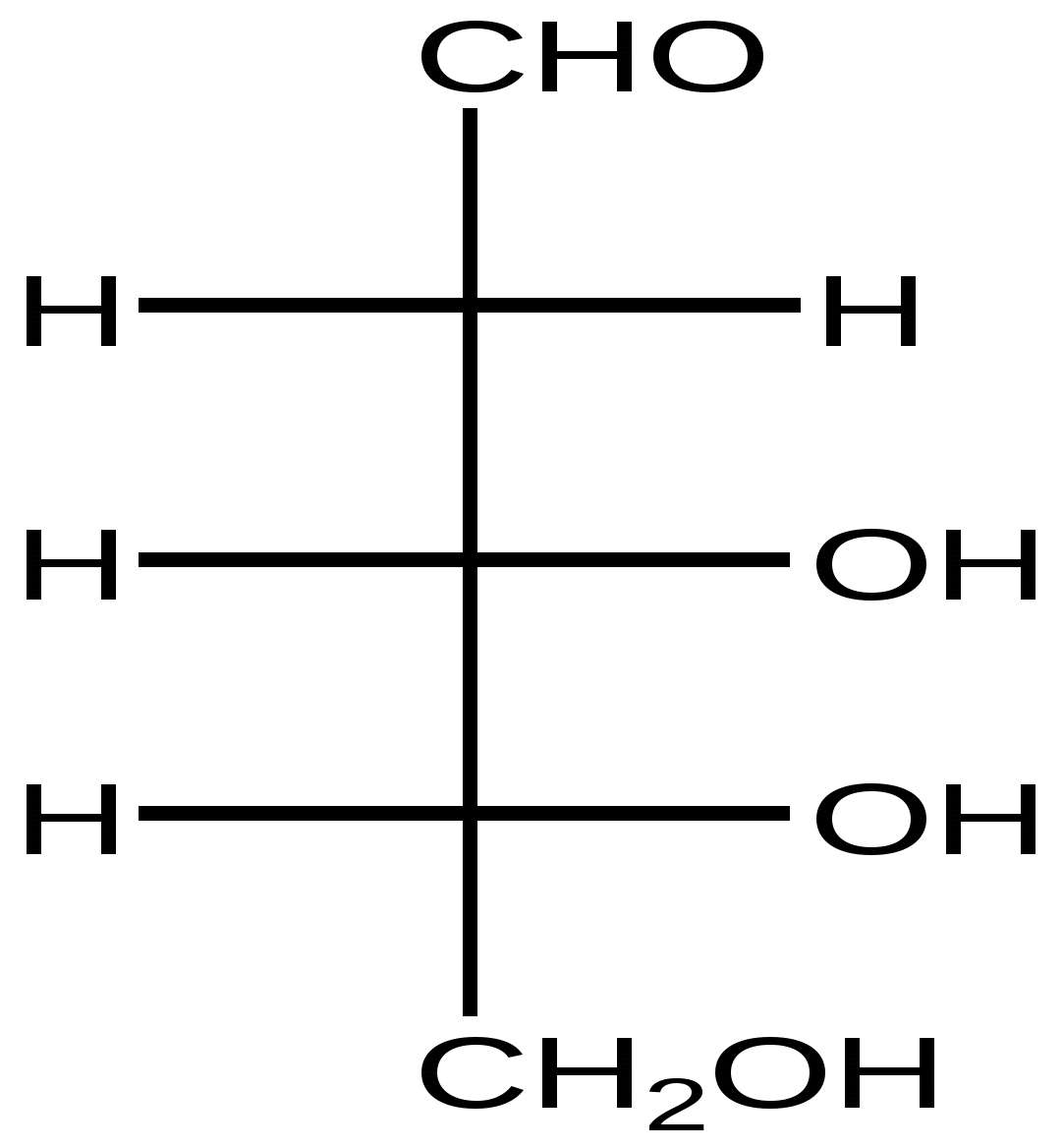
2-дезокси-D-рибоза
|
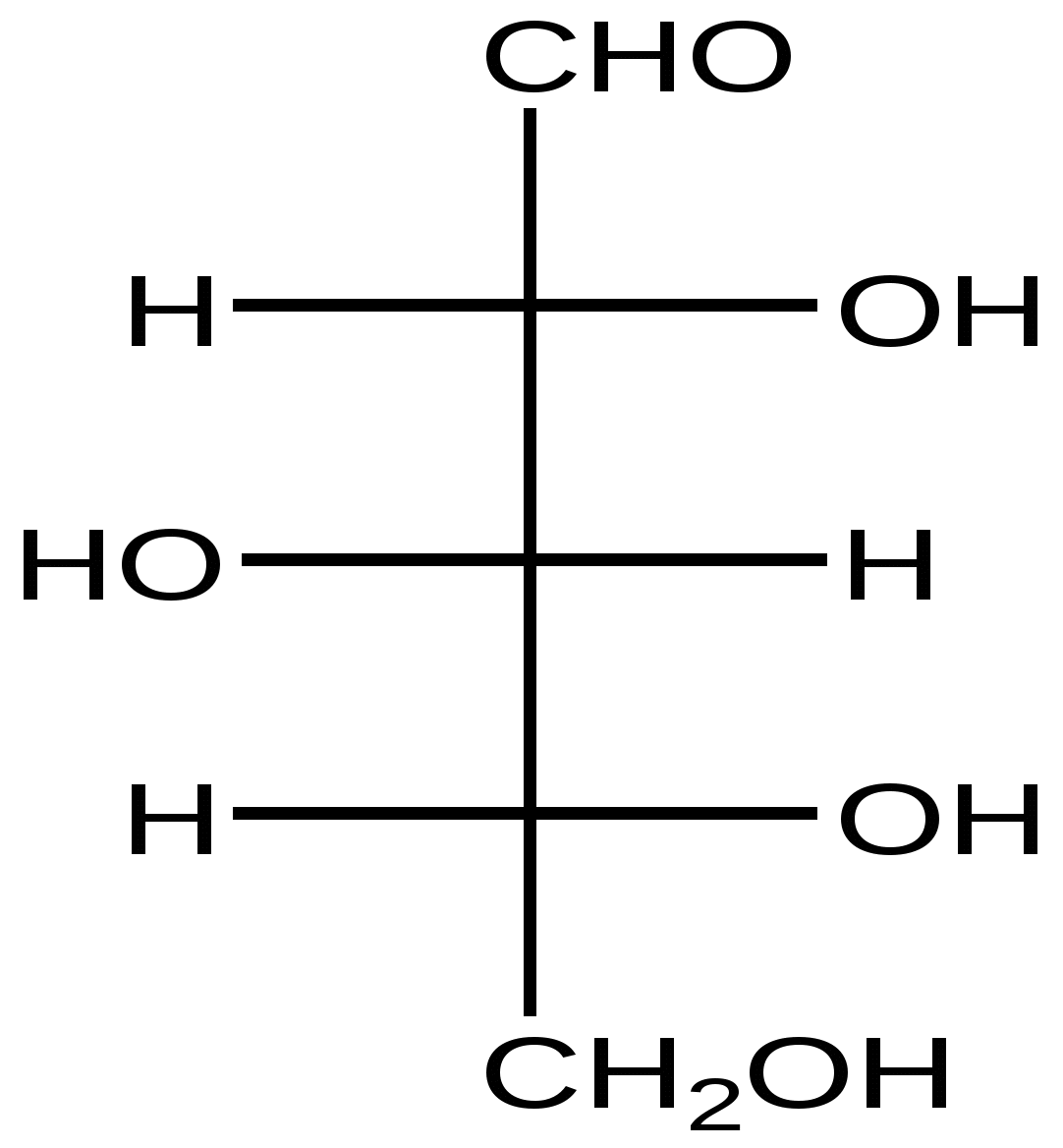
D-Ксилоза
|
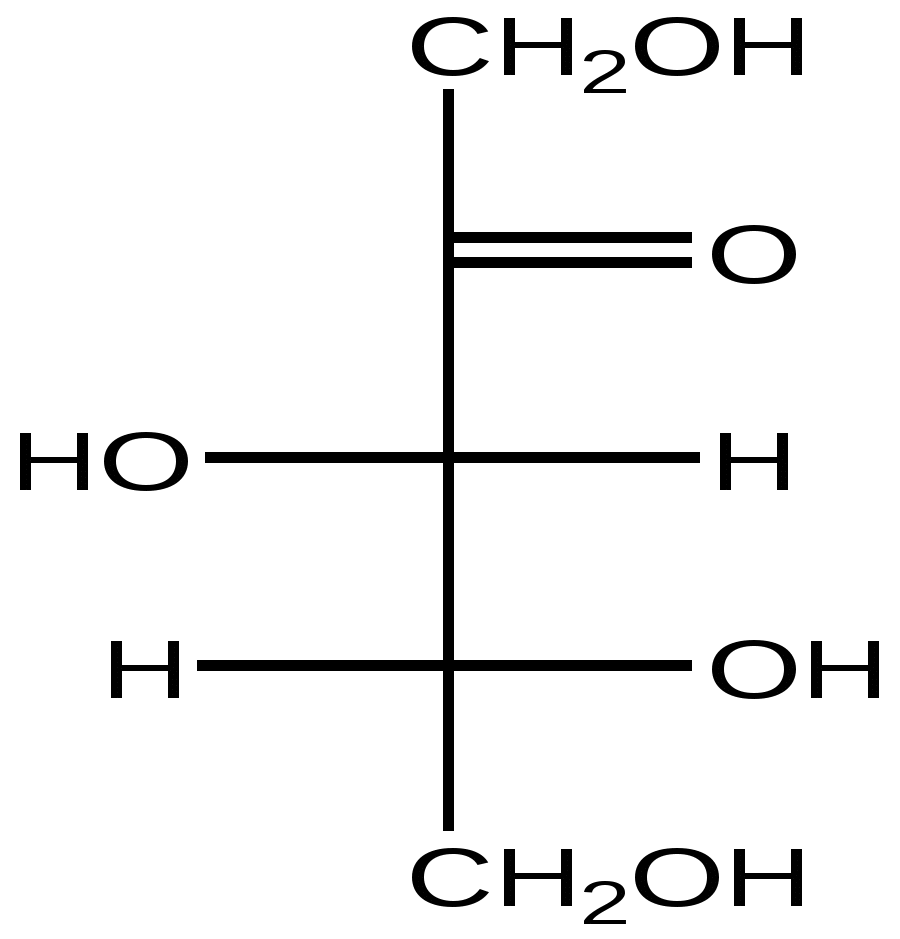
D-Ксилулоза
|
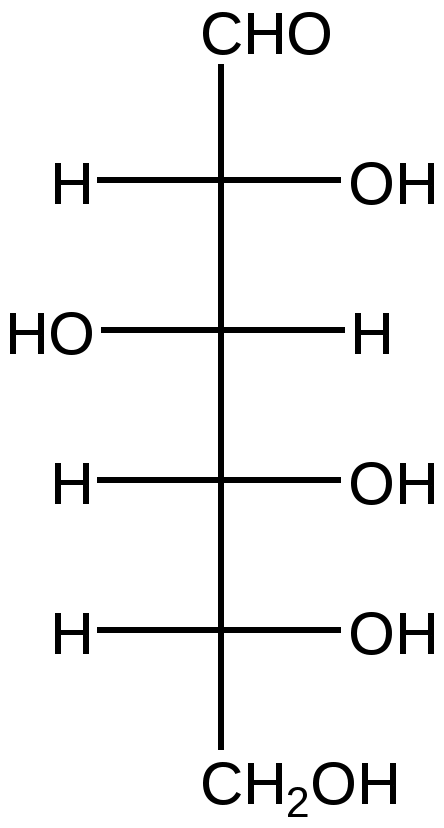 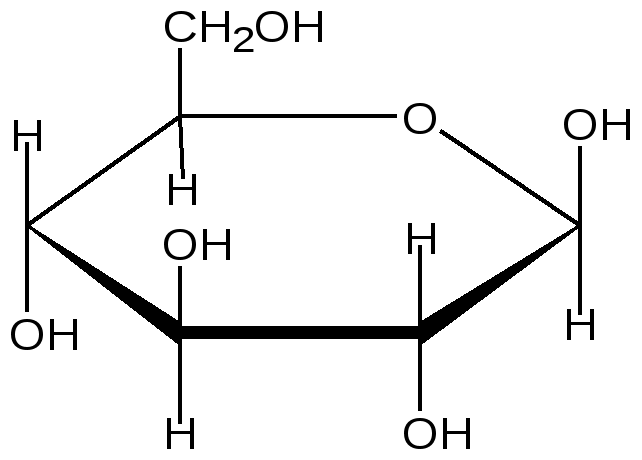
D-Глюкоза β-D-Глюкопираноза
|
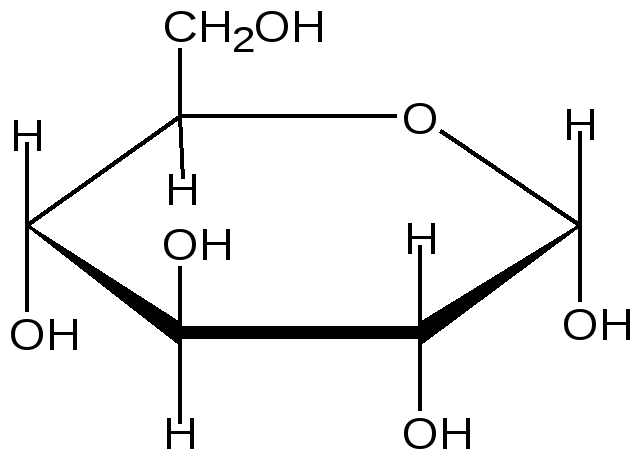
α-D-Глюкопираноза
|

D –Манноза
|
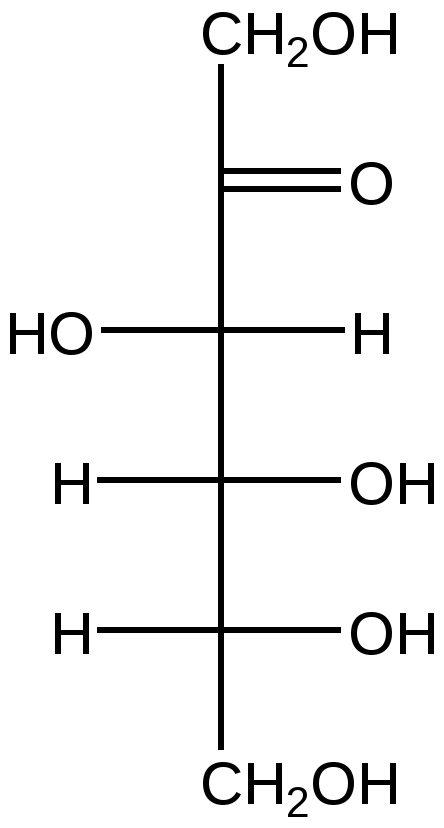 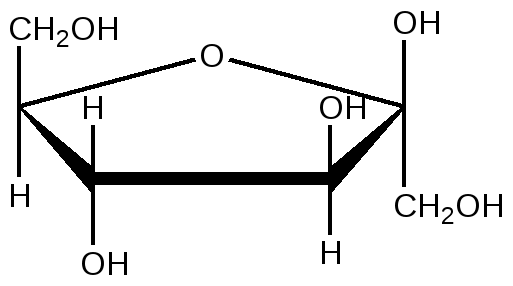
D -Фруктоза β-D-фруктофураноза
|
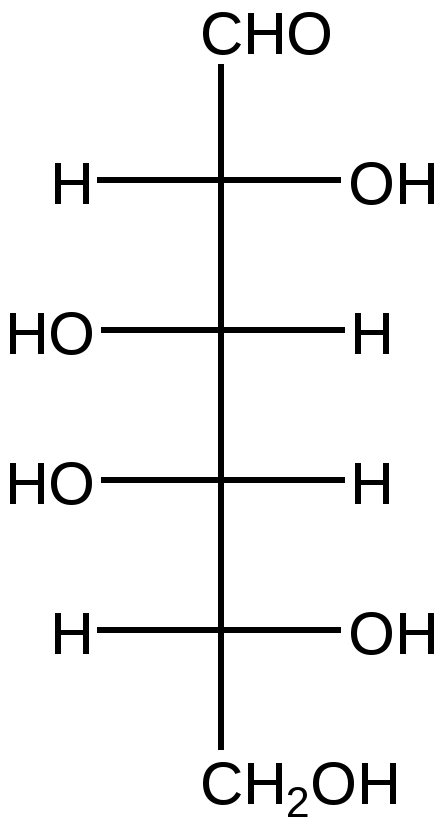 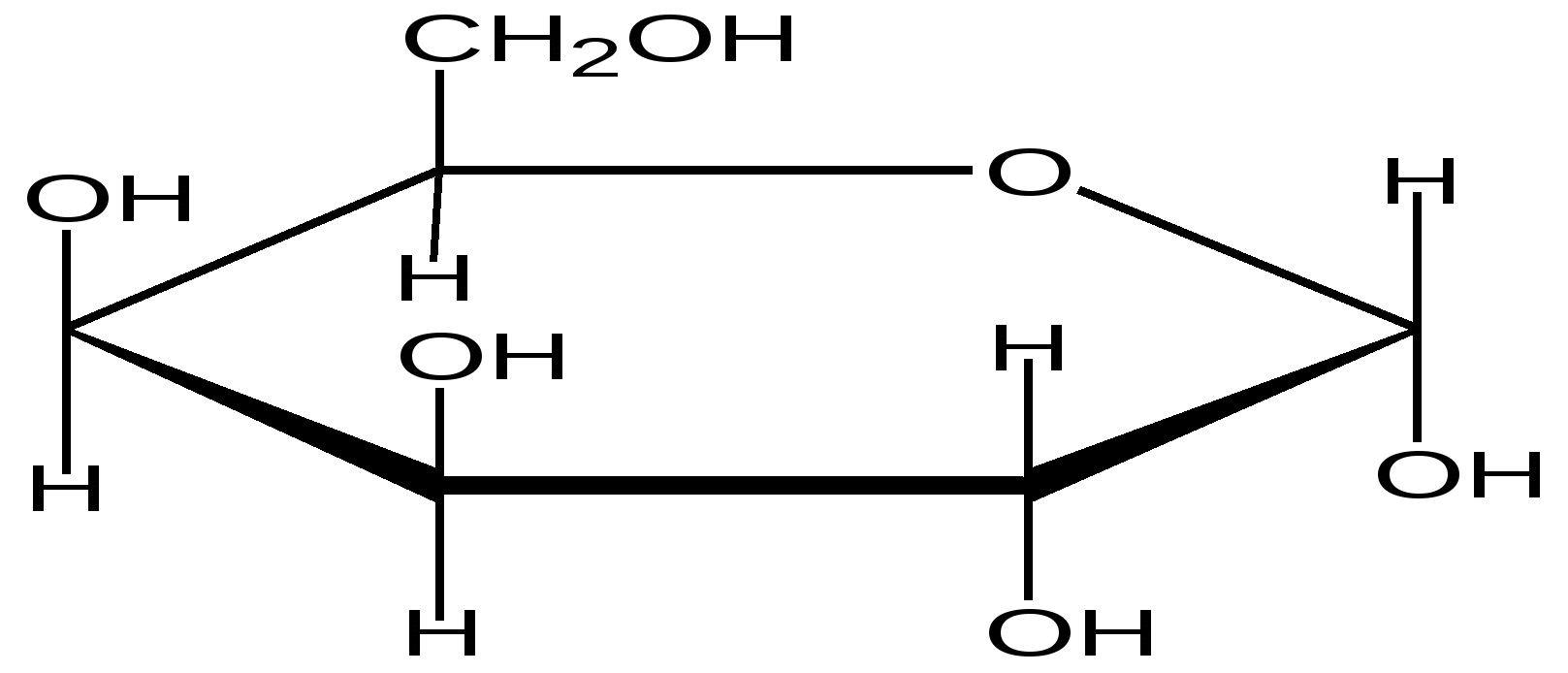
D-Галактоза α-D-Галактопираноза
|
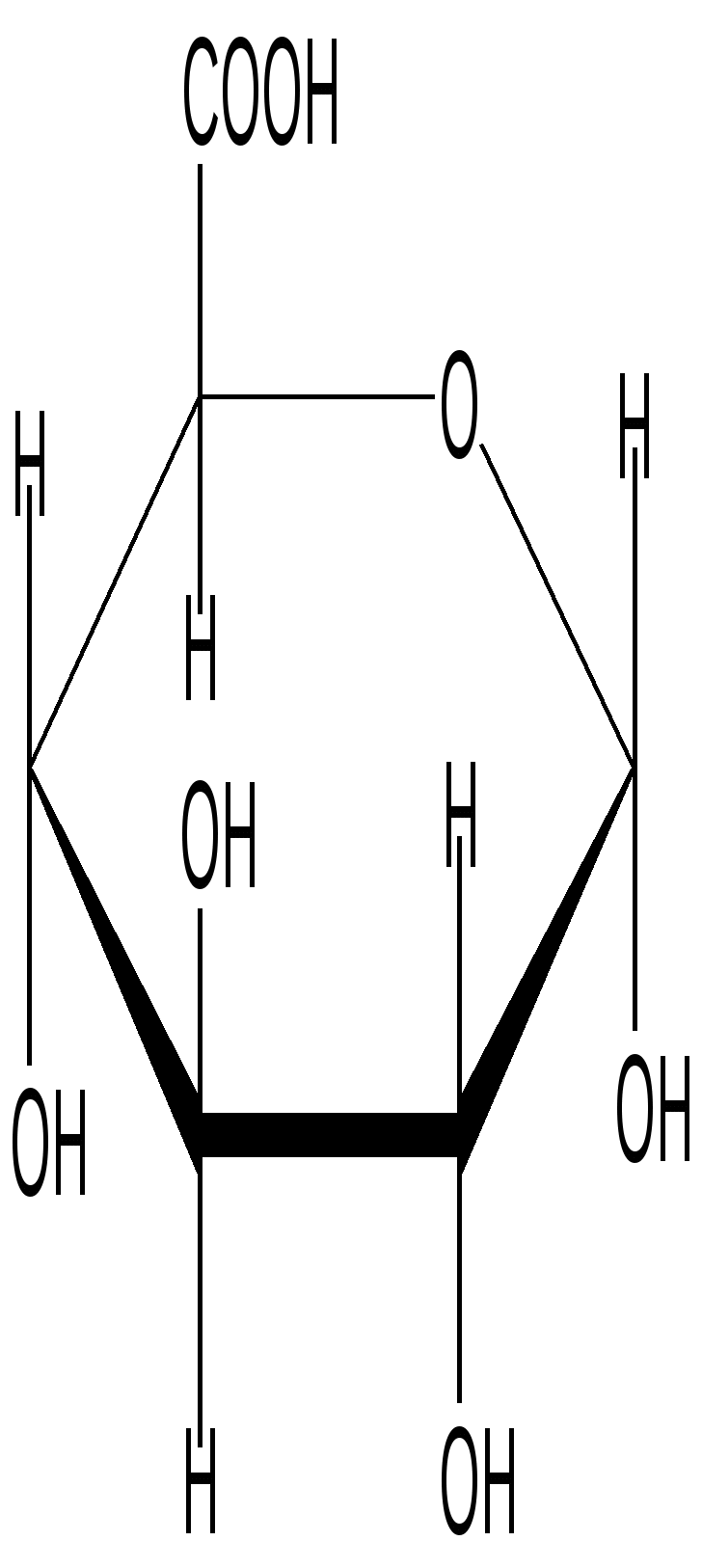
α-пиранозная форма
D-глюкуроновой кислоты
|
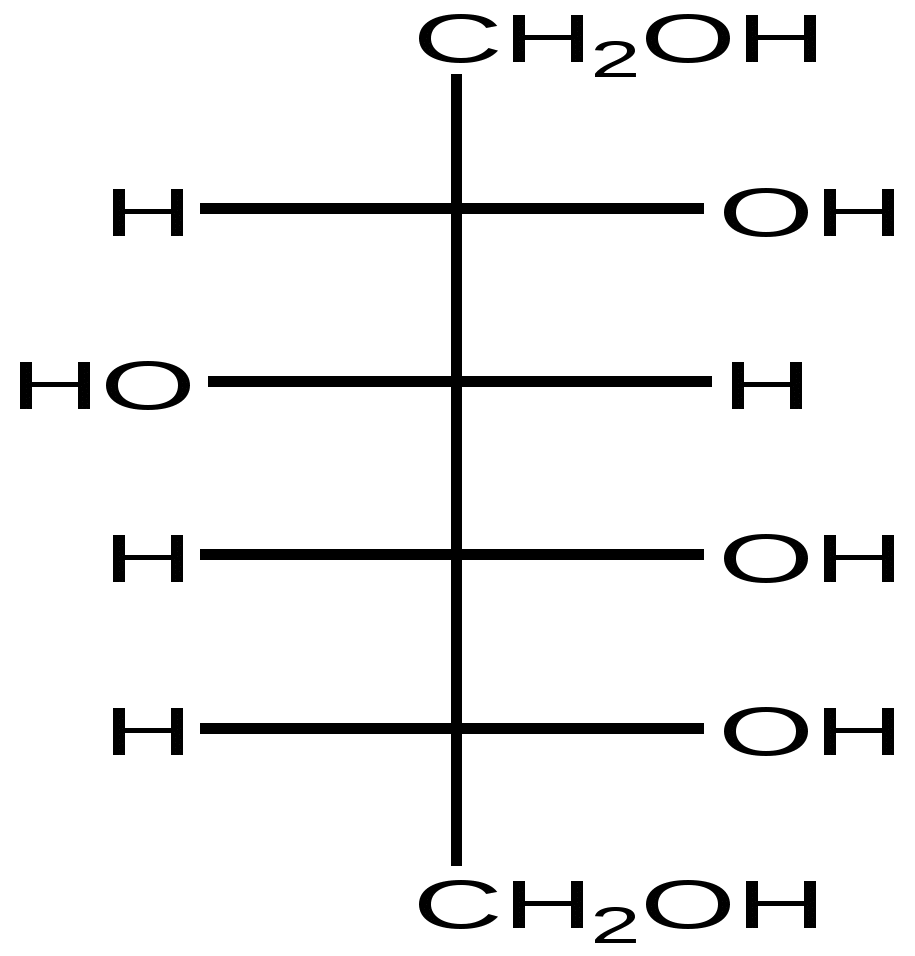
D-Сорбит
|
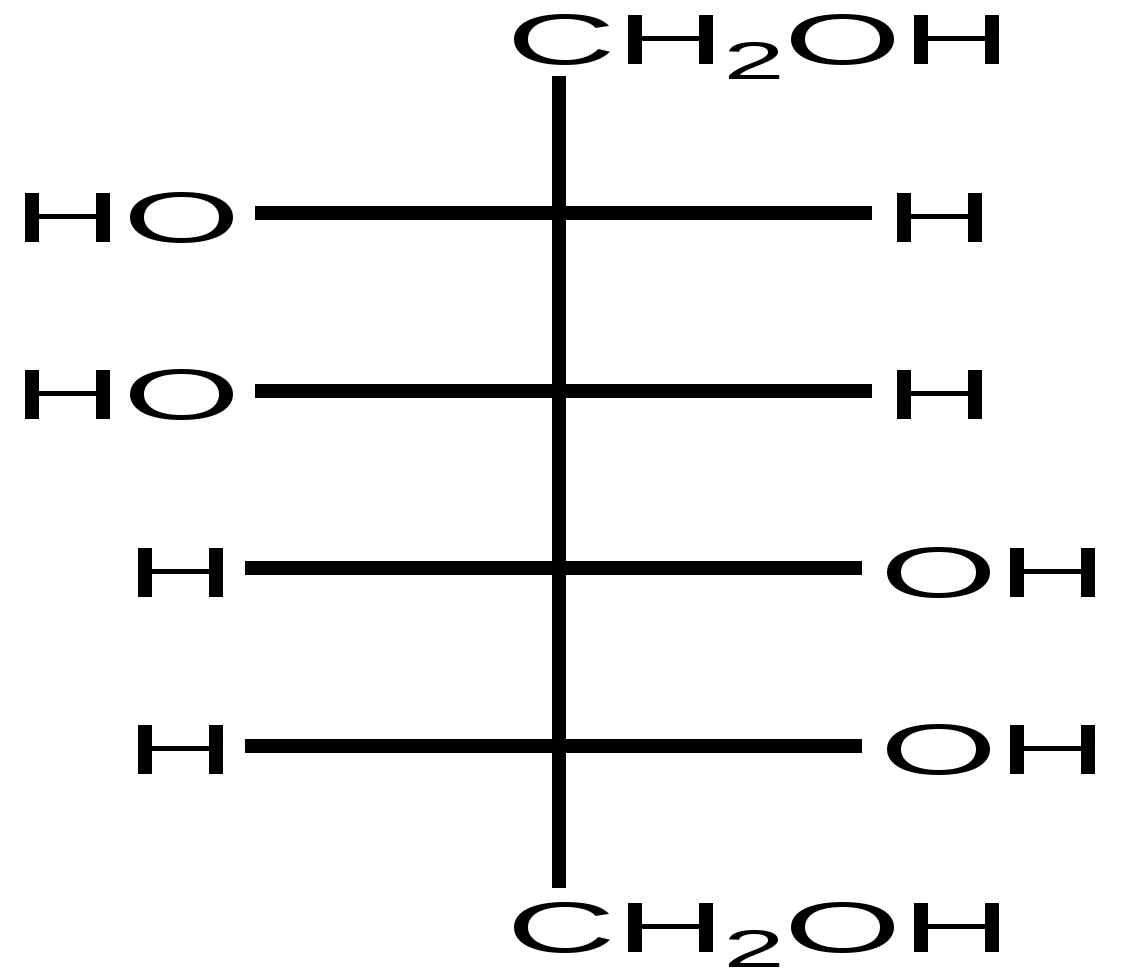
D-Маннит
|
Дисахариды
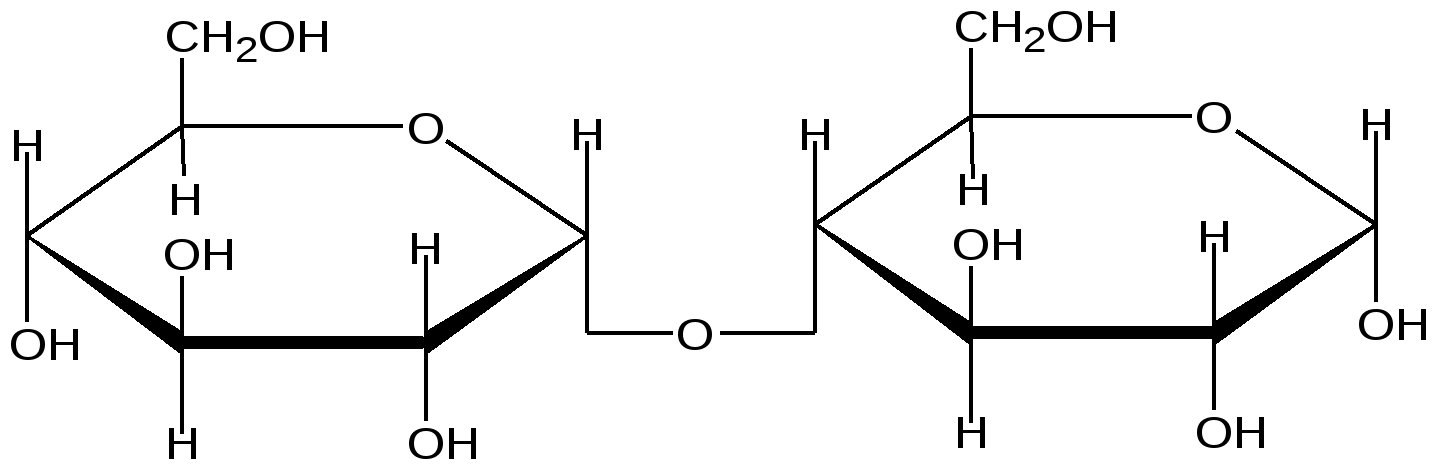
Мальтоза
(связь α-1, 4)
|
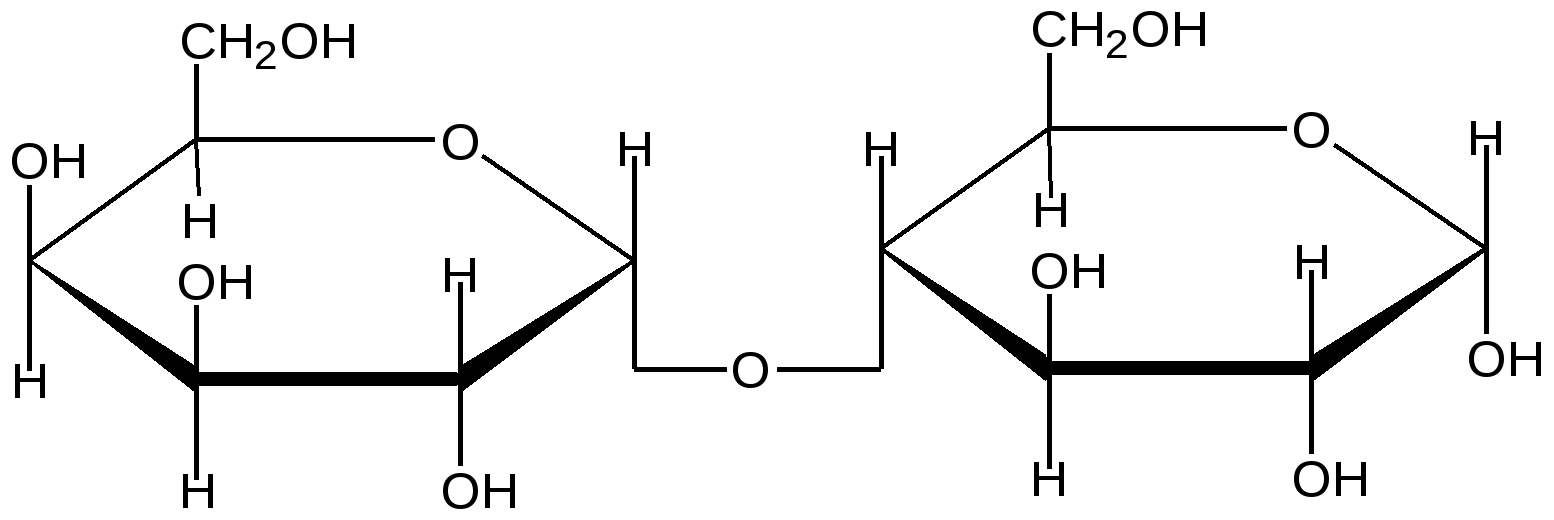
α-Лактоза
(связь α-1, 4)
|
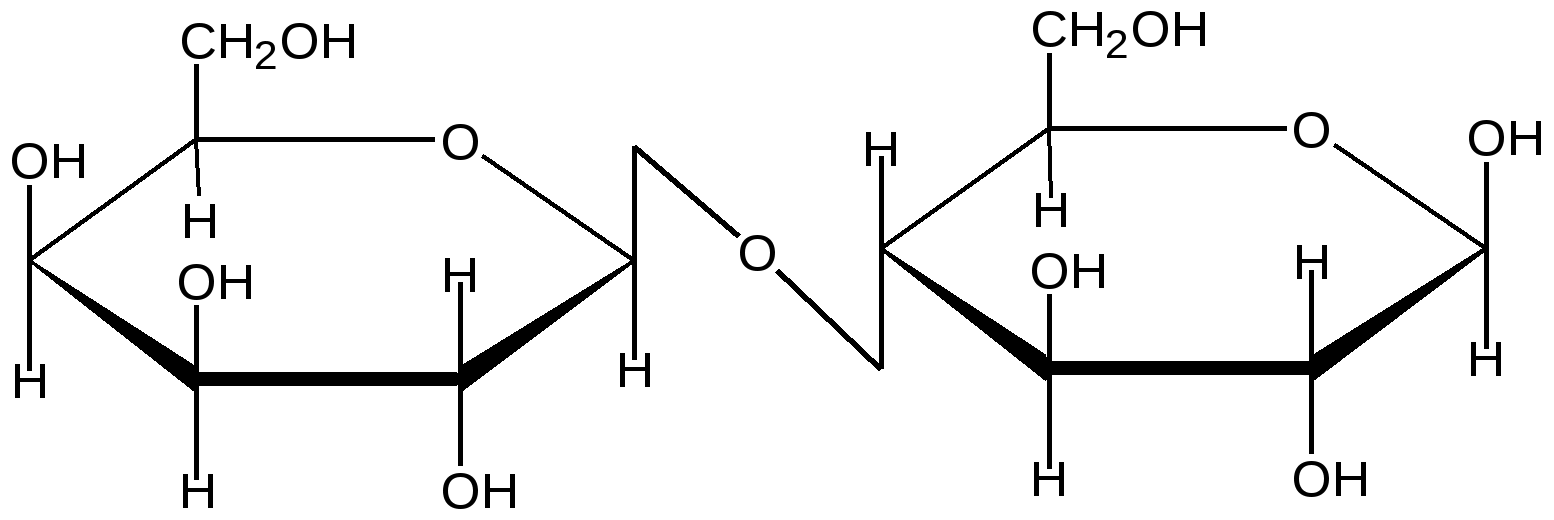
β-Лактоза
(связь β-1, 4)
|
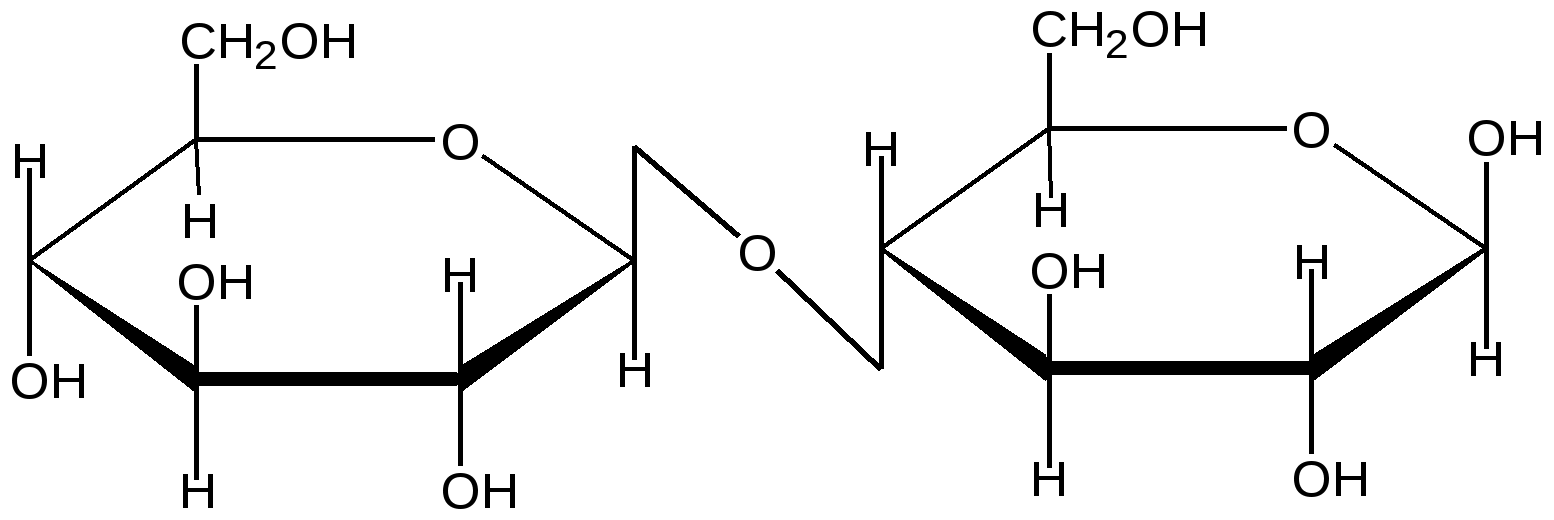
β-Целлобиоза
(связь β-1, 4)
|
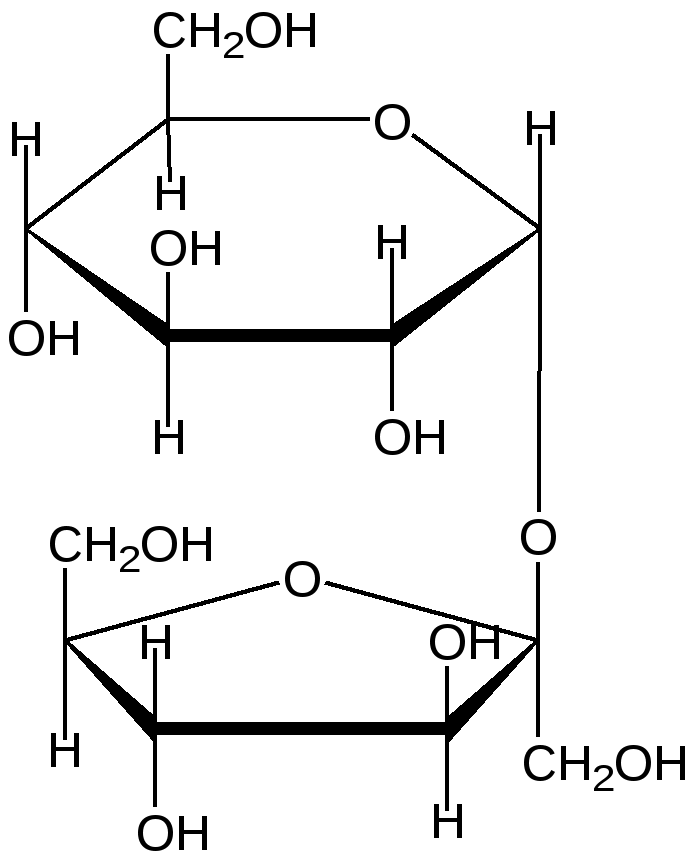
Сахароза
(связь α-1, 2)
|
Полисахариды (гомополисахариды, гетерополисахариды)
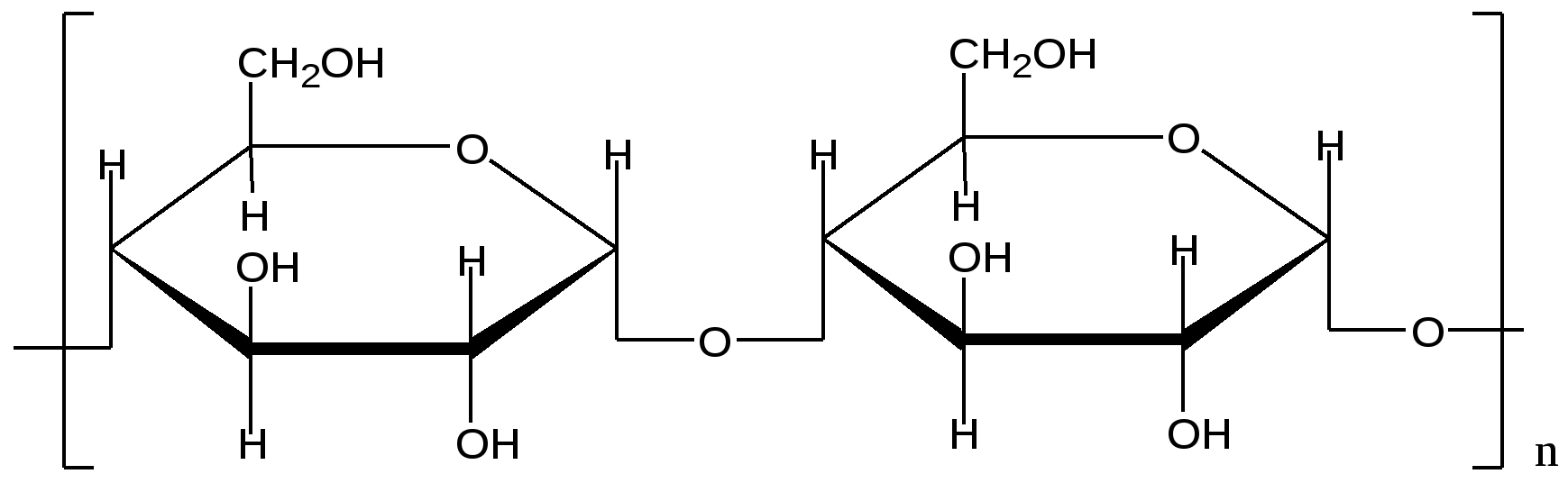
Фрагмент амилозы
(связь α-1, 4)
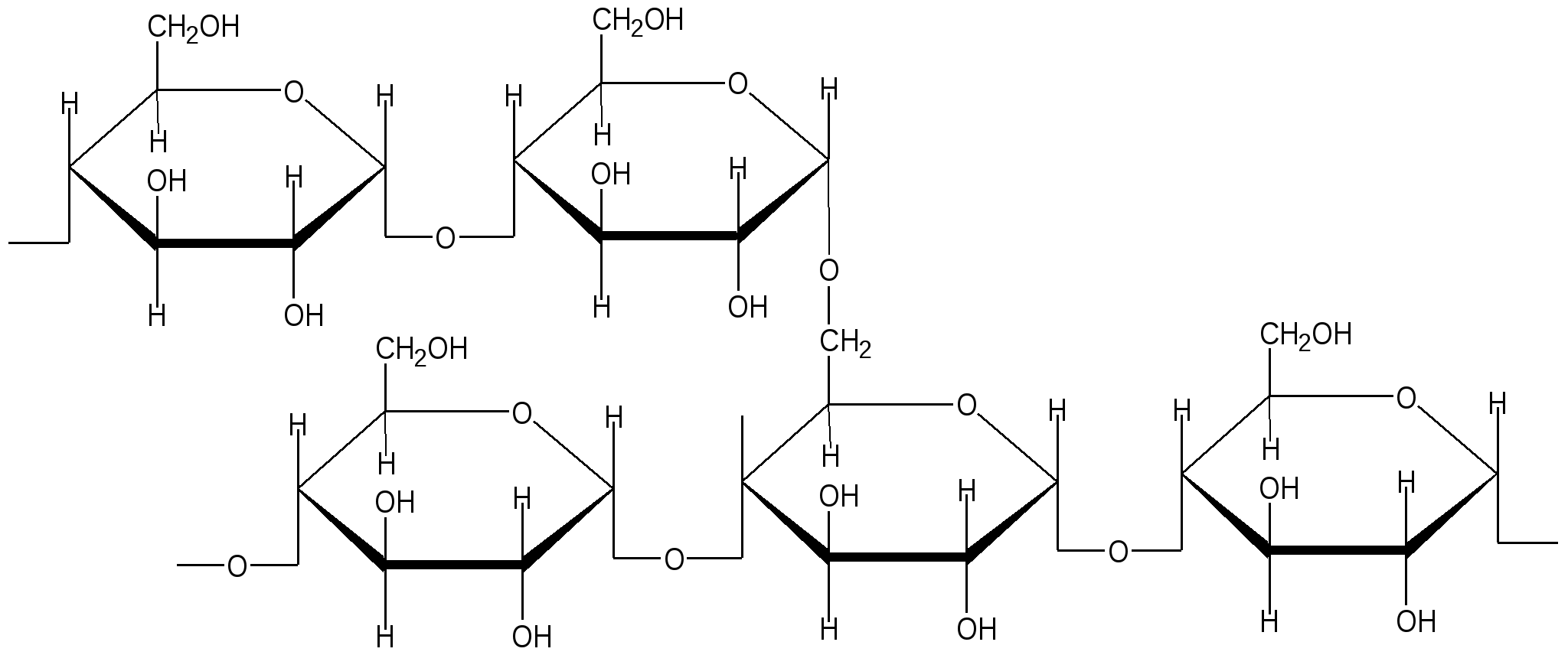
Фрагмент амилопектина
(Основная связь α-1, 4, ветвление α-1, 6 через 20-25 остатков глюкозы)
Крахмал (состоит из амилозы и амилопектина)
|
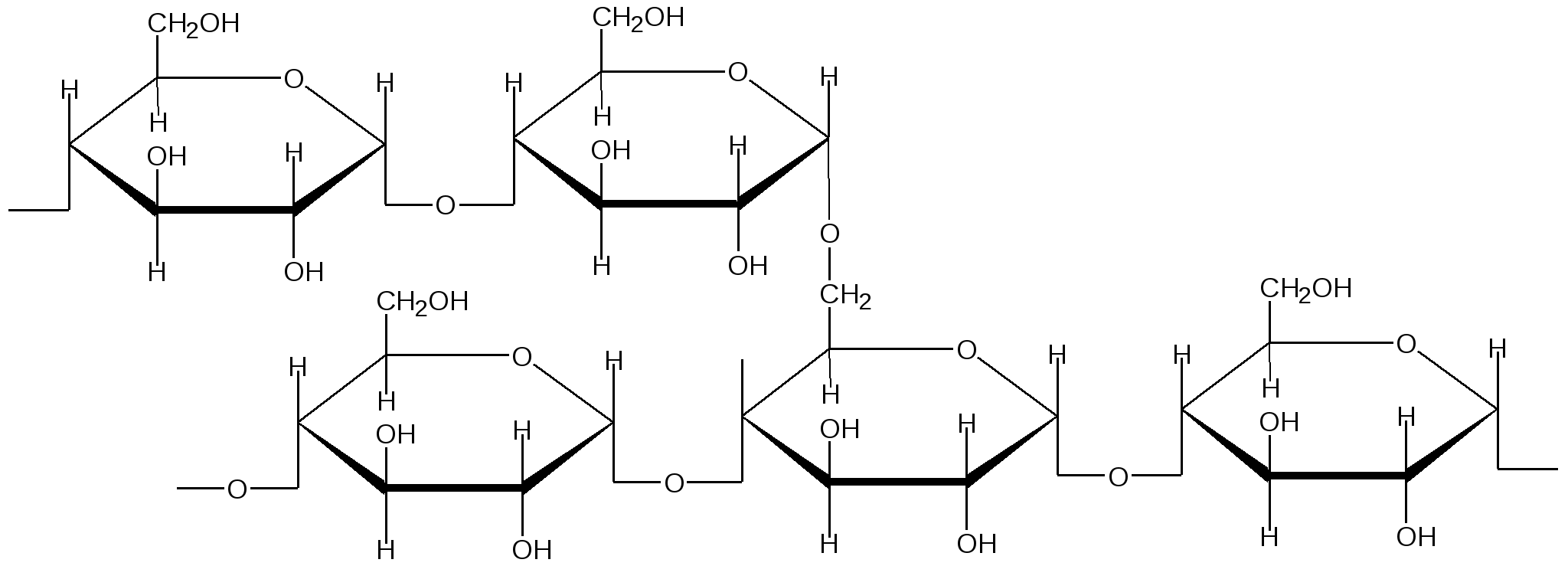
Гликоген
(Основная связь α-1, 4, ветвление α-1, 6 через 8-12 остатков глюкозы)
|
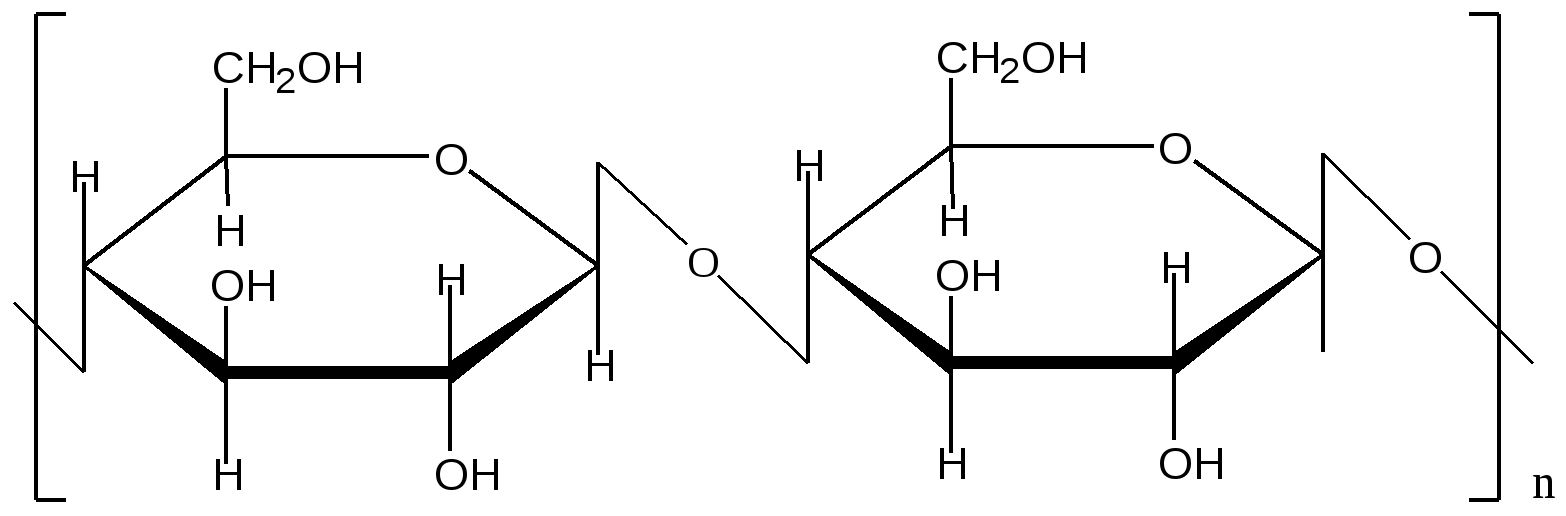
Целлюлоза
(связь β-1, 4)
|
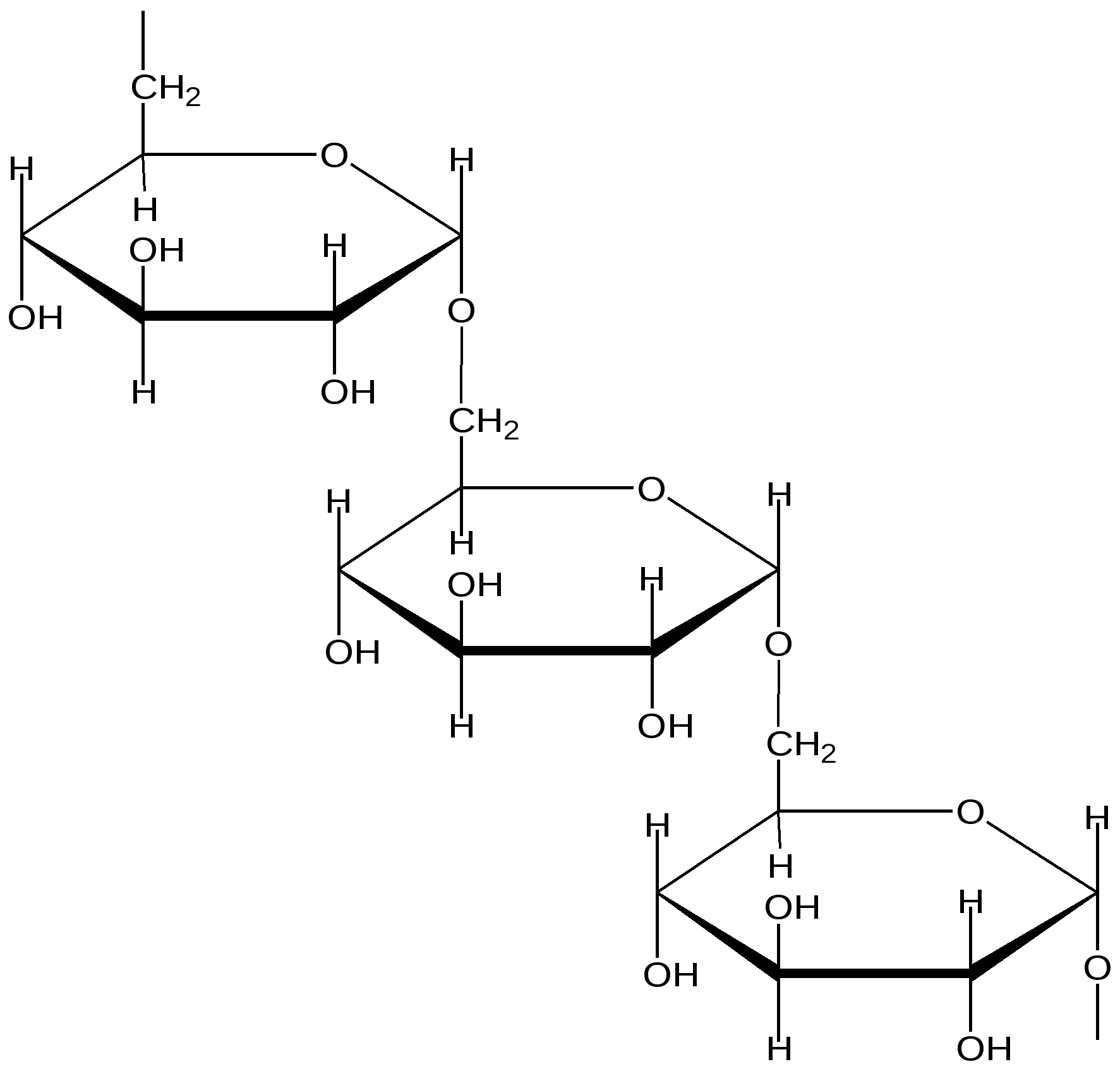
Декстран
(указана только основная связь α-1, 6)
|
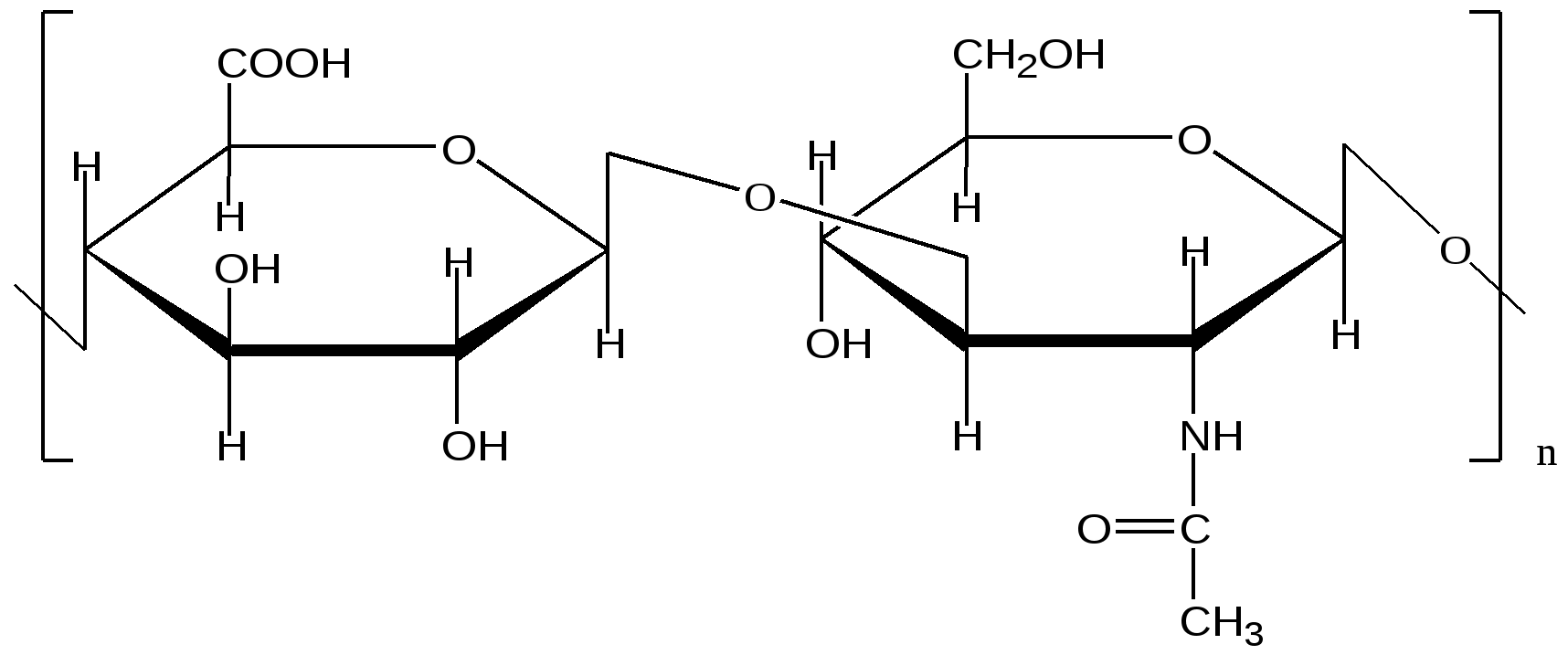
биозный фрагмент гиалуроновой кислоты
1. D-глюкуроновая кислота (β-1, 3)
2. N-ацетил-D-глюкозамин (β-1, 4)
|
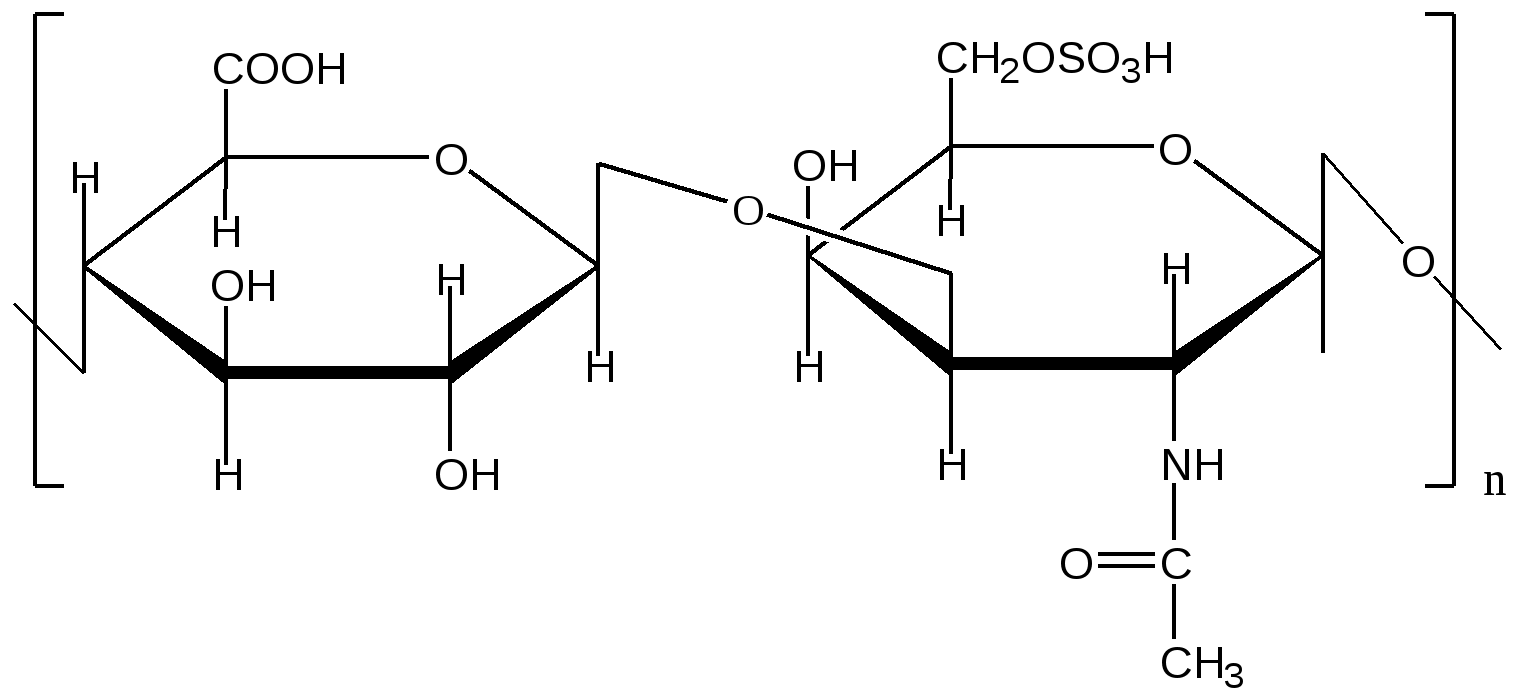
биозный фрагмент хондроитин-6-сульфата
1. D-глюкуроновая кислота (β-1, 3)
2. N-ацетил-D-галактозамин-6-сульфат (β-1, 4)
|
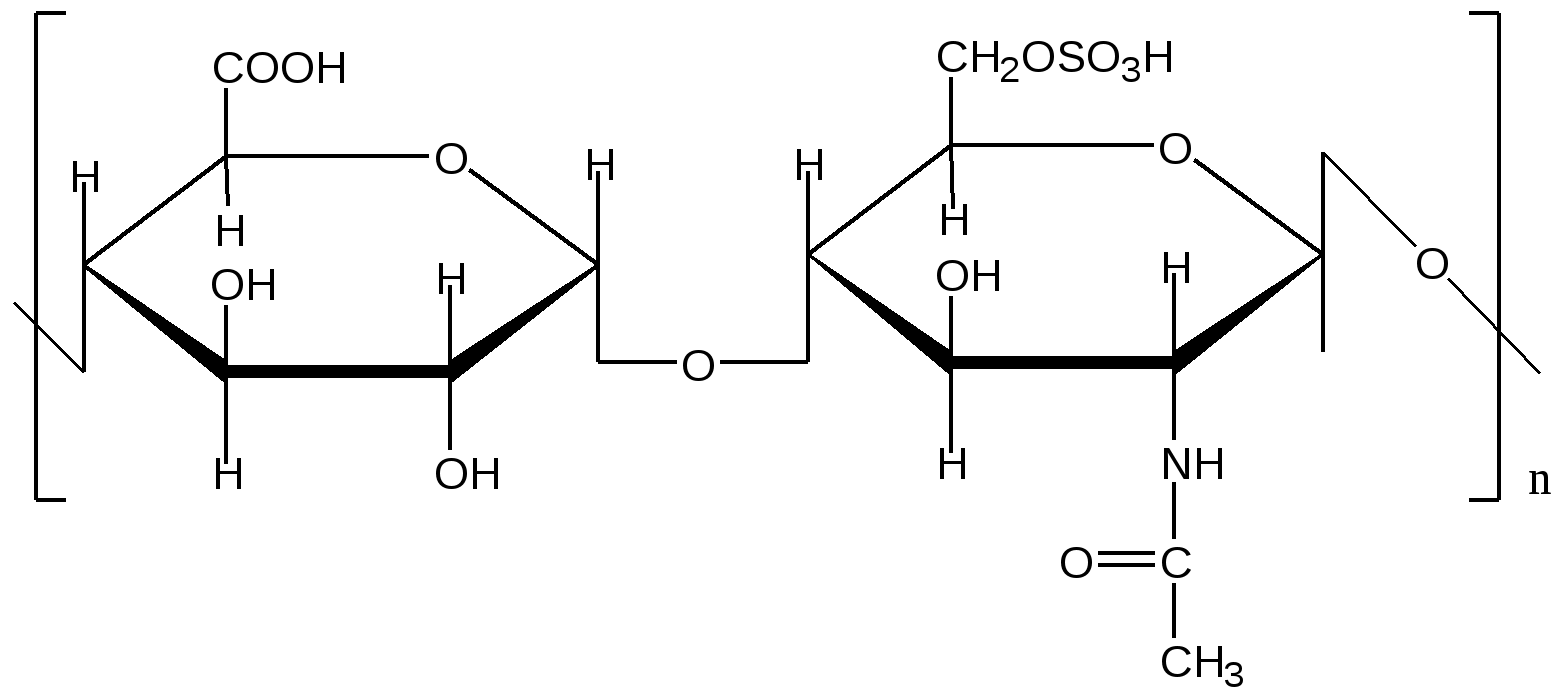
биозный фрагмент гепарина
1. D-глюкуроновая кислота (α-1, 4)
2. N-ацетил-D-глюкозозамин- 6-сульфат (β-1, 4)
|
Азотистые основания и их производные
Нуклеиновые основания
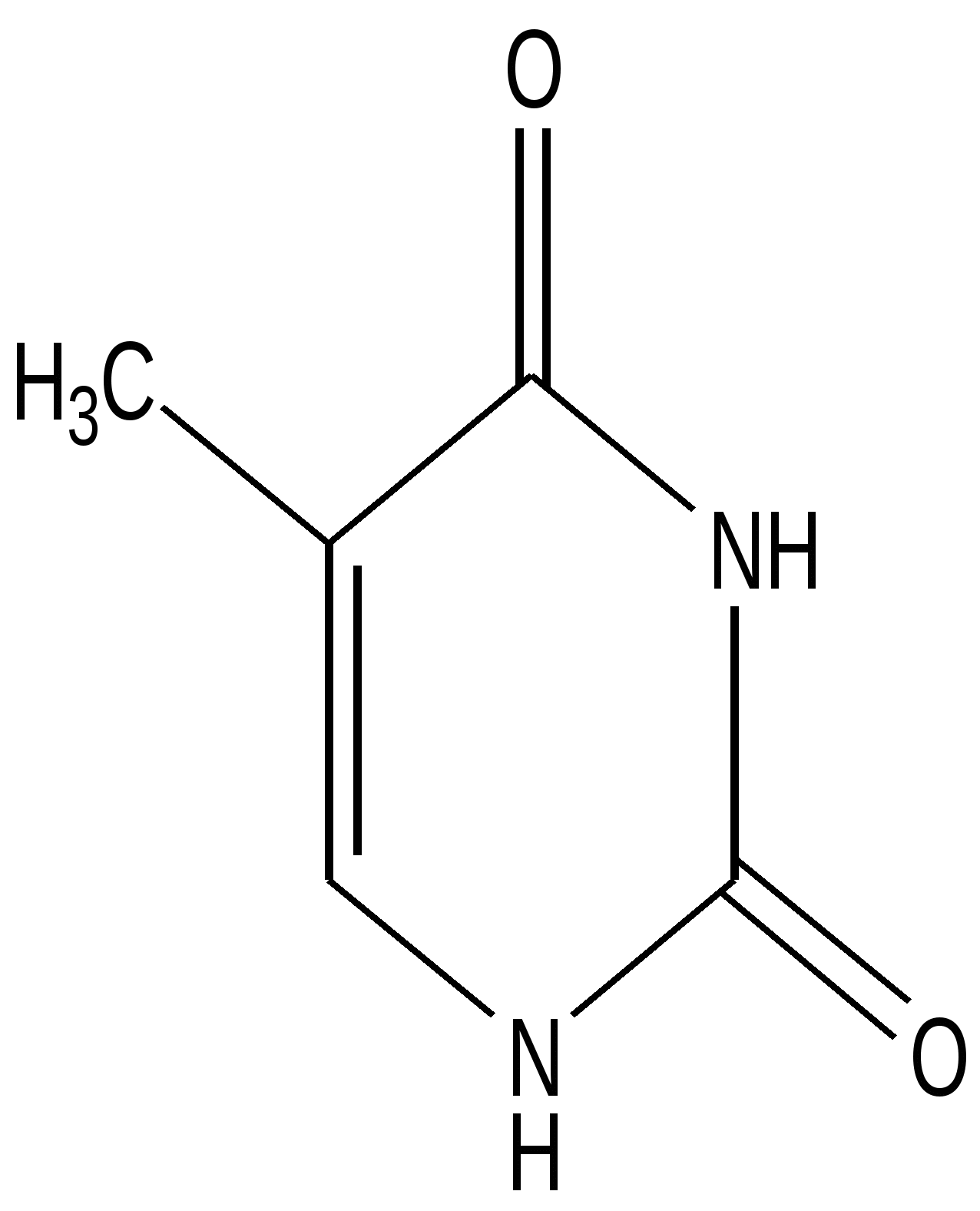
Тимин
(5-метил-2,4-диоксопиримидин)
|
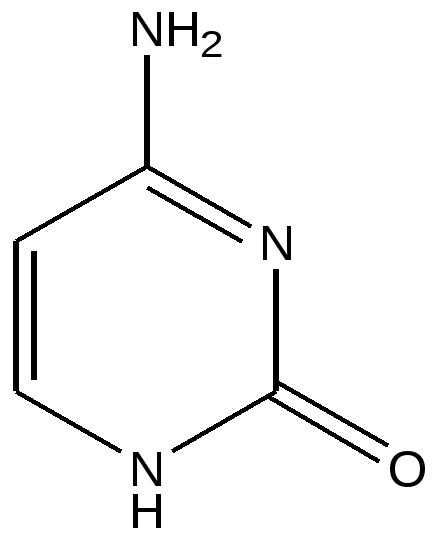
Цитозин
(4-амино-2-оксопиримидин)
|
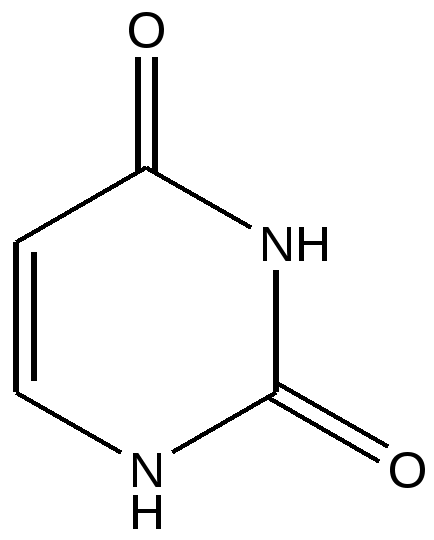
Урацил
(2,4-диоксопиримидин)
|
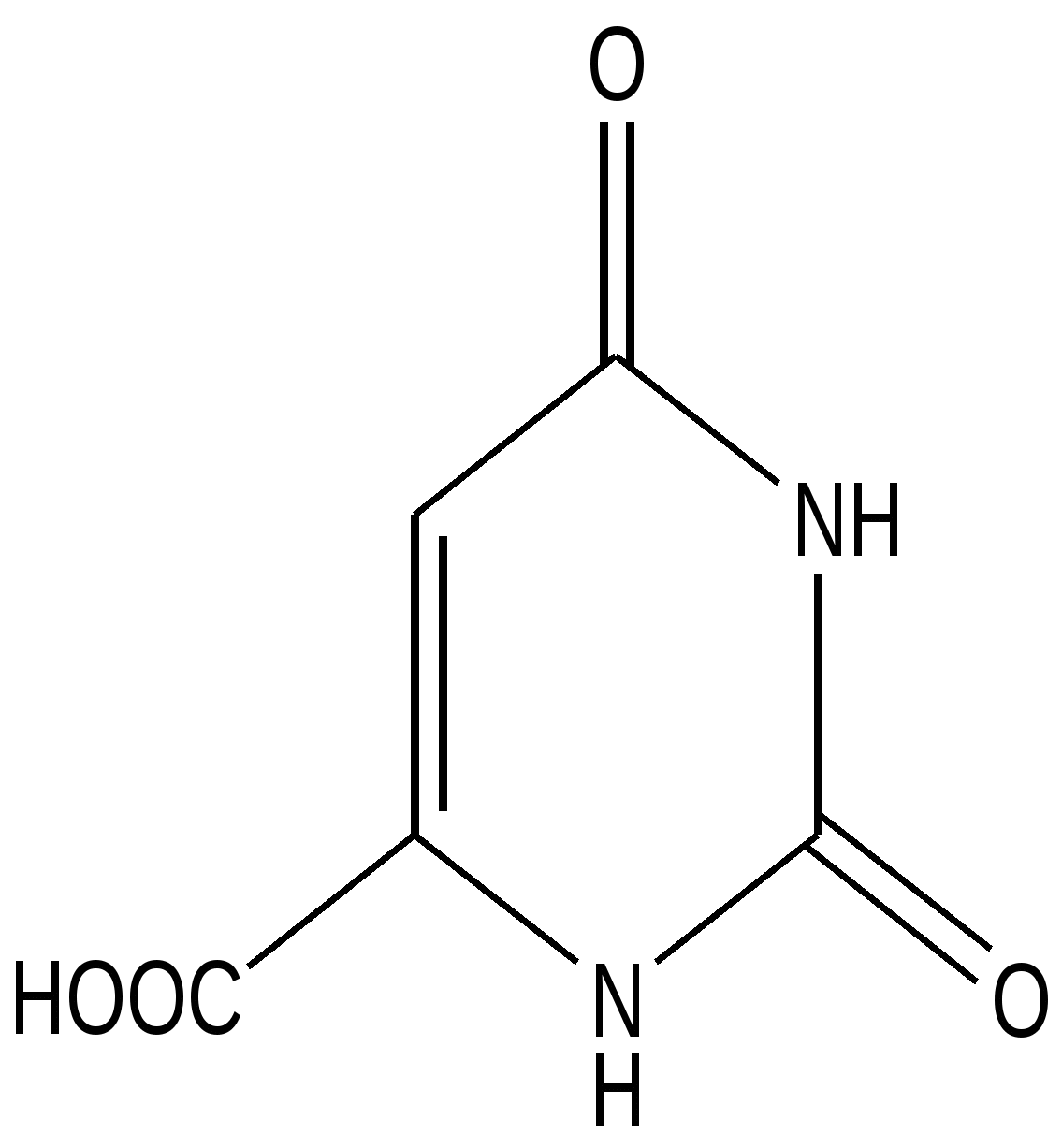
Оротовая кислота
|
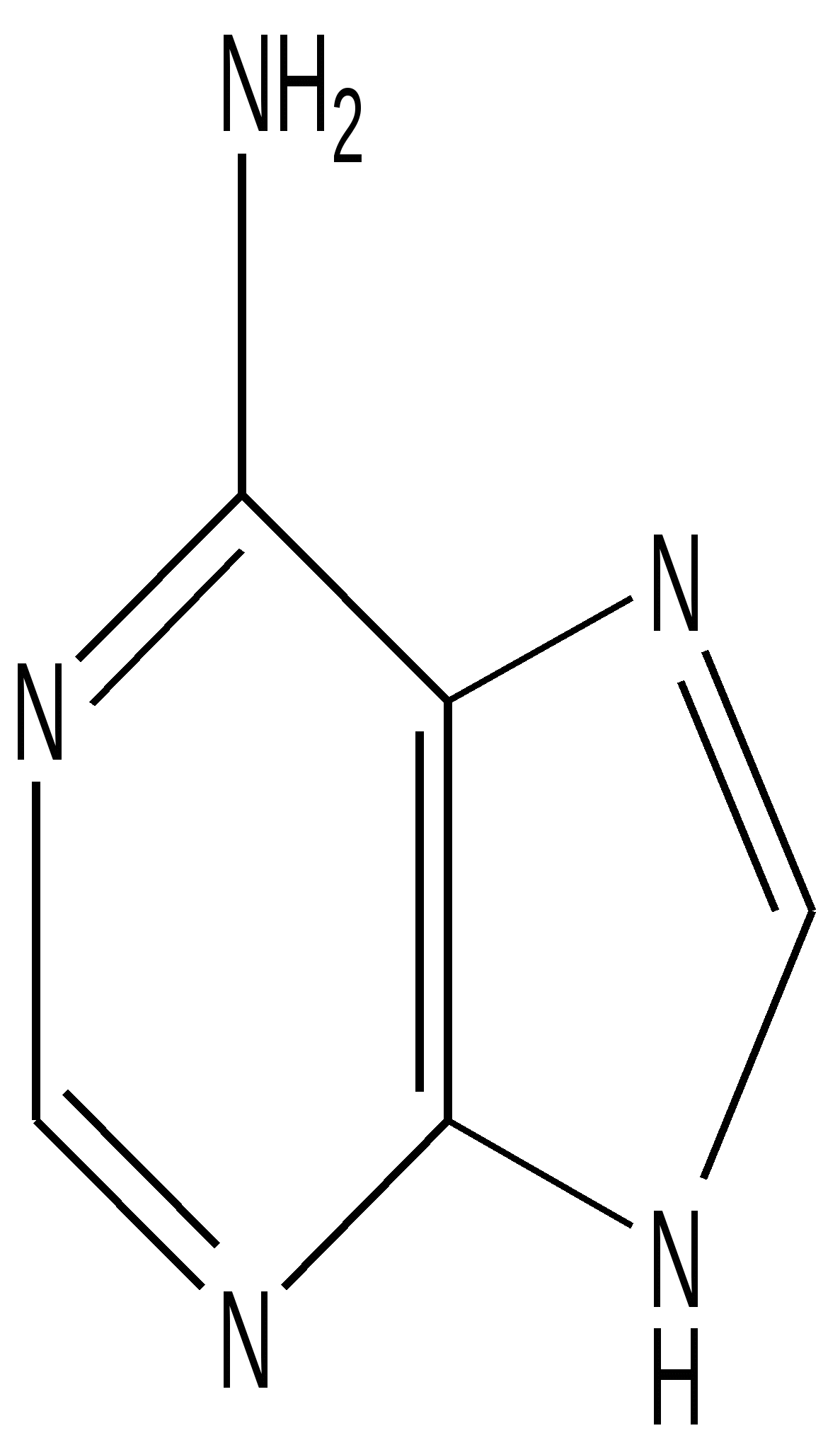
Аденин
(6-аминопурин)
|
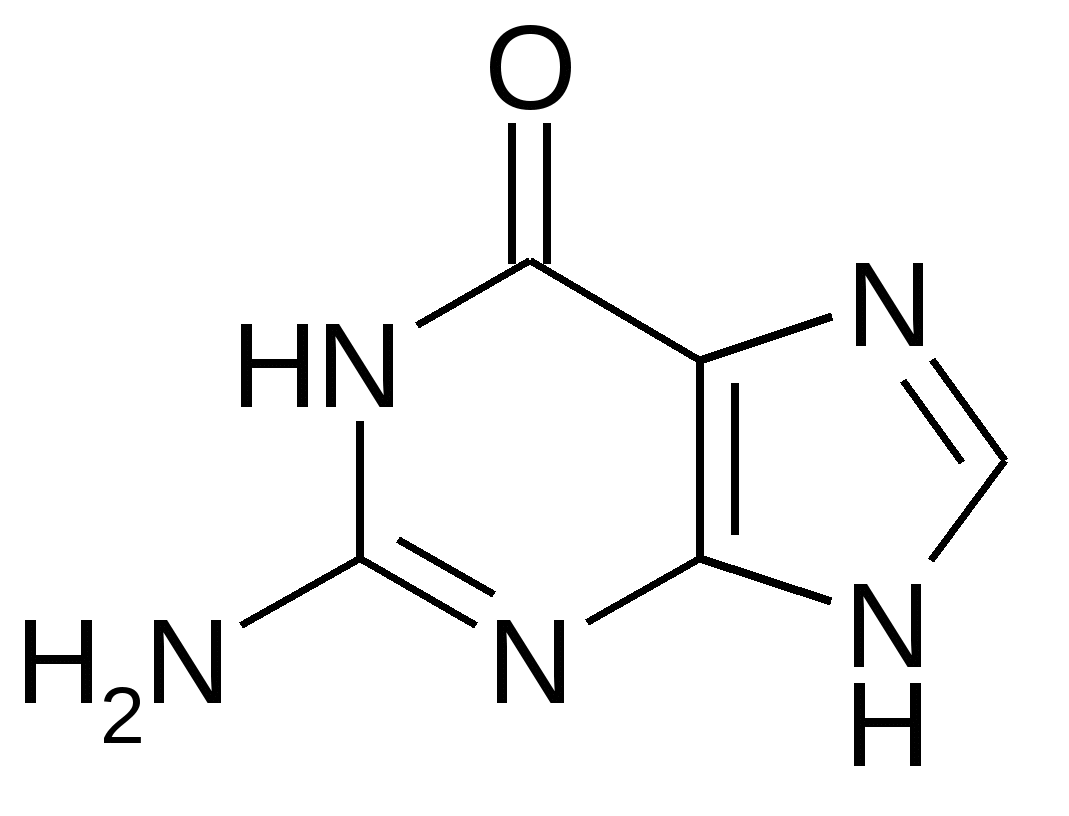
Гуанин
(2-амино-6-оксопурин)
|
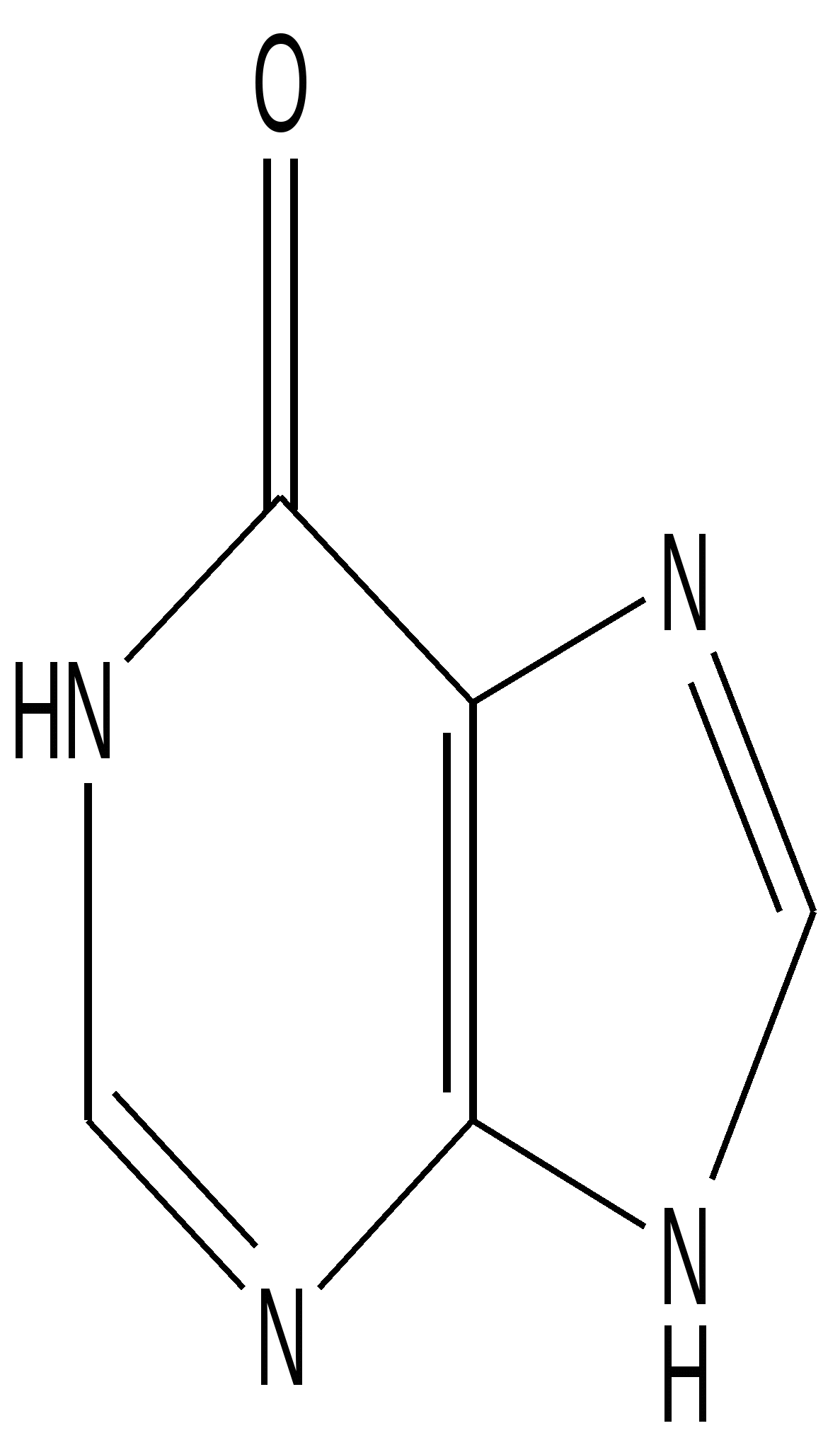
Гипоксантин
(6-оксопурин)
|
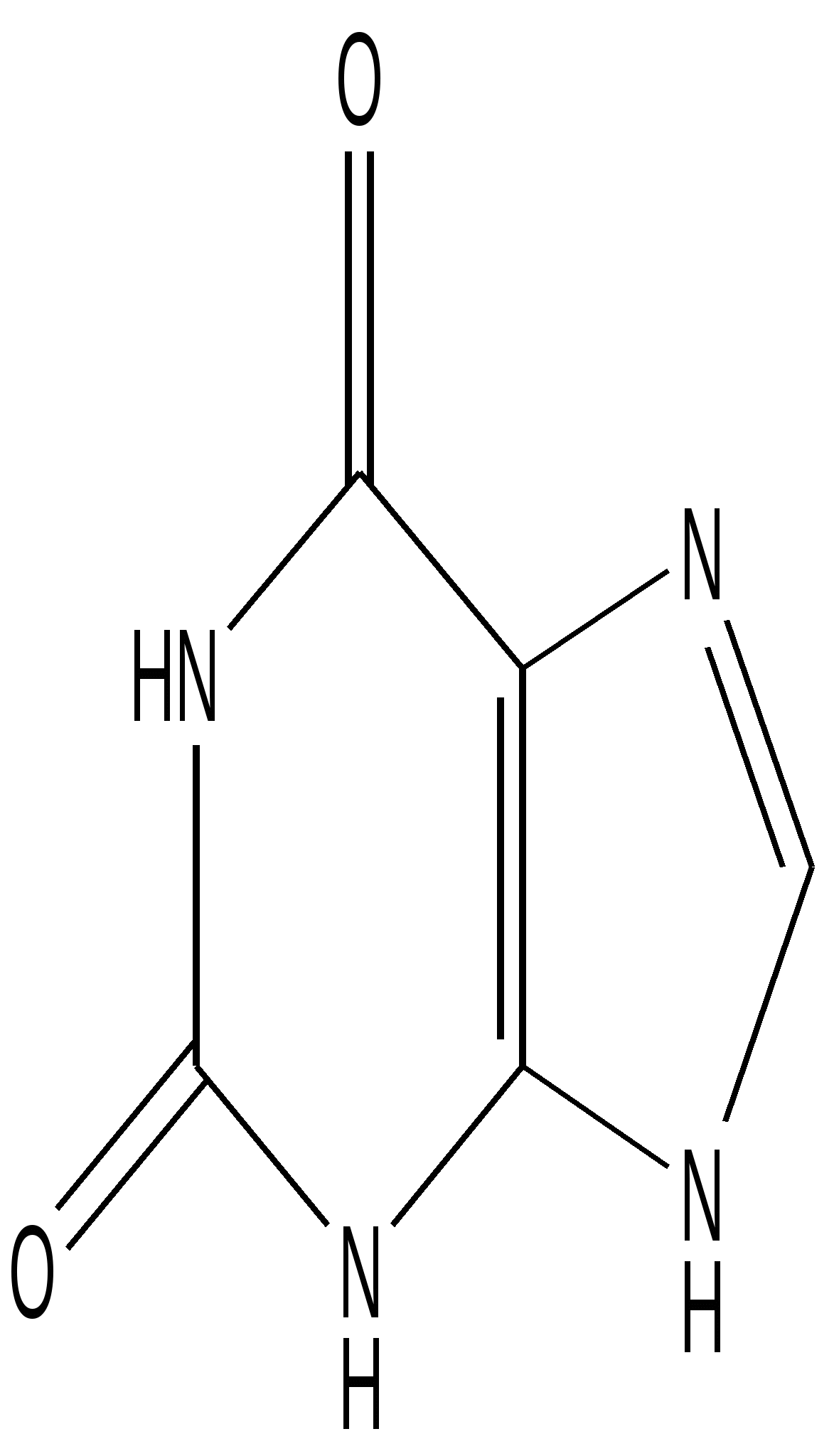
Ксантин
(2,6-диоксопурин)
|
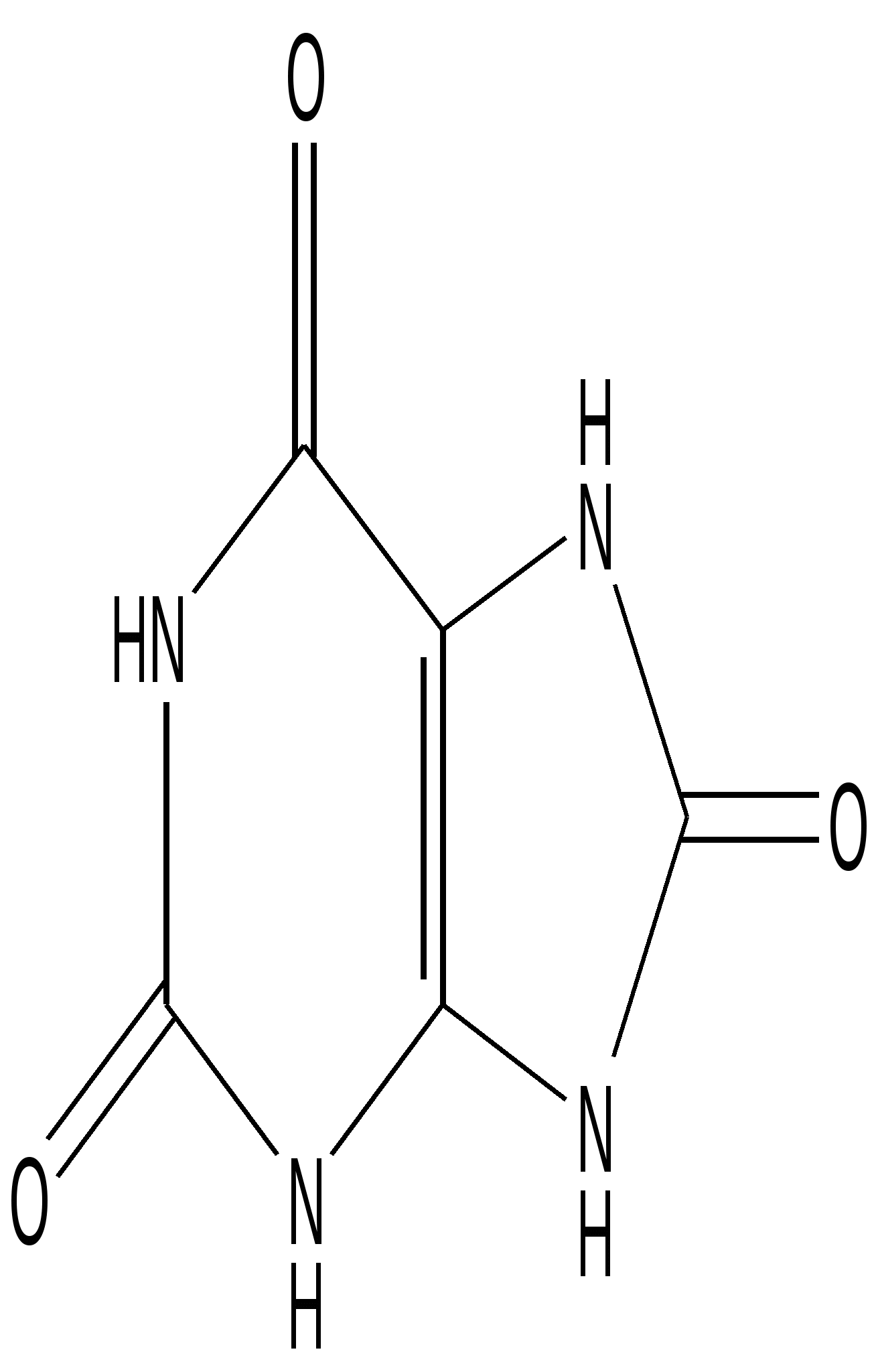
Мочевая кислота
(2,6,8-триоксопурин)
|
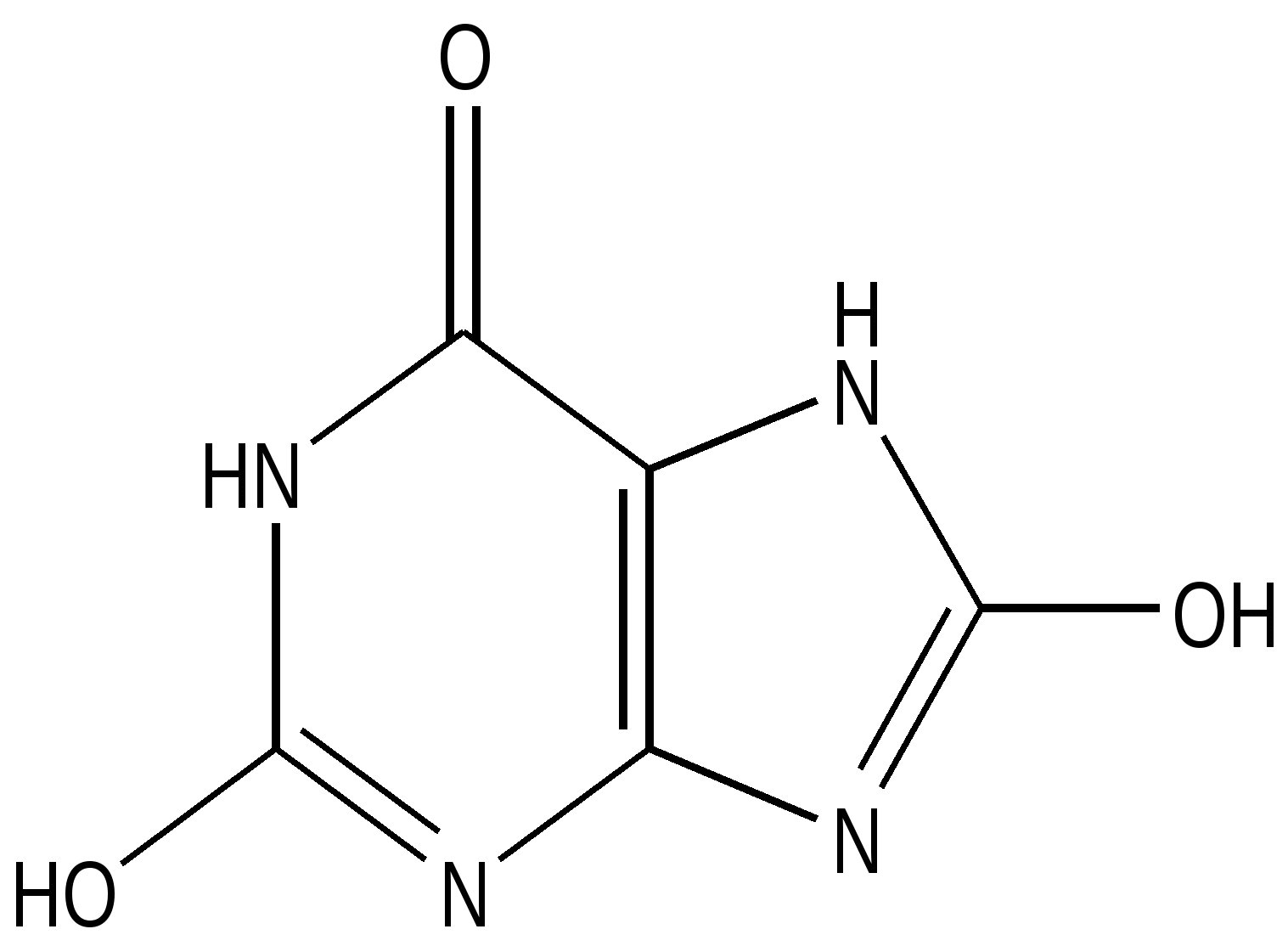
Мочевая кислота
(2,8-дигидрокси, 6-оксопурин)
Солеобразующая форма
|
Нуклеозиды (Рибонуклеозиды)
Производные пиримидина
Окончание: иДИн
|
Производные пурина
Окончание: озин
|
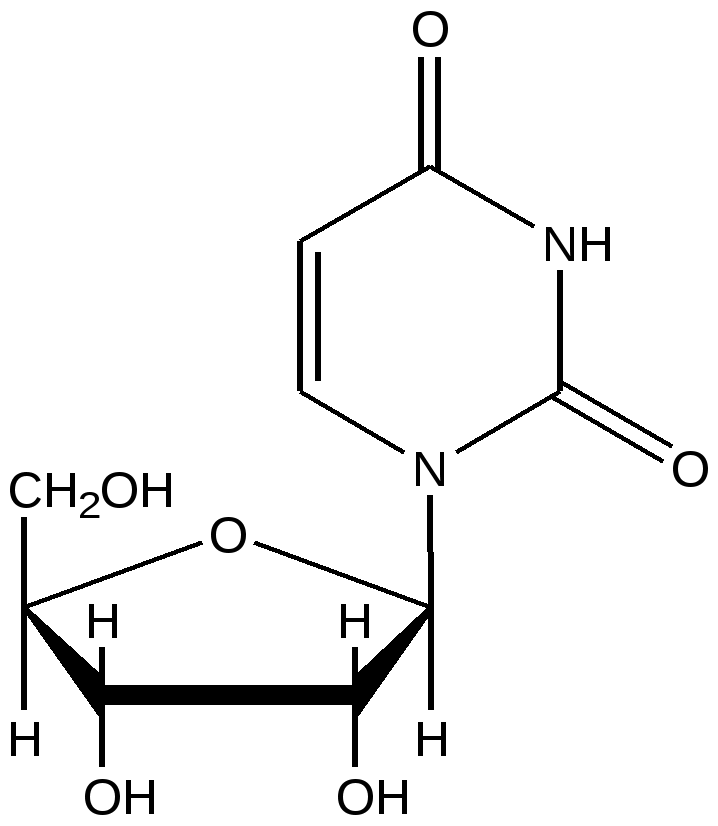
Уридин
|
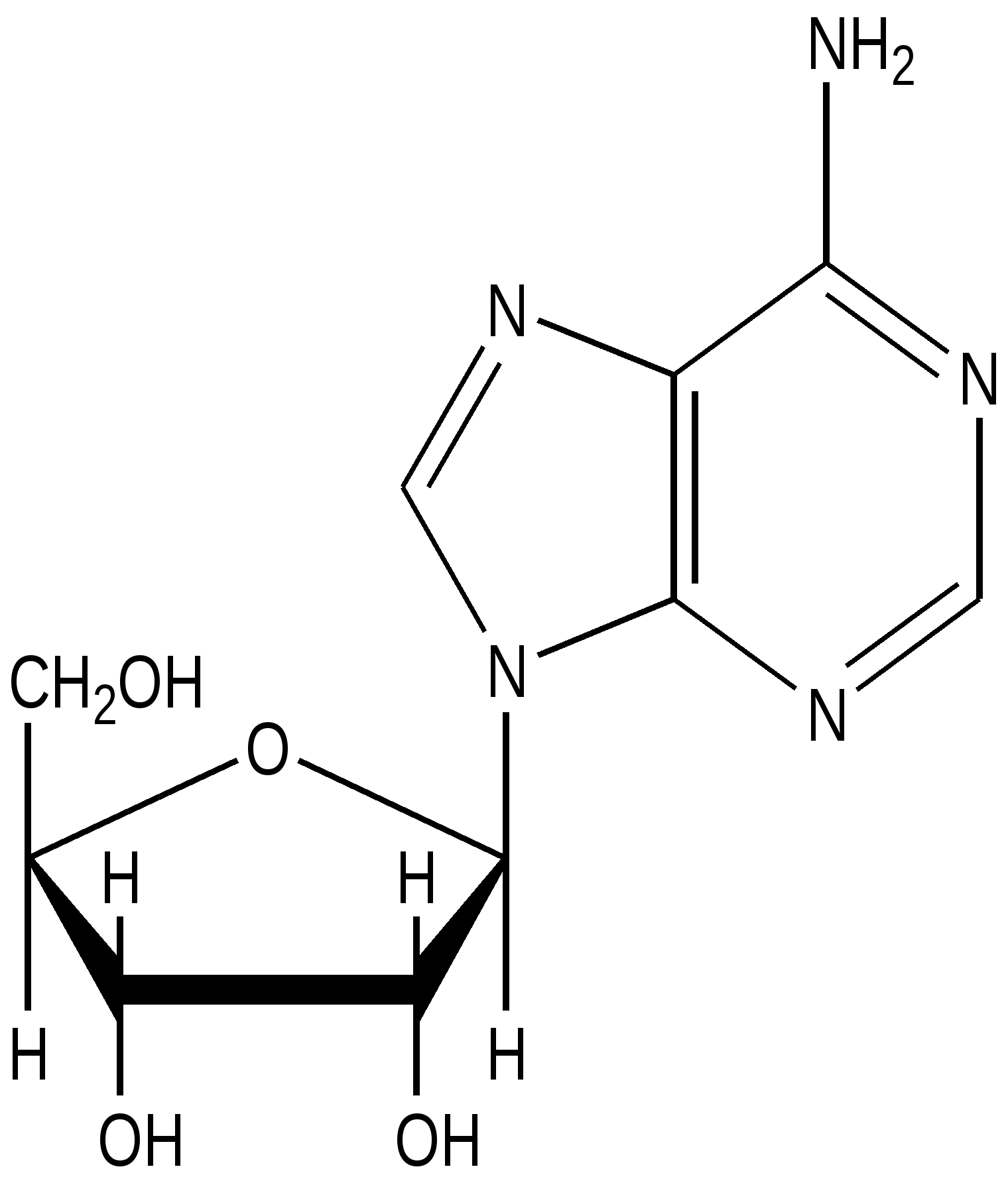
Аденозин
|
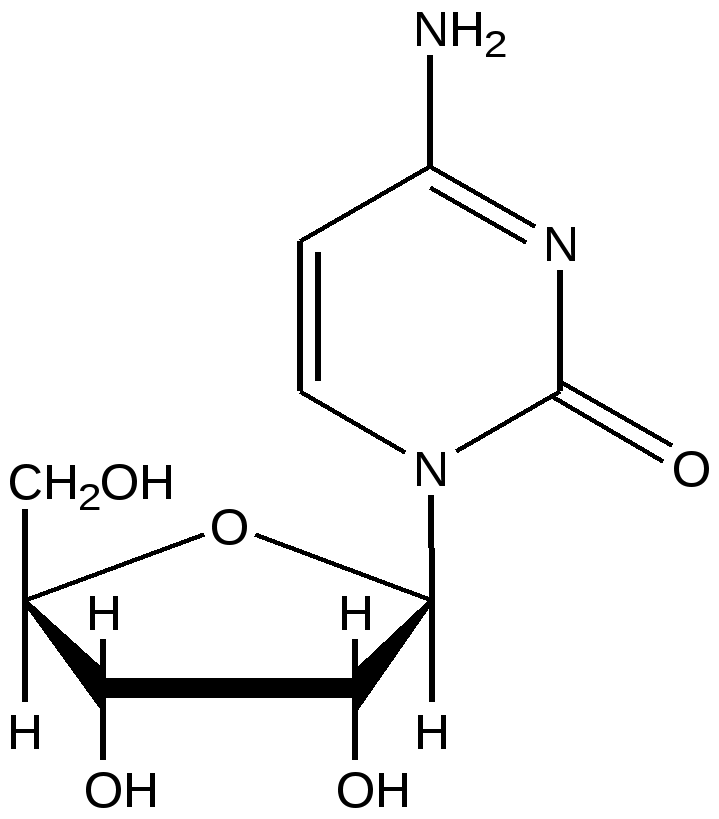
Цитидин
|
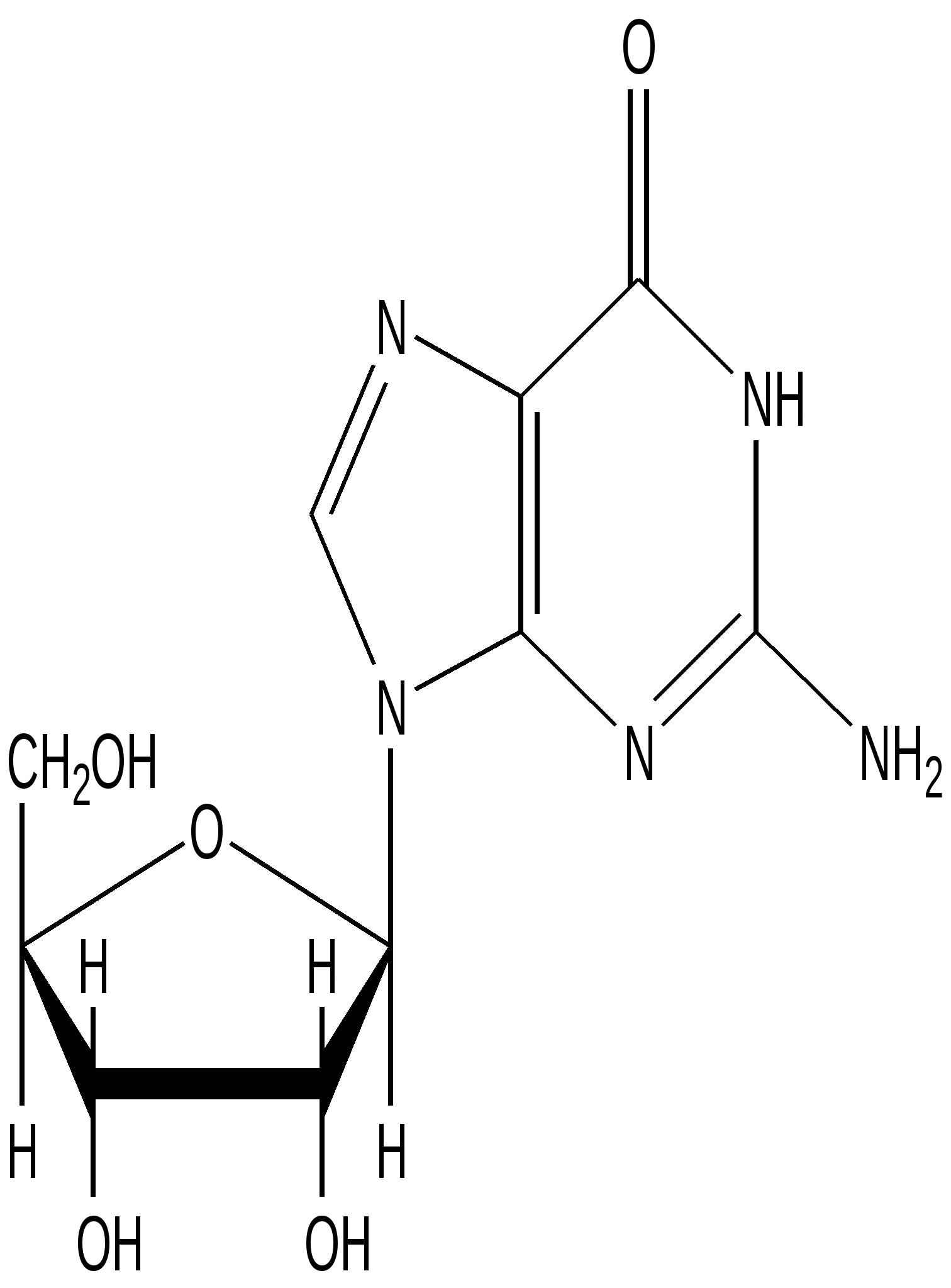
Гуанозин
|
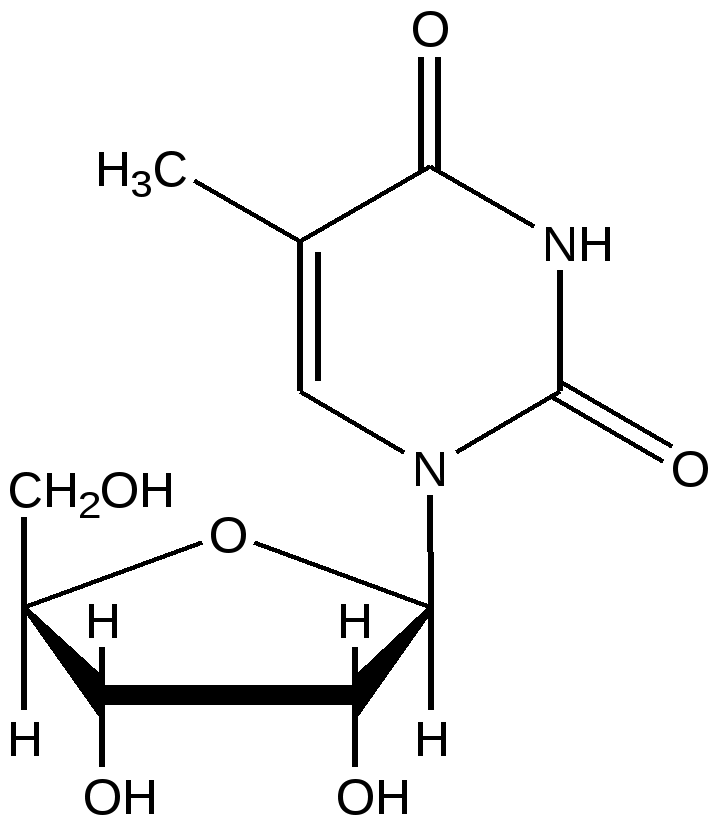
Тимидинрибозид
Риботимидин
|
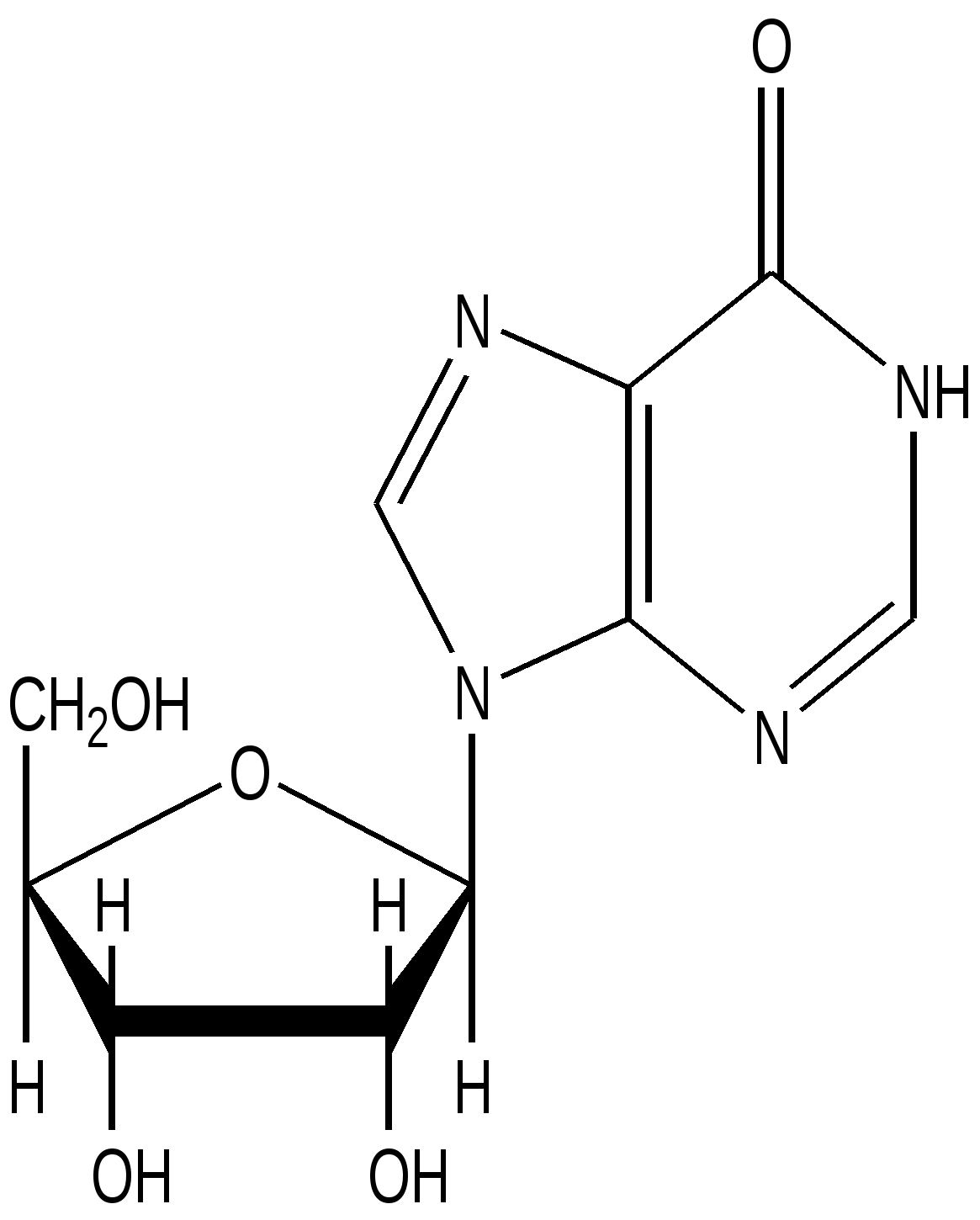
Инозин
Минорный нуклеозид
|
Нуклеозиды (Дезоксирибонуклеозиды) Приставка: ДЕЗОКСИ
Производные пиримидина
Окончание: иДИн
|
Производные пурина
Окончание: озин
|
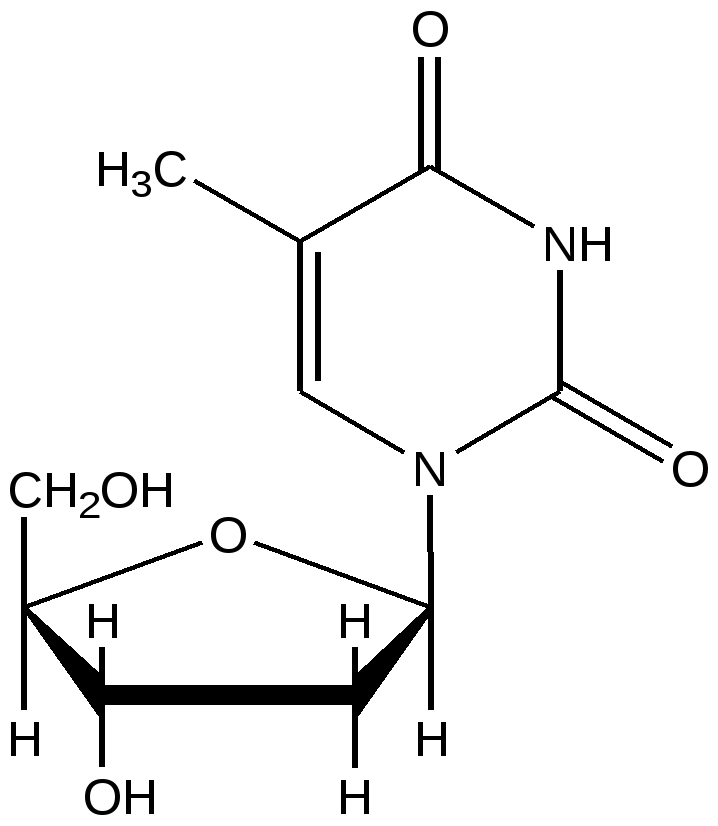
Тимидин
|
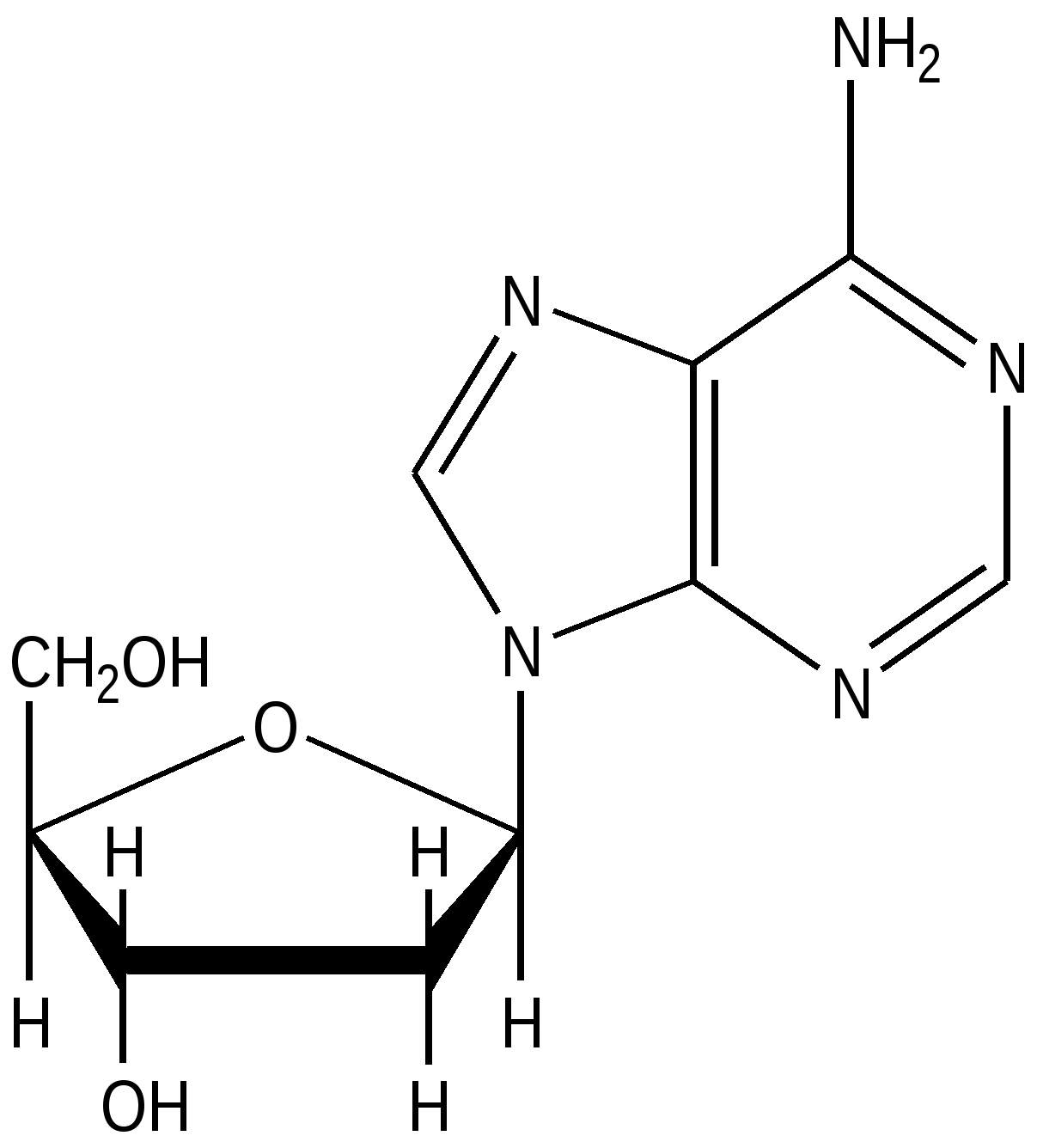
2’-Дезоксиаденозин
|
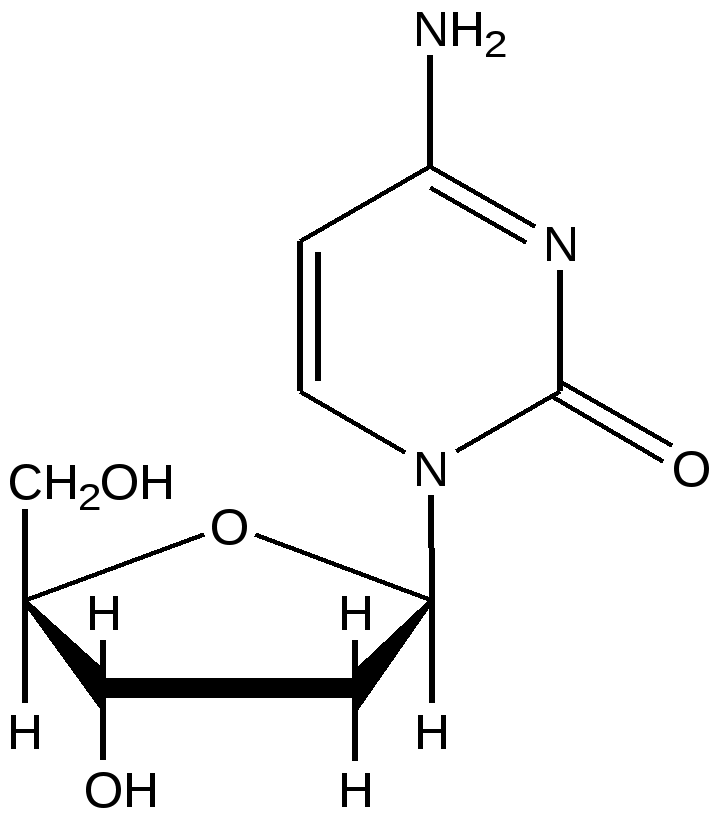
2’-Дезоксицитидин
|
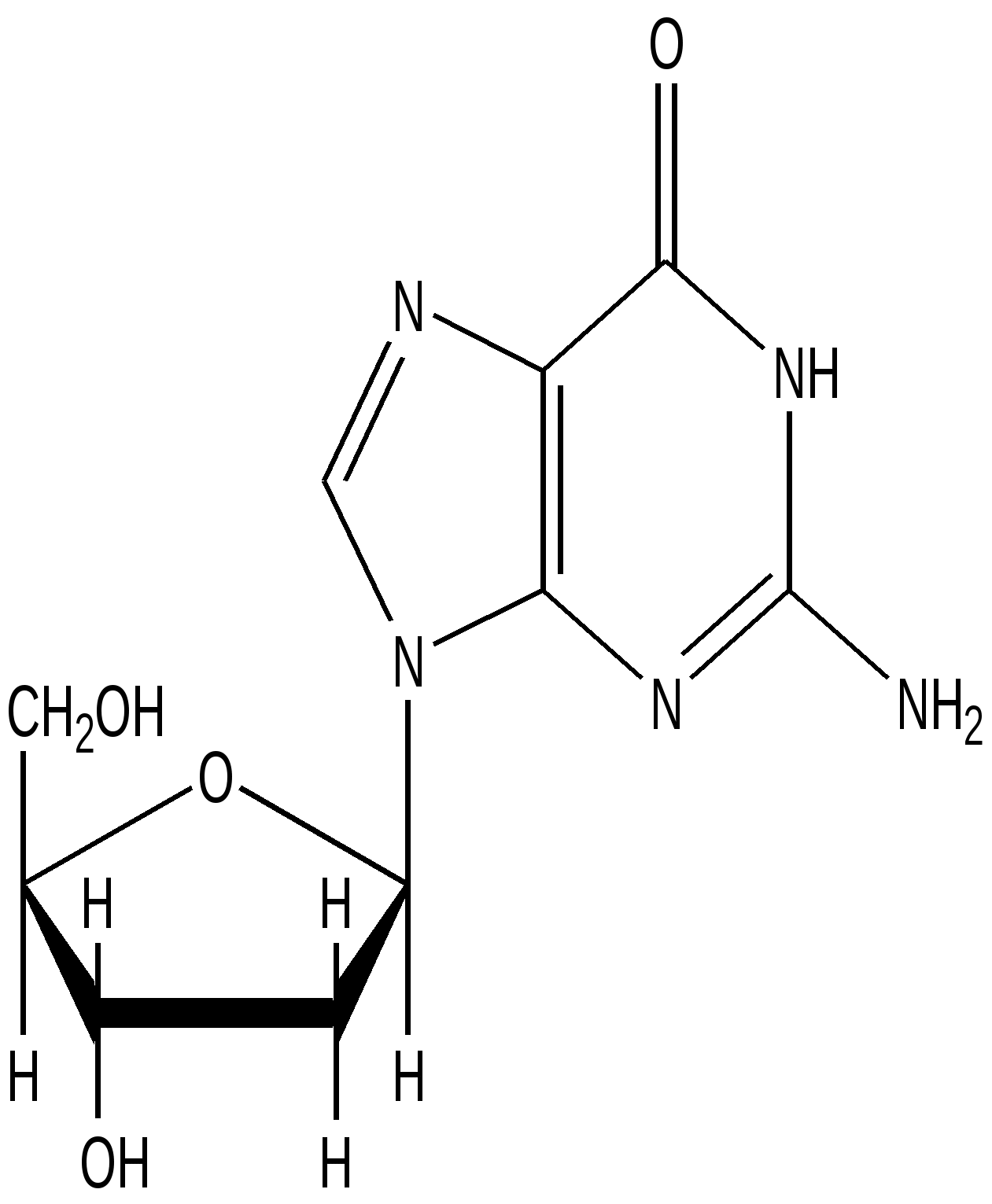
2’-Дезоксигуанозин
|
Нуклеотиды – составные компоненты РНК (Рибонуклеотиды)
Окончание: ИЛОВАЯ КИСЛОТА
|
Окончание: ИЛОВАЯ КИСЛОТА
|
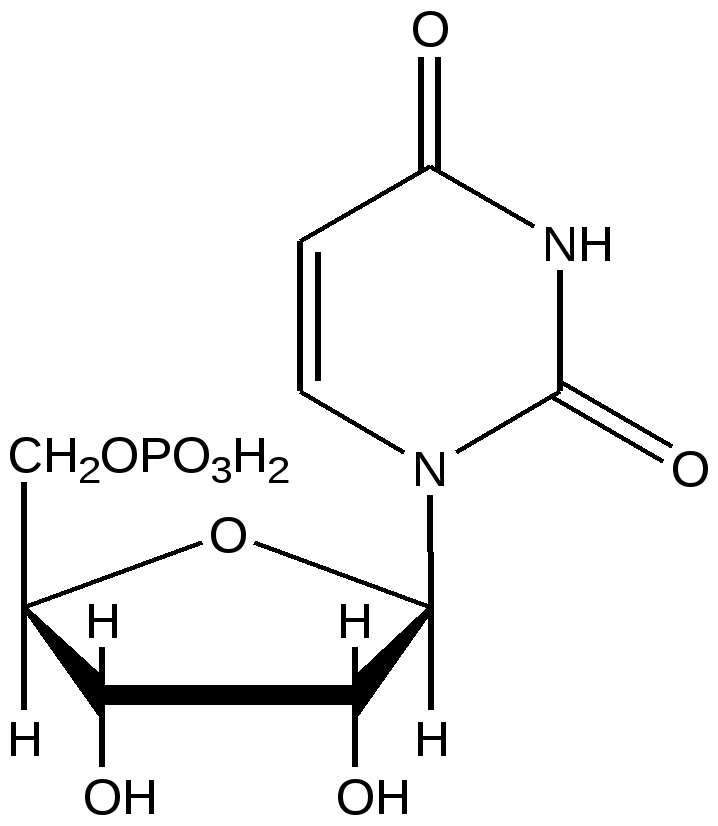
УМФ
Уридинмонофосфат
Уридин-5’-ф
Уридиловая кислота
|
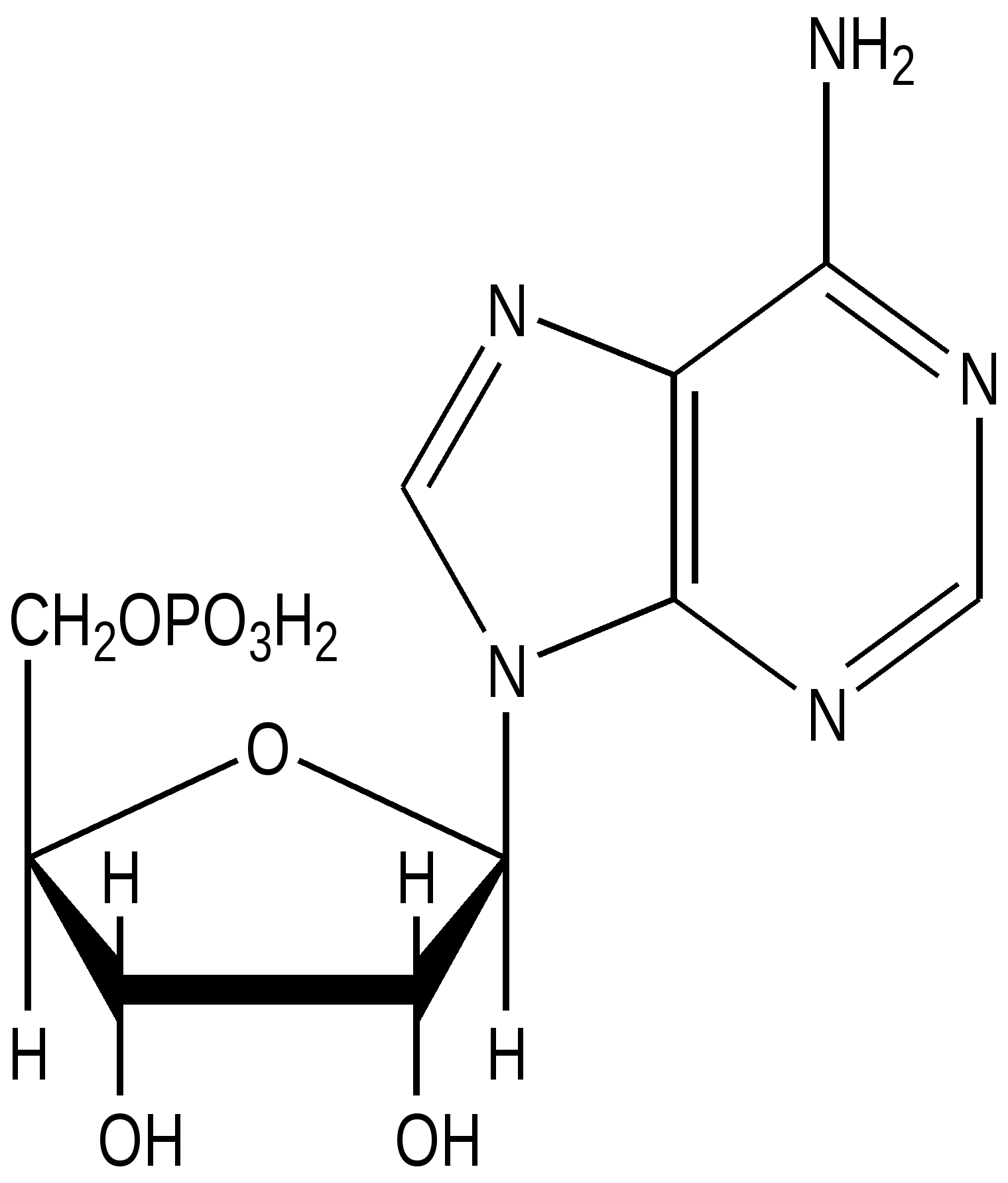
АМФ
Аденозинмонофосфат
Аденозин-5’-ф
Адениловая кислота
|
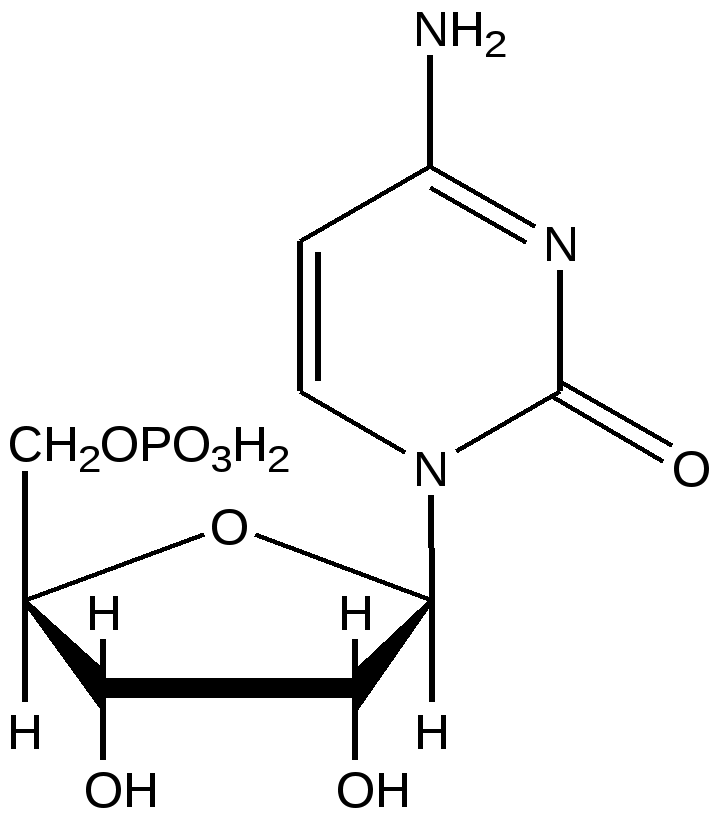
ЦМФ
Цитидинмонофосфат
Цитидин-5’-ф
Цитидиловая кислота
|
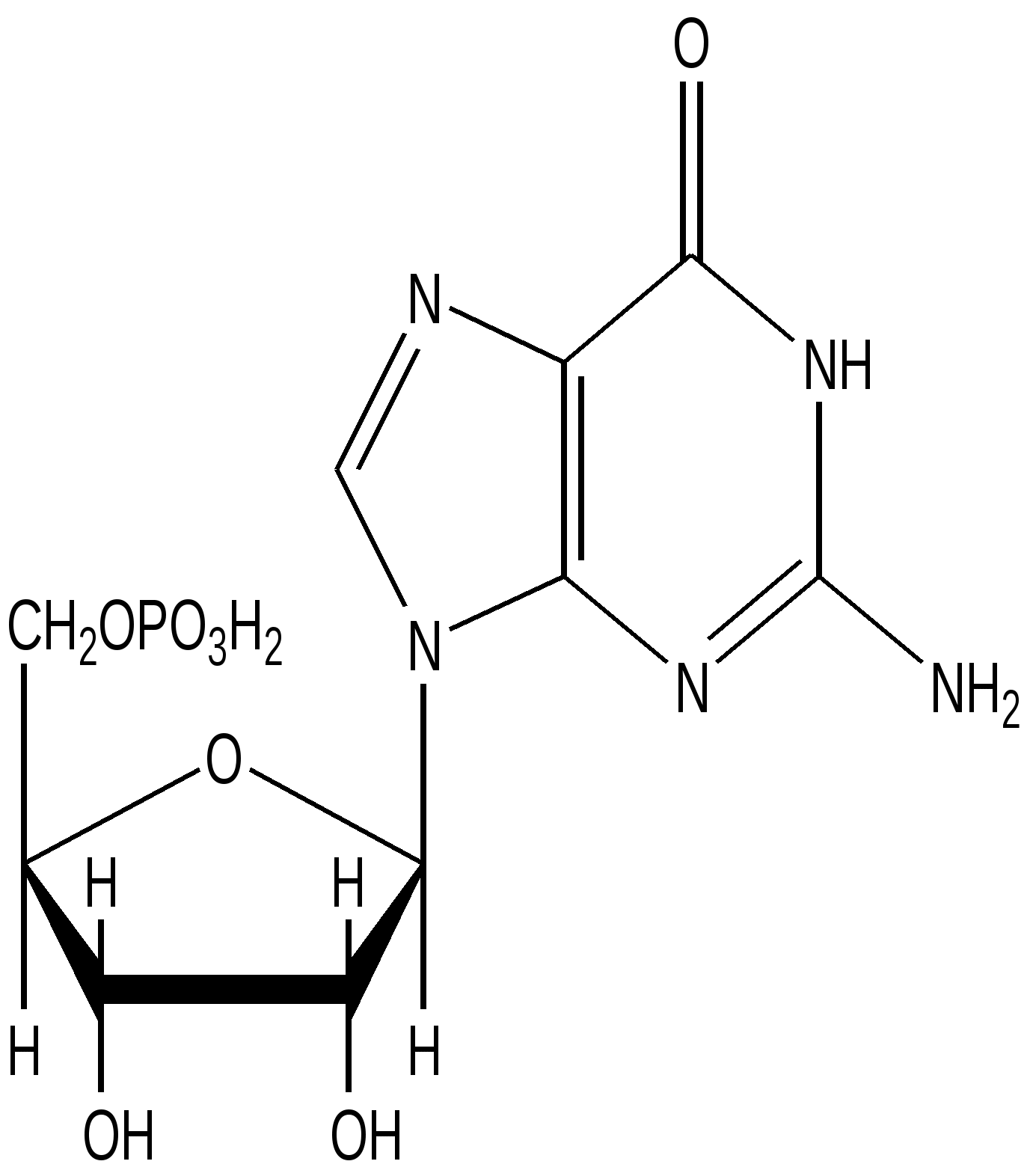
ГМФ
Гуанозинмонофосфат
Гуанозин -5’-ф
Гуаниловая кислота
|
Важные нуклеотиды и динуклеотиды
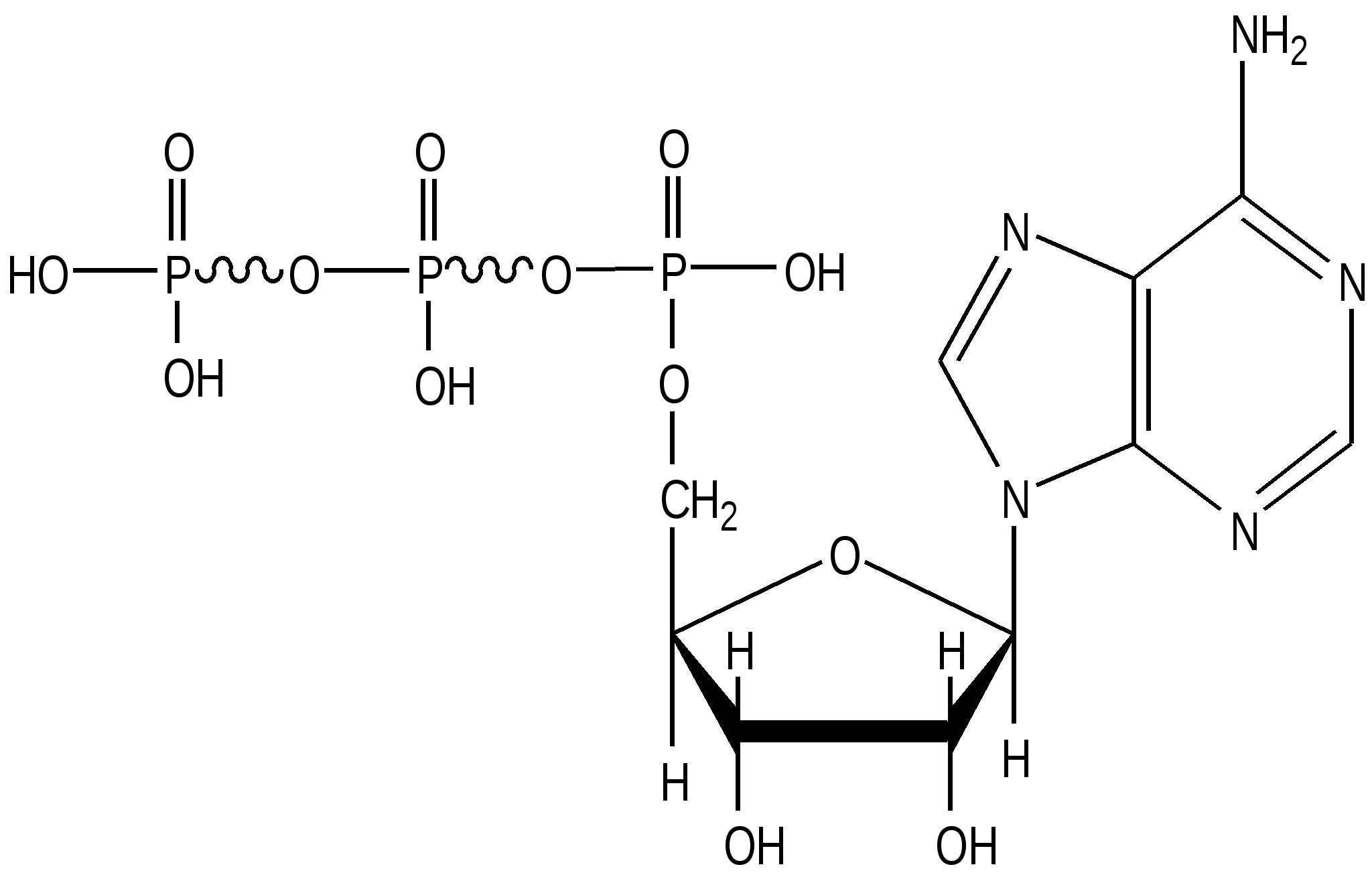
АТФ
Аденозинтрифосфат
|
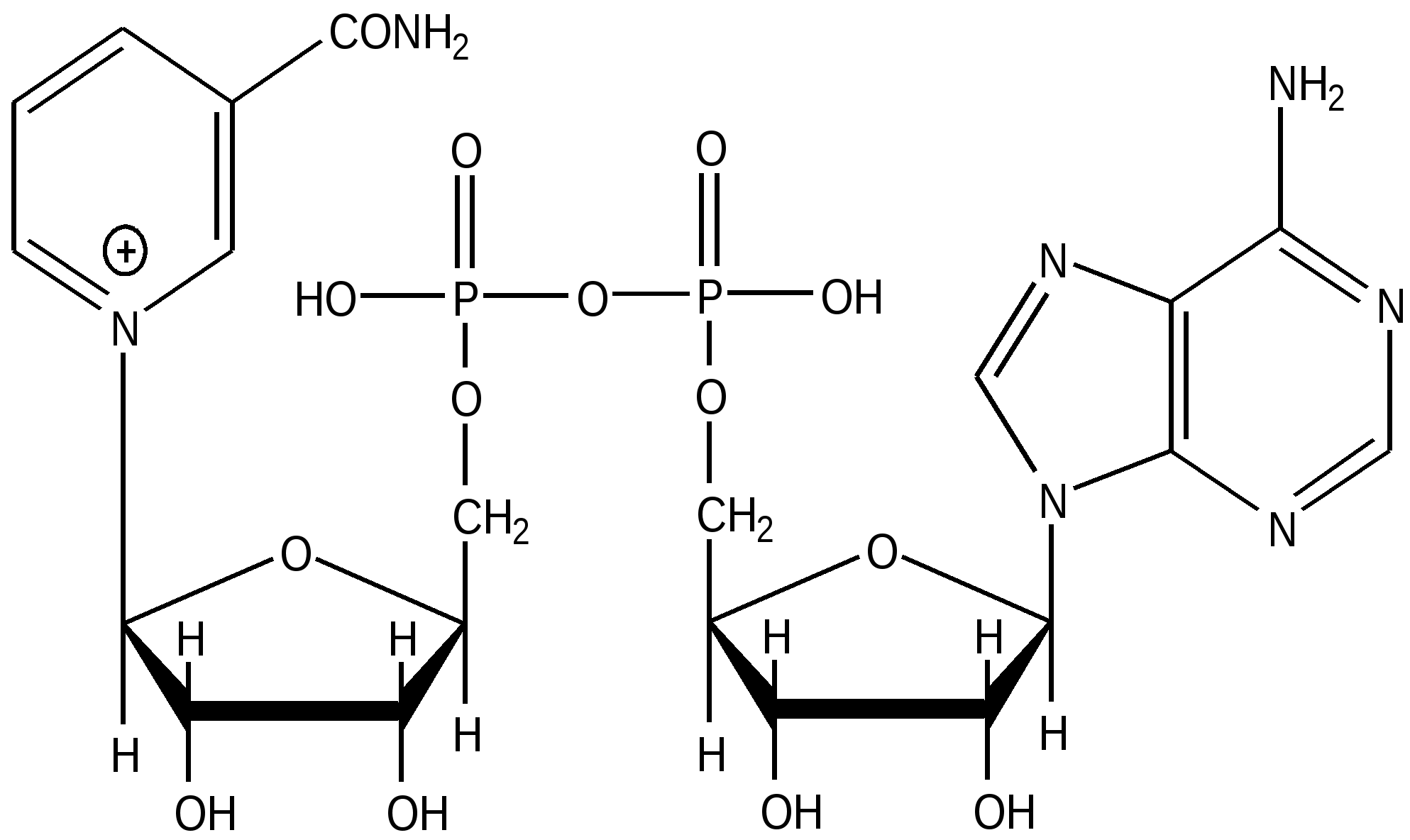
НАД+
Никотинамидадениндинуклеотид
|
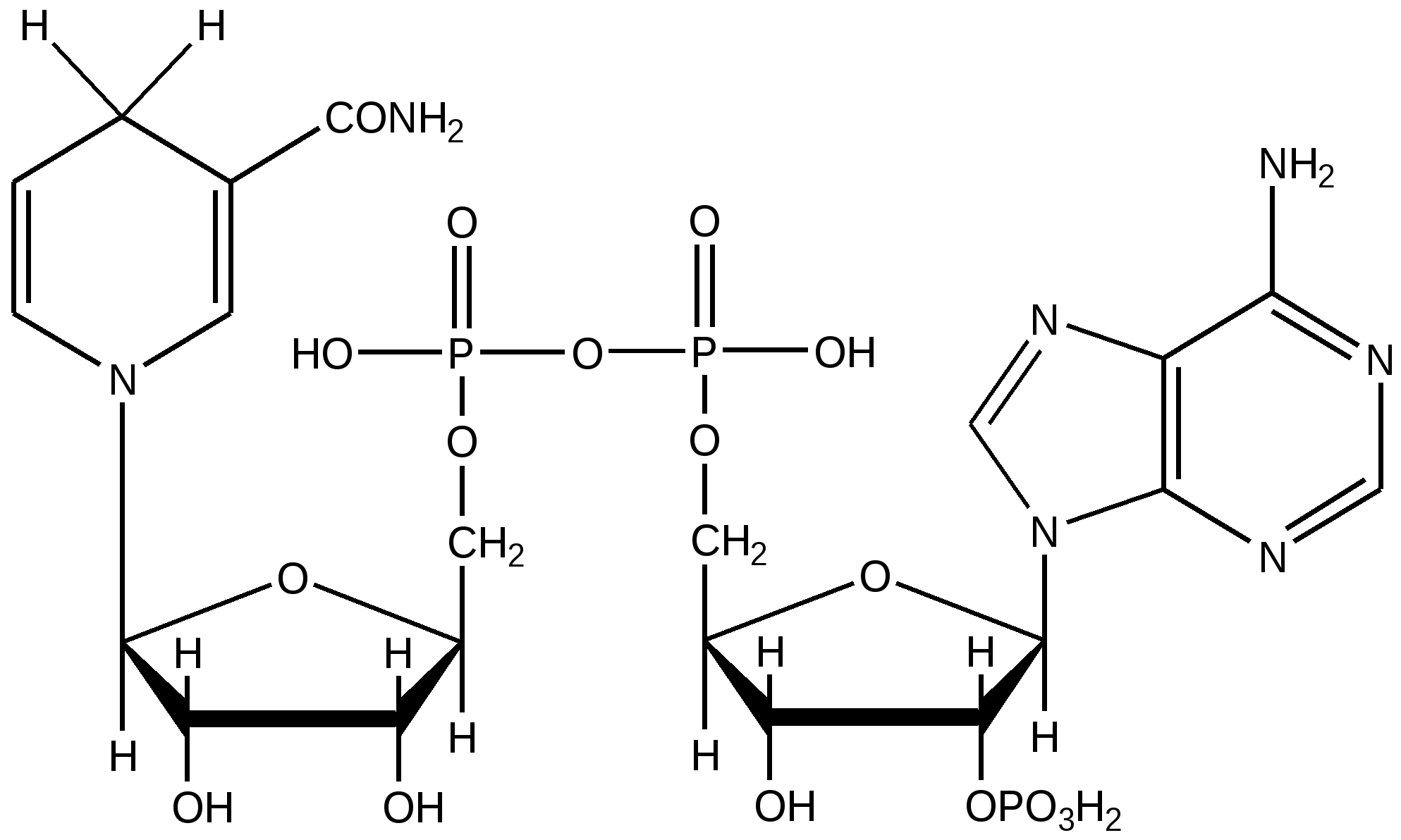
НАДФ·H
Никотинамидадениндинуклеотид фосфат
|
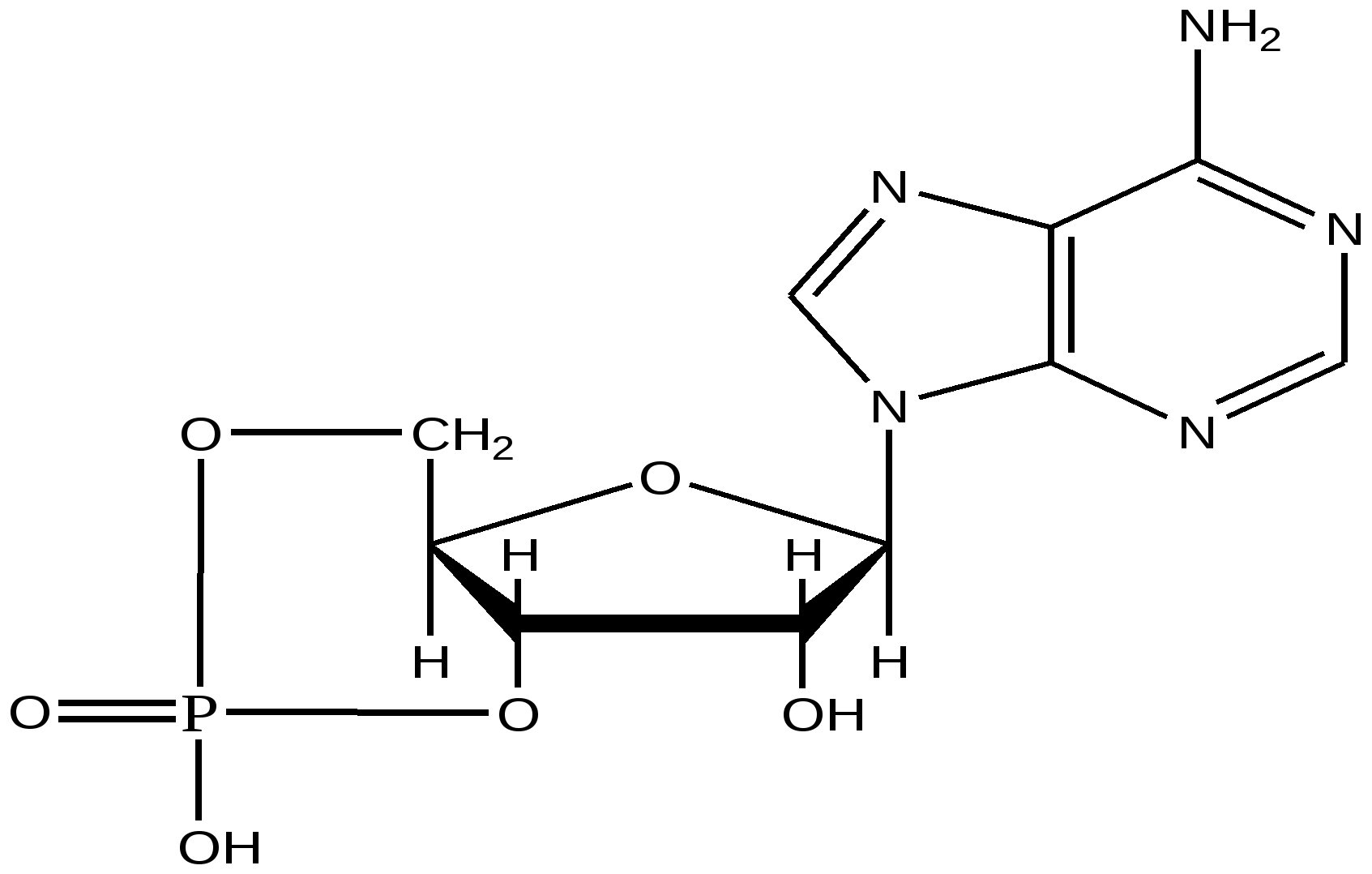
ц-3’, 5’-АМФ
цАМФ
|
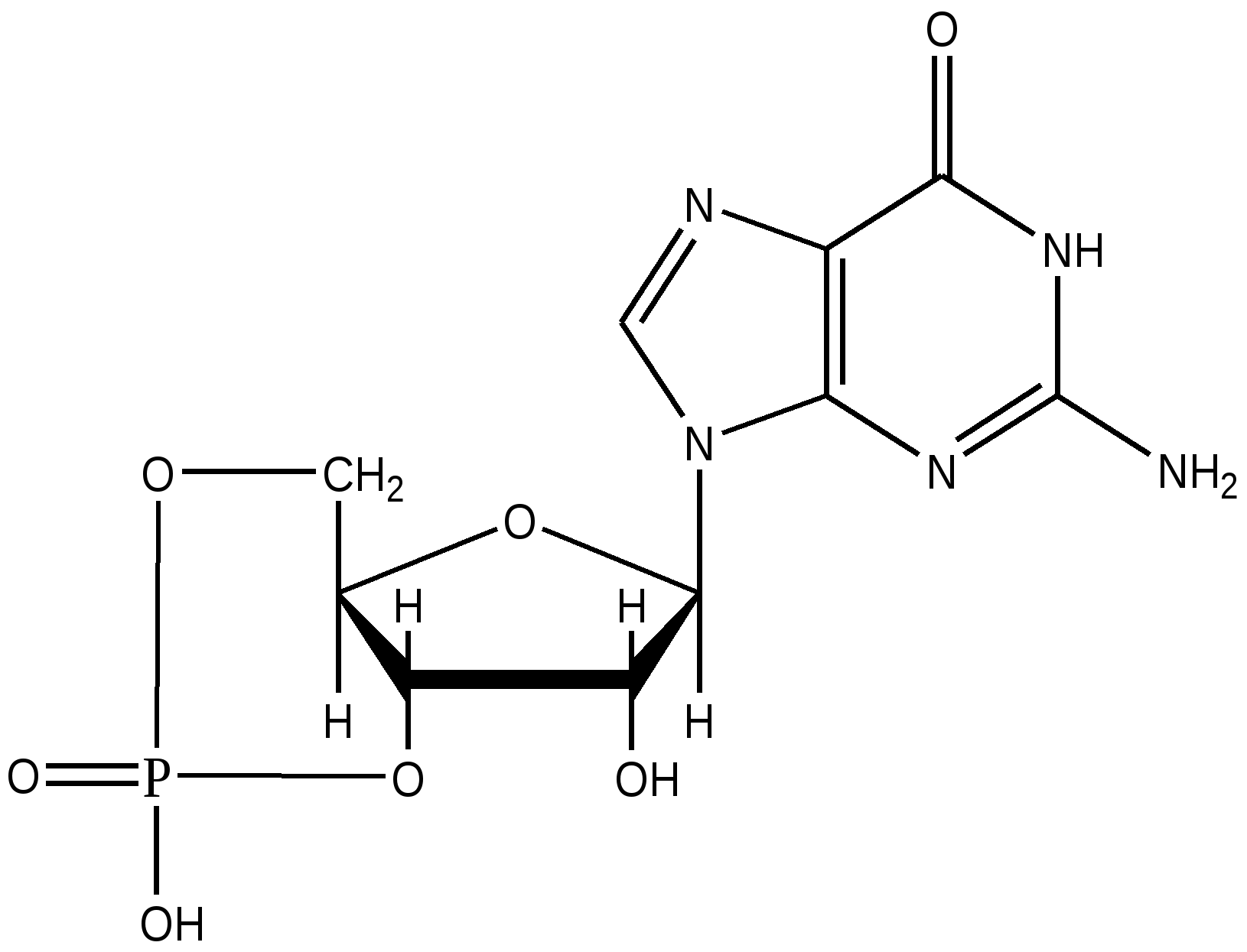
ц-3’,5’-ГМФ
цГМФ
|
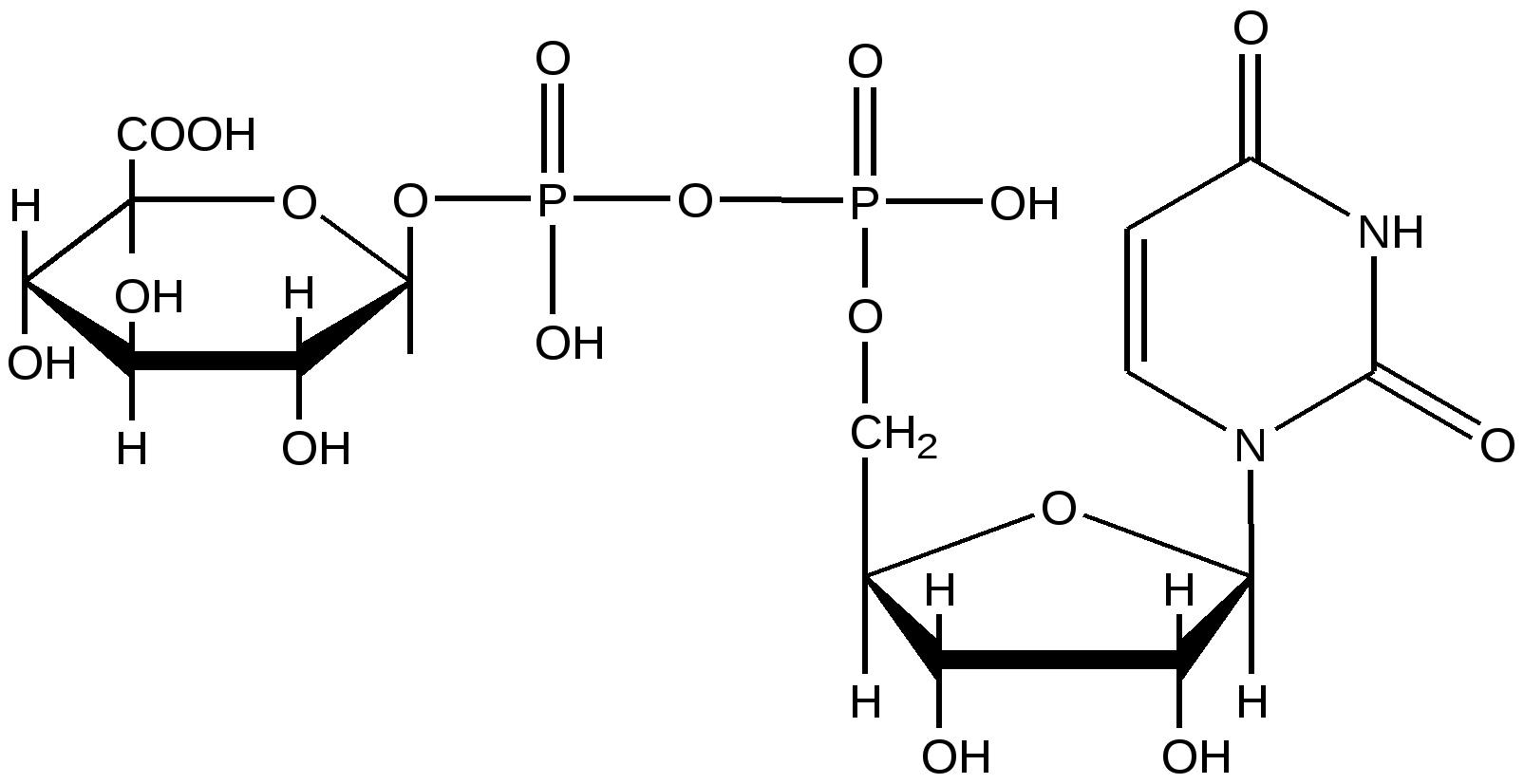
УДФ-глюкуроновая кислота
|
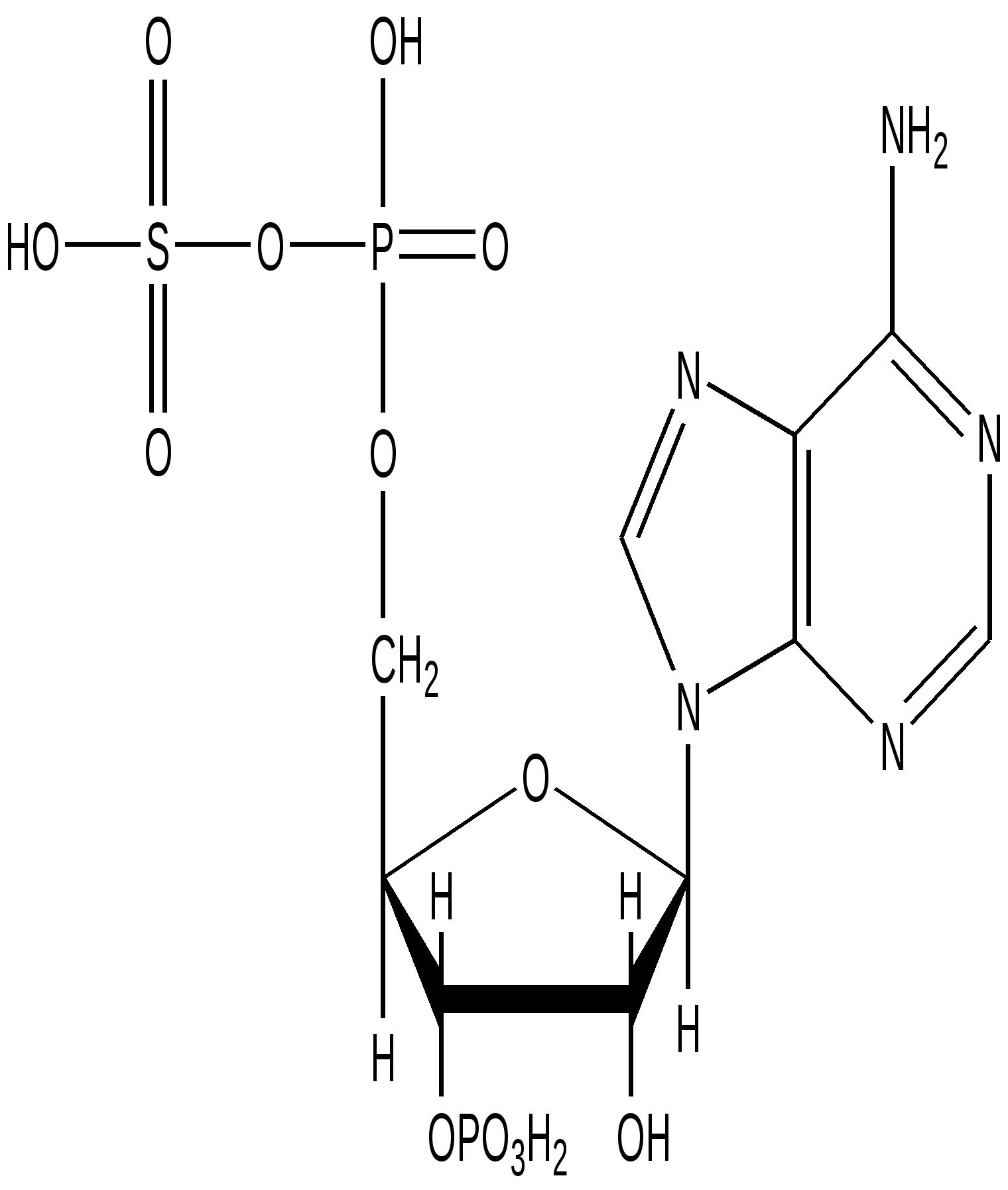
ФАФС
3’-Фосфоаденозил-5’-фосфосульфат
|
Лекарственные препараты
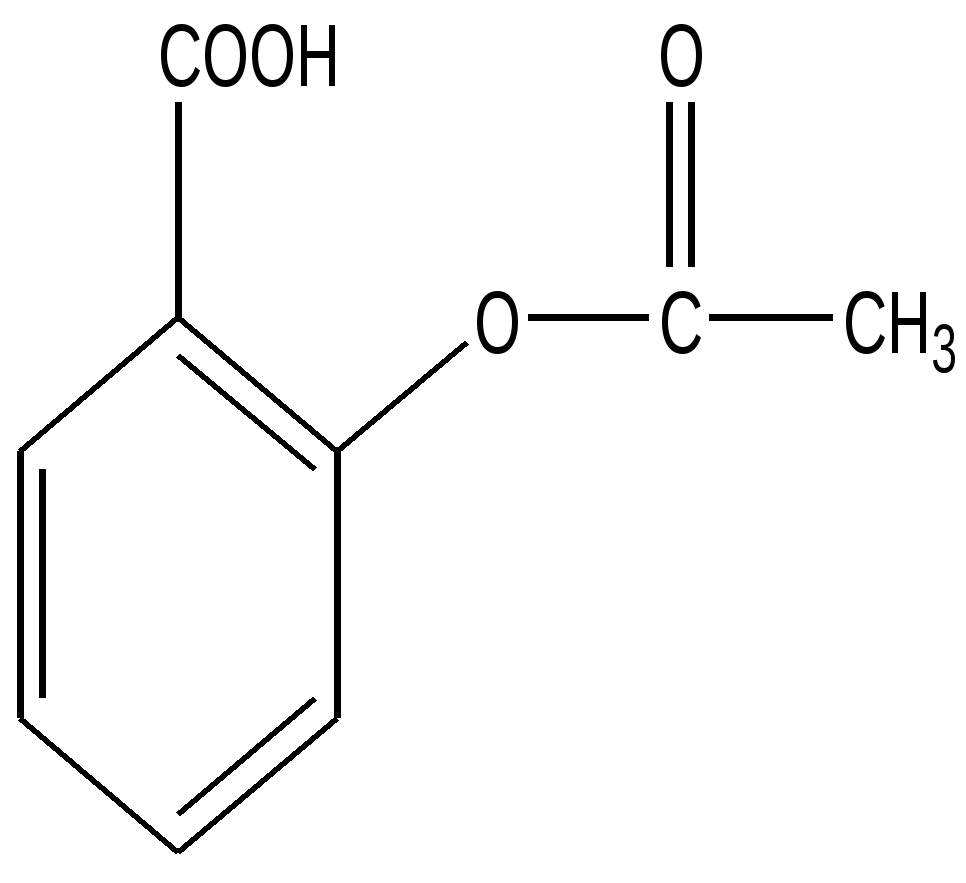
Аспирин
(Ацетилсалициловая кислота)
|
|
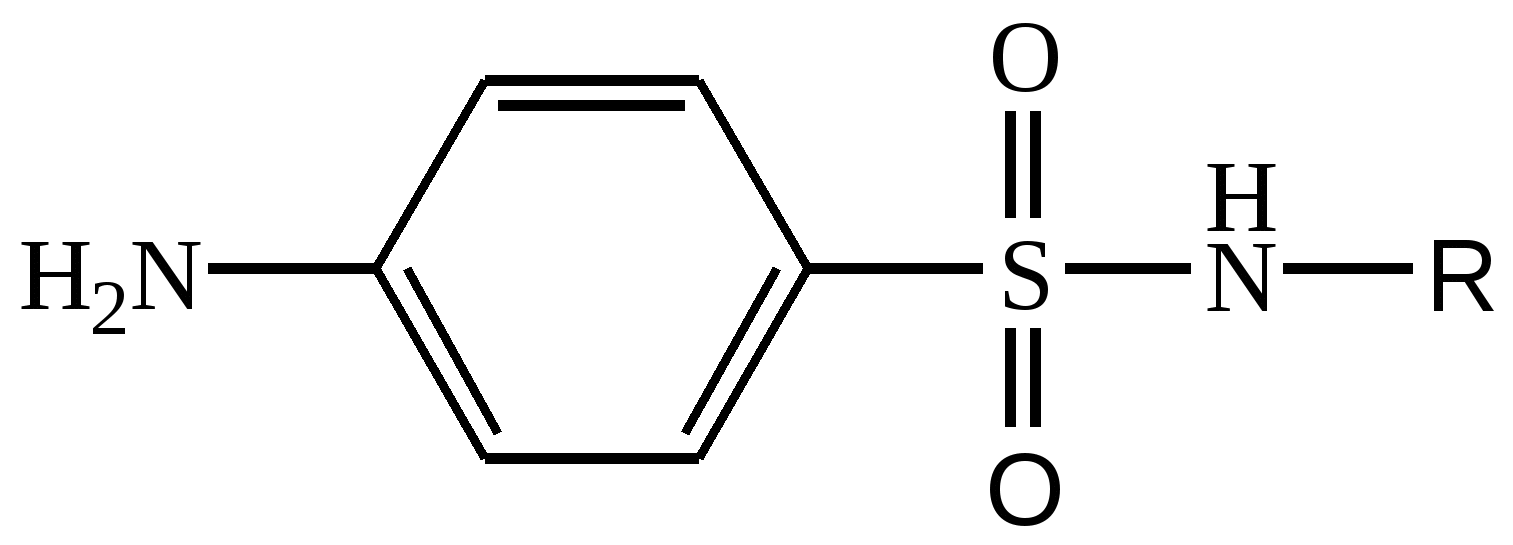
Сульфаниламидный препарат
|
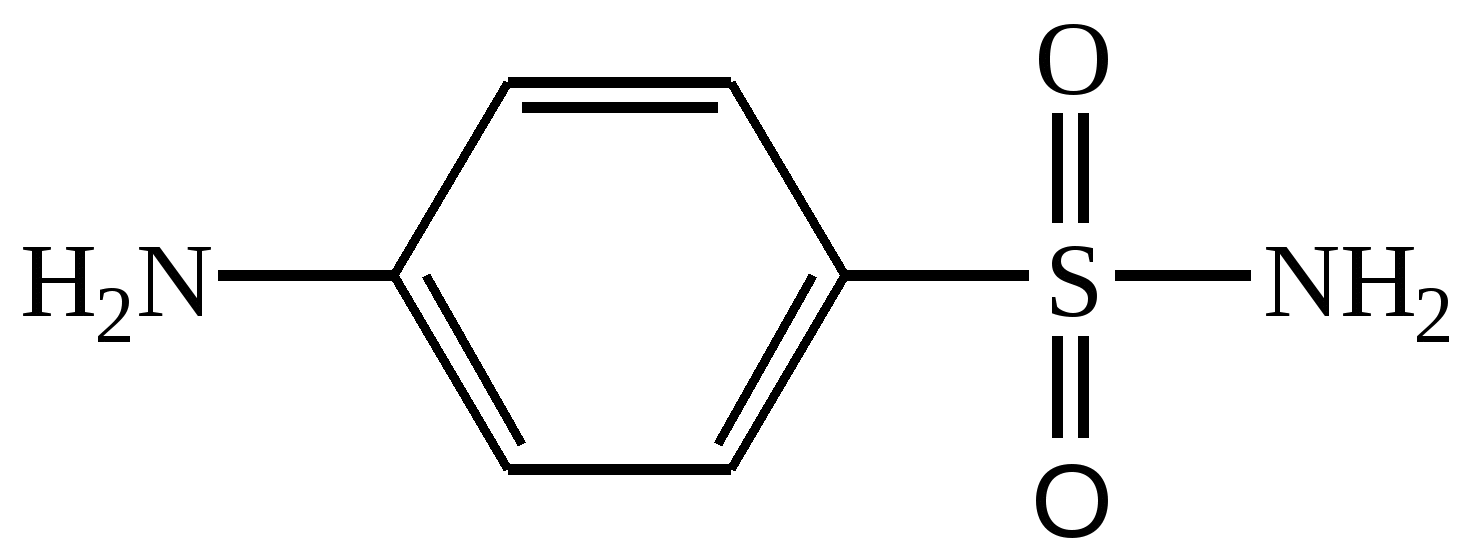
Белый стрептоцид
|
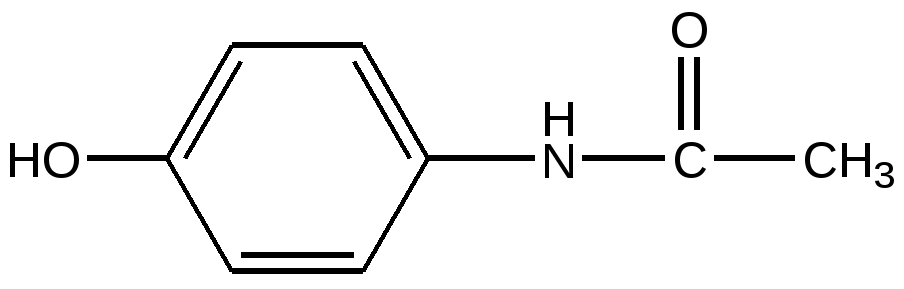
Парацетамол
|
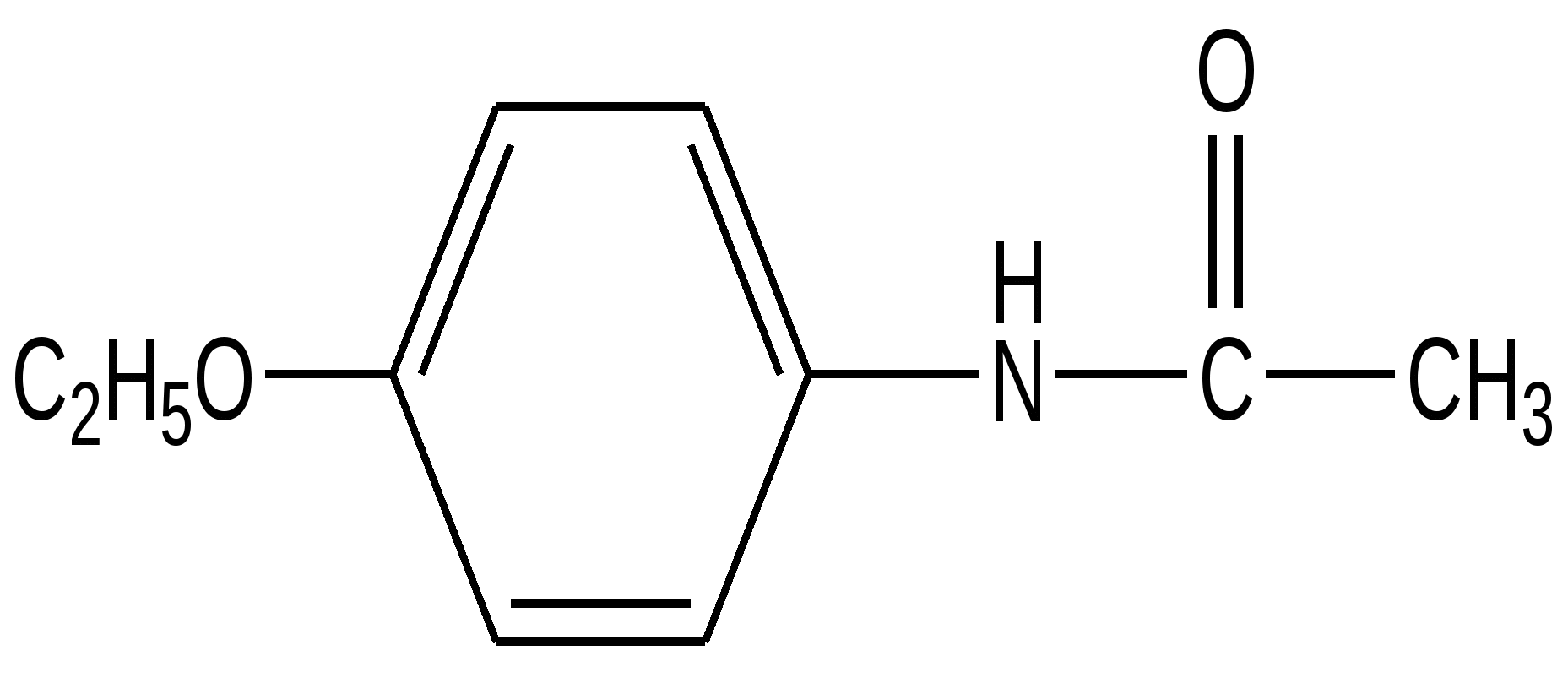
Фенацетин
|
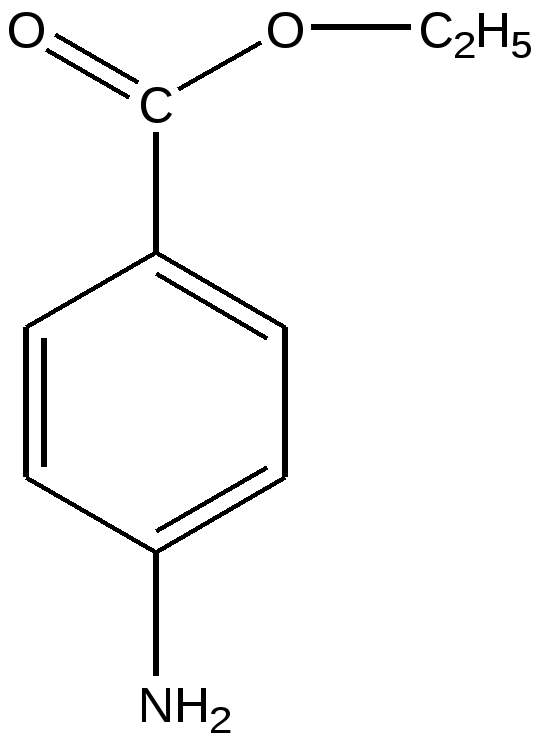
Анестезин
|
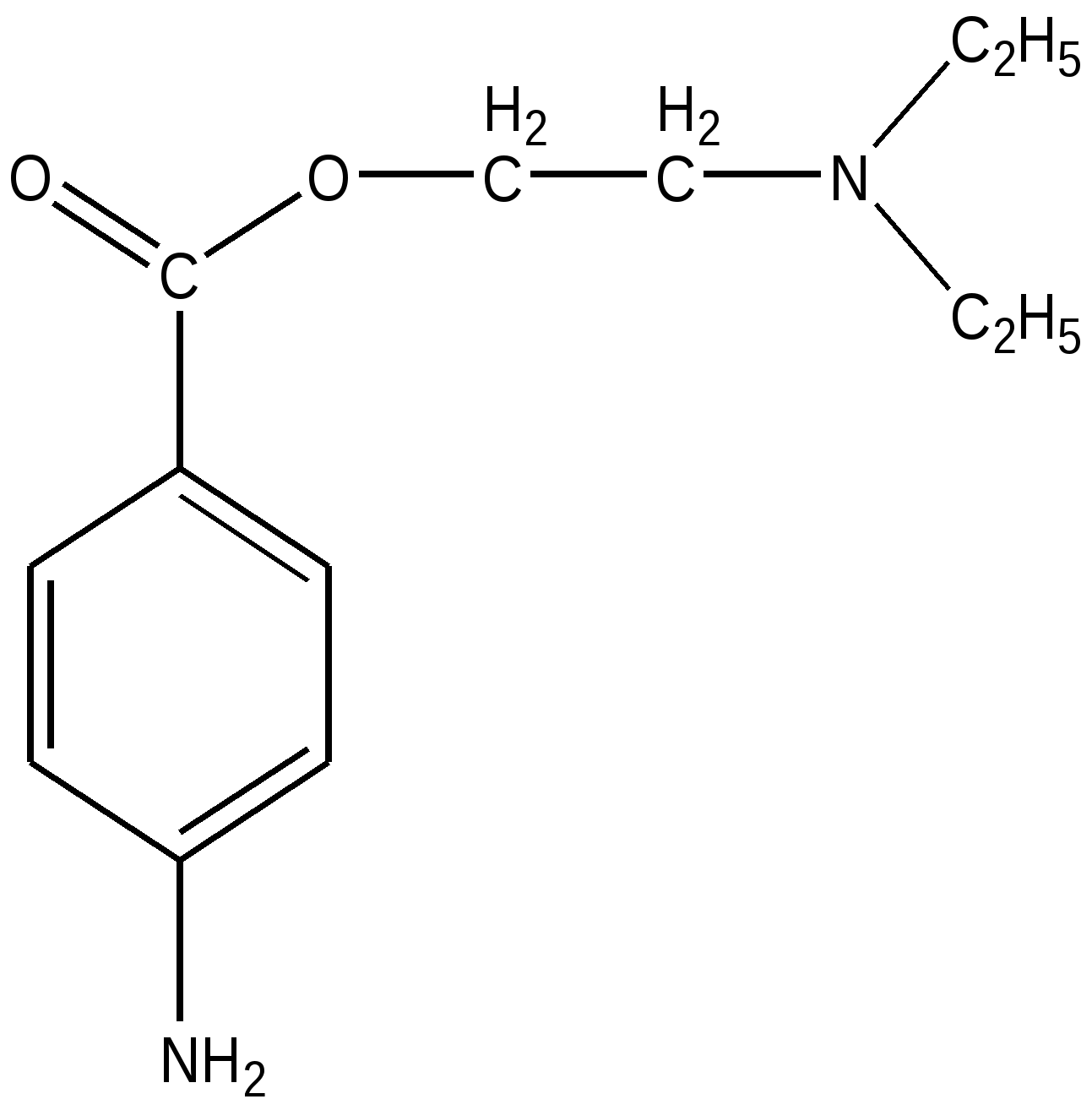
Новокаин
|
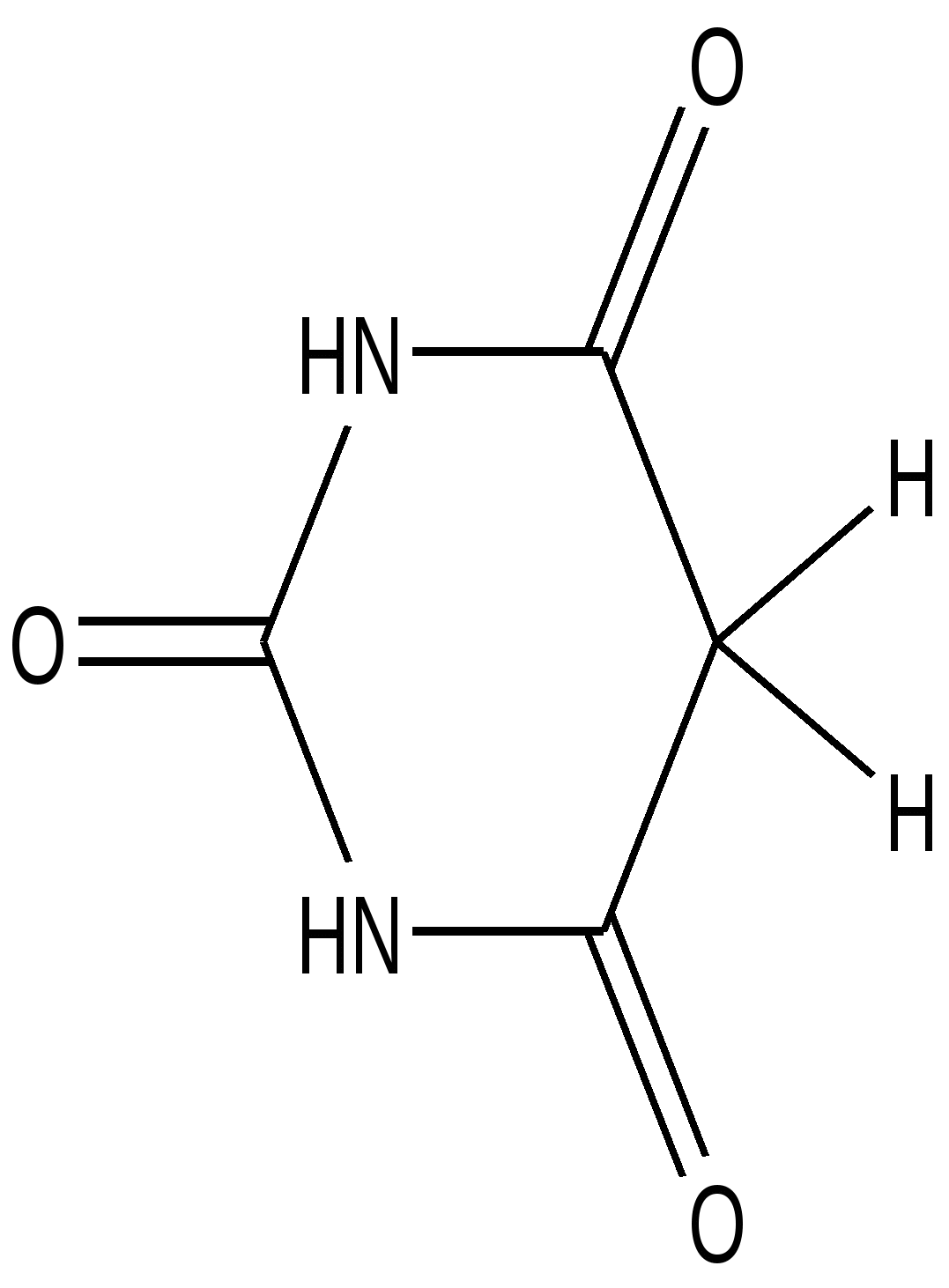
Барбитуровая кислота
(2,4,6-триоксопиримидин)
|
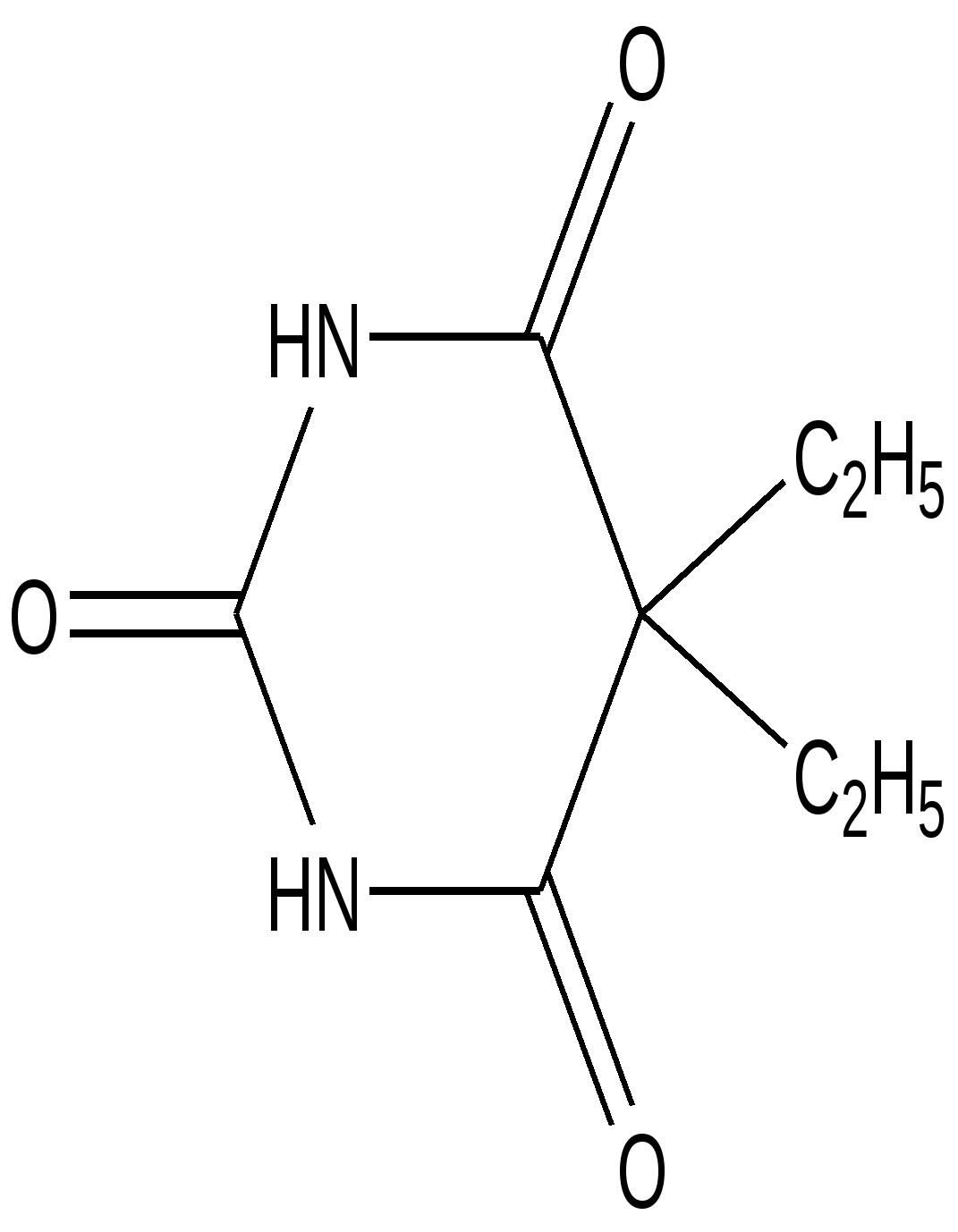
Барбитал (Веронал)
(5,5-диэтилбарбитуровая кислота)
|
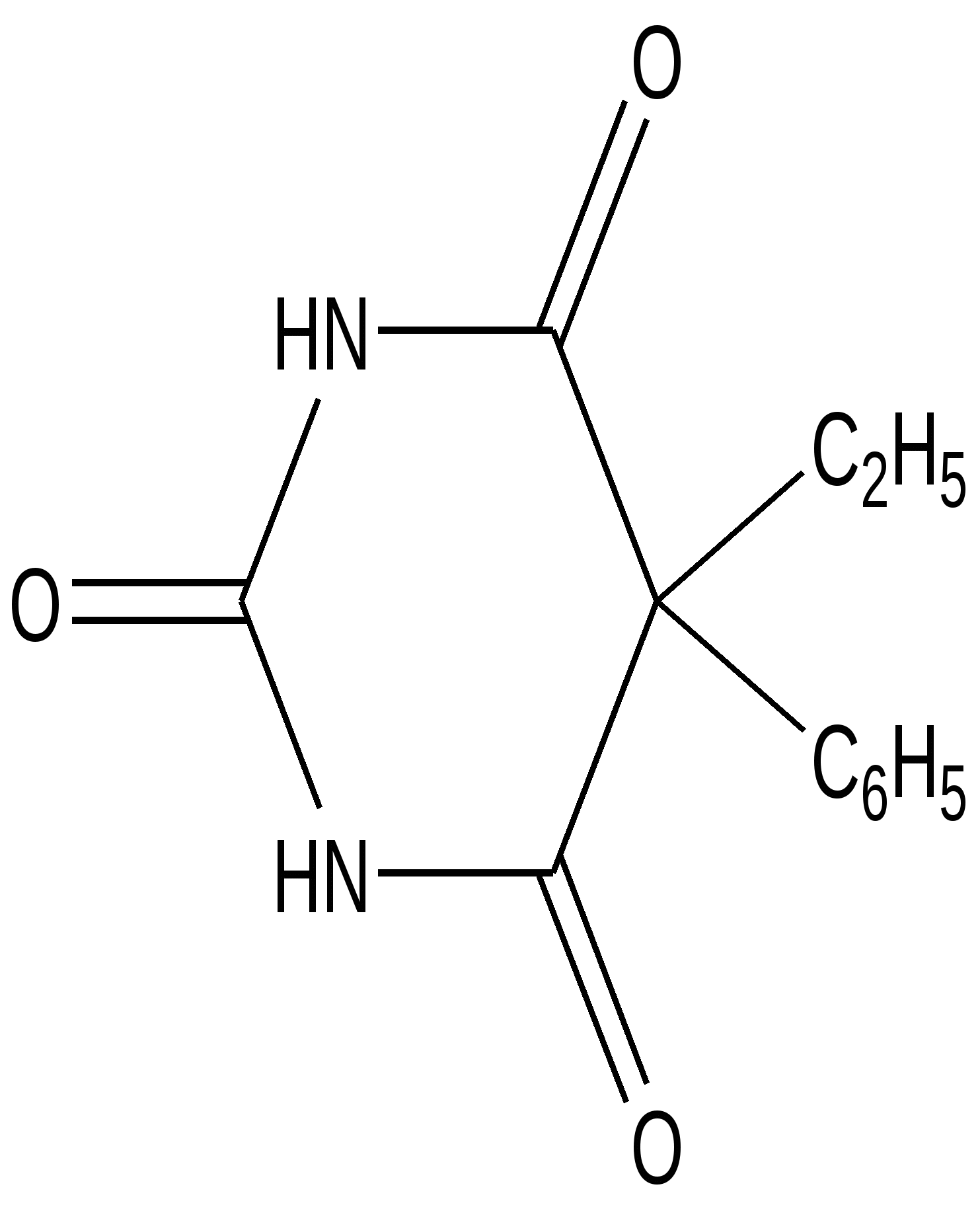
Фенобарбитал (люминал)
(5-этил-5-фенилбарбитуровая кислота)
|
|
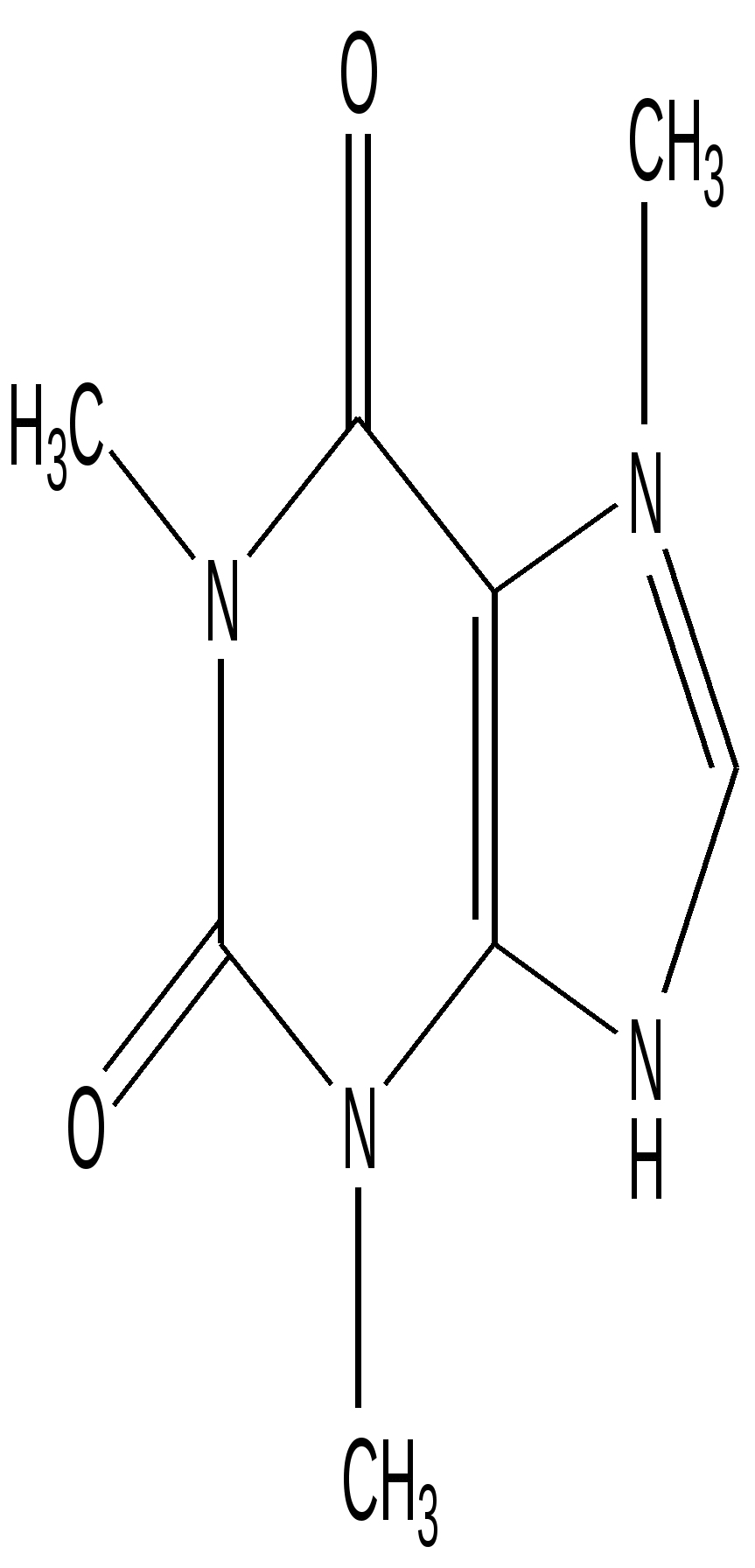
Кофеин
(1,3,7-триметилксантин)
|
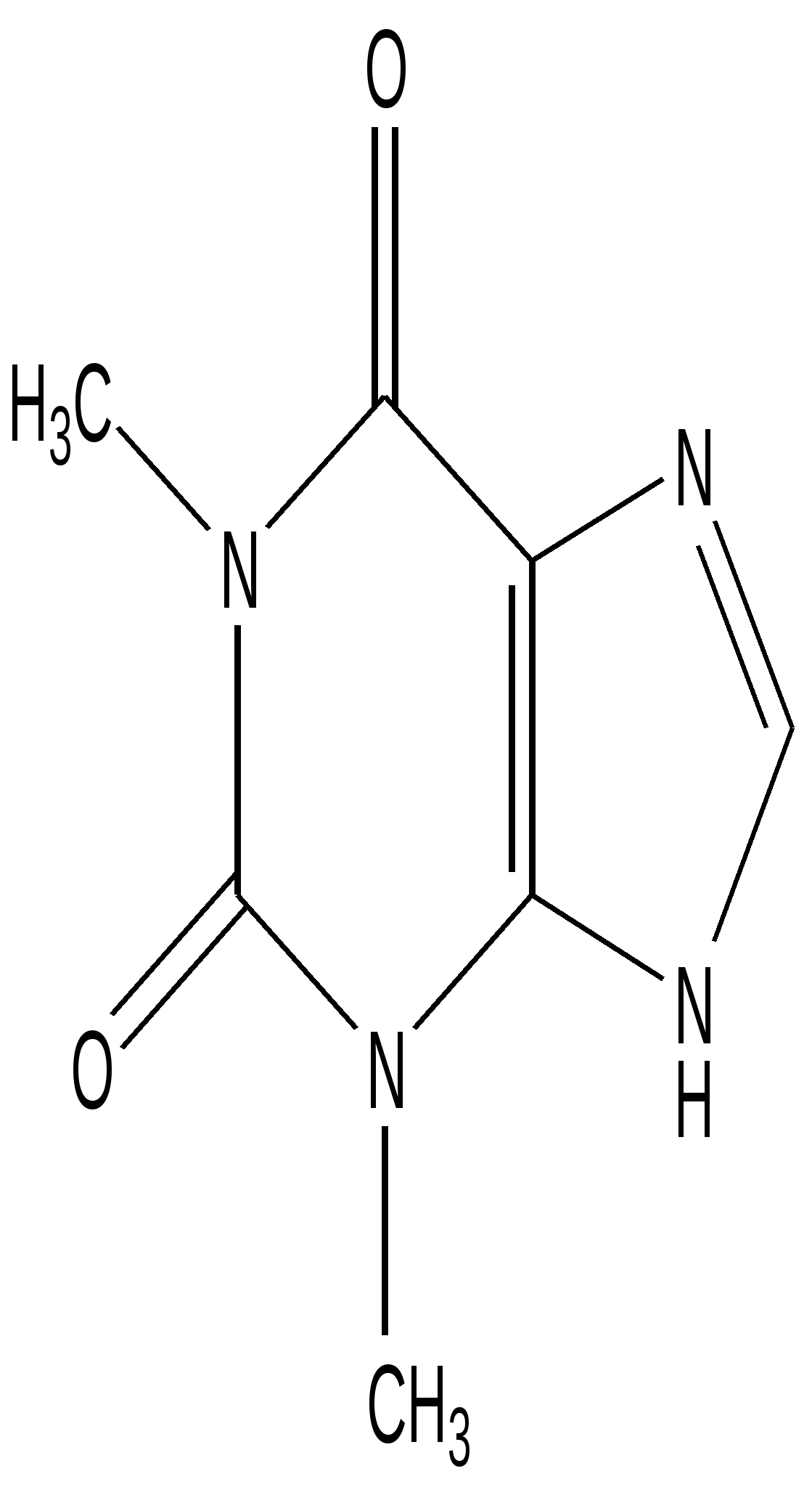
Теофиллин
(1,3-диметилксантин)
|
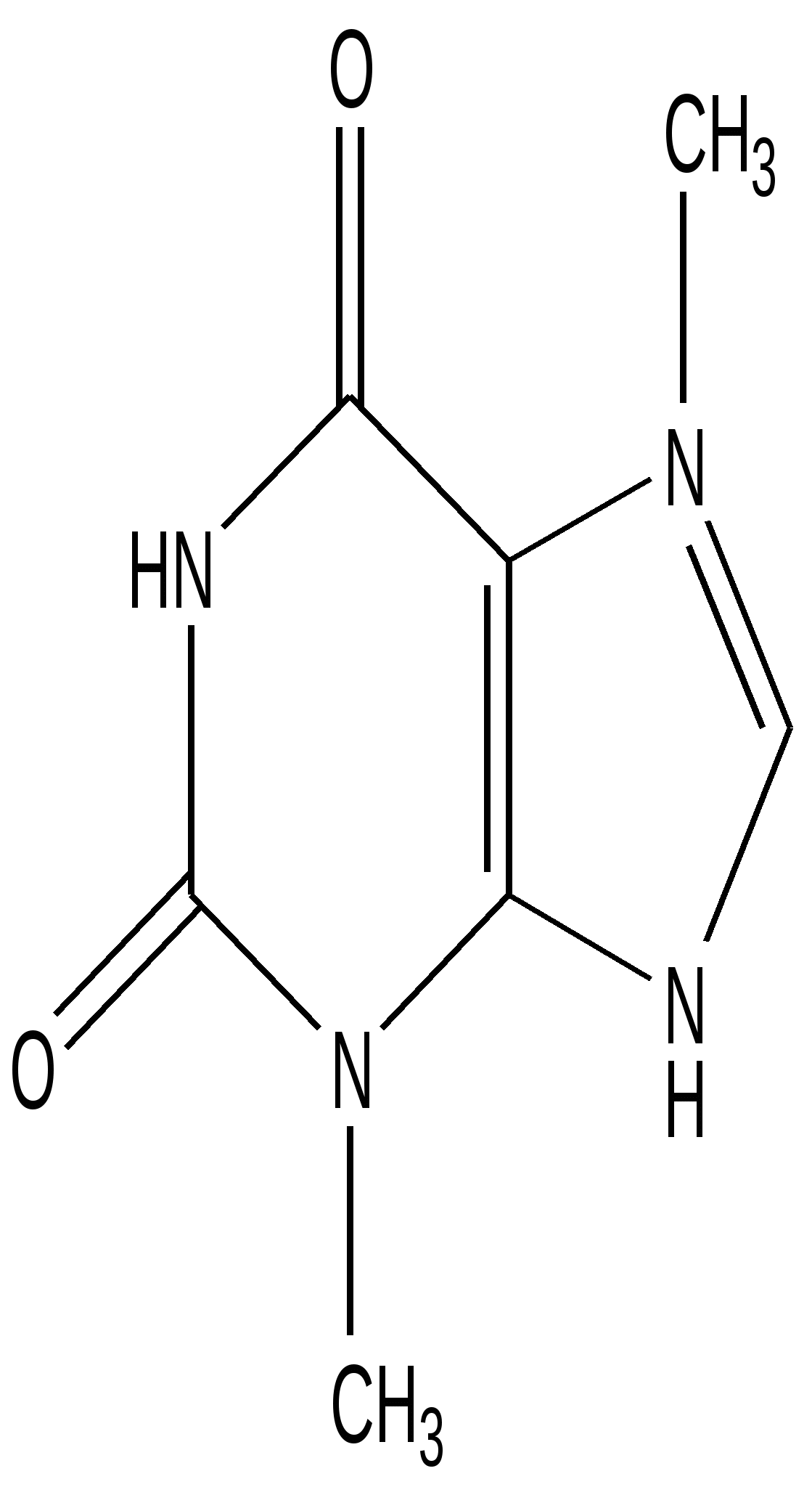
Теобромин
(3,7-диметилксантин)
|
|
Витамины
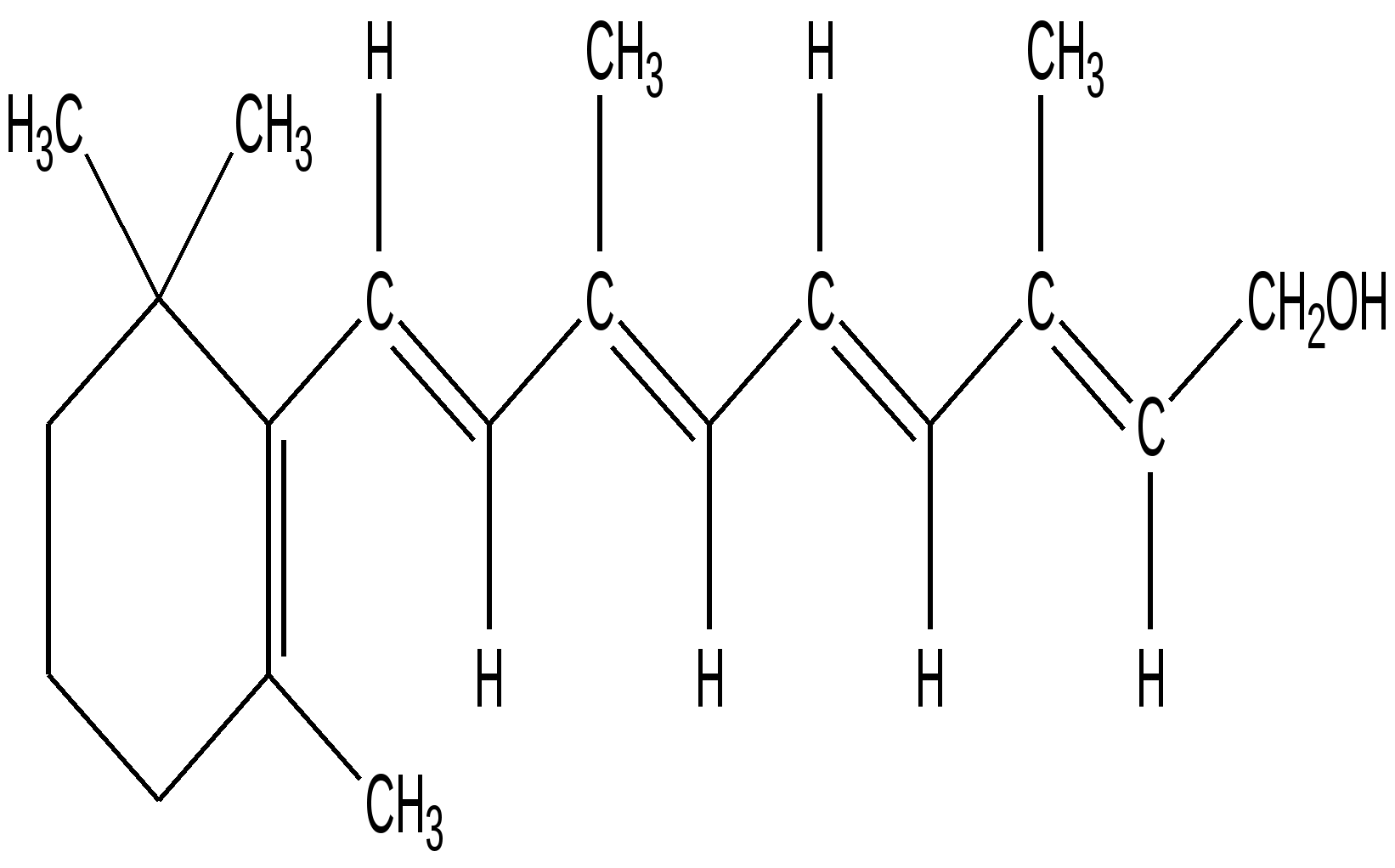
Ретинол
|
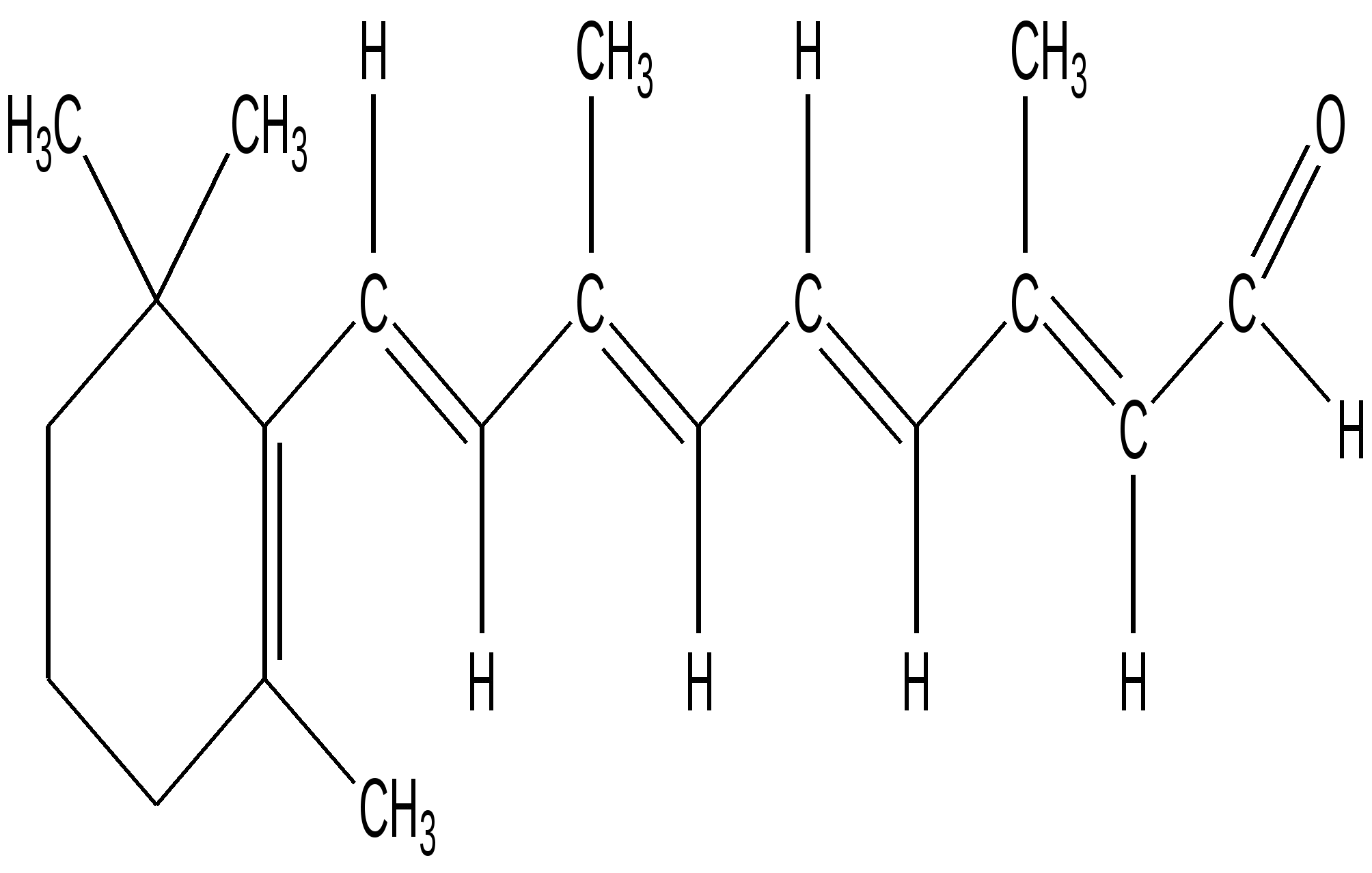
Ретиналь
|
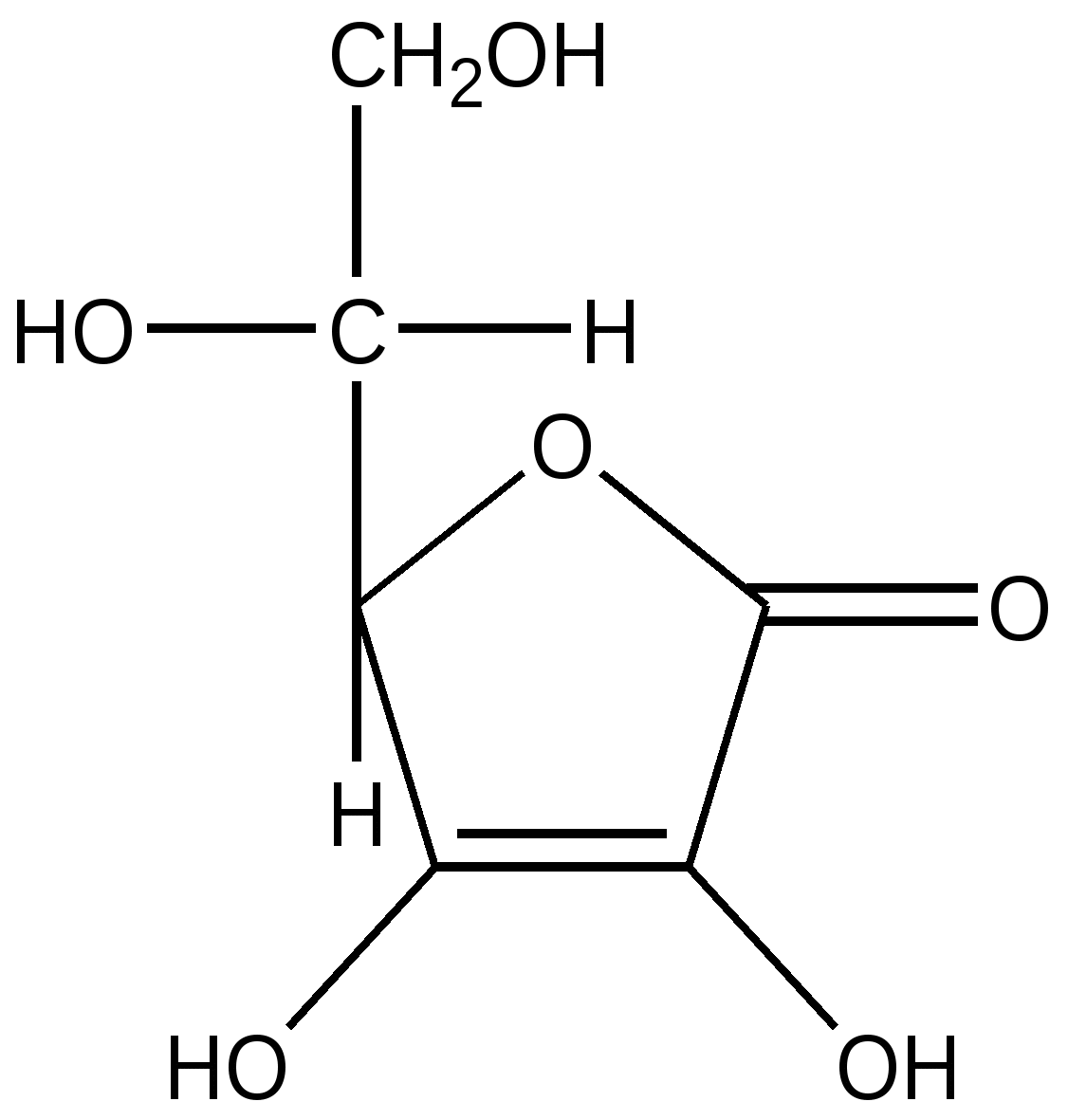
Аскорбиновая кислота
(аскорбат)
|
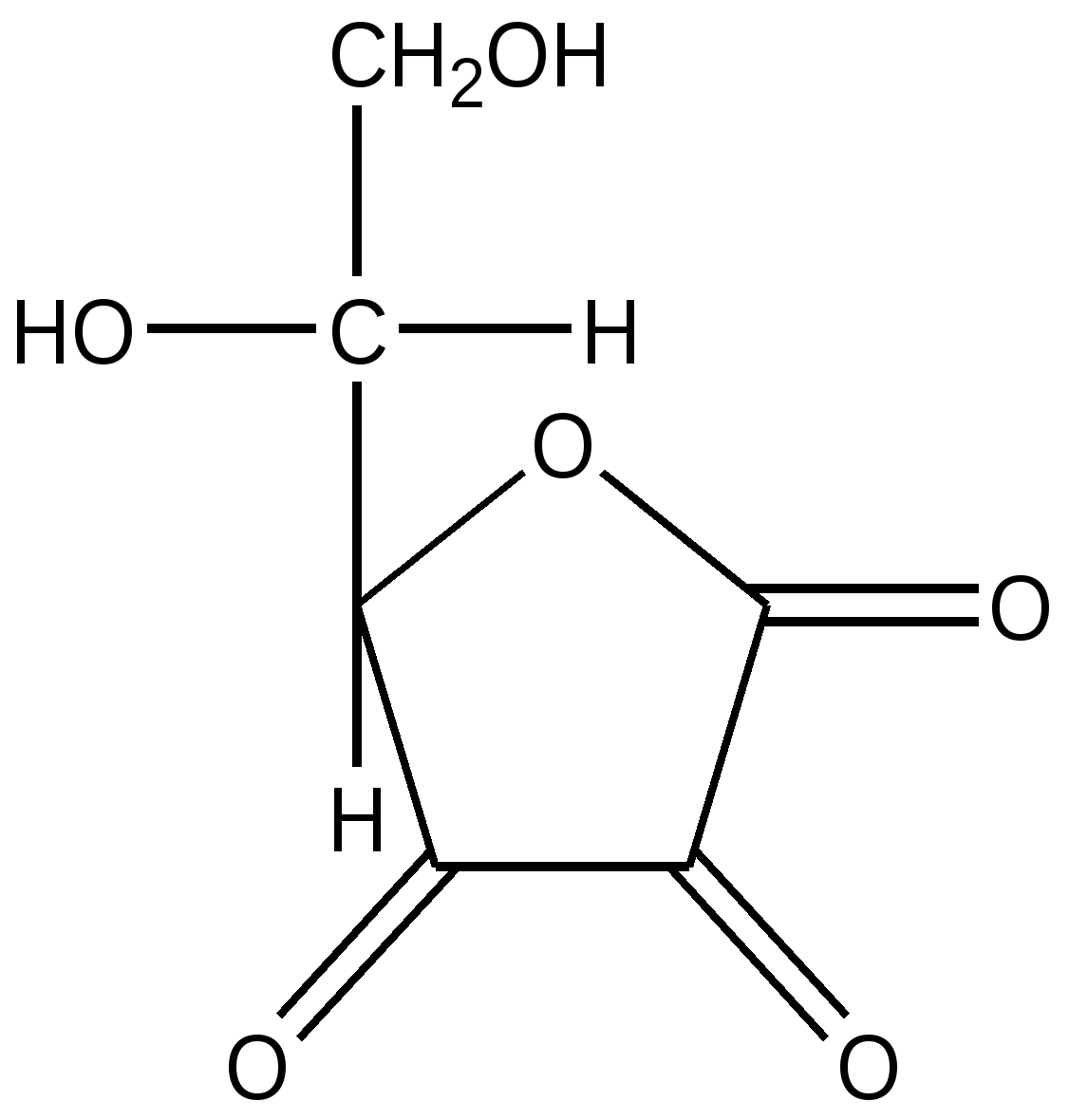
Дегидроаскорбиновая кислота
(дегидроаскорбат)
|
Гормоны, нейромедиаторы и другие биологически активные молекулы

Адреналин
|
Норадреналин
|
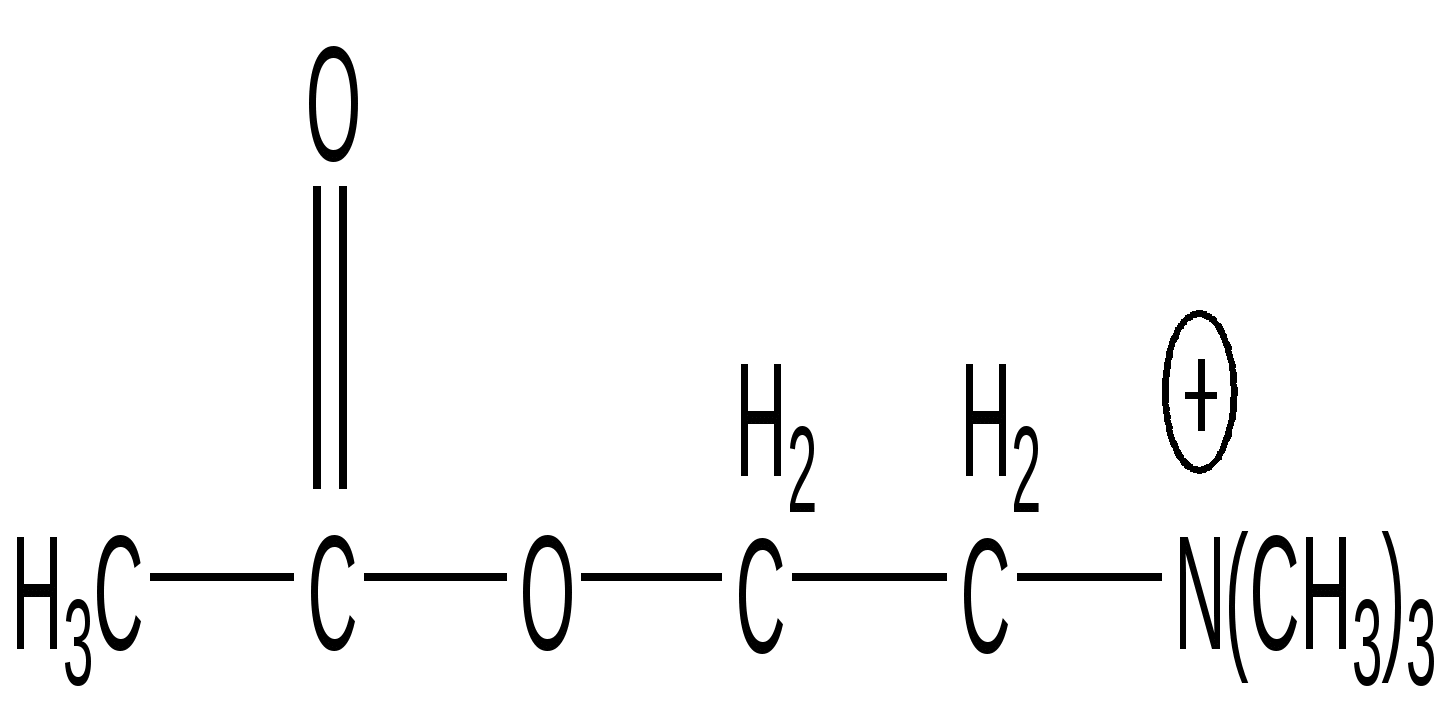
Ацетилхолин
|
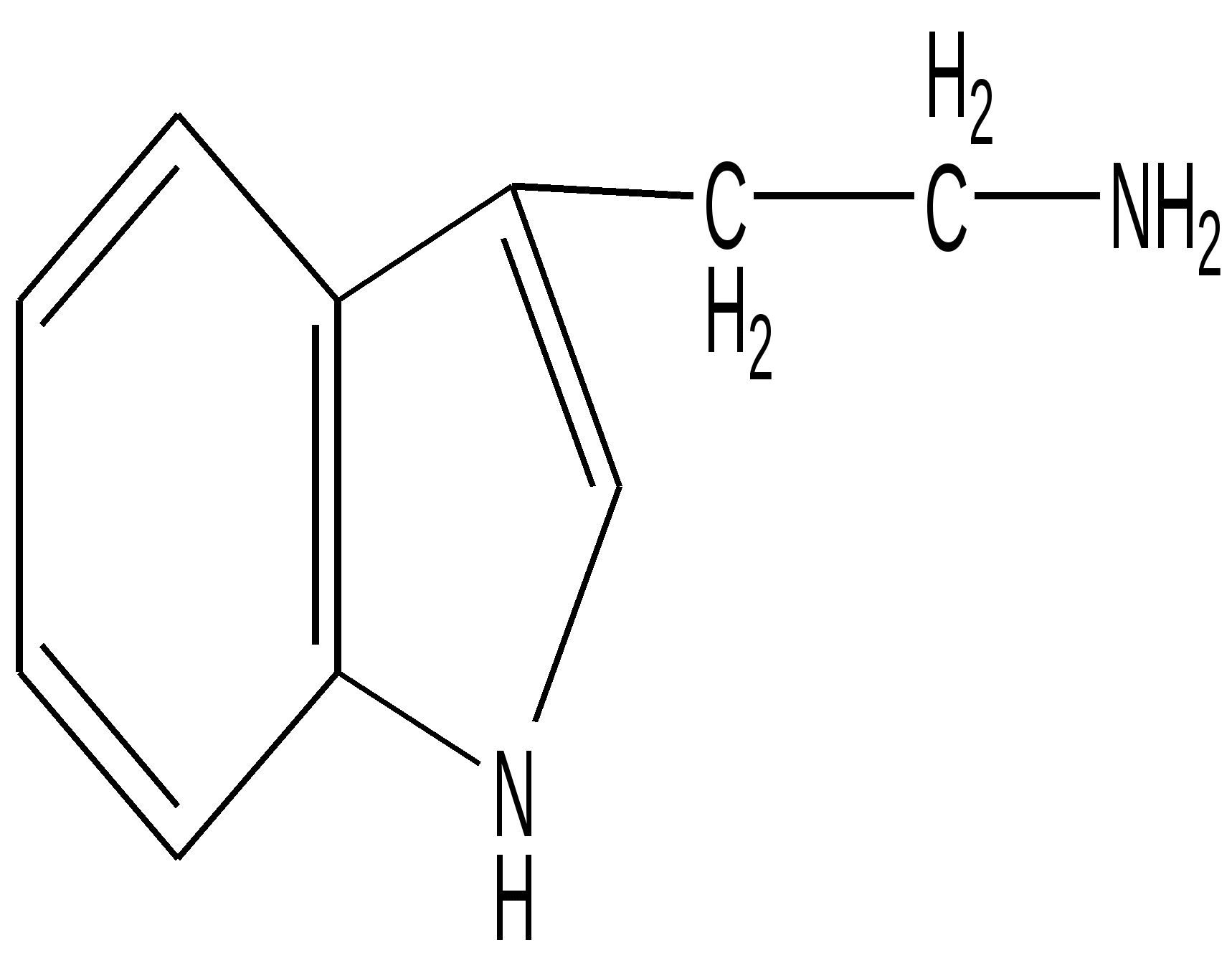
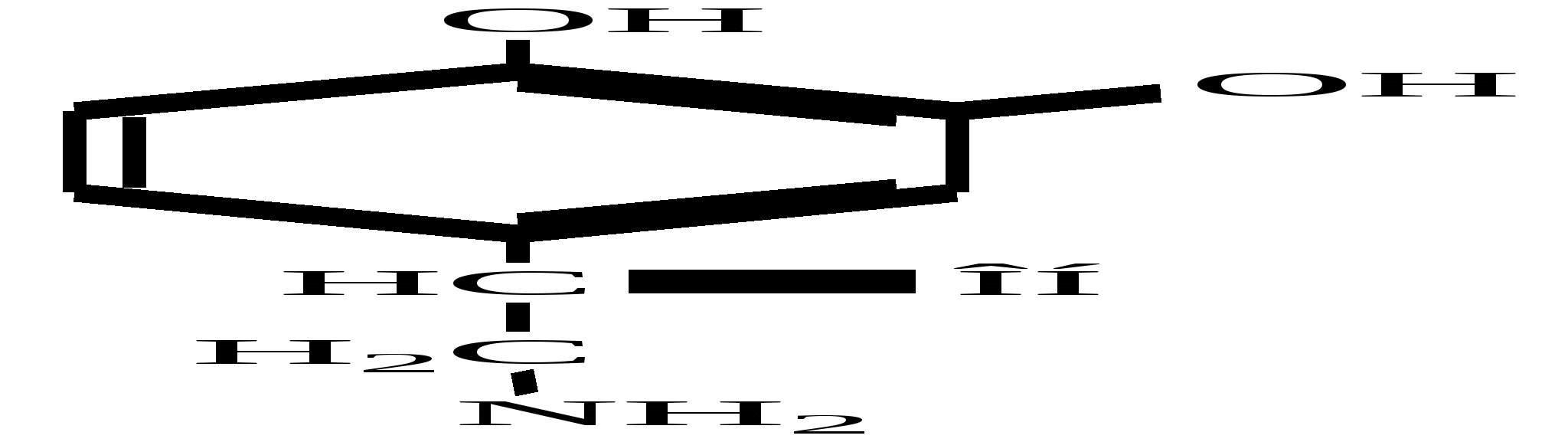
Триптамин
|
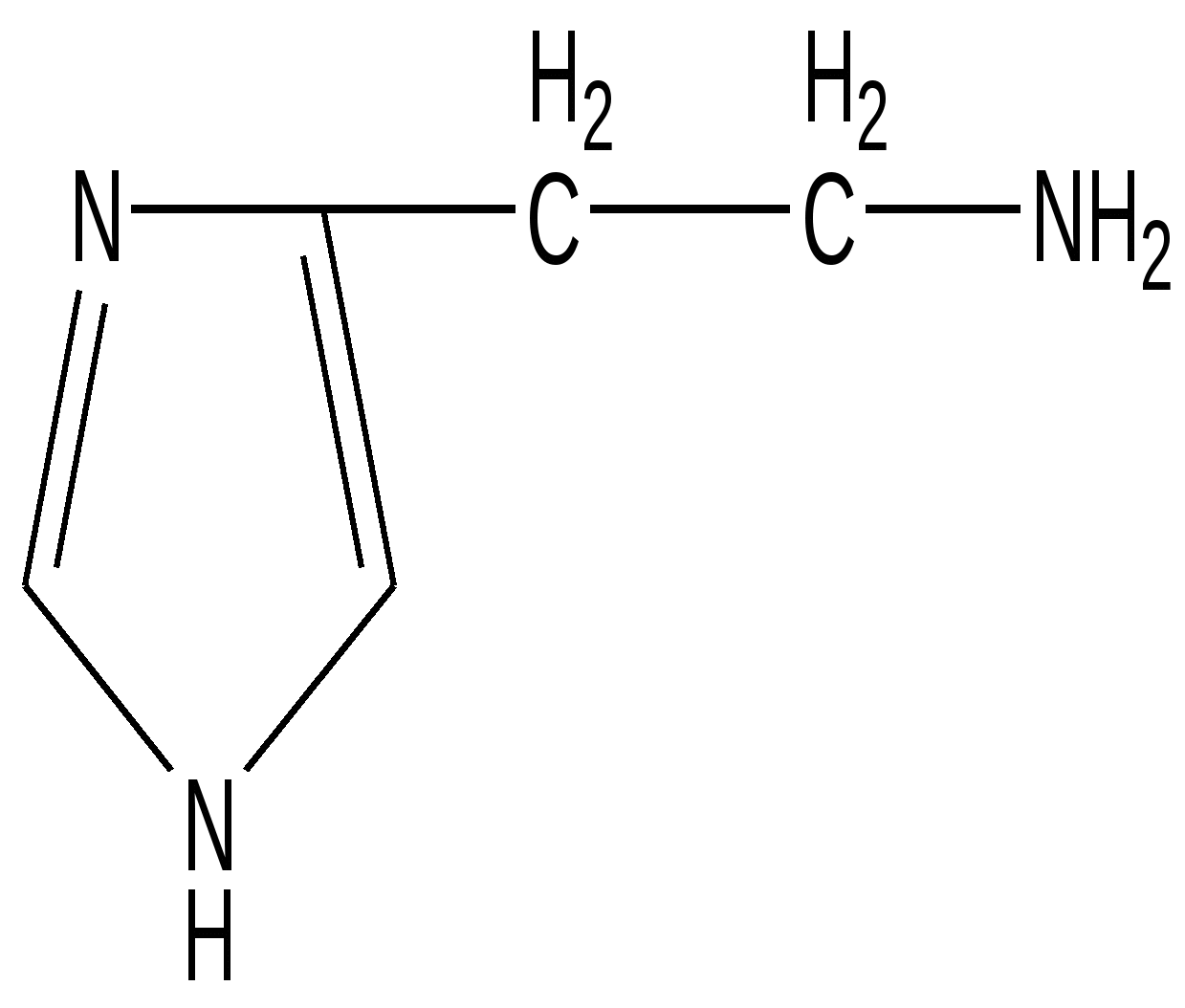
Гистамин
|
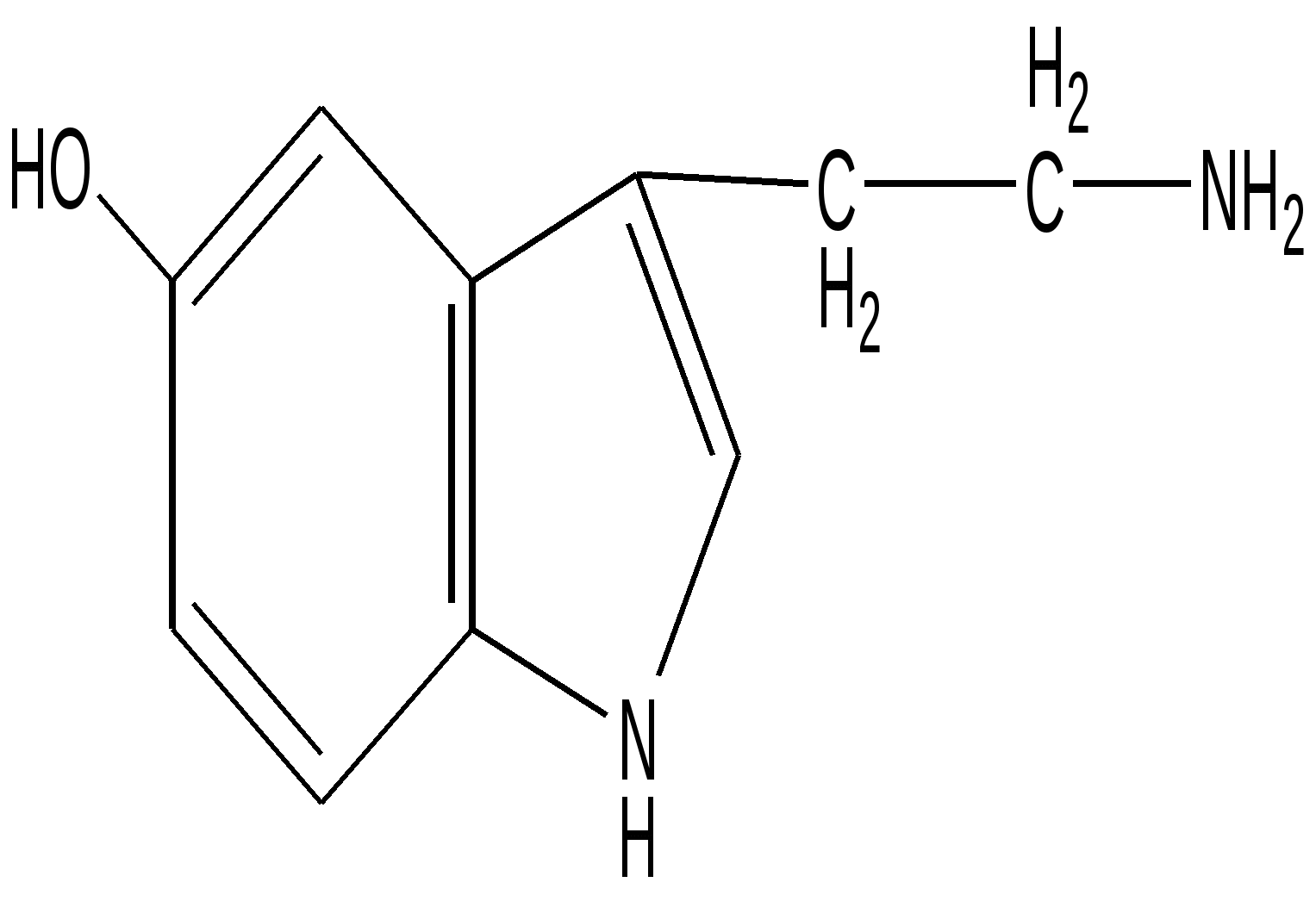
Серотонин
|
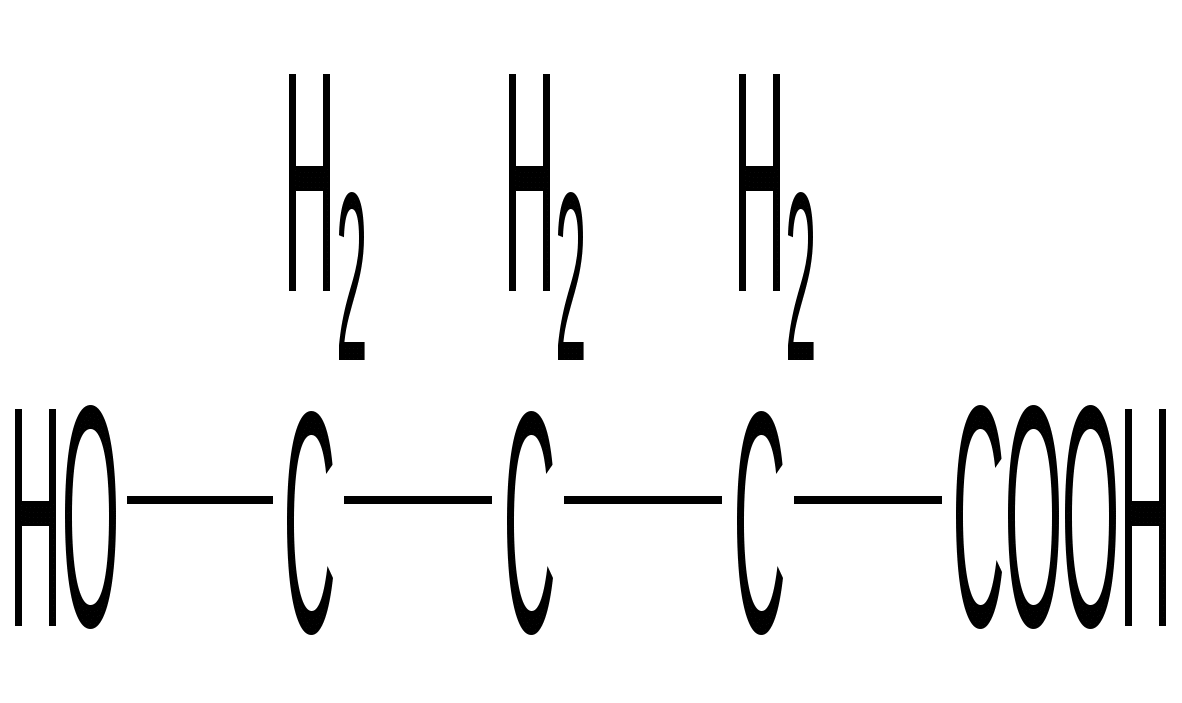
γ-Гидроксимасляная кислота
ГОМК
|
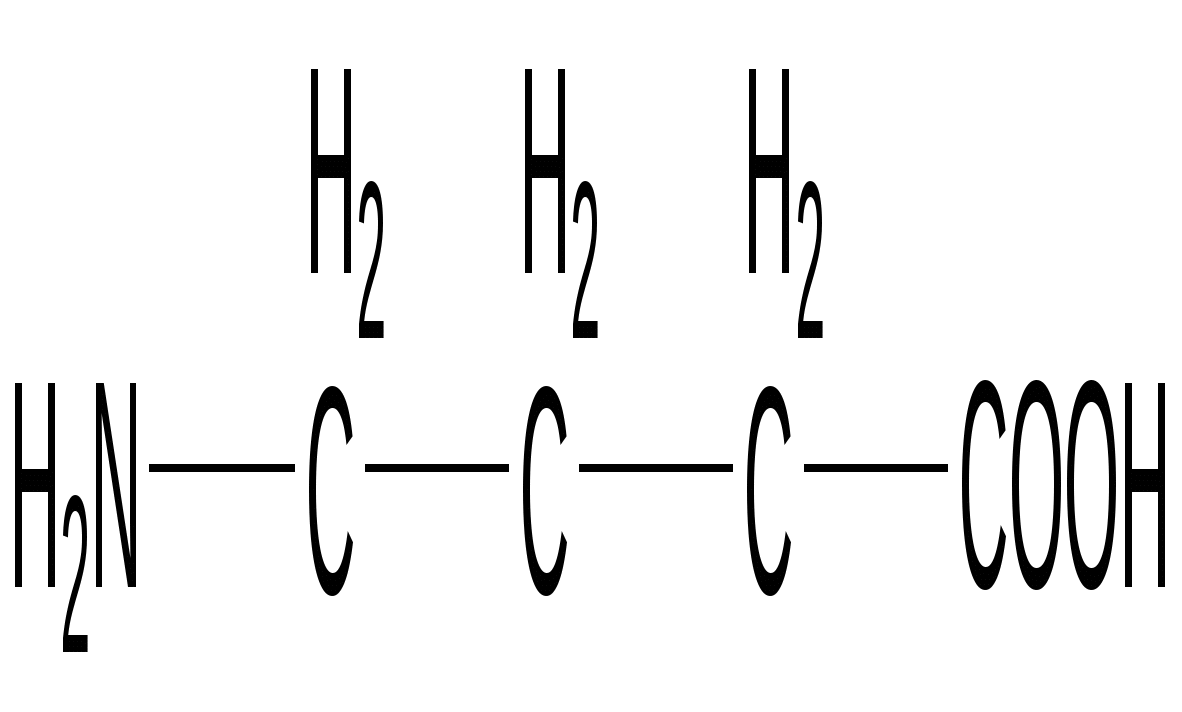
γ-Аминомасляная кислота
ГАМК
|
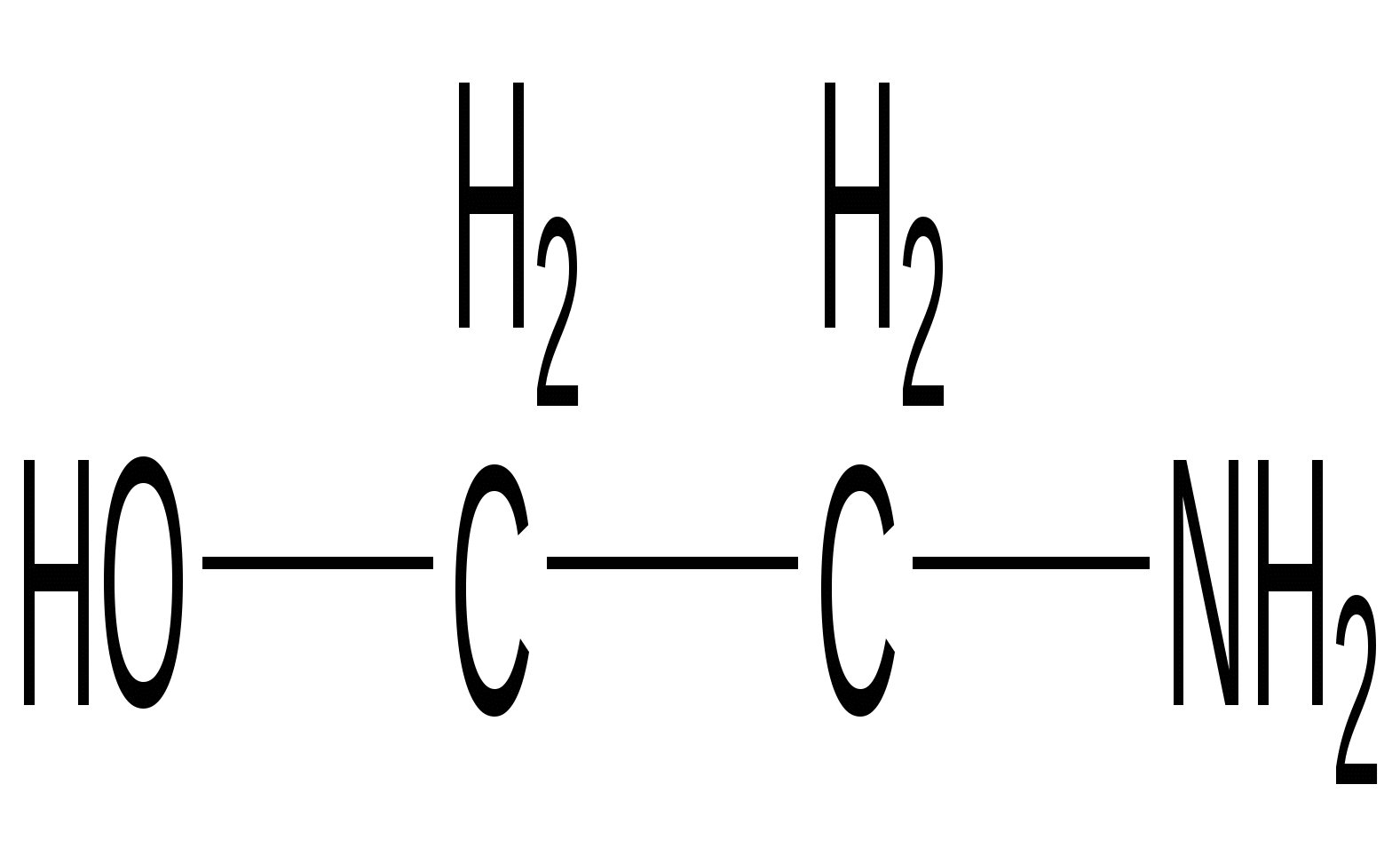
Аминоэтанол
|
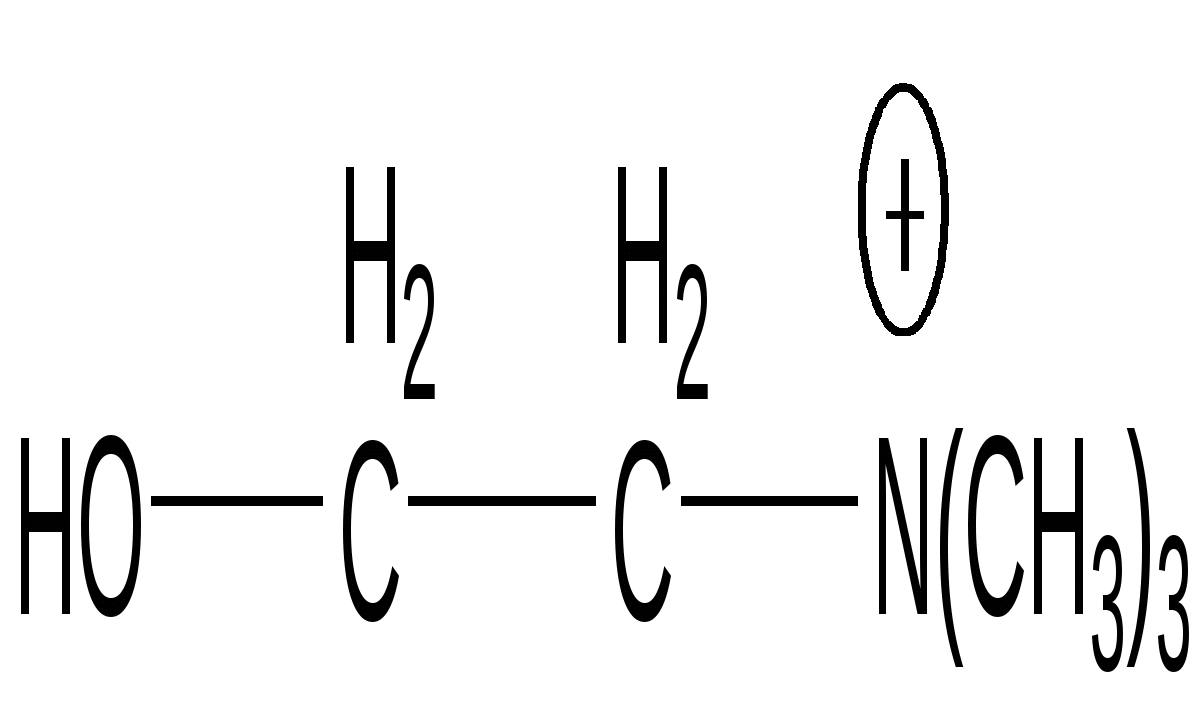
Холин
|
Биоактивные вещества
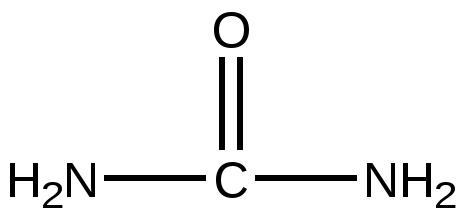
Мочевина
|
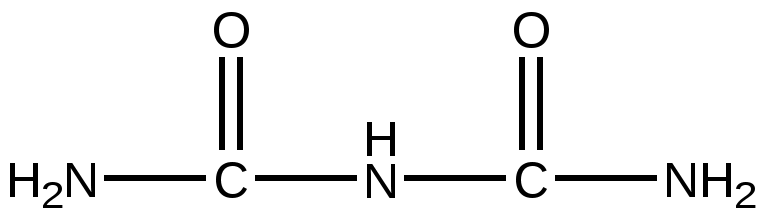
Биурет
|
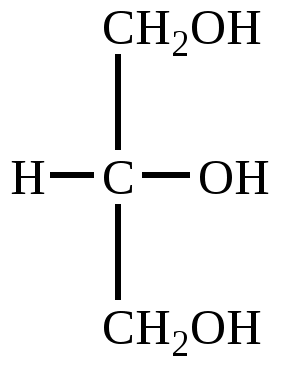
Глицерин
|
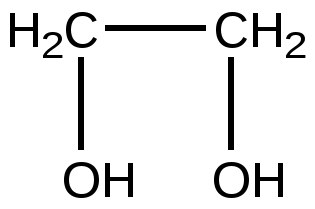
Этиленгликоль
|
СНI3
Йодоформ
|
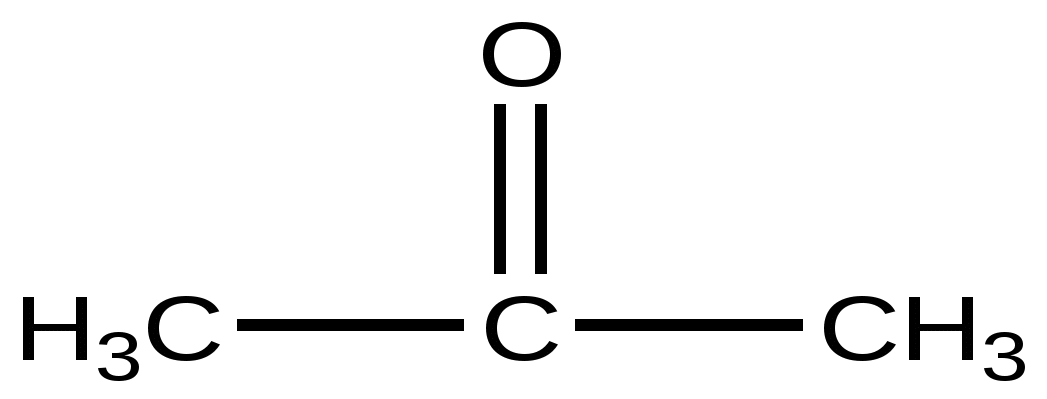
Ацетон
|
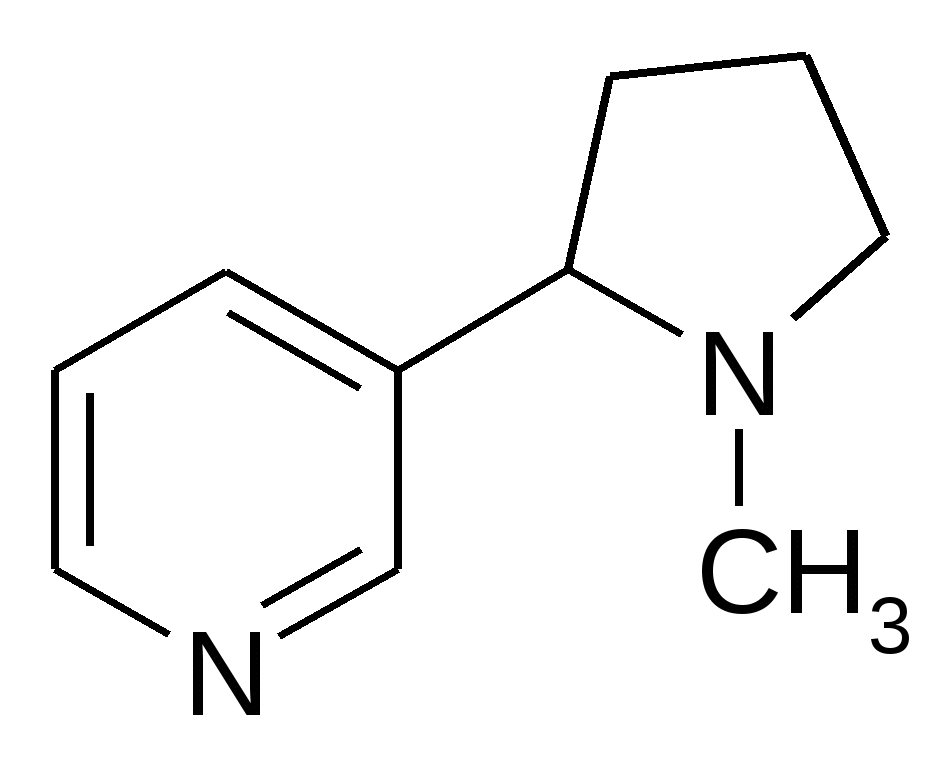
Никотин
|
|
ВОПРОСЫ ДЛЯ САМОПОДГОТОВКИ
К ЗАЧЕТУ И ЭКЗАМЕНУ
1. Теоретические положения строения и свойств биоорганических
соединений
1
|
Предмет и задачи биоорганической химии. Роль биоорганической химии в подготовке врача.
|
2
|
Изомерия органических соединений. Определение понятия. Классификация.
|
3
|
Пространственная (стереоизомерия) на примере моносахаридов и аминокислот. Определение понятия энантиомеры, диастереомеры, рацемат. Биологическое значение стереоизомерии в биологических системах.
|
4
|
Лактам-лактимная и кето-енольная таутомерия. Определение понятия. Значение таутомерных форм в биосистемах (примеры).
|
5
|
Сопряженные системы с открытой цепью сопряжения. Характеристика. Виды сопряжения. Энергия сопряжения. Классификация сопряженных систем.
Сопряженные системы с открытой цепью сопряжения (бутадиен-1,3, изопрен, каротин, ретинол, ретиналь, хлорэтен, кротоновая кислота). Биологическое значение.
Карбоциклические ароматические системы (бензол, нафталин, антрацен, фенантрен). Правило Хюккеля, критерии ароматичности.
|
6
|
Гетероциклические сопряженные системы (пяти- и шестичленные). Участие атома азота в образовании гетероциклических ароматических систем, тип гибридизации - пиррольный и пиридиновый атомы азота. Строение пиррола тиофена, фурана, пиридина, пиримидина, пурина, биологическая роль пяти- и шестичленных гетероциклических соединений.
|
7
|
Индуктивный и мезомерный эффекты. Определение. Понятие об электронодонорных и электроноакцепторных заместителях.
|
8
|
Теория Бренстеда-Лоури. Кислотность органических соединений и определяющие ее факторы. Основные классы биоорганических веществ, обладающие кислотными свойствами. Значение кислотно-основных свойств у биоорганических соединений.
|
9
|
Основность органических соединений и факторы, ее определяющие. Сравнительная характеристика изменения основных свойств у аминов (алифатические первичные, вторичные, ароматические, амиды). Образование солей с неорганическими кислотами, образование четвертичных аммониевых солей (на примере N-метилпиридинийхлорида и холина).
|
10
|
Типы разрыва химической связи и типы реагентов. Классификация механизмов реакции в биоорганической химии.
|
11
|
Радикалы. Определение понятия Активные формы кислорода.. Свободно-радикальное окисление жирных кислот и его роль в патологии клетки Механизм реакции радикального замещения в ряду алканов.
|
12
|
Механизмы реакции электрофильного присоединения (AE)- реакции гидратации, гидрогалогенирования, дигалогенированияв ряду алкенов. Влияние электронодонорных и электроноакцепторных заместителей на направленность реакции AE в алкенах. Значение реакции гидратации в биохимических процессах.
Механизм реакции электрофильного замещения в ароматических соединениях (бензол и его замещенные)
|
13
|
Механизм реакций нуклеофильного присоединения к карбонильных соединений (ANU). Нуклеофильные реагенты - вода, спирты, циановодород, тиолы, амины. Электронное строение карбонильной группы. Биологически важные реакции нуклеофильного присоединения в клетке (образование полуацеталей, тиополуацеталей, азометинов).
|
14
|
Реакции нуклеофильного замещения и элиминирования. Конкурентный характер процессов. Условия реакций дегидратации и дегидрогалогенирования. Значение реакций дегидратации в биохимических процессах
.Механизм реакции нуклеофильного присоединения-отщепления в ряду карбоновых кислот. Образование производных карбоновых кислот и их биологическое значение (сложные эфиры, амиды, ангидриды, тиоэфиры - активные формы карбоновых кислот в клетке) АцетилКоА.
|
15
|
Окисление спиртов, тиоспиртов и альдегидов. Особенности окисления –SH и –ОН групп. Значение SH групп в биологических системах.
|
16
|
Строение и механизм работы НАД+. Участие НАД+ в окислительно-восстановительных реакциях.
| |
 Скачать 4.37 Mb.
Скачать 4.37 Mb.



















































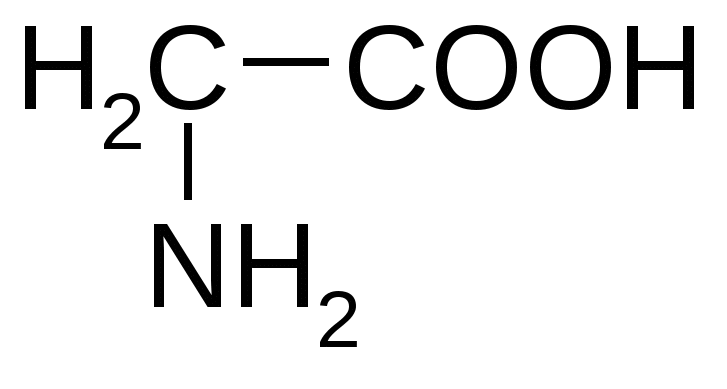






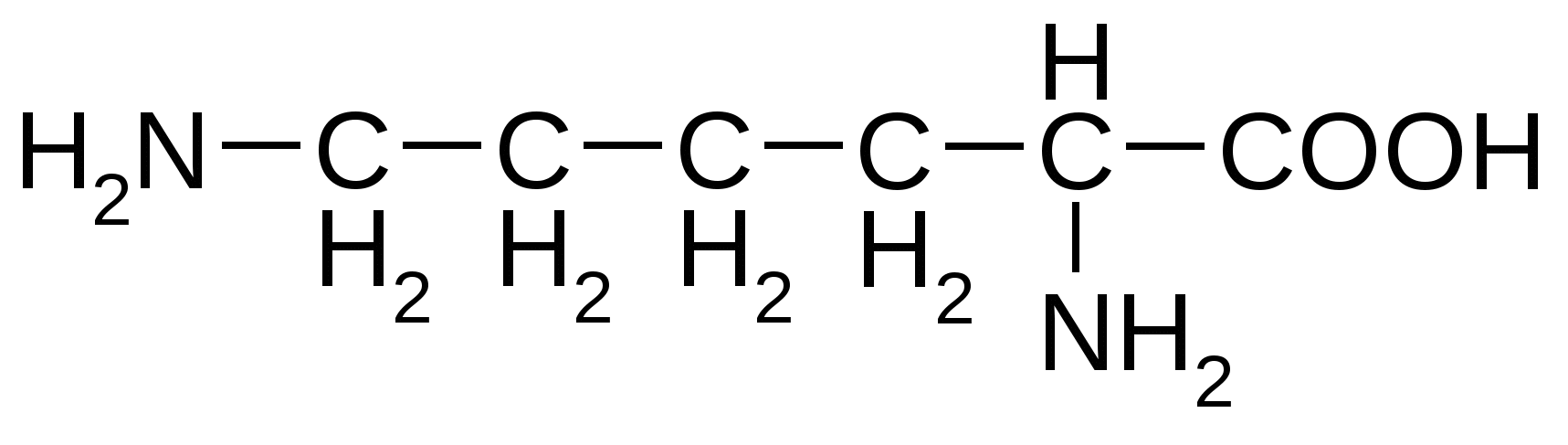








 Триптофан*
Триптофан*