Лекции по неорганической химии. Курс лекций по дисциплине неорганическая химия
 Скачать 2.04 Mb. Скачать 2.04 Mb.
|
4. Химия германия, олова, свинца (Ge, Sn, Pb)GeO, SnO – сильные восстановители. Все оксиды и гидроксиды (II) амфотерны, реагируют как с кислотами, так и основаниями. Диоксиды Ge, Sn получают синтезом из простых веществ. Диоксид свинца в 2 стадии получают. У свинца 2 простых оксида PbO и PbO2. Рb2О3 – смешанный оксид или РbРbО3 – метаплюмбат свинца (II). Рb3О4 (2 PbO • PbO2 - сурик). Диоксиды не образуют с водой кислот. Со щелочами дают гидроксокомплексы PbO2 – сильный окислитель. Pb + О2 Pb3О4 – – красный краситель, свинцовый сурик можно рассматривать как соль Pb22+(PbO4) (ортоплюмбат свинца II). Pb3O4 + HNO3 PbO2 + Pb(NO3)2 + H2O. Sn + HCIконц Sn + H2SOконц Sn + HNO3разб Sn + HNO3конц β -оловянная t Sn + NaOH конц станнит (соль оловяннистой кислоты H2SnO2) В водных растворах станниты дают гидроксостанниты. Na2Sn+2O2 + 2H2O Sn(OH)2 ++ HCI амфонит Sn(OH)2 + 2NaOH тетрагидроксостаннит SnO2 кислотные свойства Sn(OH)4 амфотерный, с преобладанием кислотных, H2SnO3 – оловянная кислота (α и β), растворяется в кислотах и щелочах. H2SnO3 + 2NaOH + H2O H2SnO3 + 4HCI SnCI4 + 3H2O Ge(OH)2 Sn(OH)2 Pb(OH)2 усиление основных свойств  Ge(OH)4 Sn(OH)4 Pb(OH)4 усиление основных свойств  2PbCO3Pb(OH)2 – белая краска – свинцовые белила. Pb(CH3COO)4 – тетраэтилсвинец – летучая ядовитая жидкость, добавляется к бензину для повышения его качеств как моторного топлива. 5. Биогенная роль Значение углерода в природе и сельском хозяйстве Среди биомолекул клетки важнейшими является 4 класса веществ: 1) белки, 2) нуклеиновые кислоты; 3) углеводы; 4) липиды. В природе главное горючее – ископаемые угли (антрациты, каменные и бурые угли). Главное транспортное горючее – нефть. Горючий природный газ, содержит 80-99% СН4 – экологически чистое бытовое и промышленное топливо. Основная форма углерода в гидросфере – это растворенный в воде СО2 и НСО3-. Она является буферной системой, поддерживающей содержание СО2 в атмосфере на постоянном уровне. В атмосфере – углерод в виде СО2, его содержание меньше чем в гидросфере. Атмосфера и гидросфера интенсивно обмениваются СО2. Наземные растения и фитопланктон ассимилируют СО2 атмосферы и НСО3- гидросферы, превращая их в биомассу. Одним из основных источников поступления СО2 в атмосферу служит дыхание растений и фитопланктона. Углерод инертный элемент. Поэтому служит основой для конструкционных материалов. Кремний – микроэлемент, в котором растения не испытывают недостатка. Главный минерал – кварц, содержание его превышает 60% массы почвы и достигает 90% в песчаных почвах. Алюмосиликаты – полевые шпаты и слюды, за счет обменных реакций в почвенных растворах образуются вторичные алюмосиликаты, группа глинистых минералов, возникающих в процессе выветривания. Они обладают набухаемостью, пластичностью, способностью к ионному обмену. Освобождаются ионы K+, Na+, Mg2+, Ca2+, Fe2+, Fe3+ и создаются благоприятные химические условия корневого питания растений. В стеблях растений присутствие Si увеличивает их прочность и уменьшает полегаемость. Внесение в почву силиката Na повышает усвоение фосфатов. ЛЕКЦИЯ 5Тема: р - Элементы V группы
Главная подгруппа V группы периодической системы Д.И. Менделеева включает пять элементов: типичные p-элементы азот N, фосфор P, а также сходные с ними элементы больших периодов мышьяк As, сурьму Sb, и висмут Bi. Они имеют общее название пниктогены. Атомы этих элементов имеют на внешнем уровне по 5 электронов (конфигурация пs2 пp3). В соединениях элементы проявляют степень окисления от -3 до 5. Наиболее характерны степени +3 и +5. Для висмута более характерна степень окисления +3. 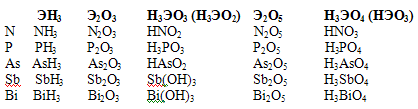 При переходе от N к Bi радиус атома закономерно возрастает. С увеличением размеров атомов уменьшается энергия ионизации. Это значит, что связь электронов наружного энергетического уровня с ядром у атомов ослабевает, что приводит к ослаблению неметаллических и усилению металлических свойств в ряду от азота к Bi. Азот и фосфор – типичные неметаллы, т.е. кислотообразователи. У мышьяка сильнее выражены неметаллические свойства. У сурьмы неметаллические и металлические свойства проявляются приближенно в одинаковой степени. Для висмута характерно преобладание металлических свойств. Закономерно нарастает от N к Bi ионный радиус, но он много меньше атомного. Это связано с тем, что внешние электроны находятся на значительном расстоянии от ядра по сравнению с предвнешними, и когда атом теряет внешние электроны, переходит в ион, радиус иона соответственно ниже радиуса атома. Плотность закономерно нарастает. Незакономерность изменения свойств (Tпл и Ткип) обусловлена особенностью строения кристаллической решетки. Если азот – это газ, то последний элемент группы находится в твердом агрегатном состоянии. В кристаллической решетке молекулы белого фосфора связаны межмолекулярными силами (силы Ван дер Ваальса), а так как они очень слабы, то белый фосфор легко распадается на молекулы под влиянием различных воздействий (температуры, растворителя). По этой причине он легко плавится при 44°С в бесцветную жидкость, при 275°С кипит. Для элементов, не проявляющих металлических свойств стандартные электронные потенциалы отсутствуют. Электронное строение внешних энергетических уровней атомов азота и фосфора следующие: 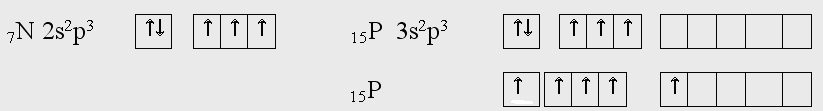 У атома азота три неспаренных электрона. Поэтому валентность азота равна трем. Из-за отсутствия у него d-подуровня на внешнем уровне его электроны разъединиться не могут. Однако в результате донорно-акцепторного взаимодействия азот становится четырехвалентным. У атомов фосфора и последующих элементов VА группы имеются свободные орбитали на d-подуровне и переходя в возбужденное состояние будут разъединятся 3s-электроны. В невозбужденном состоянии у всех элементов 5А группы валентность равна 3, а в возбужденном состоянии всех, кроме азота, равна пяти. Элементы этой группы образуют газообразные водородные соединения (гидриды) типа ЭН3 , в которых степень их окисления -3. NH3 аммиак PH3 фосфин AsH3 арсин SbH3 стибин BiH3 висмутин AsH3, SbH3 газы с неприятным запахом, легко разлагаются. Чрезвычайно ядовиты. В кислородных соединениях для элементов VА группы наиболее характерны степени окисления +3 и +5. Для висмута более характерна степень окисления +3. Все элементы VА группы имеют оксиды типа Э2О5 и гидроксиды НЭО3 или Н3ЭО4 , которые обладают кислотными свойствами. Кроме того для них характерны оксиды типа Э2О3 и соответствующие гидроксиды НЭО2 или Н3ЭО3 , у азота и фосфора они имеют кислотные свойства, у мышьяка и сурьмы – амфотерные, а у висмута проявляют основной характер. Характерно также образование галидов типа ЭГ3 (тригалиды), которые (за исключением NF3) гидролизуются по схеме: ЭГ3 + 3Н2О = Н3ЭО3 + 3НГ ЭCl3 + H2O = H3ЭО3 + 3НCl но в присутствии галоводородной кислоты галиды сурьмы и висмута гидролизуются с образованием галоксидов, например SbCl3 + H2O = SbOCl + 2HCl Группу SbO+ называют антимонилом, а соединение SbOCl – хлоридом антимонила. Для фосфора, мышьяка и сурьмы известны пентафториды ЭF5 , а для фосфора и сурьмы пентахлориды ЭCl5. Мышьяк и сурьма имеют ряд аллотропных форм. Наиболее устойчивые металлические формы серого (As) и серебристо-белого (Sb) цвета. Это хрупкие вещества, легко превращаемые в порошок. Висмут – металл серебристо-белого цвета с едва заметным розовым оттенком. Соединения As, Sb, Bi ядовиты. Особо опасны соединения As3+ ( AsH3- арсин). 2. Химия азота Азот (лат. nitrogenium) в свободном состоянии газ без цвета и запаха. Азот – основной компонент атмосферы Земли (78,09% по объему или 75,6% по массе, всего около 4·1015 т). Мы живем в азотной атмосфере, умеренно обогащенной кислородом и в малых количествах другими химическими элементами. В космосе он занимает 4-е место вслед за водородом, гелием и кислородом. В живых организмах его до 0,3% в виде соединений. Растения, получая азот из почвы в виде минеральных солей, используют его для синтеза белков, витаминов и других жизненно важных веществ. Азот относится к органогенам, наряду с углеродом, водородом и кислородом – элементы, которые чаще всего содержатся в органических веществах. Все важнейшие части клеток (протоплазма и ядро) построены из белковых веществ. Без белка нет жизни, а без азота нет белка. Свободный азот несколько легче воздуха. Он плохо растворим в воде. Прочность молекулы азота велика. Даже при 3300°С только одна из тысяч молекул N2 распадается на атомы. Поэтому свободный азот в обычных условиях инертен к подавляющему большинству веществ. Для того чтобы азот вступил в химическую реакцию, требуется предварительная активация его молекул путем нагревания, облучения, действие катализатора или другими способами. Из металлов свободный азот реагирует в обычных условиях только с литием, образуя нитрид: 6Li + N2 = 2Li3N С Na, Ca, Mg реакция идет только при нагревании. С кислородом азот взаимодействует только в электрической дуге (или при грозовом разряде в атмосфере): N2 + O2 = 2NO С водородом реакция идет при нагревании (t ≈ 450-5000С), под давлением и в присутствии катализатора N2 + 3H2 = 2NH3 Пропуская азот через раскаленный кокс можно получить (дициан) – соединение азота с углеродом N ≡ C — C ≡ N. С другими неметаллами кроме бора свободный азот не реагирует. Причина инертности молекулярного азота – крайне прочная ковалентная неполярная связь. Два атома в молекуле удерживаются одной σ - связью и двумя π- связями. Т.е. связи в молекуле азота неравноценны. На разрушение молекулы азота на атомы затрачивается довольно большое количество энергии: N2 = 2N ∆H0 = 946 кДж/моль Строение молекулы N2  Получение N2 В промышленности – сжижением воздуха с выделением фракций азота. В лаборатории разложением нитрита аммония или азида натрия NH4NO2 = N2 + 2 H2O 2 NaN3 = 3 N2 + 2 Na или 2NH3 + 3Br = N2 + 6 HBr |
