Лекции по неорганической химии. Курс лекций по дисциплине неорганическая химия
 Скачать 2.04 Mb. Скачать 2.04 Mb.
|
|
HI I2 (H2S) HBr + H2SO4 разб. → Br2 + SO2 +H2O I2 Для всех этих кислот характерны реакции с Ме, с основными оксидами, с основаниями и некоторыми солями. НCl при взаимодействии с сильными окислителями окисляется до свободного хлора. PbO2 + 4HCl → PbCl2 + Cl2 + H2O Гидролиз галогенидов Основной галогенид – с образованием сильного электролита: MgCl2 + HOH ↔ MgOHCl + HCl 2KF + HOH → KHF2 + KOH Кислотный галогенид - с образованием 2-х кислот PCl5 + H2O → H3PO4 + HCl 4. Кислородсодержащие соединения галогенов Галогены непосредственно с кислородом не взаимодействуют. Это обусловлено небольшой энергией связи Г-О и невозможностью использовать высокие температуры для осуществления реакций окисления, т.к. для них ∆S0 <0, оксиды получают косвенным путём. При 25ºС сравнительно стабильны следующие кислородные соединения: +1 +4 +6 +7 Cl2O ClO2 Cl2O6 Cl2O7 в соединениях с О2 хлор проявляет степени окисления (с. о.): с. о. +1 +3 +4 +5 +6 +7 оксид Cl2O ClO2 Cl2O4 Cl2O6 Cl2O7 кислота HClO HClO2 HClO2 HClO3 HClO3 HClO4 HClO3 HClO4 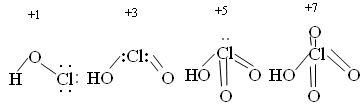 Если сопоставить свойства кислот со структурой молекул, то можно отметить следующее: с ростом степени окисления хлора уменьшается число несвязывающих электронных пар и происходит постепенное достраивание кислородного окружения хлора до тетраэдрического. Увеличение силы кислот HClO – HСlO4 обусловлено тем, что с ростом числа кислородных атомов электронные облака всё больше стянуты к центральному атому и связь Н – О становится всё более полярной. Окислительные свойства уменьшаются, у оксо-анионов ClO-, ClO2-, ClO3-, ClO4- - увеличивается прочность связи кислорода с хлором. Оксикислоты хлора  Возрастание силы кислот связано с увеличением количества кислорода, который оттягивает на себя электронную плотность и прочность связи Н – О ослабевает. Возрастание устойчивости связано с увеличением степени окисления хлора и большим количеством электронов, принимающих участие в образовании связи. Во всех соединениях Cl – в sp3 гибридизации. Самая высокая окислительная способность у хлорноватистой кислоты, за счет атомарного кислорода. HСlO = HCl + O 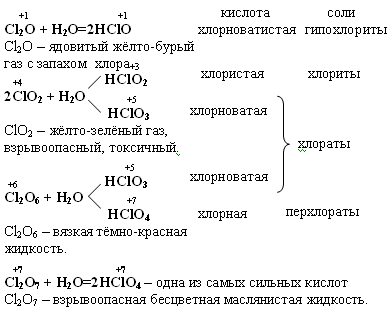 Реакции разложения HClO
3. 2HClO → Cl2O + H2O 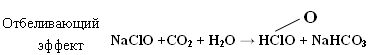 Cl2 + H2O → HCl + HClO ClF + H2O → HClO + HF Cl2 +KOHхол → KCl + KClO + H2O Cl2 + KOHгор → KCl + KClO3 + H2O Гипохлорит калия KClO → KCl + O2 KClO → KCl + KClO2 (KClO3) (KClO4) Получение белильной извести. Cl2 + Ca(OH)2 → CaOCl2 + H2O -о 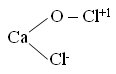 чень сильный окислитель даже на воздухе разлагается чень сильный окислитель даже на воздухе разлагаетсяCaOCl2 + СО2 + H2O → CaCl2 + CaCO3 + O CaOCl2 + HCl → CaCl2 + Cl2 + H2O ClO2 – газ жёлтого цвета HClO3 напоминает HNO3 KClO3 - бертолетова соль 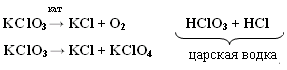 Cl2O6 - тёмно-красная жидкость, получена 2ClO2 + O3 → Cl2O6 + O2 Cl2O7 - маслянистая бесцветная жидкость, получается обезвоживанием HСlO4 2HСlO4 + P2O5 → Cl2O7 + 2HPO3 Окислительные свойства почти не проявляет KClO4 + H2SO4 (к) → HClO4 + KHSO4 KClO4 → KCl + O2 разложение 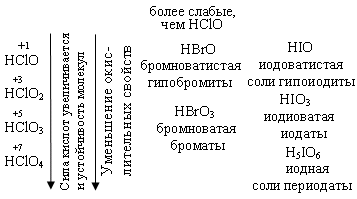 Самая высокая окислительная способность у хлорноватистой кислоты. HСlO = HCl + O Кислородсодержащие кислоты брома и йода H5IO6 можно получить IF7 + 4H2O → 7HF + H5IO6  5. Биогенная роль (фтор и йод как микроэлементы) Безводный перхлорат магния Mg(ClO4)2 жадно поглощает воду, образуя кристаллогидраты. Это один из наиболее сильных осушителей. Техническое название ангидрон. Он удобен тем, что после поглощения воды может быть вновь обезвожен нагреванием. Действуя хлором на сухой гидроксид кальция получают смесь, называемую хлорной или белильной известью, которая состоит из гипохлорита и хлорида кальция. 2Ca(OH)2 + 2Cl2 = Ca(ClO)2 + CaCl2 + 2H2O Гипохлорит кальция используется как дезинфицирующее вещество (хлорная известь). Белильная известь – это белый порошок с резким запахом. Применяется для отбеливания тканей и бумаги, дезинфекции в медицине и дегазации в противохимической обороне. Окисляет хлорная известь потому, что входящий в её состав гипохлорит кальция взаимодействует во влажном воздухе с двуокисью углерода. +1 активный хлор обеспечивает дезинфицирующее свoйство Ca(ClO)2 + CO2 + H2O = 2HClO + CaCO3↓ хлорноватистая кислота далее разлагается с выделением активного кислорода (атомного). Активный кислород обесцвечивает краски (пигменты) и убивает микробы. HClO = HCl + O H – Cl – O KCl –удобрение (калийная соль). Раствор I2 в водном растворе KI, I2 + KI – раствор Люголя в медицине. AgBr, AgCl, AgI – в фотографии. BaCl2 – ядовитое вещество для борьбы с вредителями с/х. CaCl2 – для осушения газов (образуется CaCl2∙6Н2О), в медицине HgCl2 – сулема сильный яд разбавленные растворы используются для протравливания семян. AgBr – в медицине для успокоения нервной системы. Хлораты NaClO3, Mg(ClO3)2, Ca(ClO3)2 – гербициды сильного действия, т. е. уничтожают все растения. В меньших дозах действуют как дефолианты. NaI, KI отхаркивающие средства при заболеваниях дыхательных путей. C  l2 + KOH → KClO + KCl + H2O l2 + KOH → KClO + KCl + H2OЖавелева вода Учебное издание Апанович Зинаида Васильевна Курс лекций по дисциплине «НЕОРГАНИЧЕСКАЯ ХИМИЯ» Учебно-методическое пособие Ст. корректор Ж.И. Бородина Компьютерная вёрстка: З.В. Апанович Подписано в печать Формат 60×84/16. Бумага офсетная. Гарнитура Таймс. Печать Riso. Усл. печ. л. 8,25. Уч.-изд. л. 9,14 Тираж … экз. Заказ № Учреждение образования «Гродненский государственный аграрный университет» Л.И. №02330/0133326 от 29.06.2004 230028, г. Гродно, ул. Терешковой, 28 Отпечатано на технике издательско-полиграфического отдела Учреждения образования «Гродненский государственный аграрный университет». 230028, г. Гродно, ул. Терешковой, 28 |
