Лекции по неорганической химии. Курс лекций по дисциплине неорганическая химия
 Скачать 2.04 Mb. Скачать 2.04 Mb.
|
т.е. положительный молекулярный ион О2+ - самый прочныйПри заполнении одной π·2pу орбитали образуются надпероксиды со связью O==O, имеющей кратность 1,5. О2 + ē → О2- Na + O2 → Na+O2- надпероксид. При заполнении обеих π*2p орбиталей происходит образование пероксидов с одинарной слабой связью :О−О: :О≡О: + 2ē → [:O – O :]2- 2Na + O2 → Na2+O2-2 - пероксид После заполнения 2х π*2p и σ*2p орбиталей четырьмя электронами связи молекулы О2 разрываются и образуются оксиды со степенями окисления-2. :О≡О: + 4ē → 2О-2 О2 + 4Na → 2Na2O оксид. Лабораторные способы получения О2 1.Термическое разложение солей 2 KNO3 = 2 KNO2 + O2 2 KСlO3 = 2 KCl + 3 O2 2 KMnO4 = K2 MnO4 + MnO2 + O2 BaO2 = BaO + ½ O2 Промышленные способы получения О2 1. Сжижение воздуха (tкип(O2)= -183oC), tкип(N2)= - 196oC) 2.Электролизом водных растворов щелочей, который сводится к электролизу H2O 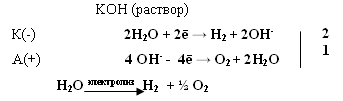 Химические свойства О2 1.Плохо растворим в воде 2. Реагирует с большинством металлов и неметаллов 2Са + О2 = 2СаО О  2 + N2 эл. разряд 2 NO(t ≈ 3000oC) 2 + N2 эл. разряд 2 NO(t ≈ 3000oC)4P + O2 = 2P2O5 H2S + O2 = SO2 + H2O 2ZnS + 3O2 = 2ZnO + 2SO2 CH4 + O2 = CO2 + H2O K + O2 = K[O2]- - надпероксид калия 2 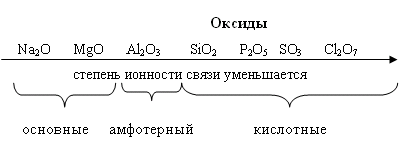 Na + O2 = Na2O2 - пероксид натрия Na + O2 = Na2O2 - пероксид натрияЧем сильнее выражены основные свойства, тем меньше значение энергии Гиббса для реакции с H2O Na2O + H2O = 2 NaOH ∆G = -147 кДж/моль MgO + H2O = Mg(OH)2 ∆G = - 17 кДж/моль Al2O3 + H2O = Al(OH)3 ∆G = - 7 кДж/моль 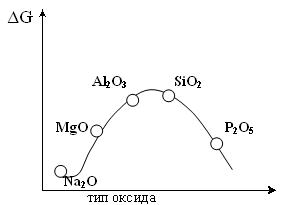 Молекула озона О3. О3 – голубоватый газ с сильным запахом, означает «пахучий»: в сосновых лесах его много, у морского побережья, после грозы. Образуется из О2 под действием УФ излучения и при грозовых разрядах: 3  О2 hν 2О3 ∆G = - 323 кДж О2 hν 2О3 ∆G = - 323 кДжОзон – сильнейший окислитель, окислительная способность обусловлена нестойкостью его молекул, которые при обычной температуре распадаются с образованием атомарного кислорода, который активнее молекулы кислорода О2, на этом и основано окислительное действие его.  O3 ↔ O2 + O ΔH=-142 кДж/моль Окисляет почти все металлы, действуют на неметаллы, обесцвечивает красители, убивает микробы. При высоких концентрациях – яд. (Один кислород имеет с.о. равную +4).Молекула имеет угловое строение. 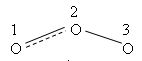  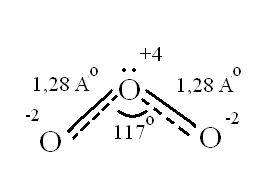 Связь трехцентровая ( центральный атом О+4 находится в sp2-гибридизации, связи его с двумя крайними атомами кислорода неравноценны, одна двойная, одна одинарная).Две sp2- гибридные орбитали образуют σ-связи, а 3-я гибридная орбиталь расположена перпендикулярно плоскости молекулы, образуя 3х-центровую 2х-электронную связь с крайними атомами кислорода. Предполагается что центральный aтом кислорода находится в возбужденном состоянии и по донорно-акцепторному механизму пара электронов помещается на пустую орбиталь. 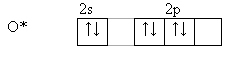 Качественная реакция на озон, крахмальная бумага, смоченная раствором KI синеет в присутствии озона в результате выделения I2 ,озон более сильный окислитель, чем О2 с ним эта реакция не протекает. 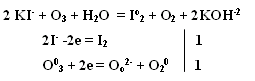 Земля окружена слоем озона, располагающегося на высоте 25 км от её поверхности. Он образуется за счёт поглощения кислородом ультрафиолетового излучения Солнца. Озоновый слой ограничивает поток ультрафиолетового излучения, падающего на землю. Увеличение интенсивности ультрафиолетового излучения, достигающего Землю, могло бы привести к возрастанию заболеваний раком кожи. Вызывает беспокойство возможное разрушение озонового слоя выхлопными газами реактивных самолётов. Сейчас этот вопрос актуален и широко освещается в печати. Химичесие свойства О3
Al + O3 → Al2O3 + O2 2. Со сложными веществами PbS + 2O3 → PbSO4 + O2 3. Со щелочами 2 KOH + 7/3 O3 → O2 + 2KO3 + H2O озонид калия Кроме степени окисления +4, кислород может проявлять степень окисления +2 в соединении со фтором O+2F2 и +1 О2+1F2 |
