Лекции по неорганической химии. Курс лекций по дисциплине неорганическая химия
 Скачать 2.04 Mb. Скачать 2.04 Mb.
|
СО
С 2s22p2 С +1е = С- О 2s22p4 О -1е = О+ Возможно иное объяснение образования тройной связи в молекуле СО.
Невозбужденный атом углерода имеет 2 неспаренных электрона, которые могут образовать 2 общие электронные пары с 2-мя неспаренными электронами атома кислорода (по обменному механизму). Однако имеющиеся в атоме кислорода 2 спаренные р -электрона могут образовывать тройную химическую связь, поскольку в атоме углерода имеется одна незаполненная ячейка, которая может принять эту пару электронов. Подобно N2 - СО обладает высокой энергией диссоциации (1069 кДж), плохо растворим в воде, инертен в химическом отношении. СО – газ без цвета и запаха, безразличный несолеобразующий, не взаимодействует с кислотными щелочами и водой при обычных условиях. Ядовит, т.к. взаимодействует с железом, входящим в состав гемоглобина. При повышении температуры или облучении проявляет свойства восстановителя. Получение: в промышленности в лаборатории: В реакции СО вступает лишь при высоких температурах. Молекула СО имеет большое сродство к кислороду, горит образуя СО2: СО + 1/2О2 = СО2 + 282 кДж/моль. Из-за большого сродства к кислороду СО используется как восстановитель оксидов многих тяжелых металлов (Fe, Co, Pb и др.). СO + Cl2 = COCl2 (фосген) Наибольший интерес представляют карбонилы металлов (используются для получения чистых металлов). Химическая связь по донорно-акцепторному механизму, имеет место -перекрывание по дативному механихму. Все карбонилы – диамагнитные вещества, характеризуются невысокой прочностью, при нагревании карбонилы разлагаются [Ni(CO)4] → 4CO + Ni (карбонил никеля). Как и СО карбонилы металлов – токсичны. Химическая связь в молекуле СО2 В молекуле СО2 sp-гибридизация атома углерода. Две sp-гибридные орбитали образуют 2 -связи с атомами кислорода, а оставшиеся негибридизованными р-орбитали углерода дают с двумя р-орбиталями атомов кислорода -связи, которые располагаются в плоскостях перпендикулярных друг другу. О ═ С ═ О Под давлением 60 атм. и комнатной температуре СО2 сгущается в бесцветную жидкость. При сильном охлаждении жидкая СО2 застывает в белую снегоподобную массу, возгоняющуюся при Р = 1 атм и t = 195К(-78). Спрессованная твердая масса называется сухим льдом, СО2 не поддерживает горения. В нем горят лишь вещества, у которых сродство к кислороду выше чем у углерода: например, 2Mg + CO2 2MgO + C. СО2 реагирует с NH3: 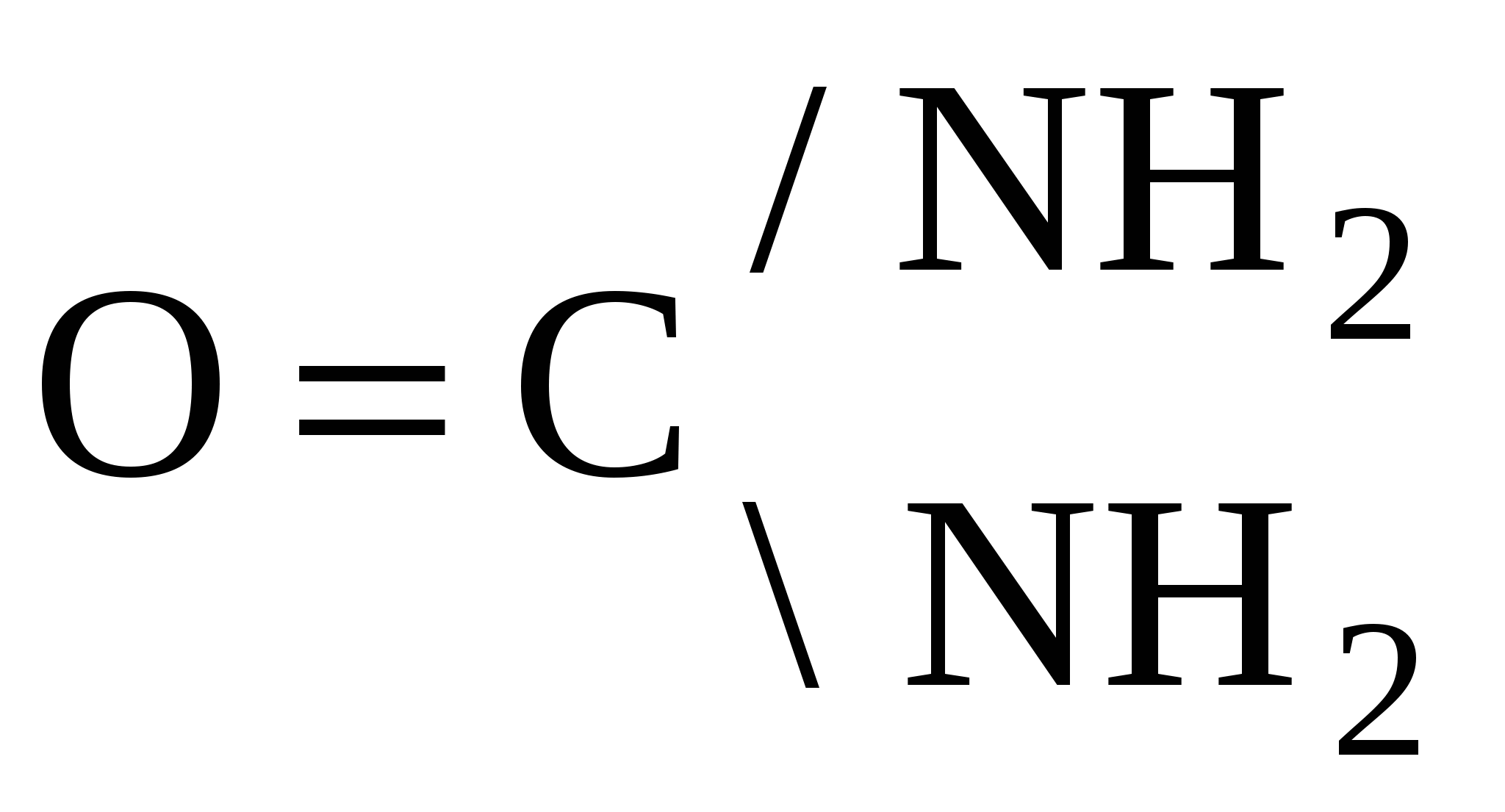 (карбамид мочевина) 2СО2 + 2Na2O2 2Na2CO3+O2 Мочевина разлагается водой: CO(NH2)2 + 2H2O (NH4)2CO3 → 2NH3 + СО2  фотосинтез фотосинтезСО2 получают в технике: из кокса В лаборатории (в аппарате Киппа): Угольная кислота и ее соли Растворяясь в воде, углекислый газ частично взаимодействует с ней, образуя угольную кислоту H2CO3; при этом устанавливаются равновесия: К1 = 410-7 К2 = 4,810-11 – слабая, неустойчивая, кислородсодержащая, двухосновная кислота. Гидрокарбонаты растворимы в Н2О. Карбонаты нерастворимы в воде, кроме карбонатов щелочных металлов, Li2CO3 и (NH4)2CO3. Кислые соли угольной кислоты получают, пропуская избыток СО2 в водный раствор карбоната: либо постепенным (по каплям) добавлением сильной кислоты в избыток водного раствора карбоната: Na2CO3 + HNO3 NaHCO3 + NaNO3 При взаимодействии со щелочами или нагревании (прокаливании) кислые соли переходят в средние: Соли гидролизуются по уравнению: Из-за полного гидролиза из водных растворов нельзя выделить карбонаты Gr3+, Al3+, Ti4+, Zr4+ и др. Практическое значение имеют соли - Na2CO3 (сода), CaCO3 (мел, мрамор, известняк), K2CO3 (поташ), NaHCO3 (питьевая сода), Са(НСО3)2 и Mg(HCO3)2 обусловливают карбонатную жесткость воды. Сероуглерод (CS2) При нагревании (750-1000С) углерод реагирует с серой, образуя сероуглерод, органический растворитель (бесцветная летучая жидкость, реакционноспособное вещество), огнеопасен и летуч. Пары CS2 – ядовиты, применяется для фумигации (окуривания) зернохранилищ против насекомых - вредителей, в ветеринарии служит для лечения аскаридоза лошадей. В технике – растворитель смол, жиров, йода. С сульфидами металлов CS2 образует соли тиоугольной кислоты – тиокарбонаты. Эта реакция аналогична процессу Тиокарбонаты – желтые кристаллические вещества. При действии на них кислот выделяется свободная тиоугольная кислота. Она более стабильна чем Н2СО3 и при низкой температуре выделяется из раствора в виде желтой маслянистой жидкости, легко разлагающейся на: Соединения углерода с азотом (СN)2 или С2N2 – дициан, легко воспламеняющийся бесцветный газ. Чистый сухой дициан получают путем нагревания сулемы с цианидом ртути (II). HgCl2 + Hg(CN)2 Hg2Cl2 + (С N)2 Другие способы получения: 4HCNг + О2 2HCNг + Сl2 Дициан по свойствам похож на галогены в молекулярной форме X2. Так в щелочной среде он, подобно галогенам, диспропорционирует: (С N)2 + 2NaOH = NaCN + NaOCN Циановодород - НСN ( Циановодород получают в промышленности по каталитическим реакциям. Соли синильной кислоты – цианиды, подвержены сильному гидролизу. CN- - ион изоэлектронный молекуле СО, входит как лиганд в большое число комплексов d-элементов. Обращение с цианидами требует строгого соблюдения мер предосторожности. В сельском хозяйстве применяют для борьбы с особо опасными насекомыми – вредителями. Цианиды получают: Соединения углерода с отрицательной степенью окисления: 1) ковалентные (SiC карборунд) 2) ионноковалентные; 3) металлические карбиды. Ионноковалентные разлагаются водой с выделением газа, в зависимости от того какой выделяется газ, их делят на: метаниды (выделяется СН4) ацетилениды (выделяется С2Н2) Металлические карбиды – соединения стехиометрического состава образованные элементами 4, 7,8 групп посредством внедрения атомов Ме в кристаллическую решетку углерода. 3. Химия кремния Отличие химии кремния от углерода обусловлено большими размерами его атома и возможностью использования 3d-орбиталей. Из-за этого связи Si – O - Si, Si - F более прочны, чем у углерода. Для кремния известны оксиды состава SiO и SiO2.Монооксид кремния существует только в газовой фазе при высоких температурах в инертной атмосфере; он легко окисляется кислородом с образованием более стабильного оксида SiO2. 2SiO + О2 t 2SiO2 SiO2 – кремнезем, имеет несколько кристаллических модификаций. Низкотемпературная – кварц, обладает пьезоэлектрическими свойствами. Природные разновидности кварца: горный хрусталь, топаз, аметист. Разновидности кремнезема – халцедон, опал, агат, песок. Известно большое разнообразие силикатов (точнее оксосиликатов). В строении их общая закономерность: все состоят из тетраэдров SiO44- которые через атом кислорода соединены друг с другом. Сочетания тетраэдров могут соединяться в цепочки, ленты, сетки и каркасы. Важные природные силикаты 3MgOH2O4SiO2 тальк, 3MgO2H2O2SiO2 асбест. Как и для SiO2 для силикатов характерно (аморфное) стеклообразное состояние. При управляемой кристаллизации можно получить мелкокристаллическое состояние – ситаллы – материалы повышенной прочности. В природе распространены алюмосиликаты – каркасные ортосиликаты, часть атомов Si заменены на Al, например Na12[(Si,Al)O4]12. Наиболее прочный галогенид SiF4 разлагается только под действием электрического разряда. (SiS2)n – полимерное вещество, разлагается водой: Кремниевые кислоты. Соответствующие SiO2 кремниевые кислоты не имеют определенного состава, обычно их записывают в виде xH2O • ySiO2 – полимерные соединения Известны: H2SiO3 (H2OSiO2) – метакремниевая (не существует реально) H4SiO4 (2H2OSiO2) – ортокремниевая (простейшая реально существующая только в растворе) H2Si2O5 (H2O2SiO2) – диметакремниевая. Кремниевые кислоты – плохо растворимые вещества, для H4SiO4 характерно коллоидное состояние, как кислота слабее угольной (Si менее металличен, чем С). В водных растворах идет конденсация ортокремневой кислоты, в результате образуются поликремниевые кислоты. 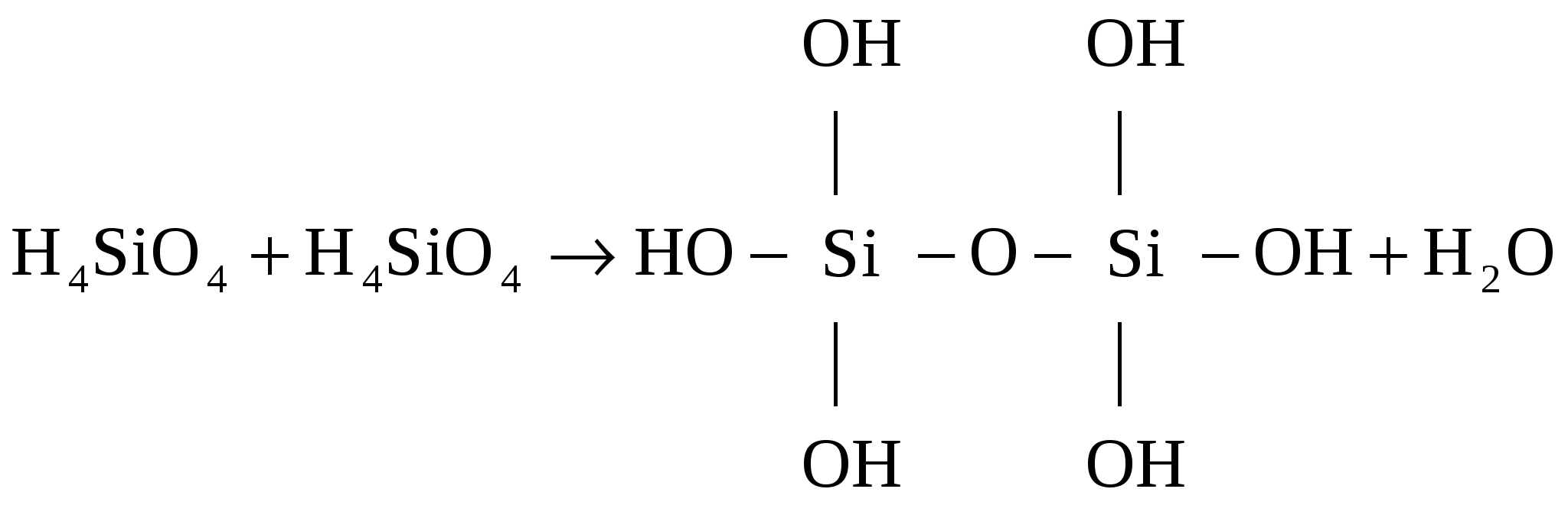 Силикаты – соли кремневых кислот, в воде нерастворимы, кроме силикатов щелочных металлов. Растворимые силикаты гидролизуются по уравнению Желеобразные растворы натриевых солей поликремневых кислот называются «жидким стеклом». Широко применяются как силикатный клей и в качестве консерванта древесины. Сплавлением Na2CO3, CaCO3 и SiO2 получают стекло, которое является переохлажденным взаимным раствором солей поликремниевых кислот. Силикаты больше всего используются в строительстве. 1 место в мире по выпуску силикатной продукции – цемент, 2-е – кирпич, 3 – стекло. Строительная керамика – облицовочная плитка, керамические трубы. Для изготовления санитарно-технических изделий – стекло, фарфор, фаянс, глиняная керамика. |
