Лекции по неорганической химии. Курс лекций по дисциплине неорганическая химия
 Скачать 2.04 Mb. Скачать 2.04 Mb.
|
|
Тема: p – Элементы III группы 1. Общая характеристика элементов III -A группы. Известно 30 р - элементов в периодической системе, это элементы, расположенные в III-A - VIII-A группах. У р - элементов заполняется электронами р- подуровень внешнего электронного уровня. III-A группа – B, Al, Ga, In, Tl – характеризуются наличием 3-х электронов в наружном электронном слое атома, причем у бора на предвнешнем слое атома – 2 электрона, у алюминия – 8 электронов, Ga, In, Tl – 18 электронов. III группа самая элементоемкая – содержит 37 элементов, включая лантаноиды и актиноиды. Все элементы металлы, за исключением бора. При переходе от Al к Ga радиус атома уменьшается. Это связано с тем, что у Ga заполнение р - подуровня начинается после того, как заполняется 3d10 электронная оболочка. Под действием 3d10 - электронов электронная оболочка всего атома сжимается и размер атома уменьшается (эффект d - сжатия). Монотонного (последовательного) изменения металлических свойств не наблюдается. Металлические свойства резко усиливаются при переходе от бора к алюминию, несколько ослабевают у галлия, и вновь постепенно растут при переходе к таллию. Обусловлено это тем, что атома Ga происходит сжатие электронной оболочки за счет d –электронов (эффект d – сжатия) , In, Tl (в отличие от B и Al) содержат по 18 электронов на предпоследнем слое. Поэтому нарушается линейное изменение свойств (rат, Тпл и т.п.) от Al к Ga. Температура кипения закономерно уменьшается от B к Tl. Температура плавления незакономерно из-за особенностей строения кристаллической решетки. Самый легкоплавкий металл – Ga (Тпл = 29,8˚С). В невозбужденном состоянии конфигурация внешнего уровня ns2np1, в возбужденном состоянии - ns1np2. В невозбужденном состоянии имеется 1 неспаренный электрон, однако соединения большинства этих элементов, в которых их степень окисления +1, очень неустойчивы и наиболее характерна для них степень окисления +3 в возбужденном состоянии, т.к. на перевод электрона из s-состояния в р - надо немного энергии.
B – неметал, Al – еще не типичный металл, Ga, In, Tl –типичные металлы. Соединения: ЭН3, Э2О3, Э(ОН)3.  B [He] 2s22p1 В2Н6 B [He] 2s22p1 В2Н6A растет восстановительная способность, устойчивость l [Ne]3s23p1 (AlH3)n Ga [Ar]4s24p1 (GaH3)n In [Kr]5s25p1 (InH3)n Tl [Xe]6s26p1 TlH3 Э2О3 B2O3 кислотный оксид Al2O3 амфотерный оксид Ga2O3 амфотерный оксид (с преобладанием основных свойств) In2O3 амфотерный оксид (с преобладанием основных свойств) Tl2O ( Tl2O3 ) основной оксид Э(ОН)3 H   нарастают основные свойства 3BO3 ортоборная кислота Al(OH)3 амфотерный гидроксид Ga(OH)3 амфотерный гидроксид In(OH)3 амфотерный гидроксид TlOH основной гидроксид Образуют соединения с галогенами ЭГ3, серой Э2S3, азотом ЭN. Много общего имеет химия кислородных соединений бора и кремния: кислотная природа оксидов и гидроксидов, способность образовывать многочисленные полимерные структуры, стеклообразование оксидов. 2. Бор. Получение. Химические свойства Бор по своим свойствам наиболее схож с элементом IV-A группы кремнием («диагональное сходство»). Бор – кристаллическое вещество, черного цвета, тугоплавкое при t = 2300 С. Наиболее распространены две модификации бора: аморфный и кристаллический. Аморфная модификация наиболее реакционноспособна. Получение бора 1. Термическое разложение гидридов бора: B2H6 2. Магнийтермией из оксида бора: B2O3 + 3Mg B2O3 + Zn 3. Из хлорида бора: 2BCl3 + 3Zn Непосредственно активно бор реагирует только со фтором, однако при нагревании протекает взаимодействие с кислородом, азотом, углеродом. B + 2F2 → BF4 4B + 3O2 2B + N2 4B + 3C Бор реагирует с горячими концентрированными кислотами H2SО4 и HNO3 B + H2SO4конц. → H3BO3 + SO2↑ + H2O B + HNO3конц. → H3BO3 + NO2↑ + H2O Со щелочами реагирует только в присутствии сильных окислителей: B + NaOH + H2O2 → NaBO2 + H2O Однако аморфный бор может реагировать со щелочами при кипячении: Bаморфн. + NaOH SiO2 + B → Si + B2O3 Галогениды бора BF3 BCl3 BBr3 BI3 газ газ жидкость твердый Ecвязи кДж 644 443 376 284  устойчивость падает устойчивость падаетВСl3 образуется посредством взаимодействия трех электронов атома бора в возбужденном состоянии. Образуется три связи по спин - валентному (обменному) механизму. B* 3Cl Тип гибридизации бора – sp2  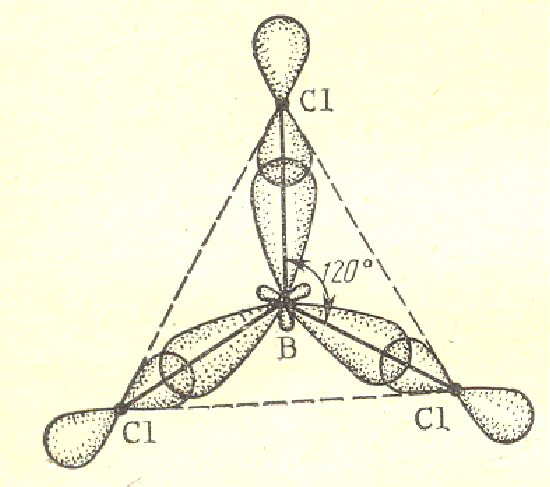 Так как в галогениде BГal3 имеется свободная орбиталь за счет атома бора, то в этом случае молекула BГal3 может быть акцептором электронной пары и участвовать в образовании связи по донорно-акцепторному механизму. BF3 + :F- → [F3B F] -→ [BF4-] атом бора (sp3 гибридизация) Ион имеет тетраэдрическую структуру BF3 + NH3 → BF3 · NH3 (валентность бора = 4) Галогениды бора имеют кислотный характер и гидролизуются: BCl3 + H2O → H3BO3 + HCl BF4 + HF → H[BF4] (сильная кислота) Кислотные галогениды реагируют с основными галогенидами: ВF3 + NaF = Na[BF4] С водородом бор непосредственно не реагирует. Гидриды бора получают не прямым взаимодействием с водородом, а косвенным путем. Например, действием соляной кислоты на борид магния. Мg3В2 + 6HCl В2Н6 +3МgCl2 Получается смесь бороводородов (боранов). Бораны известны газообразные, жидкие и твердые. В2Н6 – диборан – газ В4Н10 – тетраборан – жидкость В10Н14 – твердый боран. Они имеют неприятный запах и очень ядовиты. Большинство из них самовоспламеняются и разлагаются водой. 2В4Н10 + 11 О2 = 4В2О3 + 10 Н2О В2Н6 + 6 Н2О = 2Н3ВО3 + 6Н2 В молекулах бороводородов атомы бора связаны водородными «мостиками». 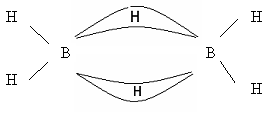 Бораны – особый вид соединений, в них образуется электроннодефицитная связь. В их молекулах электронов меньше, чем необходимо для образования двухэлектронных связей. Это так называемая «банановая связь», образуется в результате перекрывания двух sp3-гибридных орбиталей атомов бора и одной s-орбитали атома водорода. Каждый мостиковый атом водорода образует с двумя атомами бора общую двухэлектронную трехцентровую связь В – Н – В. Соединения с дефицитом электронов являются акцепторами электронов.  при температуре 4НВО2 = Н2В4О7 + Н2О Н2В4О7 = 2В2О3 + Н2О H2B4O7 ↔ 2H+ + B4O72- (кислых солей не образует) В отличие от обычных кислот ортоборная кислота не отщепляет Н+, а вызывает смещение равновесия диссоциации воды, присоединяя за счет донорно-акцепторного взаимодействия OH-, выступает в роли одноосновной. B(OH)3 + H2O → B(OH)4- + H+ Кд = 5,8 ·10-10 Координационное число бора по кислороду равно 3, поэтому кислородные соединения бора образуют полимерные соединения (полибораты). Все кислоты превращаются в ортоборную: HBO2 + H2O → H3BO3 H2B4O7 + 5H2O → 4H3BO3 Если ортоборная наиболее устойчивая кислота, то соли ее не существуют в обычных условиях по сравнению с солями мета- и тетраборной кислот. Так при действии на раствор борной кислоты гидроксидом натрия получается не ортоборат, а тетраборат натрия (при недостатке NaOH) или метаборат (в избытке NaOH): 2NaOHнед + 4H3BO3 = Na2B4O7 + 7 H2O NaOHизб + H3BO3 = NaBO2 + 2H2O При избытке щелочи образующийся тетраборат натрия превращается в метаборат натрия: Na2B4O7 + 2NaOHизб = 4NaBO2 + H2O Кислотный гидролиз тетрабората натрия приводит к образованию ортоборной кислоты: Na2B4O7 + 2HCl + 5 H2O = 2NaCl + 4 H3BO3 3. Алюминий По содержанию в земной коре занимает первое место среди металлов и третье среди всех элементов, после кислорода и кремния. Металлические свойства его выражены сильнее, чем у бора. Химические связи алюминия с другими металлами в основном ковалентного характера. Тип кристаллической структуры - ГПУ. В отличие от бора атом алюминия имеет свободные d-подуровни на внешнем уровне. У Al3+ небольшой радиус и довольно высокий заряд, за счет чего он является комплексообразователем с координационным числом 4 или 6. Соединения Al более устойчивы, чем бора. Получение алюминия В промышленности Al получают электролизом расплава Al2O3 в криолите (Na3AlF6) Al2O3 → Al+3 + AlO3-3 K (-) Al+3 + 3e = Al0 A (+) 2AlO3-3 – 6e = Al2O3 + Ga, In, Tl – рассеянные элементы, встречаются в оксидных и сульфидных рудах. В этом случае соответствующие соединения концентрируют и действуют восстановителями. Э2O3 + 3H2 → 2Э + 3H2O Э2O3 + CO → 2Э + CO2 Химические свойства алюминия
4Al + 3O2 → 2Al2O3 2Al + 3Cl2 → 2AlCl3 Al + P → AlP
Алюминий – активный металл с большим сродством к кислороду. На воздухе покрывается защитной пленкой оксида. Если пленку уничтожить, то алюминий активно взаимодействует с водой. 2Al + 6H2O 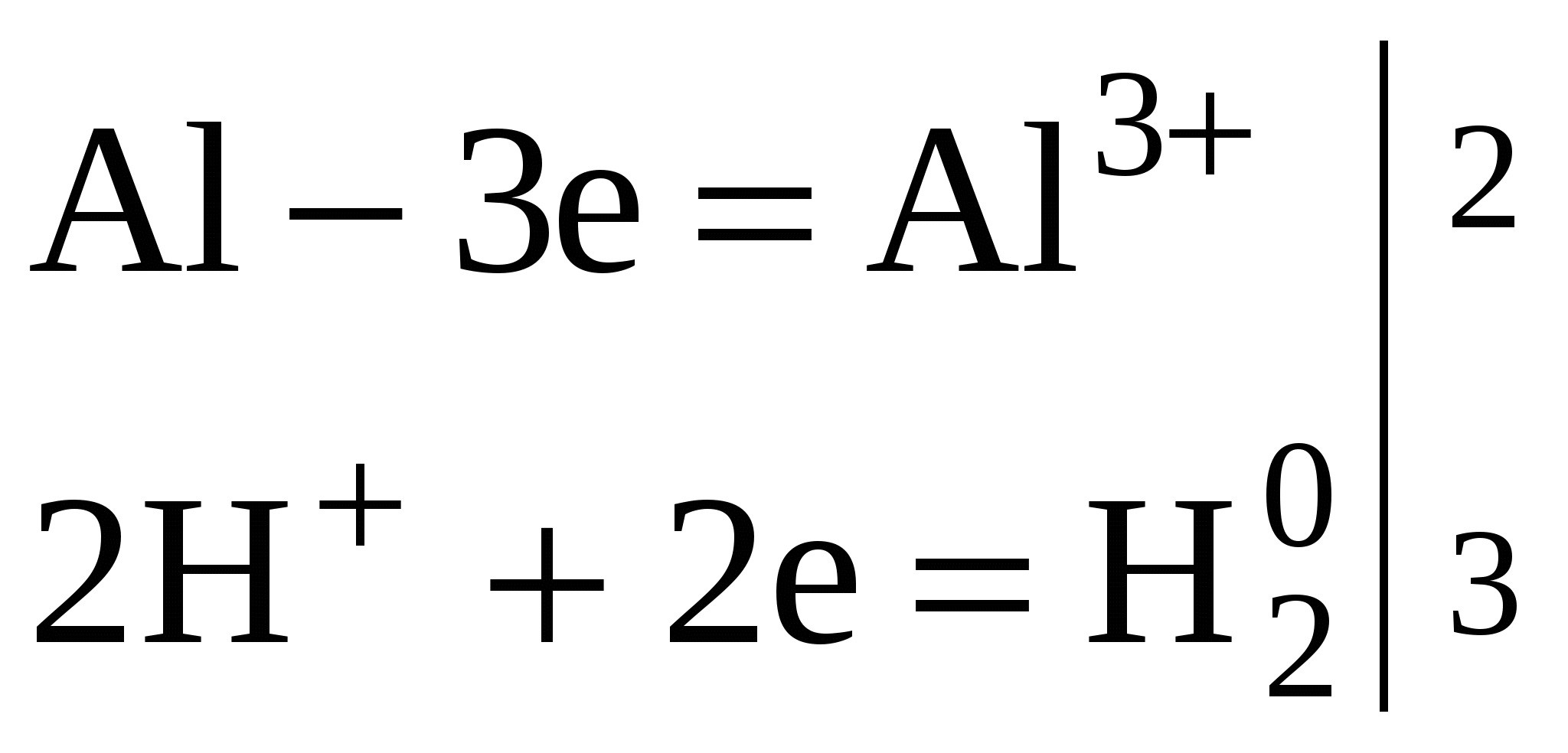
2Al + 6HCl → 2AlCl3 + 3H2 2Al + 3H2SO4 → Al2(SO4)3 + 3H2 С концентрированными HNO3 и H2SO4 при обычных условиях не реагирует, а только при нагревании. 5. Со щелочами: 2Al + 2NaOH С водными растворами щелочей алюминий образует комплексы: 2Al + 2NaOH + 10 H2O = 2Na+[Al(OH)4(H2O)2]- + 3H2↑ 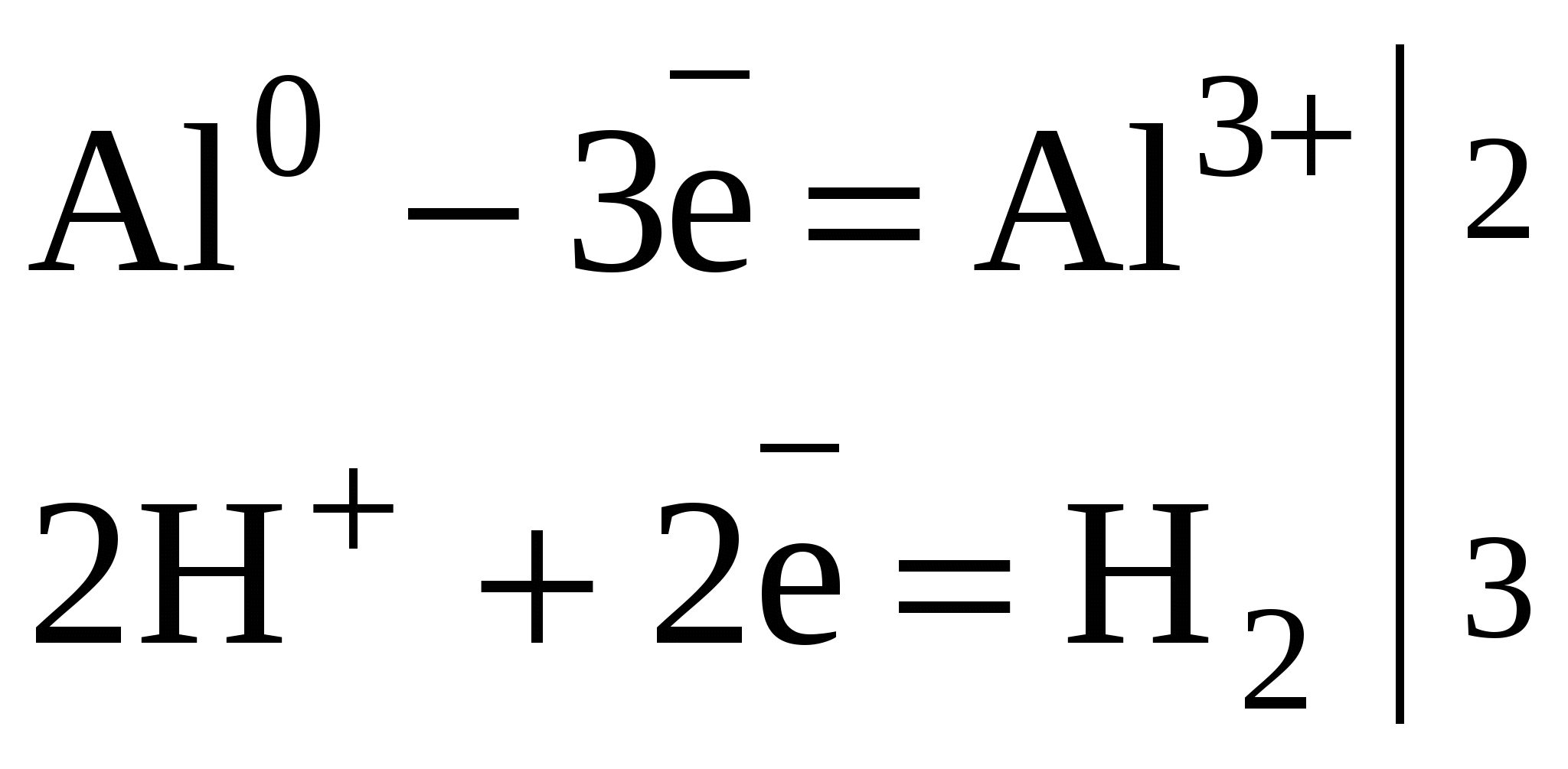 или Na[Al(OH)4], Na3[Al(OH)6], Na2[Al(OH)5] – гидроксоалюминаты. Продукт зависит от концентрации щелочи. 4Al + 3O2 → 2Al2O3 Al2O3 (глинозем) встречается в природе в виде минерала корунда (по твердости близок к алмазу). Драгоценные камни рубин и сапфир – тоже Al2O3, окрашенный примесями железа, хрома Оксид алюминия – амфотерен. При сплавлении его со щелочами получаются соли метаалюминиевой кислоты HAlO2. Например: Также взаимодействует с кислотами Белый студенистый осадок гидроксида алюминия растворяется как в кислотах Al(OH)3 + 3HCl = AlCl3 + 3 H2O, так и в избытке растворов щелочей, проявляет амфотерность Al(OH)3 + NaOH + 2H2O = Na[Al(OH)4(H2O)2] При сплавлении со щелочами гидроксид алюминия образует соли метаалюминиевой или ортоалюминиевой кислот Аl(OH)3 Соли алюминия сильно гидролизуются. Соли алюминия и слабых кислот превращаются в основные соли или подвергаются полному гидролизу: AlCl3 + HOH ↔ AlOHCl2 + HCl Al+3 + HOH ↔ AlOH+2 + H+ pH>7 протекает по I ступени, но при нагревании может протекать и по II ступени. AlOHCl2 + HOH ↔ Al(OH)2Cl + HCl AlOH+2 + HOH ↔ Al(OH)2+ + H+ При кипячении может протекать и III ступень Al(OH)2Cl + HOH ↔ Al(OH)3 + HCl Al(OH)2+ + HOH ↔ Al(OH)3 + H+ Соли алюминия хорошо растворимы. AlCl3 – хлорид алюминия является катализатором при переработке нефти и различных органических синтезах. Al2(SO4)318H2O – сульфат алюминия применяется для очистки воды от коллоидных частиц, захватываемых Al(OH)3 образовавшихся при гидролизе и снижении жесткости Al2(SO4)3 + Ca(HCO3)2 = Al(OH)3 + CO2↑ + CaSO4↓ В кожевенной промышленности служит протравой при крошении хлопчатобумажных тканей – KAl(SO4)212H2O –сульфат калия-алюминия (алюмокалиевые квасцы). Основное применение алюминия – производство сплавов на его основе. Дюралюмин – сплав алюминия, меди, магния и марганца. Силумин – алюминий и кремний. Основное их достоинство – малая плотность, удовлетворительная стойкость против атмосферной коррозии. Из алюминиевых сплавов изготавливают корпуса искусственных спутников Земли и космических кораблей. Используется алюминий как восстановитель при выплавке металлов (алюминотермия) Cr2O3 + 2 Al t = 2Cr + Al2O3. Также применяют для термитной сварки металлических изделий (смесь алюминия и оксида железа Fe3O4) называемая термитом дает температуру около 3000С. При движении от Ga к Tl кислотные свойства оксидов ослабевают, а основные усиливаются. В связи с этим Тl2O3 не взаимодействует со щелочами. Устойчивость оксидов сверху вниз падает. Тl2O3 при небольшом нагревании разлагается. Тl2O растворяется в H2O. Тl2O + H2O → 2TlOH TlOH – щелочь По размерам ион Тl+1 близок к иону К+, отсюда близость свойств этих соединений. Получают их из оксидов восстановлением H2(CO). У Ga как и у алюминия амфотерные свойства. Ga + NaOH + H2O → Na[Ga(OH)4] + H2 Могут реагировать с галогенами: Tl + Cl2 → TlCl Tl + Cl2 → TlCl3 Ga + Cl2 → GaCl3 Соединения Ga, In, Tl – ядовиты. 4. Биогенная роль элементов III A группы Все элементы III-А группы относятся к примесным микроэлементам. Массовая доля их в организме человека приблизительно 10-5%. Биологическое действие их недостаточно изучено. Бор концентрируется в легких (0,34 мг), щитовидной железе (0,3 мг), селезенке (0,26 мг), печени, мозге (0,22 мг), почках, сердечной мышце. Имеются данные, что бор снижает активность адреналина. Алюминий концентрируется в сыворотке крови, легких, печени, почках, костях, ногтях, волосах. Al +3 замещает Са+2, Mg+2. (У них одинаковые координационные числа, равные 6, радиус атома и энергия ионизации). Избыток Al в организме тормозит синтез гемоглобина. Tl – весьма токсичный элемент, так как подавляет активность ферментов, содержащих тиогруппы -SH, наблюдается выпадение волос. Ионы Тl+ и К+ являются синергистами (совместно действующий в одном направлении). Борная кислота применяется в медицине как дезинфицирующее средство, Бура Na2B4O710H2O применяется при спаивании металлов. Бура в расплавленном состоянии растворяет оксиды металлов, при соприкосновении наколенного паяльника с бурой, оксиды металлов растворяются в ней (поверхность очищается) и припой хорошо пристает к поверхности металла. Бор – микроэлемент, оказывает специфическое влияние на углеводный обмен в растениях, необходим для нормального роста и деления клеток, образования семян. Болотные и подзолистые почвы бедны бором. При борном голодании растения не образуют семян или их мало. Внесение борных удобрений повышает урожай сахарной свеклы, бобовых и овощных культур, менее реагируют на борные удобрения злаковые культуры. Подкормку ведут через почву или опрыскиванием (внекорневая подкормка), эффективна предпосевная подкормка семян водными растворами борной кислоты. Применяют: бораты магния, бородатолитовое удобрение, боросуперфосфат, бородвойной суперфосфат, термические бораты. Н3ВО3 – антисептическое средство, высокая растворимость борной кислоты в липидах обеспечивает быстрое проникновение ее в клетки через липидные мембраны. В результате происходит свертывание белков (денатурация) цитоплазмы микроорганизмов и их гибель. Как антисептик применяют буру Na2В4О710Н2О. Фармакологическое действие препарата обусловлено гидролизом соли с выделением Н3ВО3. КAl(SO4)212H2O – алюмокалиевые квасцы. КAl(SO4)2 – жженые квасцы применяют для полосканий, промываний и примочек при воспалительных процессах слизистых оболочек и кожи, применяют как кровоостанавливающее средство при порезах. Жженые квасцы – в виде присыпок как вяжущее и высушивающее средство при потливости ног. Осушающее действие связано с тем, что жженые квасцы медленно поглощают воду. Al – почвообразующий элемент. Наибольшее его количество стимулирует прорастание семян; избыток – снижает интенсивность фотосинтеза, нарушает фосфорный обмен, задерживает рост корневой системы. Присутствие Al+3 в почве обуславливает вредную для растений обменную кислотность почвенного раствора. Ионы Al+3 поглощаются почвенными коллоидами, но под действием солей (KCl) вытесняются из почвы 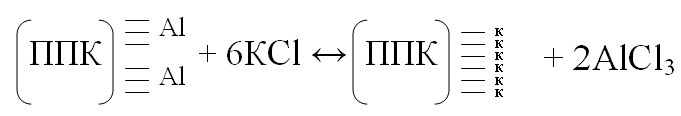 Полученная соль AlCl3 гидролизуется по уравнению Al3+ + HOH ↔ AlOH2+ + H+ , и в результате гидролиза повышается концентрация ионов Н+ (понижается pH). ЛЕКЦИЯ 4 Тема: р - Элементы IV группы 1. Общая характеристика группы В IV-A группе находятся р - элементы C, Si, Ge, Sn, Pb. Конфигурация атома в невозбужденном состоянии ns2 nр2, в возбужденном состоянии ns1nр3, все 4 электрона неспаренные.
Радиусы атомов закономерно растут с увеличением порядкового номера, ионизационный потенциал соответственно уменьшается. В большинстве неорганических соединений углерод и кремний проявляют степень окисления +4. Но от германия к свинцу прочность соединений со степенью окисления +4 уменьшается, более стабильна низкая степень окисления +2. Могут проявлять степени окисления - 4 в гидридах. Углерод стоит в середине 2-го периода, он одинаково может притягивать и отдавать электроны, промежуточное значение электроотрицательности приводит к тому, что углерод образует ковалентные связи со всеми реакционноспособными элементами периодической системы, стоящими от него слева (в том числе Н), справа (О, N, галогены) и снизу (Si,Ge, Sn, Pb). Li Be B C N O F ОЭО 1 1,5 2 2,5 3 3,5 4 Невозможность донорно - акцепторного взаимодействия в возбужденном состоянии обусловливает примерно одинаковую прочность одинарных связей с водородом. Четырехвалентность углерода предоставляет широкие возможности для разветвлений цепей углеродных атомов и образования циклических структур. C - типичный неметалл Si - типичный неметалл Ge - есть металлические свойства Sn - металлические свойства преобладают над неметаллическими Pb - металлические свойства преобладают над неметаллическими 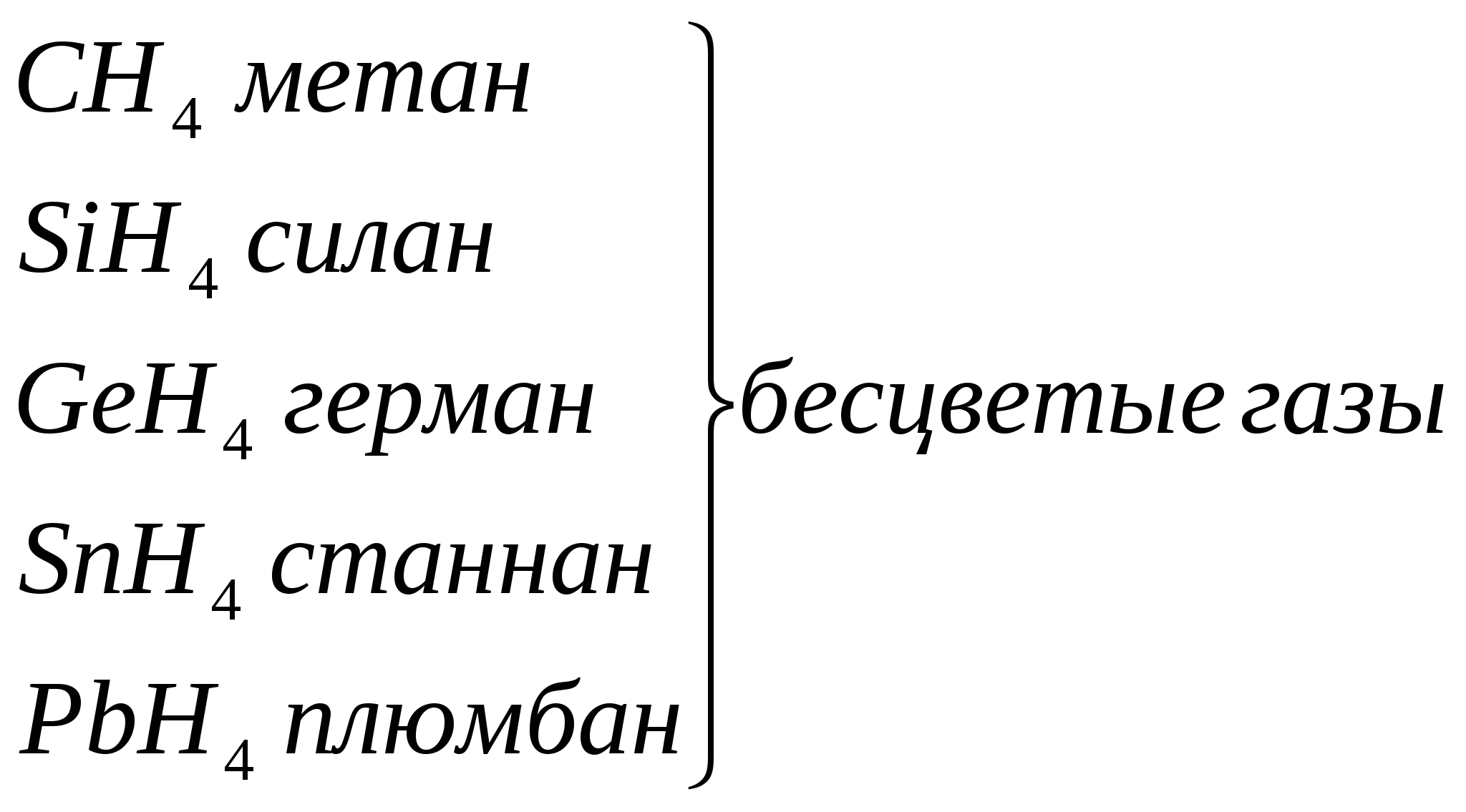  Увеличение восстано-вительных свойств, уменьшение устойчивости молекул 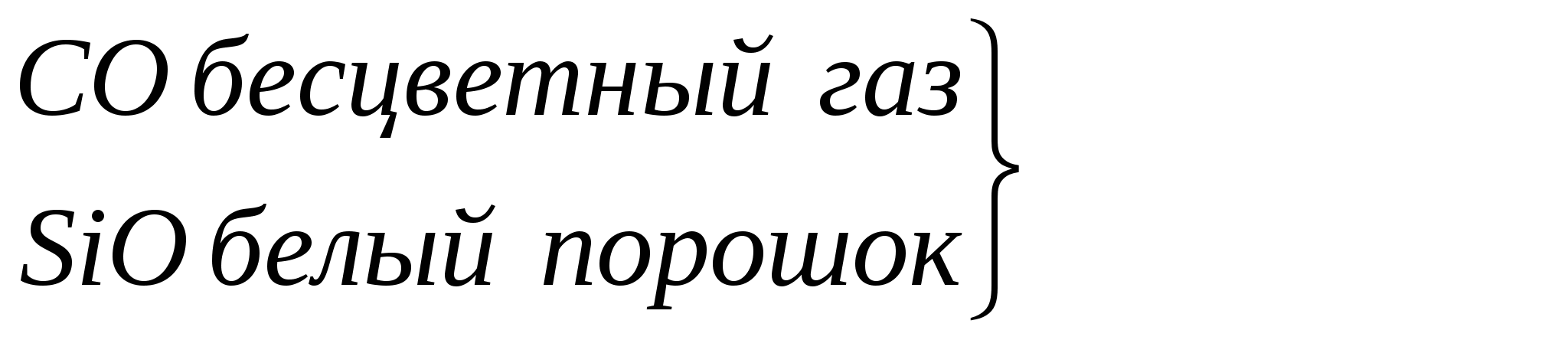  Увеличение основных свойств и устойчивости молекул. Нерастворимы в воде Гидроксидов не образуют 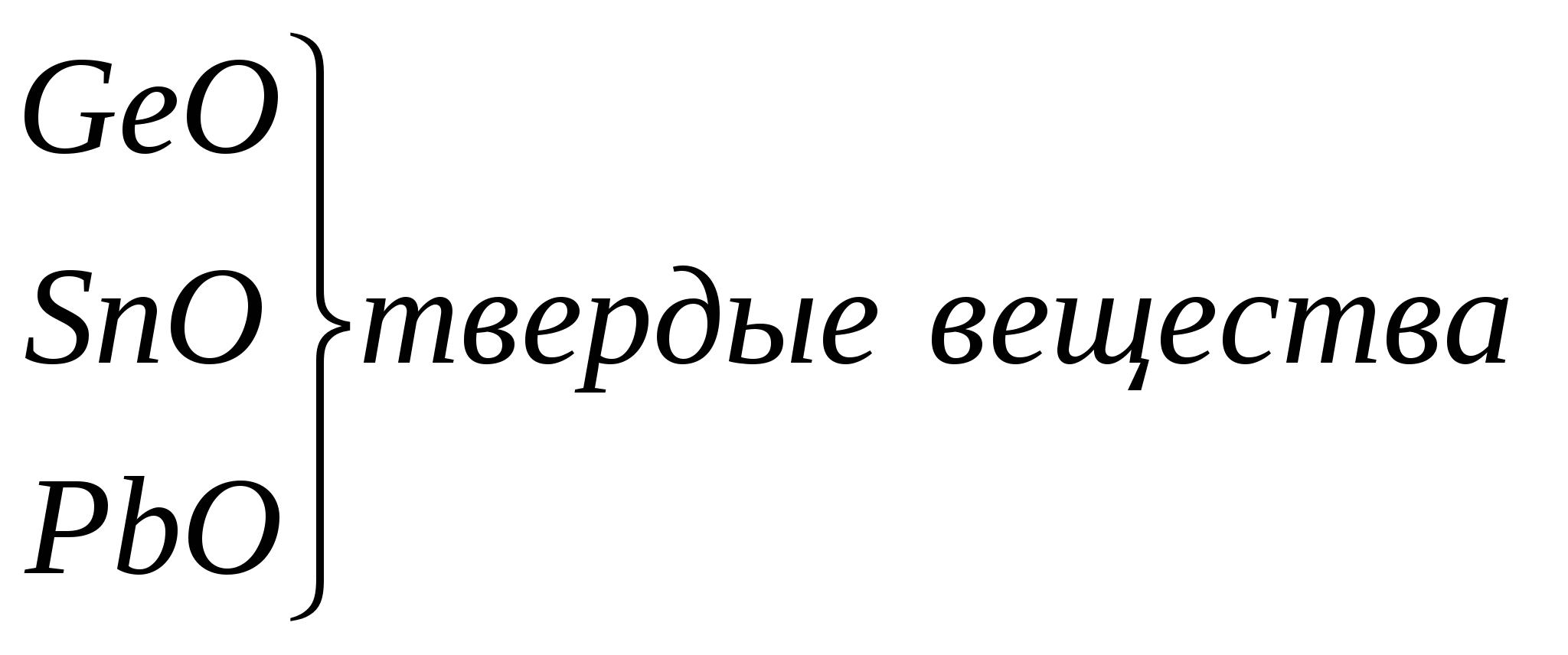 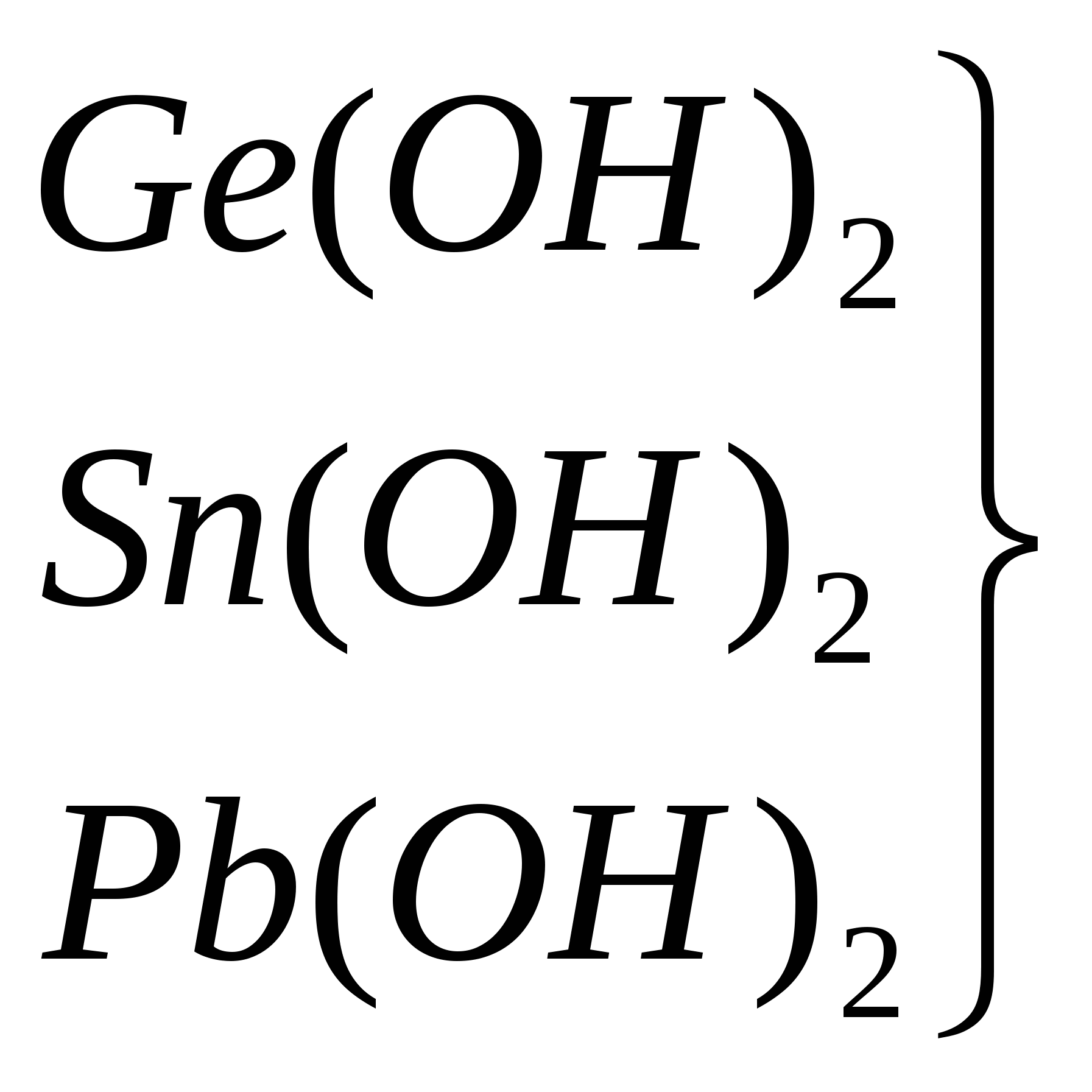 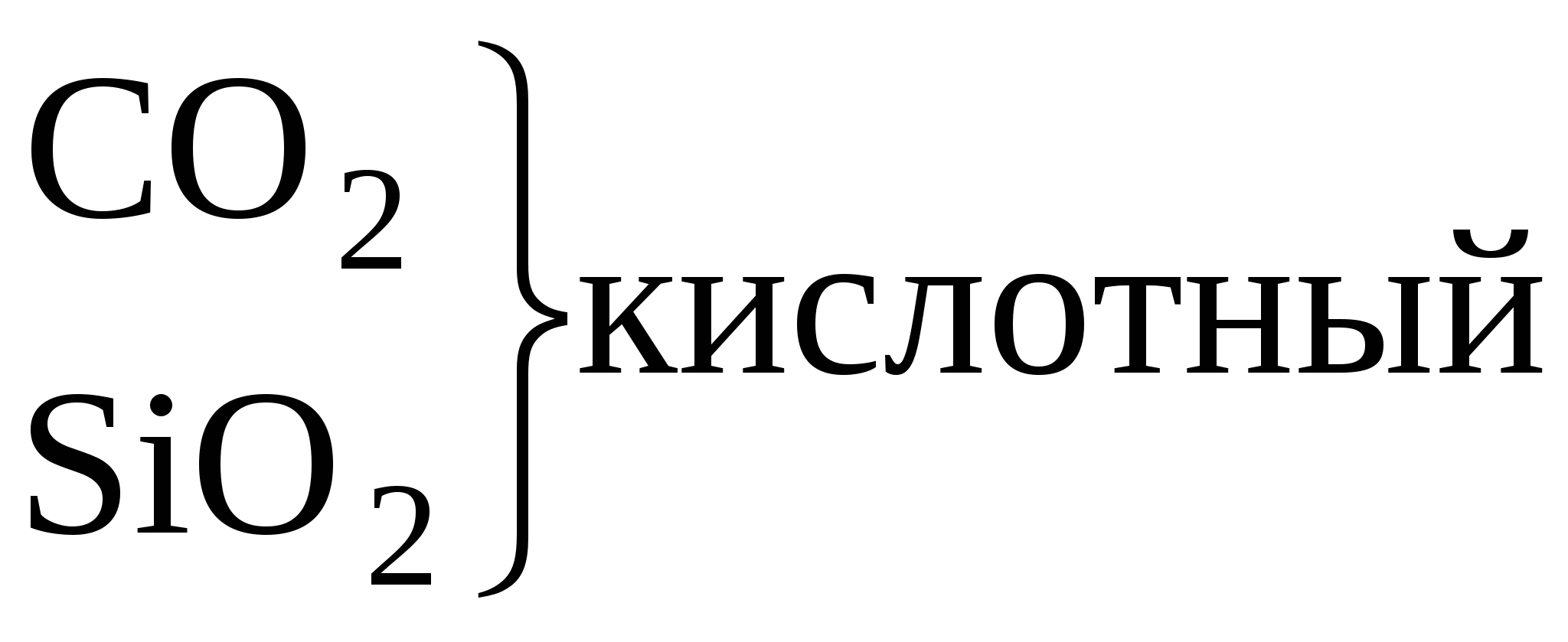  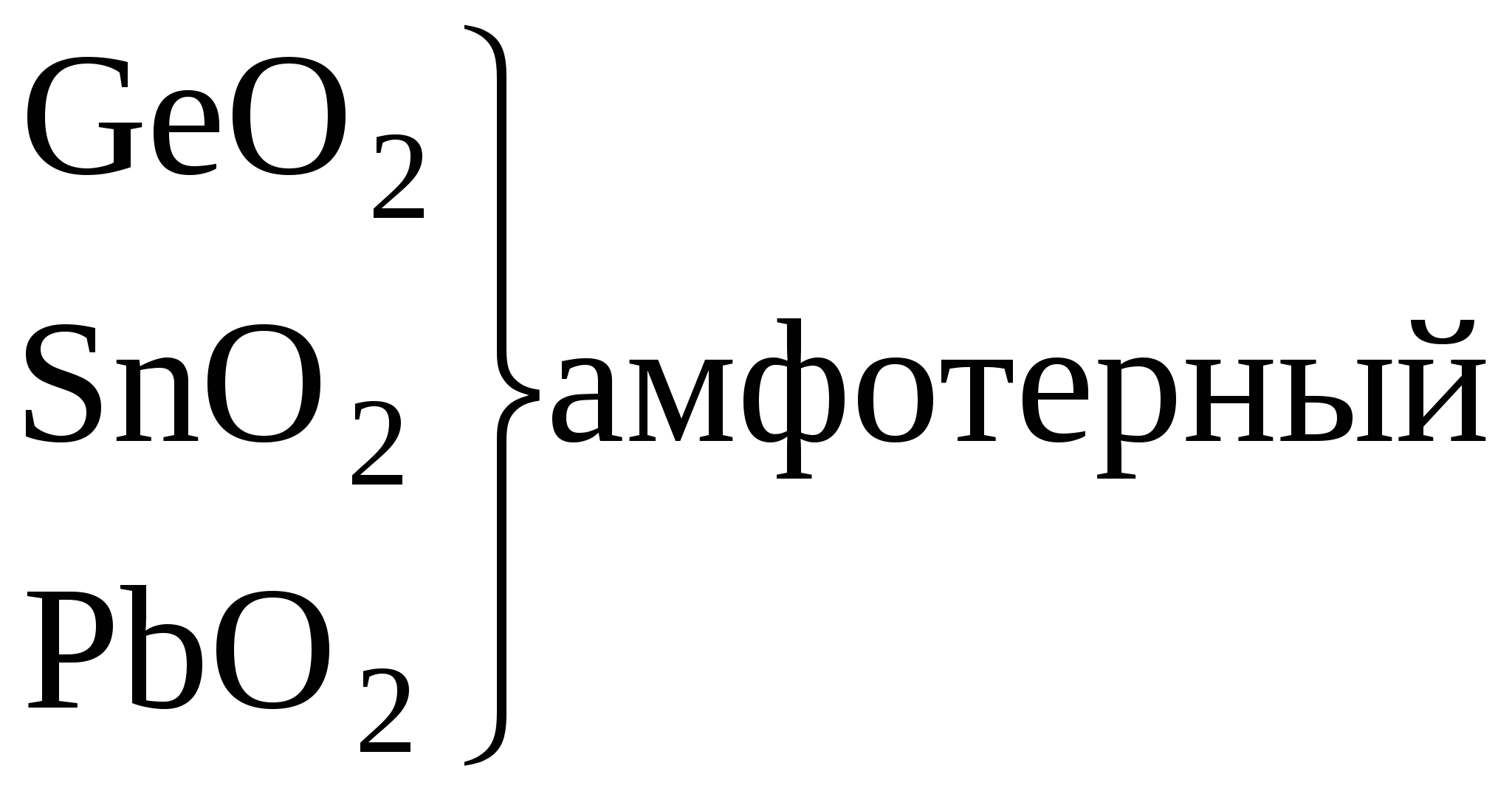 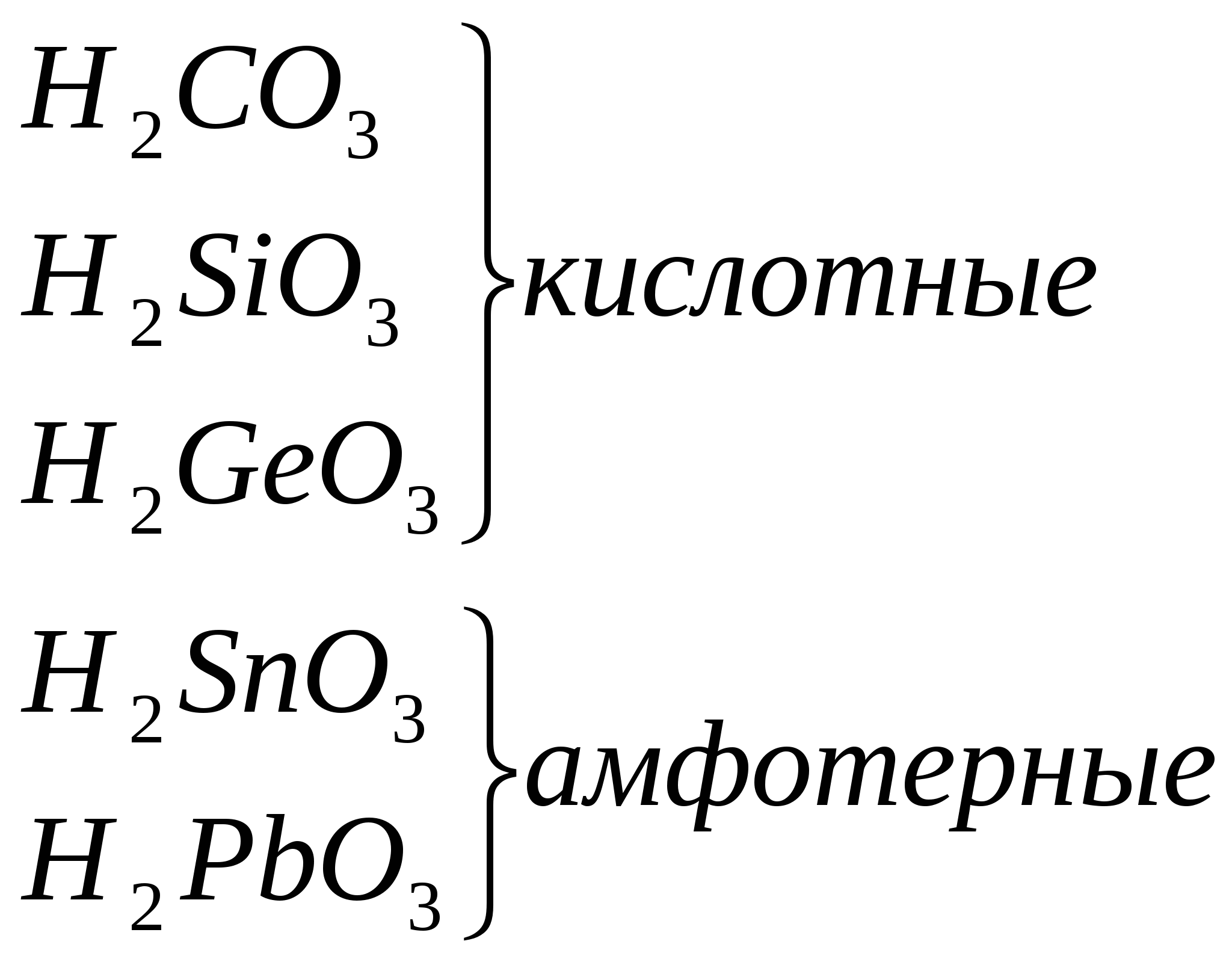 уменьшение устойчивости молекул Кремний по распространенности в земной коре занимает второе место (после кислорода). Если углерод – основа жизни, то кремний – основа земной коры. Он встречается в громадном многообразии силикатов и алюмосиликатов, песка. Германий, олово, свинец достаточно редкие элементы. Аморфный уголь (сажа) черного цвета, аморфный кремний – порошок бурого цвета. Кристаллический кремний – полупроводник. Важные сорта аморфного угля – кокс, древесный уголь. Германий как и кремний, полупроводник, имеет алмазоподобную решетку, по внешнему виду типичный металл серебристо-белого цвета. Олово имеет модификации белое (-модификация устойчива выше 286 К серебристо-белый металл, серая - -модификация (серое олово) имеет алмазоподобную решетку. Свинец – темно-серый металл. 2. Химия углерода Углерод встречается в природе в свободном виде и в соединениях. Его аллотропные видоизменения – алмаз, графит, карбин, фуллерен. Алмаз – самое твердое вещество в природе. Твердость по шкале Маоса -10, тем не менее он хрупок. Ограненный алмаз имеет более 20 граней и называется бриллиантом, используется в ювелирной промышленности. Масса бриллианта измеряется в каратах (1 карат = 0,2 г). Существенные различия в свойствах алмаза и графита обусловлены особенностями строения их кристаллов. 1. Кристаллическая решетка алмаза атомная. Каждый атом углерода расположен в центре тетраэдра, четыре вершины которого заняты другими атомами углерода. Все атомы находятся на одинаковых расстояниях друг от друга. Кристалл алмаза (диэлектрик) – имеет плотную упаковку с высокой компактностью и твердостью. Атомы углерода в sp3-гибридизации. 2. В кристаллах графита атомы углерода расположены в углах правильных шестиугольников, находящихся в параллельных плоскостях. Под внешним воздействием такой кристалл легко расслаивается на чешуйки. Графит в отличие от алмаза очень мягок. Атомы углерода в графите в sp2-гибридизации. 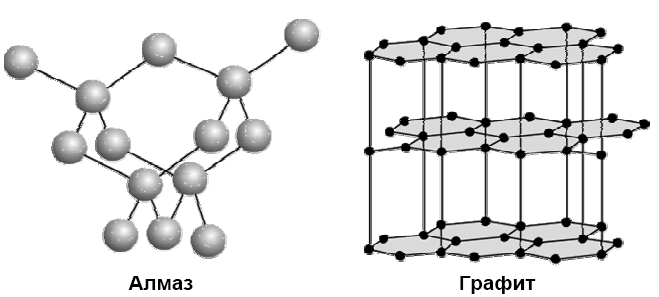 3. Карбин – твердое кристаллическое вещество. Это линейный полимер углерода, в котором чередуются одинарные и тройные связи. Атомы углерода в карбине в sp-гибридизации. Карбин – наиболее стабильная форма углерода, - карбин обладает полупроводниковыми свойствами. 4. Фуллерен – четвертая аллотропная модификация углерода. Его молекулы имеют четное число атомов углерода и имеют состав С60, С70, С80 и т.д. Молекула С60 имеет вид футбольного мяча, построенного из пяти- и шестигранных углеродных циклов с общими ребрами. Водородные соединения углерода – углеводороды являются объектом изучения в органической химии. К неорганическим соединениям углерода относятся СО и СО2. С + О2 СО2 С + О2 СО С + Н2 СН4 С + S2 CS2 (сероуглерод) С + F2 СF4 Из галогенидов СГаl самое большое значение имеет СCl4 – бесцветная, достаточно токсичная жидкость. В обычных условиях СCl4 химически инертен. Применяют как невоспламеняющийся и негорючий растворитель смол, лаков, жиров и для получения фреона CF2Cl2. CF4 – газ; CCl4 – жидкий ; CBr4 – твердый. С + H2SO4 конц СО2 + SO2 + H2O С + HNO3 конц СО2 + NO2 + H2O Химическая связь в молекуле СО. Распределение электронов в возбужденном атоме углерода и в кислороде таково, что между ними возможно образование двух химических связей – в атоме кислорода имеются 2 неспаренных электрона. Однако при переходе одного электрона от кислорода к углероду в образовавшихся ионах С- и О+ будет по 3 неспаренных электрона, аналогично электронной конфигурации азота. При соединении этих ионов образуется тройная связь, аналогичная молекуле N2, поэтому свойства СО и N2 очень близки. |
