Лекции по неорганической химии. Курс лекций по дисциплине неорганическая химия
 Скачать 2.04 Mb. Скачать 2.04 Mb.
|
|
Тема: s - ЭЛЕМЕНТЫ II ГРУППЫ 1. Общая характеристика элементов II А группы. Физические и химические свойства щелочноземельных металлов Ca, Sr, Ba ), их бинарных соединений, гидроксидов и солей Be, Mg, Ca, Sr, Ba, Ra – элементы II А группы, из них Ca, Sr, Ba, Ra – щелочноземельные металлы, т.к. их гидроксиды обладают щелочными свойствами. Из всех этих элементов только бериллий – является моноизотопным, все остальные полиизотопны. Радий – единственный элемент этой подгруппы, для которого неизвестно ни одного устойчивого изотопа. Все 14 изотопов радиоактивны и среди них наиболее устойчив 226Ra. Атомы элементов на внешнем электронном уровне имеют по 2 электрона с противоположными спинами. В возбужденном состоянии один из двух внешних электронов занимает р-орбиталь 2s 2p Be [He] 2s2 Be* [He] 2s1 2p1   Радиусы атомов их меньше, чем у атомов щелочных металлов, поэтому потенциал ионизации больше. От Be(Mg) к Ra увеличивается радиус атома и иона, в соответствии с этим усиливаются металлические свойства. Причем они менее выражены, чем у щелочных металлов. У щелочноземельных металлов – тип металлических структур:Be, Mg – ГПУ (гексагональная плотная упаковка) Ca, Sr – ГКУ (гранецентрированная кубическая упаковка) Ba – ОЦКУ (объемно-центрированная кубическая упаковка)         ГПУ ГКУ ОЦКУ Температура плавления и кипения бериллия, а также твердость значительно превосходит остальные элементы подгруппы, это связано с тем, что бериллий образует наиболее прочную кристаллическую решетку. Стандартный электродный потенциал уменьшается сверху вниз, соответственно. Восстановительная активность увеличивается от Ве к Ra, но они менее активные восстановители, чем щелочные металлы. Незакономерное изменение физических свойств: плотности, температуры плавления, температуры кипения обусловлены существенными различиями в строении пространственных кристаллических решеток. В свободном состоянии это легкие металлы, тверже щелочных, самый мягкий барий, имеют серебристо-белый цвет. Для элементов II-A группы характерна степень окисления +2, соединения со степенью окисления +1 – неустойчивы. Все окисляются на воздухе и бериллий, и магний покрываются плотной пленкой оксидов, защищающей их от воздействий. Но остальные металлы взаимодействуют с кислородом воздуха более энергично, поэтому хранят также как и щелочные. При нагревании все металлы сгорают на воздухе с образованием оксидов. При высоких температурах взаимодействуют с азотом, образуя нитриды. Взаимодействуют с водой, вытесняя водород, все кроме бериллия, магний реагирует медленно и только при высоких температурах, а остальные бурно, т.к. в ряду стандартных электродных потенциалов находятся левее водорода. Магний сначала образует оксид, а затем гидроксид. Магний покрыт оксидной плёнкой MgO, который растворяется в H2O при нагревании. Гидролиз бинарных соединений (при нагревании) СаS + 2H2O → Ca(OH)2 + H2S↑ Ca3P2 + 6H2O → 3Ca(OH)2 + 2PH3↑ CaC2 + 2H2O → Ca(OH)2 + C2H2↑ CaH2 + 2H2O → Ca(OH)2 + 2H2↑ Ca3N2 + 6H2O → 3Ca(OH)2 + 2NH3↑ Mg2Si + 4H2O → 2Mg(OH)2 + SiH4↑ Ca, Sr, Ba легко взаимодействуют с водородом, а Be, Mg – не взаимодействуют. Наряду с обычными оксидами в отличие от Be и Mg образуют пероксиды Гидроксиды щелочноземельных металлов – сильные основания (щелочи). Be(OH)2 - aмфолит. Mg(OH)2 – как основание средней силы хорошо растворяется в кислотах и в растворах солей аммония С ростом ионных радиусов Э2+ в ряду Be-Ba растет растворимость гидроксидов и усиливаются основные свойства в ряду Са(ОН)2 – Sr(OH)2 –Ba(OH)2. Об этом можно судить по значениям BeCO3 MgCO3 CaCO3 SrCO3 BaCO3 Малорастворимые гидроксиды бериллия и магния получают с помощью реакций обмена между солями этих металлов и щелочами. MgCl2 + 2KOH → Mg(OH)2↓ + 2KCl Гидроксиды рассматриваемых элементов разлагаются при нагревании. Из разбавленых кислот (кроме HNO3) эти металлы вытесняют водород разбавленную HNO3 восстанавливают до иона аммония, концентрированную как активные металлы до N2О 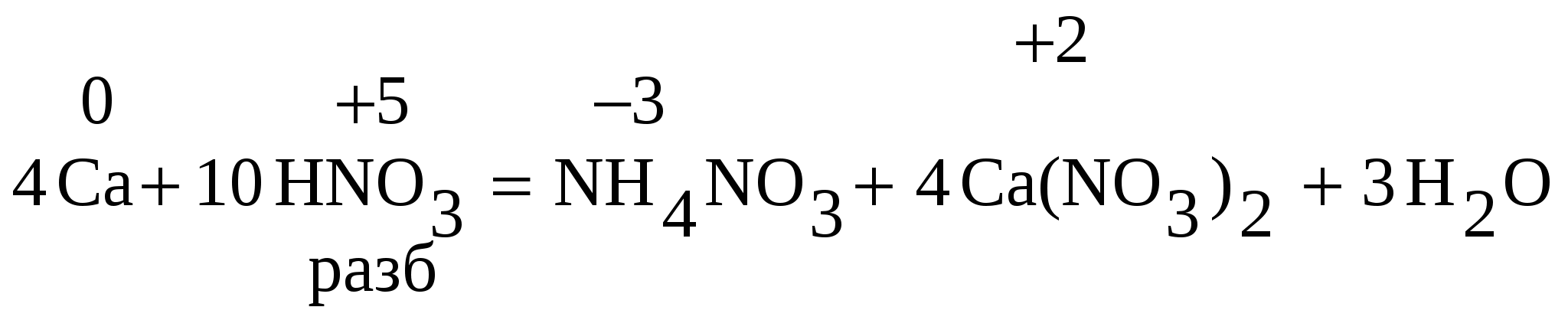 Способы получения Получение бериллия. 1. Из оксидов, фторидов пирометаллургическим методом, т.е. при высокой температуре (восстановители – CO, C, Mg). 2. Электролиз расплавов солей. Получение магния из оксидов восстановлением C и Si Mg + H2≠ Ca - электролизом расплавов солей, Sr и Ba- алюмотермией 3 Растворимость солей: Хорошо растворимы: хлориды, бромиды, иодиды и нитраты. Плохо растворимы сульфаты (кроме MgSO4), карбонаты, фосфаты, силикаты. Сульфиты – малорастворимы в воде и сильно гидролизуются. Все соли бария токсичны, применяются в сельском хозяйстве как инсектициды – яды для борьбы с вредными насекомыми (BaCl2, BaCO3). 2. Особенности бериллия Также как литий отличается от элементов I-A группы, Be – отличается от элементов II-А группы. Атом Ве имеет на предвнешнем электронном уровне только два электрона, в отличие от остальных элементов II-A группы, у которых их по 8. У него наименьший радиус. Поэтому Ве проявляет диагональное сходство с Al. Ве и его аналоги при нагревании с галогенами образуют галогениды ЭГ2. Их получают также действуя НГ на металл или на Э(ОН)2. Be + Cl2 → BeCl2 ЭГ2 – кристаллические вещества. В молекуле BeCl2 в наружном слое 4 электрона. Ве – может быть акцептором электронных пар и образовывает две связи по донорно-акцепторному механизму. Cl – донор электронной пары.  В итоге при конденсации BeCl2 образуются линейные полимерные цепи. Бериллий образует бинарные соединения: Be + O2 = 2BeO Be + S и разлагаются водой В обычных условиях бериллий не образует простых ионов, как и для алюминия, для него характерны катионные и анионные комплексы, где координационное число Be равно 4 (Кч.Be = 4); в водных растворах не существует иона Be2+ так как он гидратирован. Также как и алюминий бериллий обладает амфотерными свойствами, растворяется и в кислотах и в щелочах Be + 2H+ + 4H2O = [Be(H2O)4]2+ + H2↑ Be + 2OH- + 2H2O = [Be(OH)4]2- + H2↑ Be пассивируется концентрированной азотной и серной кислотами, но при нагревании реагируют с этими кислотами:  Амфотерный оксид Ве взаимодействует при сплавлении как с кислотными так и с основными оксидами. Как и оксид, амфотерны сульфиды и галогениды бериллия. BeS + Na2S → Na2BeS2 кис. осн. BeS + SiS2 → Be2[SiS4] осн. кис. BeF2 + NaF → Na2[BeF4] кис. осн. BeF2 + SiF4 → Be[SiF6] осн. кис. Амфотерен и гидроксид бериллия Соль бериллия, образованную слабой кислотой, можно получить только непосредственно соединением элементов, но нельзя получить смешиванием водных растворов, так как идет совместный гидролиз солей. Все соединения Ве токсичны. С учетом особенностей его свойств, применяется в атомной технике, электронике. 3. Жесткость воды, ее влияние на живые организмы. В природных водах содержатся соли кальция, например, благодаря растворимости гипса CaSO42H2O. В присутствии СО2 растворяются в воде карбонаты кальция и магния Вода, в которой много растворимых солей Ca и Mg считается жесткой. Жесткость воды выражается числом миллиэквивалентов ионов Са2+ и Mg+2, содержащихся в 1 л Н2О. где Вода считается мягкой, если в литре воды содержание кальция и магния менее 4 мг-экв/л, средней 4-8, жесткой 8-12, очень жесткой – более 12 мг-экв/л. В жесткой воде мыло плохо пенится, снижается его моющие действия, т.к. соли Ca и Mg образуют с ним нерастворимые соединения. Мыло – Na-соли высокомолекулярных кислот, натрий замещается на Ca2+и образуется осадок. В жесткой воде плохо развариваются овощи. У животных нарушается Ca-Mg обмен. Только растворимые соли Ca и Mg обуславливают жесткость воды. Различают временную и постоянную жесткость воды. Временная (карбонатная) жесткость воды связана с наличием в воде растворимых гидрокарбонатов Ca и Mg. Ее устраняют нагреванием (кипячением). или добавлением известковой воды, фосфатов 3Ca(HCO3)2 + 2Na3PO4 = Ca3(PO4)2↓ + 3Na2CO3 + 3H2O + 3CO2↑ Устранить жесткость – значит получить нерастворимые соли. При этом образуется накипь СаСO3 и MgCO3. Накипь плохо проводит тепло, вызывает увеличение расхода топлива. Постоянная жесткость обусловлена наличием в растворе Са и Mg-солей сильных кислот – сульфатов, хлоридов. Кипячением она не устраняется. Постоянная жесткость удаляется добавлением соды и извести MgSO4 + Ca(OH)2 = Mg(OH)2 + Ca SO4 Общая жесткость – сумма временной и постоянной жесткости. Общую жесткость можно удалить действием соды и известкового молока (содово-известковый способ). Все это химические способы устранения жесткости. Ионы Са2+ и Mg2+ можно удалить из воды посредством катионитов (ионообменных смол), сложных веществ, нерастворимых в воде, способных обменивать свои катионы. Ионы Са2+ и Mg2+ из воды переходят в катиониты. Для восстановления катионита, его промывают концентрированным раствором NaCl, катионит потом снова можно использовать для очистки воды. 4. Важнейшие соединения элементов II-А группы BeO, MgO – для производства огнеупорных материалов, МgO – жженая магнезия, применяется для нейтрализации при отравлении кислотами, входит в состав зубных порошков. СаО – негашеная известь. BaO2 – для производства Н2О2 и как отбеливающее средство. Са(ОН)2 – гашенная известь (известковое молоко) дешевое растворимое основание. СаСО3 – карбонат кальция – главная составная часть известняка, мела, мрамора. Служит для производства (негашеной, гашеной и хлорной извести). СаSO4 – используют для штукатурных работ, в медицине для изготовления отливочных форм и слепков, наложения повязок при переломах. 2CaSO4H2O – алебастр (в строительстве) СаSO42H2O – гипс (в строительстве) CaCl2 – широко применяется в медицине для внутренних инъекций. M применяются в медицине (слабительное) gSO47H2O M  gCl26H2O gCl26H2O Раствор Ва(ОН)2 – баритовая вода – лабораторный реактив для открытия СО2. Ba(NO3)2 – в пиротехнике. 5. Биогенная роль элементов II-А группы. Применение в сельском хозяйстве Кальций – микроэлемент. Кальцию принадлежит исключительно важная биогенная роль. Он необходим организмам для скелетообразования, костной ткани, зубов, сердечной и нервной деятельности. Кальций играет большую роль в процессах фотосинтеза, образования белков, различных органических кислот. В животных организмах его присутствие необходимо для свертывания крови, осаждения казеина (сложного белка) при действии сычужного фермента. Избыток ионов кальция подавляет возбудимость мышечной ткани и нервных волокон, повышает тонус сердечной мышцы, действие нервной системы. Радиоактивный изотоп кальция (45Са) широко используется в биологии и медицине при изучении процессов минерального обмена в живых организмах, процессов усвоения кальция растениями. Многие растения являются кальцефильными, например европейская лиственница, европейская пихта, пушистый дуб. Для своего развития они требуют повышенные концентрации кальция в почвах с нейтральной или слабощелочной средой. Ион Са2+ - антагонист иона Mg2+, Ca2+ в отличие от Mg2+ является внеклеточным катионом. При поступлении избытка солей Mg наблюдается усиленное выделение кальция из костной ткани. Основная масса Са находится в костной и зубной тканях. Са, вводимый с пищей только на 50% всасывается в кишечнике. Плохое всасывание является следствием образования труднорастворимого Са3(РО4)2. Кальций не используется внутри клетки, он выступает в качестве строительного материала в организме, в костях, зубах. Скелет – основное хранилище кальция в организме. Нарушение нормального обмена веществ приводит к отложениям различных кальциевых солей в различных органах (образование «камней», глаукомы, артериосклеротические изменения сосудов и др.). Ионы кальция участвуют в обмене веществ, они поддерживают в норме свертываемость крови. Ежедневная нормальная доза кальция для здорового человека составляет 1 г. Кальций содержит шпинат, молочный продукты, сыр, абрикосы. Са – почвообразующий элемент. Почвы с высоким содержанием Са отличаются хорошей структурой и высоким плодородием. Почвы бедные Са наоборот имеют высокую кислотность. Почвы редко нуждаются в увеличении содержания Са2+ и Mg2+. Но карбонаты Са и Mg вносят в почвы для химической мелиорации – устранение избыточной кислотности (известкование) и устранение избыточной щелочности (гипсование). ППК Н2+ + СаСО3 = ППК Са2+ + Н2О + СО2 ППК Na2+ + Ca2+ + SO42-= ППК Са2+ + 2Na+ + SO42- Хорошо растворимый Na2SO4 вымывается из почвы. Магний – необходимая часть молекулы хлорофилла растений, без которого не могут происходить процессы фотосинтеза и развитие растительного мира. Магниевое микроудобрение – доломит MgCO3CaCO3. В растениях магний участвует также в превращениях фосфорных соединений, в образовании жиров, в синтезе и распаде углеводов. При недостатке магния в почвах у растений возникают заболевания – хлороз (разрушение хлорофилла, обесцвечивание хлоропласта), у животных мышечные судороги, наблюдается остановка роста конечностей. Белое вещество мозга содержит Mg больше, чем серое, спинной мозг больше, чем головной. Богаты Mg абрикосы, персики, цветная капуста, картофель, помидоры. Магний содержат орехи, мед, морские продукты, хлеб из обойной муки, фасоль, горох, овсяная и гречневая крупа. Стронций – концентрируется в костях, частично заменяя кальций. Радиоактивный изотоп 90Sr вызывает лучевую болезнь. Он поражает костную ткань и в особенности костный мозг. Накопление 90Sr в атмосфере и в организме способствует развитию лейкемии и рака костей. Применение ЭДТА для удаления 90Sr приводит к дополнительному вымыванию Са из костей. Поэтому используют не кислоту, а Na2CaЭДТА – комплекс. Избыток стронция вызывает ломкость костей, стронциевый рахит и др. Причина – замена кальция костного вещества стронцием: ион стронция легко вымывается из костей и наступает их разрушение. ЛЕКЦИЯ 3 |
