Лекции по неорганической химии. Курс лекций по дисциплине неорганическая химия
 Скачать 2.04 Mb. Скачать 2.04 Mb.
|
|
Тема: р - Элементы VII группы (галогены) 1.Общая характеристика элементов Элементы фтор, хлор, бром, иод, астат составляют главную подгруппу VII группы – семейство галогенов (в переводе с греческого соль рождающие). Объясняется их способностью образовывать бинарные соединения типа NaCl за счёт проявления ими окислительных свойств. На внешнем уровне у них 7 электронов ns2np5, электронная конфигурация обусловливает характерную степень окисления всех элементов в их соединениях (-1). В то же время для хлора, брома и иода известны соединения, где их степени окисления имеют положительные значения: +1, +3, +5, +7. 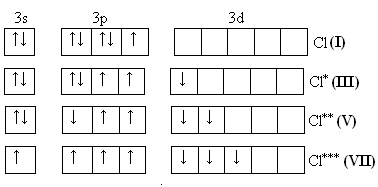 До завершения оболочки не достаёт 1 электрона. Поэтому галогены – сильные окислители. Это типичные неметаллы (за исключением At, и отчасти иода). Обладают большим сродством к электрону (сродство к электрону – энергия, которая выделяется при присоединении к атому одного электрона). Легко присоединяют электрон Э + е- = Э- , достраивая электронную оболочку до устойчивой оболочки атомов ближайших благородных газов. Радиус иона больше радиуса атома, так как при присоединении электронов радиус увеличивается. Окислительная способность (т.е. способность присоединять электроны у галогенов уменьшается от F к At). Поэтому фтор вытесняет все следующие за ним галогены, у йода и астата появляются металлические признаки. При обычных условиях галогены существуют в виде простых веществ, состоящих из двухатомных молекул типа Наl2 - 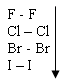 F2 , Cl2 , Br2 , I2. F2 , Cl2 , Br2 , I2.Сила связи Э – Э уменьшается вниз по группе за исключением связи F – F, которая неожиданно слабее (причина этого, по-видимому, состоит в более близком расположении неподелённых электронных пар из-за малых размеров атома фтора, отталкивание неподелённых электронных пар ослабляет связь). В Cl2 , Br2 , I2 – дативная связь дополнительная, за счёт спаренных p-электронов одного атома и вакантных d-орбиталей другого. 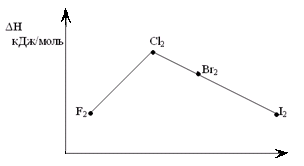 Аномальное изменение энергии связи связано с различными размерами атомов. ЕF2 < ECl2 за счёт малых размеров атома F. На близком расстоянии атомы отталкиваются друг от друга. С одной стороны в молекуле Cl2 действуют силы отталкивания между неподелёнными электронными парами, находящихся на близком расстоянии. Самой прочной молекулой является молекула Cl2. Это связано с тем, что в дополнение к образованию связи по спин-валентному механизму, происходит добавочное взаимодействие свободных электронных пар одного атома хлора со свободной d орбиталью другого - по донорно-акцепторному механизму. Такие дополнительные связи называются дативными и приводят к упрочнению молекулы. 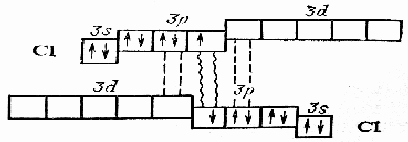 Уменьшение энергии связи от Cl2 к I2 объясняется увеличением расстояний между атомами. Увеличение tплавл. связано с тем, что с увеличением размера атома возрастает поляризуемость молекул и усиливается способность к межмолекулярному взаимодействию, а чем более прочная связь между молекулами, тем более высокая tплавл.. Физические свойства галогенов существенно различаются: так, при нормальных условиях F2 – зеленовато – жёлтый, трудно сжижаемый газ с резким запахом. Фтор крайне токсичен, при попадании а организм человека вызывает отёк лёгких, разрушение зубов, ногтей, ломкость кровеносных сосудов, повышает хрупкость костей. Cl2 – также газ желто – зеленого цвета, но сжижается легко; Br2 – красно- коричневая густая жидкость со зловонным запахом, ядовит (единственный жидкий при обычных условиях неметалл). I2 – фиолетовые кристаллы. Для человека смертельная доза 2-3 г йода, но в форме иодид - ионов безвреден. Общая характеристика VII группы 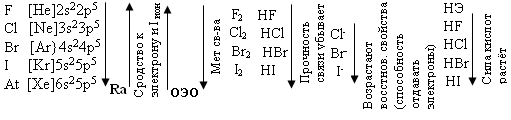 Галоводороды - летучие водородные соединения галогенов, хорошо растворимы в воде, ведут себя в водных растворах как кислоты. Сила кислот (способность к диссоциации на ионы) растёт сверху вниз, т. к. уменьшается прочность связи Н – Э в молекулах от F к At. 2.Особые свойства фтора, как наиболее электроотрицательного элемента Фтор. Из всех галогенов у него наименьший радиус. Относительная электроотрицательность равна 4, это самый электроотрицательный элемент, во всех соединениях имеет степень окисления – 1, остальные галогены от – 1 до + 7. 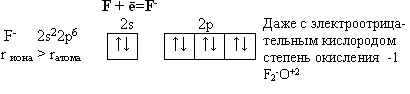 Строение молекулы F2 по МВС 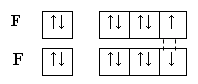  (обменный механизм) Строение молекулы F2 по ММО 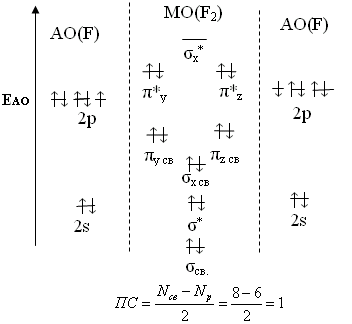 Исключительная химическая активность фтора обусловлена с одной стороны большой прочностью образуемых им связей, так энергия связи H - F 566кДж/моль, с другой стороны низкой энергией связи в молекуле F2 – 151кДж/моль. Большая энергия связей Э – F является следствием значительной электроотрицательности фтора и малого размера его атома. Низкое значение энергии связи в молекуле F2, объясняется сильным отталкиванием электронных пар, находящихся на π- орбиталях, обусловленным малой длинной связи F – F. Благодаря малой энергии связи молекулы фтора легко диссоциируют на атомы и энергия активации реакций с элементарным фтором обычно невелика, поэтому процессы с участием F2 протекают очень быстро. Нахождение в природе F CaF2 - плавиковый шпат Na3[AlF6] – криолит Ca+25(PO4)-33F - фтораппатит Cl NaCl - поваренная (каменная соль) KCl∙NaCl- сильвинит KCl∙MgCl2∙6H2O- карналит Br в нефтяных скважинах I в морской воде Способы получения F2 - только электролизом расплавов солей (в смеси с HF) KF∙HF 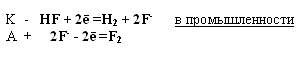 Электроды из Ni, либо сплавов Ni с Fe, Mn, Cu, т. к. F2 очень активен и реагирует почти со всеми элементами. Ni устойчив в атмосфере фтора за счёт образования плёнки NiF2. Поэтому F2 хранят в баллонах, выполненных на основе сплавов никеля. CoF3 = CoF2 + ½F2 в лаборатории разложением фторидов. Сl2 в лаборатории действием сильных окислителей на соляную кислоту 2KMnO4 + 16HCl → 5Cl2 + 2MnCl2 + 2KCl + 8H2O (при обычной температуре) MnO2 + 4HCl → Cl2 + MnCl2 + 2H2O PbO2 + 4HCl → PbCl2 + Cl2 + 2H2O 2AuCl3 → 2Au + 3Cl2 Промышленный способ – электролиз водных растворов поваренной соли NaCl электролиз 2NaCl + 2H2O → H2 + Cl2 + 2NaOH K ( - ) 2H2O + 2ē = H2 + 2ОH- А ( + ) 2Cl- - 2ē = Cl2 Br2 и I2 получаются реакциями замещения 2KBr + Cl2 → 2KCl + Br2 NaЭ + MnO2 + H2SO4 → Э2 +MnSO4 + Na2SO4 + H2O (Э=Br2 ,I2) NaI + NaNO3 + H2SO4 → I2 + NO2 + Na2SO4 Химические свойства галогенов Стандартная энтальпия диссоциации ∆Н > 0 (энергия поглощается) Э2(г) = 2Э(г) Первое сродство к электрону галогена X(г) + ē = X-(г) ∆Н<0 (энергия выделяется). Энергия выделяется при образовании галогенида M+(г) + X-(г) →MX(тв) Фтор реагирует со взрывом со всеми металлами и неметаллами, кроме O2, N2, Гal2 при этом во всех соединениях с фтором элементы имеет высшую степень окисления. Например: SiO2 + 2F2 = Si+4F4 + O2 (во фторе горит SiO2, H2O) t = 0º – 90º Н2O + F2 = Н+F + O+2F2 (H2O + F2=HF + O2 (O3) 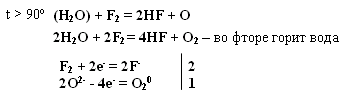 2 Au + 3F2 = 2AuF3 5P + 5F2 = 2PF5 2NH3 + 3F2 = 6HF + N2 F2 + NaOHP → NaF + OF2 + H2O 2F2 + 4NaOHК → 4NaF + O2 + 2H2O (O3) F2 + Xe → XeF4 В ряду Cl2, Br2, I2 окислительная активность падает, а восстановительная активность увеличивается, поэтому, если протекает реакция, Cl2 + I2 + H2O→HCl + HIO3 ок. восст хлор выступает в роли окислителя. 1) Галогены реагируют с неметаллами, образовывая галогениды: 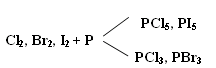 2) С металлами, которые приобретают высшую степень окисления: 2Fe + 3Cl2 → 2FeCl3 3) реагируют с H2, только Br2 и Cl2 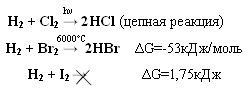 4)Cl2 и Br2 реагируют с H2Oобразуя хлорную и бромную воду, а с I2 реакция практически не протекает Гal2 + H2O→HГal + HГalO 5) Гal взаимодействует с растворами щёлочей, продукты зависят от температуры Cl2 +NaOH → NaCl + NaClO + H2O t >70ºC 3Cl2 + 6NaOH → 5NaCl + NaClO3 + 2H2O с I2 один продукт, NaIO3, а NaIO – не образуется. I2 + NaOH → NaI + NaIO3 + H2O В ряду Cl2 – Br2 – I2 – металлические свойства усиливаются, что связано с увеличением размера атома. Поэтому I2 реагируя с концентрированной HNO3, образует катион I+, или присутствует в кислотном остатке в виде IO3-. I2 + AgNO3 → AgI + INO3 I2 + HNO3 конц.→ HIO3 + NO2 + H2O IСlO4 – перхлорат йода, йод в катионной форме неустойчив  Водные растворы HГаl – кислоты, сила кислот ↓ увеличивается.
HF H2 + F2 – не получается из-за высокой Q 1)СaF2 + H2SO4 → CaSO4↓ + 2HF↑ t летуча 2)KHF2 → KF + HF hν HCl 1) H2 + Cl2 → 2HCl 2) NaClк + H2SO4 конц. → NaHSO4 + HCl↑ 3) BCl3 + H2O → H3BO3 + HCl↑ 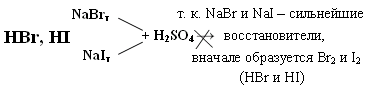 Протекает ОВР NaBr + H2SO4 → Br2 + SO2 + Na2SO4 + H2O NaI + H2SO4 → I2 + S + Na2SO4 + H2O (H2S) Поэтому HBr и HI получают гидролизом галогенидов фосфора. PBr5 + 4H2O → H3PO4 + 5HBr- PBr3 + H2O → HBr↑+ H3PO3- PI3 + 3H2O → H3PO3 + 3HI Безводный HF неэлектролит, а в жидком HF возможны процессы ионизации. 2HF → H+ + HF2- 3HF → HF2- + H2F+ Жидкий HF образует целые цепочки, состоящие из молекул HF- (6,8) (HF)4, (HF)6, (HF)8, только при t = 3500ºС возможен разрыв связи H – F. Вследствие наличия сильной водородной связи даже в парах молекулы HF ассоциированы. HF может смешиваться с Н2О в неограниченном количестве, образуя слабую плавиковую кислоту, при этом между молекулами HF и Н2О также возникают водородные связи. 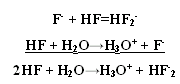 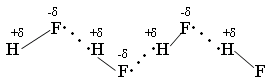 HF хранят в сосудах из платины или полиэтилена. В стеклянном сосуде хранить нельзя т. к. в стекле есть SiO2, а плавиковая кислота разрушает стекло. SiO2 + 4HF = SiF4 + 2H2O – реакция травления стекла SiF4 + 2HF = H2[SiF6] Для HF характерны обычные свойства кислот Zn + 2HF = ZnF2 +H2 3HF + Al(OH)3 = AlF3 +3H2O HF + KOH = KHF2 + H2O NH3 +2HF = NH4HF2 Фториды – в основном нерастворимые соединения. Как и другие бинарные соединения они бывают: Основные - галогениды металлов. Амфотерные - с амфотерными элементами. Кислотные - с неметаллами. 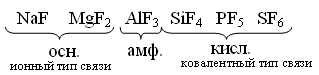 2KF +SiF4 → K2[SiF6] 3NaF + AlF3 → Na3[AlF6] 2KF + BeF2→ K2[BeF4] O K O K 3SiF4 + 2AlF3 → Al2[SiF6]3 K O 2KI + HgI 2→ K2[HgI4] KBr + AlBr3 → K[AlBr4] К О Для элементов 2-го периода К.ч. = 4 3-го периода К.ч. = 6 Основные фториды гидролизуются, только растворимые в воде: 2NaF + H2O → NaHF2 + NaOH Кислотные гидролизуются с образованием 2-х кислот: 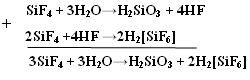 Свойства НCl, НBr, НI Водные растворы – сильные кислоты, галогениды – сильные восстановители: t 2HCl- + O2 ↔ 2H2O-2 + Cl20 процесс Дикона при t < 6000С окислитель - кислород, при высоких – хлор, поэтому процесс может протекать в прямом и обратном направлениях. HI- + O2 → HI+5O3 +H2O Восстановительные свойства НГаl проявляются в реакциях с кислотами: HBr + H2SO4 к. → Br2 + S +H2O |
