лекции микробы. Курс лекций по учебному материалу V семестра специальная микробиология. Вирусология. Одесса2012 Лекция 11
 Скачать 3.28 Mb. Скачать 3.28 Mb.
|
Рис. 4. Иммунологический профиль гепатита СГепатит типа E. (Энтерально передающийся NANB или эпидемический NANB гепатит) Вирусы Гепатита A и B составляют меньше половины случаев острых вирусных гепатитов в большинстве развивающихся стран. Большая часть NANB гепатита в этих регионах передается энтерально через фекальное загрязнение питьевой воды (отсюда название – энтерально передающийся ни А ни В гепатит, или гепатит Е). Он часто проявляется в виде эпидемий (следовательно также называется эпидемический гепатит NANB). Самая большая эпидемия произошла в Дели зимой 1955-56, поразив более чем 30 000 человек в течение шести недель. Разные по величине вспышки и спорадические заболевания наблюдались во многих частях Индийского субконтинента, Центральной и Юго-восточной Азии, Северной Африки и Центральной Америки. Гепатит Е не отмечался в Западных странах кроме случаев завоза из эндемических областей. В Индии, HEV ответствен за большинство эпидемических и спорадических случаев гепатита у взрослых. Гепатит типа Е раньше принимался за гепатит A из-за их клинического и эпидемиологического подобия. Он был признан в качестве самостоятельной нозологической формы при отсутствии серологических и вирусологических доказательств HAV инфекции. Причина инфекции - фекальное загрязнение питьевой воды и окружающей среды. Вторичное распространение путем бытового контакта при гепатите типа E незначительно, 2-3 процента против 10-20 процентов при гепатите А. Инкубационный период 2-9 недель, в среднем - шесть недель. Большинство случаев относится к лицам молодого и среднего возраста (15 – 40 лет). Заболевание чаще всего умеренное и самоизлечивающееся, летальность составляет примерно 1 %. Отличительная особенность – тяжелое клиническое течение и высокая летальность (20-40 процентов) у беременных женщин, особенно в последнем триместре беременности. HEV - сферический безоболочечный вирус, диаметром 32 - 34 нм, с односпиральной РНК. На поверхности вириона обнаруживаются углубления и шипы. Вирус чрезвычайно лабилен. По морфологии и физическим характеристикам он похож на калицивирусы. HEV можно выявить ИЭМ в желчи и кале больных в инкубационном периоде или острой фазе болезни. Вирусоносительство не наблюдается. Культивирование in vitro пока малоуспешно. Вирусный геном был клонирован. Имеются тест-наборы для IgG и IgM антител в ИФА, использующие рекомбинантные и синтетические пептидные антигены. Вирус гепатита F Некоторые люди, получающие кровь и препараты крови, свободные от HBV и HCV заболевают гепатитом. Было предложено назвать предполагаемого возбудителя вирусом гепатита F. Вирус гепатита G Название «вирус гепатита G» было предложено для агента, ответственного за синцитиальный гигантоклеточный гепатит. При этом заболевании часты хронический гепатит и печеночная недостаточность. Электронномикроскопические и серологические исследования указывают, что возбудителем может быть парамиксовирус, родственный вирусу кори (таблица 1). 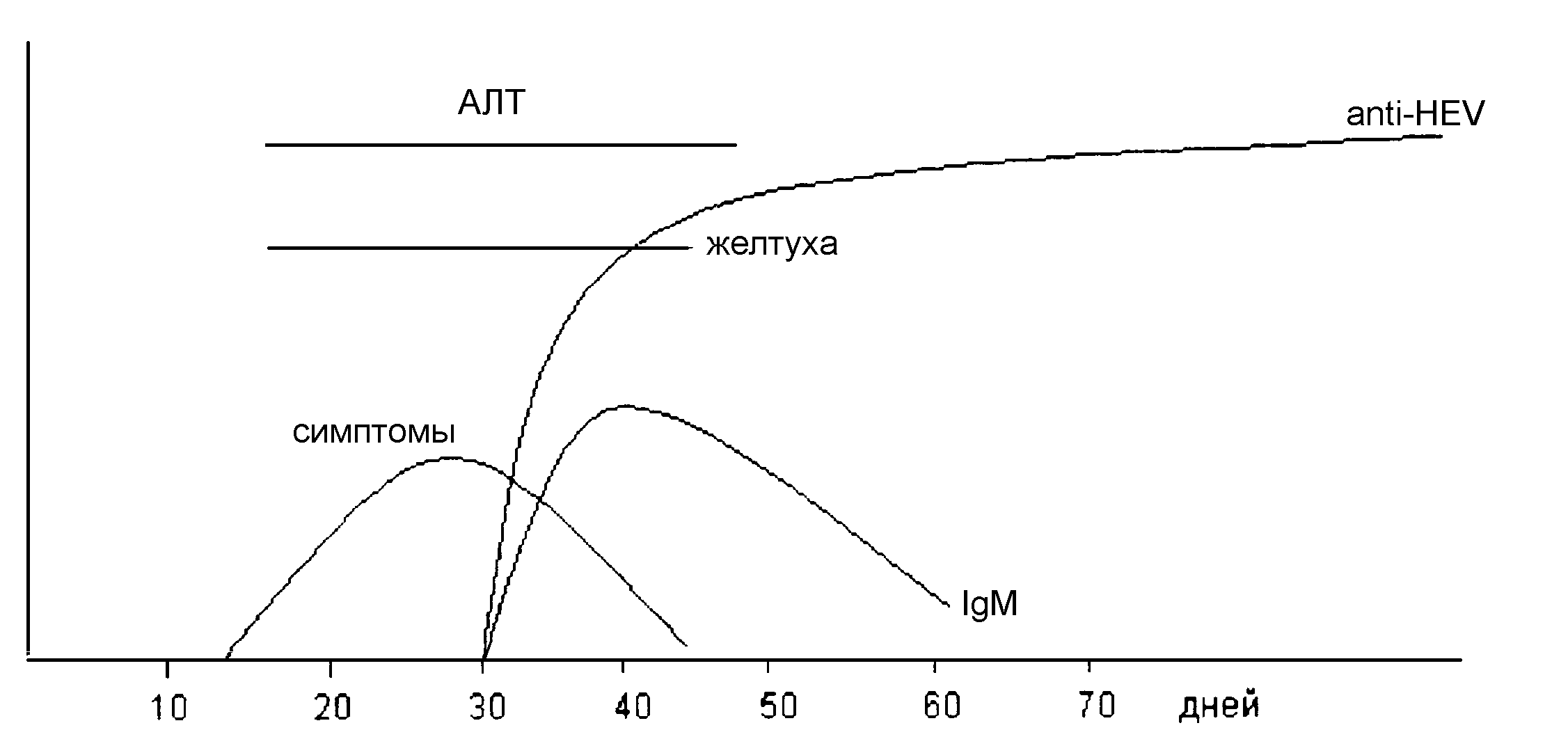 Рис. 5. Иммунологический профиль гепатита Е 5. Онкогенные Вирусы Впервые вирусы связали со злокачественными новообразованиями в своих наблюдениях Эллерман и Банг (1908), которые отметили, что способ передачи лейкемии у домашней птицы напоминает таковой при инфекционной болезни. Раус (1911) показал, что солидная злокачественная опухоль, куриная саркома вызывается вирусом; за это открытие он был запоздало удостоен Нобелевской премии в 1966. Вирусы, вызывающие опухоли у млекопитающих были впервые обнаружены Шоупом, который выделил вирус фибромы кролика в 1932 и вирус папилломы в 1933. Хотя папиллома является доброкачественной опухолью, она может малигнизироваться. Биттнер (1936) предположил, что рак молочной железы у мышей может быть вызван вирусом, передаваемым от матери потомству через грудное молоко. В течение 1950-ых годов было выявлено большое количество вирусов, вызывающих лейкемию у грызунов. Большой интерес был вызван открытием Стюарт и Эдди (1957) вируса полиомы, который при введении новорожденным грызунам мог вызывать развитие большого количество разнообразных опухолей. Трентином (1962) было показано, что введение некоторых типов аденовирусов человека новорожденным хомякам вызывало развитие сарком. Бёркит (1963) выявил специфическое географическое распространение лимфом у африканских детей и предположил, что они могут быть вызваны вирусом, передающимся насекомыми. Выделенный из лимфомы Бёркита вирус Эпштейна-Барр было предложено считать этиологическим агентом лимфомы Бёркита. Много вирусов было выделено из человеческих опухолей или обнаруживалось электромикроскопически в пораженных клетках и тканях, но большинство из них были только «вирусами-пассажирами». присутствующими в поражениях, а не вызывающими их агентами. Вирусы, которые вызывают опухоли у своих естественных хозяев или у подопытных животных, или же стимулируют злокачественное преобразование в культуре клеток, известны как онкогенные вирусы. Трансформация представляет собой различные изменения, которые сопровождают преобразование нормальной клетки в злокачественную. Трансформация из нормальных в злокачественные клетки является многостадийным процессом, и может быть частичной или полной. Например, некоторые вирусные агенты могут превращать инфицированные клетки в «неумирающие», так что они становятся способными к непрерывному размножению в культуре, без приобретения других особенностей злокачественного развития. Таблица 3. ОНКОГЕННЫЕ ВИРУСЫ
Преобразованные клетки изменены по форме и теряют способность к «контактному торможению» так что вместо роста одним слоем, они растут скоплениями, одна над другой, формируя «микроопухоли». Участки трансформации могут быть легко выявлены и используются при исследовании онкогенных вирусов, таких как вирус саркомы Рауса. Около четверти из приблизительно 600 вирусов животных обладают онкогеным потенциалом (Таблица 1). Вирусы, связанные с раковыми образованиями людей описаны в Таблице 2. Среди онкогенных вирусов есть и РНК- и ДНК-содержащие. В то время как все онкогенные РНК-содержащие вирусы (которые раньше назывались онкорнавирусы) принадлежат к единственному семейству (Ретровирусы), онкогенные вирусы встречаются среди всех основных групп ДНК-содержащих вирусов, кроме парвовирусов. Ретровирусы ответственны за естественно возникающую лейкемию и саркому у нескольких видов животных. Среди ДНК-содержащих вирусов, некоторые герпесвирусы вызывают злокачественные опухоли у их естественных хозяев. Ретровирусы. Ретровирусы - оболочечные, сферические вирусы, которые выходят почкованием через клеточную мембрану хозяина. Они имеют приблизительно 100 нм в диаметре. Геном состоит из двух идентичных линейных односпиральных молекул РНК. Икосаэдральный нуклеокапсид содержит спиральный рибонуклеопротеид и окружен оболочкой состоящей из гликопротеидов и липидов. Характерная особенность ретровирусов - присутствие в вирионе необычного фермента - РНК зависимой ДНК полимеразы или обратной транскриптазы (отсюда имя retro, означающее обратно). В отличие от классической транскрипции генетической информации от ДНК на РНК, фермент обратная транскриптаза готовит ДНК-копию РНК-генома ретровируса - первоначально РНК-ДНК гибрид, а затем его двухспиральную ДНК-форму. Двухспиральная ДНК-форма ретровирусного генома, называемая провирусом, интегрирует в ДНК инфицированной клетки-хозяина. Именно от провируса транслируются все ретровирусные белки. Заражение онкогенным ретровирусом не ведет к цитолизу или гибели инфицированных клеток, но провирус остается интегрированным в ДНК клетки-хозяина до конца жизни клетки и воспроизводится вместе с клеточным геномом при размножении клеток. В то время как все онкогенные РНК-содержащие вирусы принадлежат семейству Retroviridae, не все ретровирусы онкогенны. Семейство Retroviridae классифицируется на три подсемейства. 1. Oncovirinae включает все онкогенные РНК содержащие вирусы (прежде называемое онкорнавирус). 2. Spumavirinae содержит неонкогенные «пенистые вирусы» (spuma = пена) вызывающие бессимптомные инфекции у нескольких видов животных и представляющие собой загрязняющие примеси первичных культур клеток, в которых они вызывают пенистое перерождение. 3. Lentivirinae включает как вирусы вызывающие «замедленные инфекции» (lentus = медленно) у животных, так и вирусы человеческих и животных иммунодефицитов. Ретровирусы широко распространены; их находят почти у всех позвоночных, включая животных, птиц и рептилий. Основываясь на круге хозяев и типах вызываемых болезней, онкогенные Ретровирусы можно разделить на следующие группы: 1. Вирусы лейкозно-саркоматозного комплекса птиц. Группа антигенно родственных вирусов, которые вызывают Avian лейкозы (вирусы лимфоматоза, миелобластоза и эритробластоза) или саркому у домашних птиц (вирус саркомы Рауса, ВСР). 2. Вирусы мышиных лейкозов. Эта группа состоит из нескольких штаммов вирусов мышиной лейкемии и вирусов саркомы, названных по имени исследователи впервые описавших их (например Гросс, Френд, Молони, Раушер). 3. Вирус опухоли молочной железы мышей. Этот вирус имеется в некоторых линиях мышей, у которых часто встречается рак молочной железы. Он известен как «молочный фактор» или «вирус Биттнера». Он размножается в молочной железе и передается от матери потомству через грудное молоко. Мыши могут быть заражены через рот, через подкожную или внутрибрюшинную инъекцию. Рак молочной железы развивается только у мышей восприимчивых линий после латентного периода в 6-12 месяцев. 4. Вирусы лейкозов и сарком других животных. Большое количество вирусов было выделено из лейкозов и сарком различных видов животных - кошек, хомяков, крыс, морских свинок и обезьян. 5. Т-лимфотропные вирусы человека (HTLV). Ретровирусы, названные «человеческие Т-лимфотропные вирусы» были выделены в 1980 из культур клеток от взрослых больных кожной T-клеточной лимфомой (грибковый микоз) и лейкемией (синдром Сезара) в США. Подобные вирусы были выделены от больных Т-клеточной лейкемией в Японии и Карибском бассейне. HTLV 1-го типа имеются во всем мире, но распространенность заболеваний ограничена эндемичными областями. Помимо Т-клеточной лейкемии, HTLV-I также связан с тропическим спастическим парапарезом, демиелинирующей болезнью. Вирус в основном инфицирует T4 (CD4) клетки. На инфицированных T-клетках обнаруживается большое количество рецепторов к ИЛ-2. Близко родственные HTLV-II также связаны с T-клеточными злокачественными новообразованиями. Известно, что HTLV-инфекция передается при переливании крови и другими способами введения лейкоцитов. Видовая специфичность. Ретровирусы обычно поражают только один вид хозяина, специфика обусловлена главным образом присутствием вирусных рецепторов на поверхности клетки-хозяина. В зависимости от их способности расти в клетках другого вида, ретровирусы делятся на 1) экотропные (размножаются только в клетках естественного хозяина); 2) амфитропные (размножаются в клетках естественного и чужих видов); и 3) ксенотропные (размножаются только в клетках чужих видов, но не в клетках естественных хозяев). Передача вирусов. Возможны два типа передачи ретровирусов. Экзогенные ретровирусы распространяются горизонтально. Большинство онкогенных ретровирусов являются экзогенными. Эндогенные ретровирусы передаются вертикально от родителей потомству провирусом, интегированным в геном половых клеток. Эндогенный ретровирусный провирус ведет себя как клеточный ген и подчинен регулирующему влиянию клетки-хозяина. Эндогенные ретровирусы обычно «молчащие», не трансформируют клетки и не вызывают какое-либо заболевание. Они могут быть обнаружены либо из-за «активации» после воздействия радиации или химикатов, или методом гибридизации нуклеиновой кислоты. Резистентность. Ретровирусы неустойчивы, инактивируются при 56 оС в течение 30 минут, слабыми кислотами, эфиром и формалином. Они устойчивы при – 30о С Морфология. Ретровирусы существуют в виде четырех морфологических типов. Частицы типа А существуют только внутри клеток. Они имеют 60-90 нм в диаметре и содержат кольцевидный нуклеоид, окруженный мембраной. Они могут являться формой предшественника других типов. Типы B, C и D являются внеклеточными. Диаметр В частицы – 100-130 nm, с эксцентрическим нуклеоидом и несут поверхностные шипики. Частицы С типа имеют центральный нуклеоид и гладкую поверхностную мембрану. Частицы D типа еще не охарактеризованы. Они имеют эксцентрический нуклеоид и несут короткие поверхностные шипики. Большинство ретровирусов – частицы С типа. Вирус рака молочных железы мыши - частица типа B, а вирус рака молочной железы обезьян Мэзон-Пфайзера - частица типа D. Антигены. Имеется два типа антигенов – типоспецифические гликопротеидные антигены, расположенные на оболочке, и группо-специфические нуклеопротеидные антигены, расположенные в ядре вириона. Перекрестные реакции между поверхностными антигенами ретровирусов от различных видов хозяев не наблюдаются. Геномная структура. Ретровирусы имеют относительно простую геномную структуру. Провирус стандартного ретровируса (такого как недефектный вирус лейкоза птиц или мышей) состоит из трех генов, требуемых для вирусной репликации - gag, pol, и env. Ген gag кодирует белки нуклеокапсида, которые являются группоспецифическими антигенами, ген pol кодирует РНК-зависимую ДНК-полимеразу, ген env кодирует гликопротеиды оболочки. С обоих концов провируса имеется длинный концевой повтор (LTR), непосредственно связывающийся с ДНК клетки-хозяина. LTR-участки обеспечивают контроль регуляции функции генов провируса. Некоторые ретровирусы (трансрегулирующие вирусы) типа HTLV или HIV несут четвертый ген tat после env гена. Это – трансактивирующий ген, который регулирует функцию вирусных генов. Стандартные онкогенные ретровирусы типа вирусов хронической лейкемии является медленными трансформирующими вирусами, то есть они имеют низкий онкогенный потенциал и стимулируют злокачественное преобразование вообще только клеток крови после длительного латентного периода. Они не трансформирует культивируемые клетки. Они способны к нормальной репликации. Напротив, острые трансформирующие вирусы - высоко онкогенны и вызывают злокачественное развитие после короткого латентного периода в недели или месяцы. Они могут вызывать различные типы сарком, карцином, лейкозов и также трансформировать клетки в культуре. Однако, наиболее сильные трансформирующие вирусы неспособны нормально реплицироваться, потому что они содержат в своем геноме дополнительный ген, вирусный онкоген (V-onc ген) который заменяет некоторых из генов, существенных для репликации вируса. Такие V-onc вирусы могут репродуцироваться только при коинфекции со стандартным помощником ретровируса. Вирус саркомы Рауса, который несет онкоген src (произносится «сарк»), наиболее хорошо изученный среди острых трансформирующих вирусов, отличается способностью реплицироваться, то есть он может нормально реплицироваться, потому что обладает полным комплектом gag, pol, и env генов. Большинство острых трансформирующих вирусов дефектны в отношении репликации. |
