лекции микробы. Курс лекций по учебному материалу V семестра специальная микробиология. Вирусология. Одесса2012 Лекция 11
 Скачать 3.28 Mb. Скачать 3.28 Mb.
|
ДНК-содержащие онкогенные вирусыPapovaviruses Вирусы папилломы могут вызывать развитие доброкачественных опухолей у их естественных хозяев, но некоторых из них (например, condyloma acuminatum у людей, папиллома кролика) могут стать злокачественными. Имеются данные о связи между инфекцией вирусом папилломы человека (ВПЧ), и раком шейки матки, особенно ВПЧ 16 и 18 типов. В перевиваемой клеточной линии HeLa, полученной много десятилетий назад из карциномы шейки матки и широко используемой в различных лабораториях, была найдена ДНК ВПЧ-18. Вообще, инфекционные вирусные частицы не обнаруживаются в опухолях, вызываемых ДНК-содержащими вирусами, но папиллома дикого белохвостого кролика - исключение. Вирус папилломы кролика, или выделенная из нее ДНК, может вызывать папиллому у кроликов после подкожного введения. Вирус полиомы вызывает естественную латентную инфекцию у лабораторных и домашних мышей. Однако, будучи введенным новорожденным мышам или другим грызунам, он вызывает развитие большого количества гистологически различных опухолей. Вирус можно культивировать в фибробластах эмбриона мыши или клетках почки новорожденного хомяка, в которых он вызывает трансформацию. ТАБЛИЦА 4. Вирусы, ассоциирующиеся с раком человека
Обезьяний вирус 40 (ОВ-40) был обнаружен в нормальных по внешнему виду культурах почки обезьяны, используемых для производства полиомиелитной вакцины. Он вызывает бессимптомную инфекцию у обезьян резус и циномольгус, но не оказывает цитопатического действия в культурах клеток этих обезьян. Однако когда жидкость из таких культур вводится в культуры клеток почек, полученных от африканских зеленых обезьян, отмечаются цитопатические изменения с отчетливой цитоплазматической вакуолизацией. Введение новорожденным хомячкам приводит к развитию опухоли. Трансформация вызывается в культивируемых клетках нескольких видов, включая клетки человека. До открытия вируса были использованы миллионы доз полиомиелитной вакцины, приготовленной на культурах клеток почки обезьяны, которые могли содержать ОВ-40. Пошло более 25 лет, но никаких опухолей, связанных с ОВ-40 не было отмечено. Были значительные опасения после обнаружения онкогенного эффекта ОВ-40. Однако нет никаких данных, что введение вакцины, содержащей ОВ-40 вызвало рак у людей. Из организма человека были выделены два вируса, близкие по антигенным и другим свойствам к вирусу ОВ-40: вирус ВК, изолированный из мочи больных, получавших иммунодепрессивную терапию после пересадки почки, и вирус Jc – из мозга человека с прогрессивной многоочаговой лейкоэнцефалопатией. Эти же вирусы выделены от больных с вяло текущими респираторными заболеваниями. У новорожденных хомячков и иммунодепрессивных обезьян эти вирусы вызывают опухоли. Серологическое обследование здорового населения США показало, что около 70 % взрослых людей имеют антитела к вирусам JC и BK. Онкогенность их для человека невыяснена. Паповавирусы BK и JC, вызывающие широко распространенную бессимптомную человеческую инфекцию, могут вызывать опухолеобразование у иммунодефицитных индивидуумов. Паповавиурсы широко распространены среди людей, часто существуют в латентном состоянии. Инфицированию способствует высокая устойчивость паповавирусов во внешней среде. PoxvirusТри представителя группы поксвирусов вызывают развитие доброкачественных опухолей - вирус фибромы кролика, вирус контагиозного моллюска и Яба вирус. Последний вызывает развитие естественно возникающих доброкачественных гистиоцитом у обезьян. Очевидно он передается насекомыми. Подобные опухоли могут быть вызваны экспериментально у многих видов приматов, включая людей. Опухоли спонтанно регрессируют через несколько недель. Другие животные, не относящиеся к приматам, нечувствительны. Аденовирусы. Хотя некоторые типы (12, 19, 21) аденовирусов человека могут вызывать развитие сарком у новорожденных грызунов после экспериментальной прививки, не установлена их связь с опухолями человека. Герпесвирусы. Многие герпесвирусы ассоциируются с естественными опухолями животных и людей. Болезнь Марека: болезнь Марека - это инфекционный нейролимфоматоз цыплят с высокой летальностью. Из пораженных тканей нельзя выделить или обнаружить под электронным микроскопом какие-либо инфекционные частицы. Однако больные птицы выделяют большое количество вируса из фолликулов их перьев. Вирус - типичный герпесвирус. Болезнь Марека может быть вызвана введением вируса молодым цыплятам. Вирус хорошо развивается в фибробластах куриного эмбриона, вызывая цитопатические изменения, но без всяких признаков трансформации. Болезнь Марека может быть предотвращена живой авирулентной вакциной. Это - первый случай злокачественной болезни, контролируемой вирусной вакциной. Опухоль Люке у лягушек: этиологическим агентом аденокарциномы почек лягушек считается герпесвирус. Herpesvirus saimiri. Этот вирус был выделен из культуры клеток почки беличьей обезьяны. Он вызывает летальную лимфому или саркому ретикулярной ткани при введении ночным обезьянам или кроликам. Инфекция Herpesvirus saimiri была предложена в качестве модели для изучения взаимодействий между вирусом Эпштейна-Барра и человеком. Вирус Эпштейна-Барр (ВЭБ. Герпесвирус, называемый вирусом Эпштейна-Барра, регулярно обнаруживается в культивируемых лимфоцитах больных лимфомой Бёркитта. В теле опухолевых клеток вирус не содержится, но линии клеток, полученные от них, почти всегда содержат 5-20 процентов клеток, продуцирующих вирус. Вирус размножается только в человеческих лимфоидных клетках. Серологические исследования показывают, что инфицирование вирусом - повсеместное явление. Инфекция обычно бессимптомная. У молодых лиц, не имеющих антител, инфекция ВЭБ вызывает инфекционный мононуклеоз. Полагают, что лимфома развивается при инфицировании детей, чья иммунная система подавлена, например хронической малярией. Лимфомы связанные с ВЭБ отмечаются у реципиентов трансплантатов. ВЭБ также связан с носоглоточной карциномой у представителей популяции китайских мужчин Южной Азии и Восточной Африки. Вирус простого герпеса и рак шейки матки. Было предложено связать вирус простого герпеса 2-го типа и рак шейки матки, хотя это не столь очевидно, как связь с ВПЧ 16-го и 18-го типов. Также было высказано предположение о связи вируса простого герпеса 1-го типа с раком губы. Цитомегаловирусную инфекцию связывают с раком простаты и саркомой Капоши. Вирус гепатита B. HBV непосредственно или косвенно связан с этиологией гепатоцеллюлярного рака. Исследования во многих странах показали большое преобладание маркеров инфекции ВГВ у пациентов с первичным гепатоцеллюлярным раком по сравнению с контролем или со всей популяцией. Гепатит С также ведет к гепатоцеллюлярному раку. ОНКОГЕНЫВирусные онкогены (V-onc), обычно известные как раковые гены являются генами, которые кодируют белки, вызывающие трансформацию нрмальных клеток в раковые. Онкогены не существенны для репликации вируса, и мутанты, испытывающие их недостаток, реплицируются нормально, не являясь онкогенными. Гены, похожие на вирусные онкогены найдены как в нормальных, так и в раковых клетках. Онкогены, выделенные из раковых клеток называются клеточными онкогенами (C-onc). Подобные гены, обнаруженные в нормальных клетках называются протоонкогенами. Они не имеют вирусного происхождения. Напротив, вирусные онкогены оказались клеточного происхождения. Клеточные онкогены содержат интроны, характерные для эукариотичных генов, тогда как вирусные онкогены - нет. Очевидно, вирусные онкогены, произошли в прошлом от протоонкогенов путем рекомбинации между ретровирусными и клеточными генами. Протоонкогены широко распространены среди позвоночных и многоклеточных - от людей до мух. Они хорошо сохраняются в их геномах; предполагают что они выполняют некоторые существенные функции в нормальных клетках. Было обнаружено, что они кодируют белки, участвующие в регулировании роста клетки и ее дифференцировании. Предполагаемые функции многих онкогенов были идентифицированы. Например, онкоген src связан с тирозин-специфическими протеинкиназами, sis - с фактором роста, продуцируемым тромбоцитами, myc - с ДНК-связанными белками, все они связаны с регулированием нормального роста клетки. Ценный метод для изучения онкогенов - трансфекция. Определенные линии фибробластов мыши, такие как NIH 3T3, могут воспринимать чужую ДНК, включать ее в геном и проявлять ее. Этот метод передачи гена называется «трансфекция». Этим методом ДНК, извлеченная из человеческих опухолевых клеток, преобразовывала 3T3 клетки, и такие гены преобразования оказались идентичными с клеточными онкогенами. Анти-онкогены. В нормальных клетках человека была идентифицирована категория генов, функцией которых оказалось подавление злокачественной трансформации. Они были названы анти-онкогены, ингибиторы опухоли или гены-супрессоры роста. Их прототип – ген ретинобластомы, потеря которого связана с развитием ретинобластомы у детей. Специфические хромосомальные делеции, связанные с определенными типами опухолей человека могут отражать потерю генов-супрессоров опухоли. Механизмы вирусного онкогенеза. Русский ученый академик Л.А.Зильбер предложил вирусо - генетическую теорию онкогенеза, которая в настоящее время получает все большее подтверждение и дальнейшее развитие. Основные постулаты теории ЗилЬбера: 1.Все известные естественно развивающиеся опухоли животных вызываются вирусами. Поэтому можно предположить, что опухоли человека также имеют вирусную природу. 2. Для вирусного онкогенеза необходима интеграция генома онкогенного вируса в клеточный геном, и это приводит к нарушению регулции размножения клеток и опухолевому росту. 3. Онкогенные виурсы являются пусковым фактором в развитии опухоли. В дальнейшем росте опухоли вирус участия не принимает, может вообще исчезнуть из клетки, или присутствовать в ней в качестве «пассажира". По выражению Л.Зильбера - " Мавр сделал свое дело, мавр может и уйти». Теория предложена в конце 1950-х. С того времени теория обогатилась новыми фактами, подтверждающими ее основные положения. В случае онкогенных ДНК-содержащих вирусов вирусная ДНК (или ее часть) интегрирована с геномом клетки-хозяина. РНК-содержащие вирусы, ретровирусы интегрируют свой геном в форме провируса. Вирусная ДНК, будучи неполной или «дефектной», неспособна обеспечить воспроизводство инфекционных вирусов. Однако под ее влиянием клетка-хозяин подвергается злокачественной трансформации. Трансформированная вирусом раковая клетка во многом аналогична бактерии, пораженной дефектным фагом. В обоих случаях клетка не разрушается, и вирусы не продуцируются. Приобретение новых характеристик трансформированной клеткой походит на лизогенную конверсию у бактерий. Вообще, ретровирусы вызывают развитие опухолей двумя путями - или путем внедрения в клеточный геном нового трансформирующего гена (онкогена) или, стимулируя или изменяя экспрессию существующего клеточного гена. Несколько молекулярных механизмов были предложены для объяснения преобразования доброкачественных протоонкогенов в гены рака. Гены могут сверхэкспрессироваться, и их продукт может вызывать ненормальный рост. Рекомбинация между ретровирусными и клеточными генами, вставка промотора, хромосомная транслокация, амплификация гена и мутация - вот некоторые из генетических процессов, связанных с этим. РЕКОМЕНДОВАННАЯ ЛИТЕРАТУРА 1. Медична мікробіологія, вірусологія та імунологія : підручник для студ. Вищ. Мед. Навч. заклад. / За редакцією В.П.Широбокова/ Видання 2-е. – Винниця : Нова книга, 2011. – 952 с. 2. Протченко П.З. Загальна мікробіологія, вірусологія та імунологія. Вибрані лекції: Навч. посібник . – Одеса: Одес. Держ. мед. ун-т, 2002. – 298 с. 3. Пятк³н К. Д., Кривоше¿н Ю.С. М³кроб³олог³я. - К : Высшая школа, 1992. - 432 с. Тимаков В.Д., Левашев В.С., Борисов Л.Б. Микробиология. - М : Медицина, 1983. - 312 с. 4. Борисов Л.Б., Козьмин-Соколов Б.Н., Фрейдлин И.С. Руководство к лабораторным занятиям по медицинской микробиологии, вирусологии и иммунологии / под ред. Борисова Л.Б. – Г. : Медицина, 1993. – 232 с. 5 Медицинская микробиология, вирусология и иммунология: Учебник под ред. А.А.Воробьева. – М.: Медицинское информационное агентство, 2004. - 691 с. 6. Медицинская микробиология, вирусология, иммунология /ред. Л.Б. Борисов, А.М. Смирнова. - М: Медицина, 1994. - 528 c. 5. Букринская А.Г. Вирусология. – М.:Медицина, 1986. – 336 с. Лекция 25. ВИРУС ИММУНОДЕФИЦИТА ЧЕЛОВЕКА Первые указания на новое заболевание – Синдром Приобретенного Иммунодефицита (СПИДе) появились летом 1979 года, когда поступили сообщения из крупных городов США (Нью-Йорка, Лос-Анджелеса, Сан-Франциско) о внезапном увеличении распространенности у молодых людей, которые были гомосексуалистами или употребляли героин и другие инъекционные наркотики, двух очень редких болезней - саркомы Капоши (ранее регистрировавшейся лишь у пожилых африканцев) и пневмонии, вызванной Pneumocystis carinii (ранее описанной в виде эпидемий в закрытых детских учреждениях). Заболевания проявлялись в потере иммунокомпетентности, что приводило к незащищенности как против трудно поддающихся лечению и фатальных инфекций, вызванных относительно маловирулентными микроорганизмами, так и против злокачественных новообразований в лимфоидной и других системах. О выделении возбудителя вначале сообщили в 1983 г. Люк Монтанье с сотрудниками из Института Пастера. Они изолировали ретровирус от больного из Западной Африки с персистирующей генерализованной лимфаденопатией, которая является проявлением СПИДА, и назвалаи его Lymphadenopathy Associated Virus (LAV). В 1984 г. Роберт Галло и сотрудники из Национального Институтов Здоровья, США, сообщили о выделении от больных СПИДом ретровируса и назвали его «Человеческий T –лимфотропный вирус-III», илиHTLV-III. Ретровирусы HLTV-I и II ранее ранее были описаны в связи с T-клеточной лейкемией человека. HTLV-III можно было культивировать в перевиваемой культуре клеток T-клеточной лейкемии, получая в достаточном количестве антиген для серологических тестов. Серологический анализ и молекулярное клонирование позволили установить общее происхождение этих вирусов, несмотря на различной степени антигенные отличия между этими изолятами, которым дали раньше разные названия. Для разрешения этого номенклатурного недоразумения Международный комитет по номенклатуре вирусов в 1986 г. остановился для этих вирусов на родовом названии Human Immunodeficiency Virus (HIV), или Вирус Иммунодефицита Человека (ВИЧ). В 1984 г. стали доступными первые серологические тесты для обнаружения анти-ВИЧ антител. Это сделало возможным более реальную оценку распространенности ВИЧ инфекции. До этого инфекция могла быть диагностирована только тогда, когда у больных развивались характерные клинические проявления типа оппортунистических инфекций или злокачественных новообразований. Эти случаи заключительных стадий представляли только верхушку айсберга. Серологический скрининг групп высокого риска, доноров и др. показал очень большой и расширяющийся резервуар ВИЧ-инфекции у больных и носителей в различных регионах мира. Было установлено, что в мире каждую минуту инфицируется ВИЧ более трех человек. Прогнозируется, что к 2000 году число ВИЧ-инфицированных людей в мире составит 40 миллионов, а больных СПИДом - 15 миллионов. ВИРУС ИММУНОДЕФИЦИТА человека (ВИЧ) ВИЧ, возбудитель СПИДА, относится к подсемейству Lentivirinae семейства Retroviridae. Подсемейство Lentivirinae (от L. lentus = медленно) включает возбудителей медленных вирусных инфекций висна/мэди овец и др. Помимо ВИЧ в эту группу включены также вирусы иммунодефицита животных. Структура. ВИЧ – оболочечный вирус сферической формы размером 90 -120 нм (рис. 1). Р 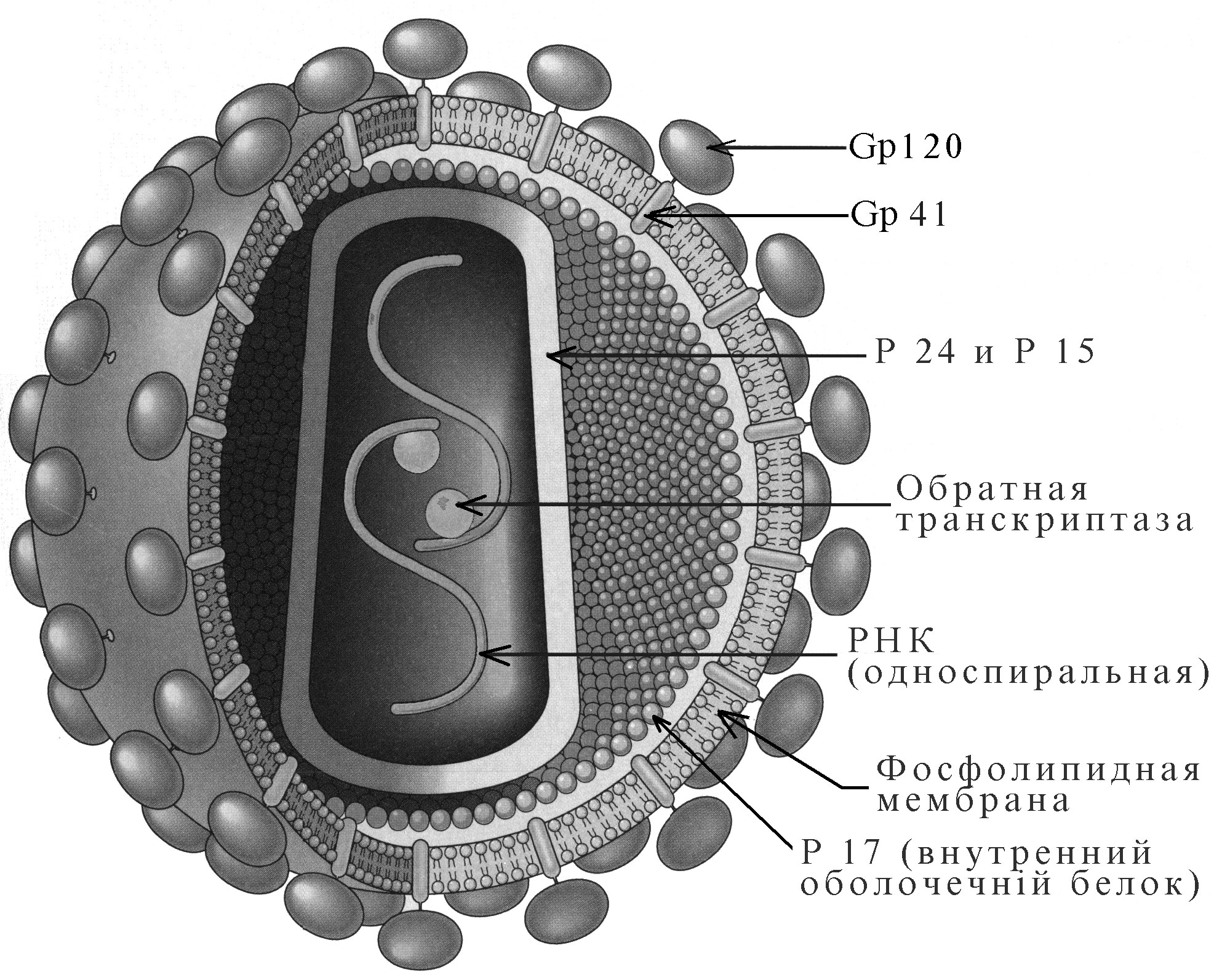 ис. 1. Вирион ВИЧ ис. 1. Вирион ВИЧНуклеокапсид имеет наружную оболочку икосаэдрической формы и внутреннее конусообразное ядро, окружающее рибонуклеопротеид. Геном - диплоидный, состоящий из двух одинаковых спиралей плюс-нитей РНК. В ассоциации с вирусной РНК находится фермент обратная транскриптаза, которая является характерной особенностью ретровирусов. Когда вирус инфицирует клетку, вирусная РНК транскрибируется ферментом сначала в односпиральную ДНК, а затем в двухспиральную ДНК (провирус), которая интегрируется в хромосому клетки - хозяина. Провирус может оставаться в скрытом состоянии в течение длительного времени, хотя это и влияет на функции клетки - хозяина. Время от времени, в ответ на действие факторов, активирующих вирус, провирус индуцирует репликацию вируса путем управления синтезом вирусной РНК и других компонентов вируса. Во время репликации вируса, когда лишенные оболочки отпочковующиеся вирусы проходят через оболочку клетки, они приобретают липопротеидную оболочку, состоящую из липидов оболочки клетки-хозяина и гликопротеидов, кодируемых вирусом. Большинство кодируемых вирусом протеинов в проекции имеют вид поверхностно расположенных кнопкообразных шипов с закрепляющими их трансмембранными ножками. Шипы, являются основным поверхностным компонентом вируса, который связывается с CD4 рецепторами на восприимчивых клетках. Вирусные гены и антигены. Геном ВИЧ содержит три структурных гена (gag, pol и env) характерные для всех ретровирусов, также как и другие неструктурные и регуляторные гены, специфичные для вирусов. Продукты этих генов, структурных и неструктурных, являются антигенами. Сыворотки инфицированных людей содержат антитела к ним. Обнаружение этих антигенов и антител имеет большое значение для диагностики и прогноза ВИЧ-инфекции. A. Кодирующие гены для структурных белков: 1. Ген gag определяет сердцевину и оболочку вируса. Его продуктов является белок-предшественник p55. (Белки и гликопротеиды обозначаются по их молекулярной массе, выраженной в килодальтонах.). Этот белок- предшественник расщепляется на три белка, pl5, pl8 и p24, которые составляют сердцевину вируса и оболочку. Главный сердцевинный антиген - p24 может быть обнаружен в сыворотке в ранней стадии ВИЧ инфекции, прежде, чем появляются антитела. Позднее в течение инфекции исчезновение из кровотока свободных anti-p24 антител указывает на отягощение болезни и служит показанием для активного антивирусного лечения. 2. Ген env определяет синтез гликопротеида оболочки gp l60, который расщепляется на два компонента оболочки - gp l20, который образует поверхностные шипы, и gp 41, являющийся трансмембранным прикрепляющим белком. Гликопротеид шипов gp l20 - главный антиген оболочки, и антитела к gpl20 появляются первыми после инфицирования. 3. pol ген кодирует обратную транскриптазу и другие вирусных ферменты, типа протеазы и эндонуклеазы. Он экспрессируется как белок-предшественник, который расщепляется на белки p31, p51 и p66. B. Неструктурные и регуляторные гены. 1. tat (trans activating gene - транс-активирующий ген) усиливающий экспрессию всех вирусных генов. 2. nef (negative factor gene - ген негативного фактора) подавляющий репликацию вируса. 3. rev (regulator of virus gene - регулятор вирусного гена) увеличивающий синтез структурных белков. 4. vif (viral infectivity factor gene - ген фактора инфекциозности вируса) влияющий на инвазионную способность вирусных частиц. 5. vpu (у ВИЧ-1) и vpx (у ВИЧ-2) вероятно увеличивающие созревание и выход вирусного потомства из клетки. (Обнаружение типоспецифических последовательностей vpu и vpx – существенно для дифференциации инфекции ВИЧ-1 от ВИЧ-2.). 6. vpr – имеются сообщения, что он активирует область промотора вируса. 7. LTR (long terminal repeat) последовательности (длинные концевые повторы), по одному с обоих концов, содержащие последовательности, дающие промотору усиливающие и интегрирующие сигналы. Антигенные варианты и разнообразие ВИЧ. ВИЧ – высоко изменчивый вирус. У него обнаруживаются как частые антигенные изменения, также и изменения других свойств, таких как нуклеотидные последовательности, клеточный тропизм, особенности роста и цитопатологии. Различия наблюдаются не только между изолятами из различных регионов или разных лиц, но и между повторными изолятами от одного и того же человека и даже между изолятами из разных мест одного человека в одно и то же время. Эта большая вариабельность ВИЧ, как полагают, является следствием ошибок, присущих природе обратной транскрипции. Антигенные вариации наиболее часто отмечаются в отношении белков оболочки, но обнаруживаются реже в отношении других антигенов. На основании антигенных различий выделено два типа ВИЧ. Первоначально выделенный ВИЧ и родственные штаммы, распространенные во всем мире, принадлежат ВИЧ типа 1. Штаммы ВИЧ, вначале изолированные в Западной Африке в 1985 г., которые очень слабо или вообще не реагируют с иммунной сывороткой против ВИЧ-1, были названы ВИЧ типа 2. Антигены оболочки двух типов различны, хотя их основные полипептиды обнаруживают некоторую перекрестную реактивность. ВИЧ-2 имеет генетическую идентичность с ВИЧ-1 только на 40 процентов. Он более близко родственен вирусу иммунодефицита обезьян, чем ВИЧ-1. Он, как полагают, намного менее вирулентен, чем ВИЧ-1. Он в большей мере встречается в Западной Африке, хотя имеются сообщения о выделении его из других областей, включая западную и южную Индию. ВИЧ-1 штаммы классифицировались в по крайней мере девять подтипов, основанные на секвенировании их gag и env генов. Эти подтипы обозначены как буквами от A до I. В то время как все известные подтипы обнаруживаются в Африке, только один подтип B был найден в США. Доминирующий подтип в Западной Индии – C, в Таиланде - E. Подтипы, по-видимому, различаются при инфицировании из различных. Подтипы, обычные в Азии и Африке, более часто передаются при гетеросексуальном контакте, чем американские штаммы (подтип B), которые распространяются преимущественно при ведении крови и гомосексуальном контакте (гомосексуальная передача рассматривается в качестве кровяного пути, так как вирус, вероятно, проникает непосредственно в кровь через незначительные разрывы. Некоторые штаммы ВИЧ-1, выделенные недавно в Камеруне, которые выпадают из диапазона подтипов от A до I, были названы подтипом 0 («0» от «outliers» – «выбросы»). Инфекция этими штаммами не обнаруживается тест-системами для ВИЧ-1 и 2. Подтип 0- штаммов в настоящее время ограничен Камеруном, но, хотя есть сообщения о случаях камерунского происхождения из Габона и Франции. Широкое распространение этих штаммов может создавать серьезные проблемы в серодиагностике ВИЧ инфекций. Обычно наблюдаются различия в характеристике роста между ВИЧ, изолированных от бессимптомных носителей и от больных СПИДом. Первые растут медленно и инфицируют только лимфоциты периферической крови, в то время как последние растут быстрее и дают высокие титры на перевиваемых линиях клеток лимфоидного и моноцитоидного происхождения. Различия в штаммах могут объяснять различия в клиническом течении процесса у ВИЧ-инфицированных людей. Устойчивость. ВИЧ термолабилен, инактивируется за 10 мин при 50 C и за секунды при 100 С. При комнатной температуре (20-25 C), в высохшей крови может сохраняться до семи дней. Это устойчив при лиофилизации. В лиофилизированных продуктах крови вирус может быть инактивирован прогреванием при 68 C в течение 72 часов и в жидкой плазме – при 60 C в течение 10 часов ВИЧ инактивируется в течение 10 минут обработкой 50 % этиловым спиртом, 35 % изопропиловым спиртом, 0,5 % лизолом, 0,5 % параформальдегидом, 0,3 % перекисью водорода или 10 % бытовых отбеливающих веществ (например – хлорной извести). Он также инактивируется при крайних значениях рН (1,0 и 13,0). Отбеливающие порошки или хлорная известь эффективны для обеззараживания поверхностей. Для обработки зараженных медицинских инструментов применяется 2 % раствор глутаральдегида. Патогенез. Рецептор для вируса - антиген CD4, и поэтому вирус может инфицировать любую клетку, несущую на поверхности антиген CD4. Это - прежде всего T4 (хелпер/индуктор) лимфоцит. Некоторые другие иммунные клетки также обладают CD4 антигеном на поверхности и также восприимчивы к инфекции. Таким образом, восприимчиво приблизительно 5 - 10 процентов B лимфоцитов и 10 -20 процентов моноцитов и макрофагов, включая специализированные макрофаги типа альвеолярных макрофагов в легких и клетки Лангерганса кожи. Также доказана инфицированность глиальных клеток и микроглии в центральной нервной системе. Фолликулярные дендритные клетки миндалин могут инфицироваться ВИЧ без участия CD4. Специфическое прикрепление вируса к CD4 осуществляется гликопротеидом оболочки gp 120. Однако, для инфекции существенно слияние. Это обеспечивается трансмембранным gp 41. Инфекция передается, когда вирус поступает в кровь или ткани человека и входит в контакт с подходящей клеткой - хозяином, преимущественно T4 лимфоцитом. Инфекция, вероятно, более часто развивается после введения клеток, инфицированных ВИЧ (при переливании крови или половом контакте), чем свободного от клеток вируса (как при введении продуктов крови). Двухспиральная ДНК - транскрипт вирусной ДНК интегрируется в геном инфицированной клетки, вызывая латентную инфекцию. Время от времени индуцируется литическая инфекция с выходом вирусного потомства, которые инфицируют другие клетки. Длительный и меняющийся инкубационный период при ВИЧ инфекции связан с латентностью. От инфицированного человека ВИЧ может быть выделен из крови, лимфоцитов, освобожденной от клеток плазмы, спермы, цервикального секрета, слюны, слез, мочи и грудного молока. Самый ранний патогенетический механизм при ВИЧ инфекции – повреждение T4 лимфоцитов. T4 клетки уменьшаются в количестве и соотношение T4 : T8 (хелперы : супрессоры) изменяется. Вирусная инфекция может подавлять функцию инфицированных клеток без структурных повреждений. Инфицированные T4 клетки не выделяют нормального количества интерлейкина-2, гамма-интерферона и других лимфокинов. Это приводит к выраженному эффекту подавления клеточного иммунного ответа. основоХотя поражается в основном клеточный иммунитет, повреждается также целый ряд других механизмов. Активность Т хелперов существенна для оптимальной функции B клетки, особенно в ответе на тимусзависимые антигены. Больные СПИДом неспособны давать ответ на новые антигены. Важная особенность ВИЧ инфекции – поликлональная активация B лимфоцитов, приводящая к гипергаммаглобулинемии. Увеличивается содержание иммуноглобулинов всех классов, но особенно повышается уровень IgG и IgA. У младенцев и детей повышается уровень IgM. Гипериммуноглобулинемия в большей мере мешает, чем помогает, так как это главным образом «бесполезный иммуноглобулин» это составлено главным образом «бесполезный иммуноглобулин» к ненужным антигенам, а также аутоантитела. Это может также быть причиной иммунокомплексных аллергических реакций (гиперчувствительность III типа). Функция моноцитов-макрофагов также нарушается, очевидно, из-за недостатка секреции T4 лимфоцитами факторов активации. В результате хемотаксис, презентация антигена и внутриклеточный киллинг моноцитами/макрофагами снижается. Поражается также активность NK клеток и цитотоксических Т-лимфоцитов. Клинические проявления при ВИЧ инфекции обусловлены в первую очередь не вирусными цитопатологическими механизмами, а являются вторичными вследствие недостаточности иммунного ответа. Это делает больного восприимчивым к оппортунистическим инфекциям и злокачественным новообразованиям. Исключением может быть деменция (слабоумие) и другие дегенеративные неврологические поражения обнаруживаемые при СПИДе. Предполагается, что они могут быт следствием прямого поражения ВИЧ на центральную нервную систему. СИНДРОМ ПРИОБРЕТЕННОГО ИММУНОДЕФИЦИТА (СПИД) Клинические особенности ВИЧ инфекции. СПИД - только последняя стадия в широком спектре клинических особенностей ВИЧ инфекции. Естественное развитие ВИЧ инфекции может рассматриваться по следующим стадиям: 1. Острая ВИЧ инфекция.В пределах нескольких недель ВИЧ инфекции примерно у 10-15 процентов лиц наблюдается невысокая температура, недомогание, головная боль, лимфаденопатия, иногда с высыпаниями и артропатия, напоминающие инфекционный мононуклеоз. Редко, может наблюдаться острая энцефалопатия. Спонтанное разрешение происходит в течение нескольких недель. В начале болезни тесты на антитела к ВИЧ обычно отрицательны, но становятся позитивными в течении заболевания. Поэтому этот синдром был назван «болезнь сероконверсии», хотя у большинства ВИЧ-инфицированных сероконверсия происходит без каких-либо видимых проявлений болезни. В начале этой фазы может наблюдаться антигенемия ВИЧ (антиген p24). Патогенез болезни сероконверсии, как полагают, обусловлен иммунными комплеками, а также прямым эффектом вирусной репродукции. 2. Бессимптомная инфекция. Все лица, инфицированные ВИЧ, испытывают ли они болезнь сероконверсии или нет, проходят через фазу бессимптомного течения инфекции на протяжении нескольких месяцев или лет. У них выявляются положительные тесты на ВИЧ антитела в течение этой фазы и они заразны. У некоторых инфекция может дальше не прогрессировать, в то время как у других это может приводить к полному развитию СПИДа, или непосредственно, или через цитопению, малые оппортунистические инфекции, персистирующую генерализованную лимфаденопатию или СПИД-ассоциированный комплекс (ARC), как описано ниже. 3. Персистентная генерализованная лимфаденопатия (ПГЛ): Определяется по наличию увеличенных, по крайней мере до 1,0 см в диаметре, лимфатических узлов в двух или более несмежных эктраингвинальных участках, которые сохраняются по крайней мере три месяца, в отсутствии какого-либо заболевания или лечения, которое может вызывать лимфаденопатию. Это состояние само по себе может быть неопасным, но в части случаев прогрессирует в СПИД-ассоциированный комплекс или в СПИД. 4. СПИД–ассоциированный комплекс (ARC). Эта группа включает больных со значительным иммунодефицитом, страдающих от различных органических симптомов, свидетельствующих о генерализации процесса или наличии малых оппортунистических инфекций. Типичные симптомы, свидетельствующий о генерализации процесса - утомляемость, необъяснимая лихорадка, постоянный понос и обнаруженная потеря более 10 процентов веса тела. Обычные оппортунистические инфекции – кандидоз полости рта, опоясывающий герпес, сальмонеллез или туберкулез. Обычно имеются генерализованная лимфаденопатия и спленомегалия. Больные СПИД-ассоциированным комплексом тяжело болеют и большинство из них через несколько месяцев прогрессируют к СПИДу. 5. СПИД. Это – конечная стадия болезни, представляющая необратимое нарушение механизмов иммунной защиты, делающее больного беззащитным к развивающимся оппортунистическим инфекциям и злокачественным новообразованиям. Клиническая тяжесть СПИДА варьирует от существующего типа инфекции или опухолевого процесса. При раннем СПИДе, большинство пациентов больны только в случае инфекции, которая может поддаваться терапии. Между эпизодами инфекции они могут чувствовать себя относительно хорошо и вести нормальную жизнь. Больные с саркомой Капоши страдают меньше, чем пациенты с другими злокачественными новообразованиями. Болезнь прогрессирует непреклонно и через месяцы или годы наступает смерть. В соответствии с классификацией наиболее тяжелые больные предъявляют различные жалобы, некоторые из которых следующие: a. Самое частое – возрастающий сухой кашель, одышка и лихорадка. В США и других западных странах характерным возбудителем первоначально был P.carinii, но в настоящее время более часто это M.tuberculosis или атипичные микобактерии типа M. avium-intracellulare. В развивающихся странах наиболее важным возбудителем является M.tuberculosis, большинство штаммов которого обладают множественной лекарственной устойчивостью. Фактически неблагополучные нации стоят перед двойной эпидемией, ассоциацией ВИЧ и туберкулеза. Пневмония может быть вирусной (ЦМВ) или грибковой (криптококк, гистоплазма). Рецидивирующая пневмония рассматривается как свидетельство СПИДа. b. Гастро-интестинальная система. При СПИДе ротовая полость часто поражается кандидозным стоматитом, герпетическим стоматитом, гингивитом, саркомой Капоши. Затрудненное глотание может быть из-за желудочного кандидоза. Характерный кишечный патогенный микроорганизм при СПИДЕ – криптоспоридии. Кишечные инфекции также часто вызываются сальмонеллами, микобактериями, ЦМВ или аденовирусами. Может наблюдаться системный стронгилоидоз. Для мужчин-гомосексуалистов характерен хронический колит («синдром прямой кишки геев»), при котором выявляются амебы, лямблии и вызывающие диарею бактерии хозяина. c. Центральная нервная система. Типичные оппортунистические инфекции ЦНС - токсоплазмоз и криптококкоз. Наблюдаются также инфекции ЦМВ, вирусом простого герпеса, паповавирусами, микобактериями, паспергиллами и кандидами. Часты лимфомы центральной нервной системы общие. d. Злокачественные новообразования. Саркома Капоши - характерное поражение у мужских гомосексуалистов. Это – безболезненная многоочаговая неместазирующая опухоль слизистых оболочек или кожи, вероятно эндотелиального происхождения. Другие обычно отмечаемые опухоли – лимфомы лимфогранулематозного (болезнь Ходжкина) и нелимфогранулематозного типа. e. Кожный. Помимо саркомы Капоши, частыми кожными поражениями являются герпес, кандидоз, ксеродерма, себорейный дерматит, пруриго, фолликулит, импетиго и контагиозный моллюск. Определение СПИДА было расширено путем включения всех серопозитивных лиц (независимо от клинических проявлений) с числом CD4 T клеток менее 200 в mm3. 6. Деменция. ВИЧ может вызывать прямое цитопатогенное поражение центральной нервной системы. Он может преодолевать гематоэнцефалический барьер и вызывать развитие энцефалопатии, ведущей к потере высших функций, прогрессировани. слабоумия. 7. Детский СПИД. Приблизительно от трети до половины новорожденных от инфицированных матерей заражены ВИЧ. Многие из их не доживают до года. Дети могут также при переливании крови или продуктов крови. Имеются существенные различия между СПИДом у взрослых и детей. У детей рано развивается гуморальный иммунодефицит, приводящий к рецидивирующим бактериальным инфекциям. Задержка роста, хронический понос, лимфаденопатия, туберкулез и оппортунистические инфекции – обычные проявления СПИДа у детей. Лимфоцитарная интерстициальная пневмония отмечается исключительно у детей, в то время как саркома Капоши, токсоплазмоз и криптококкоз менее часты, чем у взрослых. |
