Лабораторная работа Основные классы неорганических соединений
 Скачать 2.63 Mb. Скачать 2.63 Mb.
|
|
Пример 28.4. Написать уравнения реакций, которые надо провести для осуществления следующих превращений: циклогексан → бензол → толуол → бензойная кислота. Указать условия протекания реакций. Решение. Циклогексан превращается в бензол при пропускании его паров над нагретым платиновым катализатором: С6Н12 Ввести алкильную группу в бензольное кольцо можно действием галогеналкила в присутствии хлорида алюминия: C6H6 + CH3Cl При действии раствора перманганата калия на толуол образуется бензойная кислота: C6H5−CH3 + 3[O] Задачи и упражнения для самостоятельного решения 28.1. Составить уравнения реакций, при помощи которых можно осуществить следующие превращения: Al4C3 → CH4 → CH3Br → C2H6 → CO2 → CO → CH4. Указать условия протекания реакций. 28.2. При сгорании 4,3 г образца алкана выделились 6,3 г воды и 6,72 л СО2 при нормальных условиях. Определить формулу алкана. 28.3. Составить уравнения реакций, при помощи которых можно осуществить следующие превращения: СН3−СН3 → СН2=СН2 → СН3−СН2ОН. Указать условия протекания реакций. 28.4. Сколько граммов 1,6 %-й бромной воды может обесцветить 1,12 л пропилена при нормальных условиях? (Ответ: 500 г). 28.5. 20 г карбида кальция обработали избытком воды, выделившийся ацетилен пропустили через бромную воду, получив 86,5 г 1,1,2,2-тетрабромэтана. Определить выход продукта реакции. (Ответ: 80 %). 28.6. Какие реакции следует провести, чтобы различить следующие газы: пропан, пропен и пропин? Написать уравнения соответствующих реакций. 28.7. Составить уравнения реакций, с помощью которых можно осуществить следующие превращения: метан → Х → бензол. Назвать вещество Х. Указать условия протекания реакций. 28.8. Из 3,36 л ацетилена (условия нормальные) получили 2,5 мл бензола. Определить выход продукта. Плотность бензола равна 0,88 г/мл. (Ответ: 56,4 %). 28.9. Составить уравнения реакций, с помощью которых можно осуществить следующие превращения: CH3−CH2−CH2Br → CH3−CH=CH2 → CH3−CH2Br−CH3. Указать условия протекания реакций. 28.10. Какой объем метана (условия нормальные) выделится: а) при гидролизе 72 г Al4C3; б) из 4,1 г безводного ацетата натрия? (Ответ: 33,6 л; 1,12 л). 28.11. Составить уравнения реакций, при помощи каких реакций можно осуществить следующие превращения: CH4 → CH3Cl → C2H6 → C2H5Cl → C3H8. 28.12. Как, исходя из метана, можно получить бензол? Сколько литров метана при нормальных условиях необходимо затратить на получение 7,8 г бензола? (Ответ: 13,4 л). 28.13. Какой объем 90 %-го раствора азотной кислоты (плотность 1,483 г/мл) потребуется для нитрования бензола, чтобы получилось 24,6 г нитробензола? (Ответ: 9,44 мл). 28.14. Состав соединения выражается формулой С4Н6. Известно, что это вещество легко взаимодействует с бромной водой, не реагирует с аммиачным раствором оксида серебра, но присоединяет воду в присутствии солей ртути (II). Написать структурную формулу соединения и назвать его. 28.15. Написать уравнения реакций, при помощи которых можно осуществить превращения: Al4C3 → X → Y → Cu2C2. Назвать соединения Х и Y. 28.16. Алкен нормального строения содержит двойную связь при первом углеродном атоме. 0,7 г этого алкена присоединил 1,6 г брома. Определить формулу алкена и назвать его. 28.17. Углеводород, состав которого выражается формулой С3Н4, взаимодействует с бромной водой и с натрием с выделением водорода. Определить структурную формулу углеводорода и назвать его. 28.18. При сгорании 3,6 г алкана образуется 5,6 л СО2 при нормальных условиях. Какой объем кислорода потребуется для реакции? (Ответ: 8,96 л). 28.19. Органическое вещество содержит углерод (массовая доля 84,21 %) и водород (15,79 %). Плотность паров вещества по воздуху составляет 3,93 (условия нормальные). Определить формулу этого вещества. 28.20. Массовая доля углерода в углеводороде составляет 83,33 %. Плотность паров углеводорода по водороду равна 36 (условия нормальные). Определить формулу углеводорода. Лабораторная работа 29 Спирты, альдегиды, кетоны Цель работы: изучить понятия «спирты», «альдегиды», «кетоны» и свойства этих соединений. Задание: выполнить химический эксперимент по установлению свойств важнейших представителей спиртов, альдегидов и кетонов. Выполнить требования к результатам опытов, оформить отчет, решить задачу. Теоретическое введение Спирты – это производные углеводородов, у которых один или несколько атомов водорода замещены на гидроксильные группы −ОН. Х  имические свойства спиртов определяются гидроксильной группой −ОН, входящей в состав молекулы. Химические реакции спиртов могут проте- имические свойства спиртов определяются гидроксильной группой −ОН, входящей в состав молекулы. Химические реакции спиртов могут проте-кать с участием всей группы (с разрывом связи С−О) или идти по водороду гидроксильной группы (с разрывом связи О−Н), например реакция этерификации: уксусноэтиловый эфир (этилацетат) Фенолы – это органические соединения, в которых гидроксильная группа соединена непосредственно с атомом углерода бензольного кольца. Простейшим представителем фенолов является гидроксибензол или фенол, имеющий одну гидроксильную группу в бензольном кольце:  или С6Н5−ОН Фенол – твердое кристаллическое вещество с характерным запахом, плохо растворяющееся в воде. Химические свойства фенолов определяются гидроксильной группой и связанным с ней бензольным кольцом. Кислотные свойства. Фенолы проявляют кислотные свойства и взаимодействуют со щелочными металлами и щелочами: 2C6H5OH + 2Na → 2C6H5ONa + H2; C6H5OH + NaOH → C6H5ONa + H2O. Реакции замещения в бензольном кольце. Гидроксильная группа оказывает очень большое влияние на бензольное кольцо, увеличивая его реакционную способность. Поэтому фенол легко вступает в реакции электрофильного замещения (с ориентацией заместителей в о- и п-положения). Например, он легко бромируется бромной водой с образованием 2,4,6-трибромфенола. Качественная реакция на фенол. Фенол образует с FeCl3 комплексную соль, окрашенную в фиолетовый цвет. Под действием окислителей (K2Cr2O7, KMnO4) в присутствии H2SO4 спирты окисляются с образованием альдегидов и кетонов, например:  3С2H5OH + K2Cr2O7 + 4H2SO4 → Cr2(SO)3 + K2SO4 + 3 + 7Н2О уксусный альдегид  Альдегиды и кетоны содержат в молекуле карбонильную группу В молекулах альдегидов карбонильная группа соединена с углеводородным радикалом и атомом водорода. Первым членом гомологического ряда аль-  дегидов является метаналь формальдегид 40 %-ный водный раствор формальдегида называется формалином. В молекулах кетонов карбонильная группа соединена с двумя разными R−CO−R′ или одинаковыми радикалами. Например,  ацетон По своим химическим свойствам альдегиды являются восстановителями, которые легко окисляются в кислоты. Например, при окислении альдегидов аммиачным раствором оксида серебра образуется карбоновая кислота и происходит выделение металлического серебра. Оно тонким блестящим слоем покрывает стенки сосуда, в котором проводилась реакция, поэтому данная реакция называется «реакцией серебряного зеркала» и является качественной на альдегиды:   + 2[Ag(NH3)2]OH → + 2Ag↓ + 4NH3 + H2O. пропаналь пропановая кислота Кетоны окисляются значительно труднее альдегидов и только сильными окислителями. При этом происходит разрыв углеродной цепи и образование смеси продуктов. Кетоны не вступают в реакцию серебряного зеркала. Выполнение работы Опыт 1. Окисление спирта в альдегид Налить в пробирку 2–3 мл раствора К2Cr2O7, 1–2 мл разбавленной серной кислоты и прилить по каплям примерно 0,5–1 мл этилового спирта. Обратить внимание на характерный запах выделяющегося в газообразном состоянии уксусного альдегида и изменение оранжевой окраски раствора на зеленую. Требование к результату опыта Закончить уравнение реакции К2Cr2O7+ Н2SO4 + C2H5OH → …. Опыт 2. Получение уксусноэтилового эфира Налить в пробирку 1–2 мл этилового спирта и затем осторожно такой же объем концентрированной серной кислоты. Туда же прибавить немного сухого уксуснокислого натрия, слегка нагреть пробирку и понюхать запах образовавшегося вещества. Требование к результату опыта Составить уравнение реакции образования уксусноэтилового эфира. Опыт 3. Фенол и его свойства (Проводить в вытяжном шкафу!). Поместить в пробирку несколько кристалликов фенола и постепенно приливать туда же раствор NaOH, пока при встряхивании пробирки фенол не растворится. К образовавшемусю раствору фенолята натрия прилить раствор серной кислоты. Наблюдать появление мути и выпадение в осадок слабо растворимого в воде фенола. Налить в пробирку 1–2 мл водного раствора фенола и добавить туда же несколько капель бромной воды. При встряхивании пробирки быстро образуется белый осадок трибромфенола. Налить в пробирку 3–4 мл водного раствора фенола и добавить туда же 1–2 капли раствора хлорного железа. Наблюдать появление фиолетового окрашивания. Требование к результатам опыта Составить уравнения реакций: образования фенолята натрия; взаимодействия фенолята натрия с серной кислотой; образования трибромфенола. Опыт 4. Восстановительные свойства альдегидов В химический стакан налить (до половины его объема) воды и нагреть ее до кипения. В пробирку, предворительно тщательно промытую раствором щелочи и дистиллированной водой, налить 2–3 мл 2 %-го раствора нитрата серебра AgNО3 и к нему добавить по каплям 1 %-й раствор аммиака до тех пор, пока выпадающий сначала осадок Ag2О полностью не растворится. При этом образуются комплексные ионы [Ag(NH3)2]+. В раствор комплексной соли серебра прилить при помощи пипетки (осторожно по стенке) 2–3 капли формалина и поместить пробирку в стакан с кипящей водой. Через некоторое время стенки пробирки покроются блестящим налетом металлического серебра. Требование к результату опыта Закончить уравнение реакции HCOH + [Ag(NH3)2]OH → …. Опыт 5. Окисление ацетона Налить в пробирку 6–8 капель ацетона, добавить равный объем дистиллированной воды, несколько капель 2 М раствора серной кислоты и осторожно нагреть на водяной бане до 50–60 °С. Добавить раствор KMnO4, слегка встряхивая пробирку, до тех пор, пока прекратится обесцвечивание перманганата. Требование к результату опыта Написать уравнение реакции окисления ацетона перманганатом калия, учитывая, что при этом происходит распад молекулы и образуется смесь муравьиной и уксусной кислот. Примеры решения задач Пример 29.1. Составить уравнения реакций, с помощью которых можно осуществить следующие превращения: С2Н4 → Х → Y → С2Н5−О−С2Н5. Указать условия протекания реакций. Назвать вещества Х и Y. Решение. Конечный продукт – диэтиловый эфир – получается из этилового спирта, следовательно, вещество Y – этанол. Перейти от этилена к этанолу можно через промежуточное соединение – галогенопроизводное этана (вещество Х). При взаимодействии этилена с бромоводородом образуется бромэтан: C2H4 + HBr → C2H5Br. Бромэтан гидролизуется до спирта действием водного раствора NaOH: C2H5Br + NaOH → C2H5OH + NaBr. При нагревании этанола до 140 °С в присутствии серной кислоты в качестве катализатора образуется диэтиловый эфир: C2H5OH Пример 29.2. Какая масса пропилата натрия может быть получена при взаимодействии 15 г пропанола-1 с 9,2 г натрия? Решение. Записываем уравнение реакции между пропанолом-1 и металлическим натрием: 2CH3−СH2−СН2−OH + 2Na → 2CH3−СH2−СН2−ONa + H2. Определяем количества вещества пропанола-1 и натрия: υ (С3Н7ОН) = 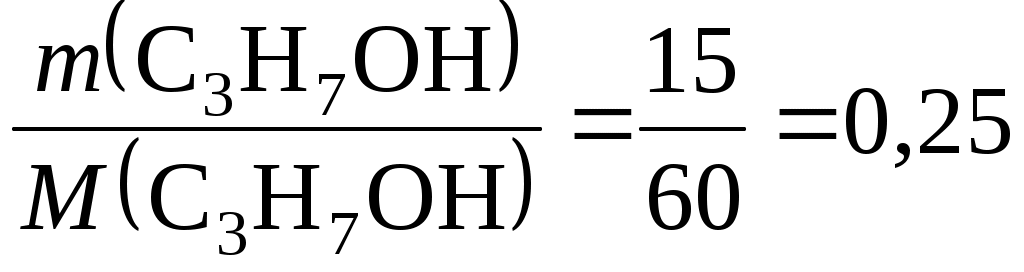 моль; моль;υ (Na) = Из уравнения реакции следует, что число моль спирта и натрия должны быть равны, следовательно, натрий взят в избытке. На основании уравнения реакции записываем: υ (C3H7ONa) = υ(C3H7OH); υ (C3H7ONa) = 0,25 моль. Определяем массу пропилата натрия, которую можно получить: m (C3H7ONa) = υ(C3H7ONa) ∙ M(C3H7ONa); m (C3H7ONa) = 0,25 ∙ 82 = 20,5 г. Пример 29.3. Формалин представляет собой 40 %-ный водный раствор формальдегида. Рассчитать массу метанола, которую необходимо окислить для получения 600 г формалина. Решение. Вычисляем массу формальдегида, который потребуется для приготовления формалина: m (CH2O) = Количество вещества требуемого формальдегида равно υ (CH2O) = 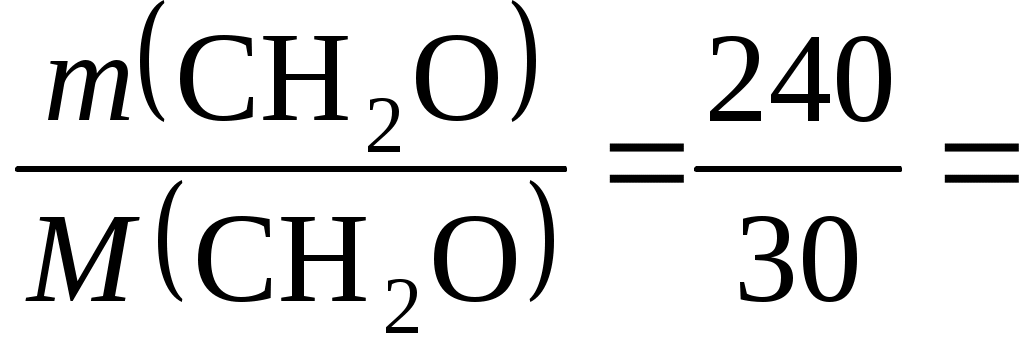 8 моль. 8 моль.Составляем уравнение реакции окисления метанола: CH3OH + [O] → CH2O + H2O. Из уравнения реакции следует, что υ (CH3OH) = υ(CH2O); υ(CH2O) = 8 моль. Масса требуемого метанола равна m(CH3OH) = υ(CH3OH) ∙ M(CH3OH); m (CH3OH) = 8 ∙ 32 = 256 г. Задачи и упражнения для самостоятельного решения 29.1. При взаимодействии бутанола-1 с избытком металлического натрия выделился водород, занимающий при нормальных условиях объем2,8 л. Определить количество вещества бутанола-1, которое вступило в реакцию. (Ответ: 0,25 моль). 29.2. Назвать вещества Х и Y и написать уравнения реакций, с помощью которых можно осуществить следующие превращения: а) пропанол-1 → Х → пропанол-2; б) этанол → Y → 1,2-дихлорэтан. Указать условия протекания реакций. |
