Лабораторная работа Основные классы неорганических соединений
 Скачать 2.63 Mb. Скачать 2.63 Mb.
|
|
29.3. Для получения метанола использовали 2 м3 оксида углерода (II) и 5 м3 водорода при нормальных условиях. Получено 2,04 кг спирта. Определить выход спирта. (Ответ: 71,4 %). 29.4. Составить уравнения реакций, при помощи которых можно осуществить следующие превращения: С → СН4 → С2Н6 → С2Н4 → С2Н5ОН → С2Н5ОNa. 29.5. Определить массу фенолята натрия, который может быть получен при взаимодействии 4,7 г фенола с 4,97 мл 35 %-го раствора NaОН (ρ = 1,38 г/мл). (Ответ: 5,8 г). 29.6. Написать уравнения реакций, с помощью которых можно осуществить следующие превращения: хлорэтан → этанол → этилен → пропаналь. 29.7. При окислении 13,8 г этанола избытком оксида меди (II) получен альдегид, масса которого составила 9,24 г. Определить выход продукта реакции. (Ответ: 70 %). 29.8. Определить массу серебра, которая будет получена, если к избытку аммиачного раствора оксида серебра прибавить 50 г 11,6 %-го водного раствора пропаналя. (Ответ: 21,6 г). 29.9. Какое количество вещества НСНО содержится в его 30 %-м водном растворе объемом 3 л и плотностью 1,06 г/мл? (Ответ: 31,8 моль). 29.10. 280 мл ацетилена было использовано для получения ацетальдегида, выход которого составил 80 %. Какая масса серебра может образоваться при добавлении всего полученного альдегида к избытку аммиачного раствора оксида серебра? (Ответ: 1,08 г). 29.11. Составить уравнения реакций, с помощью которых можно осуществить следующие превращения: С → СаС2 → С2Н2 → С2Н4 → С2Н6 → С2Н5Cl → С2Н5ОН. 29.12. При окислении 6 г технического препарата этаналя аммиачным раствором оксида серебра образовалось 20 г металла. Определить массовую долю (%) этаналя в техническом препарате. (Ответ: 67,9 %). 29.13. Составить уравнения реакций, при помощи которых можно осуществить следующие превращения: метан → ацетилен → уксусный альдегид → этиловый спирт → уксусный альдегид. 29.14. Составить уравнения реакций, при помощи каких реакций можно осуществить следующие превращения: С → СН4 → С2Н2 → С6Н6 → С6Н5Cl → С6Н5ОН. 29.15. Рассчитать массу фенолята калия, которая может быть получена из 3,29 г фенола. (Ответ: 4,62 г). 29.16. Составить уравнения реакций, с помощью которых можно осуществить следующие превращения: уксусный альдегид → этанол → этилен → ацетилен → уксусный альдегид. 29.17. Написать уравнения реакций, которые надо провести для осуществления следующих превращений: а) СН4 → Х → СН3ОН → СН3−О−СН3; б) этанол → этилен → Y → этанол. Назвать вещества Х и Y. 29.18. При дегидратации пропанола-2 получили пропилен, который обесцветил бромную воду массой 200 г. Массовая доля брома в бромной воде равна 3,2 %. Определить массу пропанола-2, взятого для реакции. (Ответ: 2,4 г). 29.19. Рассчитать массу фенола, который можно получить гидролизом бромбензола массой 47,1 г, если массовая доля выхода продукта равна 40 %. (Ответ: 11,28 г). 29.20. Составить уравнения реакций, которые необходимо провести для осуществления следующих превращений: пропин → Х → ацетон. Назвать вещество Х, указать условия протекания реакций. Лабораторная работа 30 Органические кислоты Цель работы: изучить свойства органических кислот. Задание: выполнить химический эксперимент по установлению свойств органических кислот. Выполнить требования к результатам опытов, оформить отчет, решить задачу. Теоретическое введение К  арбоновые кислоты – производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на карбоксильную группу арбоновые кислоты – производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на карбоксильную группуО  собенности химических свойств карбоновых кислот обусловлены сильным взаимным влиянием карбонильной собенности химических свойств карбоновых кислот обусловлены сильным взаимным влиянием карбонильной и гидроксильной О−Н групп. Поэтому все химические реакции карбоновых кислот будут идти по следующим направлениям: Замещение водорода в гидроксильной группе. Карбоновые кислоты – слабые электролиты и взаимодействуют с активными металлами, оксидами и гидроксидами металлов с образованием солей: 2CH3COOH + Mg → Mg(CH3COO)2 + H2; уксусная кислота ацетат магния C2H5COOH + NaOH → C2H5COONa + H2O. пропионовая кислота пропионат натрия Замещение всей гидроксильной группы. Карбоновые кислоты реагируют со спиртами в присутствии сильных неорганических кислот, в результате образуется сложный эфир:  пропионовая метиловый метиловый эфир пропионовой кислоты кислота спирт (метилпропионат) Выполнение работы Опыт 1. Свойства карбоновых кислот Налить в пробирку 2−3 мл раствора уксусной кислоты и внести туда немного стружек магния. Что наблюдается? Какое свойство карбоновых кислот характеризует этот опыт? В пробирку насыпать немного соды Na2CO3 и прилить раствор уксусной кислоты. Что наблюдается? В пробирку насыпать немного уксуснокислого натрия СН3СООNa и прилить 1−2 мл концентрированной серной кислоты. Слегка нагреть. Запах какого вещества обнаруживается? Требование к результатам опыта Записать наблюдения и составить уравнения реакций взаимодействия: магния с уксусной кислотой; соды с уксусной кислотой; уксуснокислого натрия с серной кислотой. Опыт 2. Получение уксусноэтилового эфира Налить в пробирку по 2 мл: концентрированной уксусной кислоты, этилового спирта и концентрированной серной кислоты. Пробирку со смесью опустить на 1−2 мин в кипящую воду, после чего содержимое пробирки вылить в пробирку с раствором поваренной соли (NaCl уменьшает растворимость эфира). Через несколько минут на поверхность всплывет уксусноэтиловый эфир, который можно узнать по характерному запаху. Требование к результатам опыта Написать уравнение реакции получения уксусноэтилового эфира (Н2SO4 играет роль водоотнимающего вещества). Опыт 3. Выделение карбоновых кислот из мыла В стакан налить 20−30 мл воды, всыпать туда несколько ломтиков простого мыла. Для лучшего растворения нагреть, все время помешивая стеклянной палочкой. К полученному раствору добавить 2−3 мл 10 %-го раствора серной кислоты и еще раз нагреть почти до кипения. На поверхности появляется слой кислот, выделенных из взятого мыла. При охлаждении эти кислоты затвердевают в твердый кружок. Требование к результатам опыта Написать уравнение реакции между натриевой солью стеариновой кислоты С17Н35СООNa и серной кислотой. Примеры решения задач Пример 30.1. Составить уравнения реакций, которые надо провести для осуществления следующих превращений: Метан → X → Y → уксусная кислота. Назвать вещества X и Y. Решение. При нагревании метана получают ацетилен – вещество Х: 2СН4 → С2Н2 + 3Н2. Гидратацией ацетилена в присутствии солей ртути (II) синтезируют уксусный альдегид – вещество Y: C2H2 + H2O → CH3COH. Окислив уксусный альдегид кислородом воздуха в присутствии катализатора, получают уксусную кислоту: 2СН3СОН + О2 → 2СН3СООН. Пример 30.2. В трех пробирках без надписей находятся следующие вещества: этанол, муравьиная кислота, уксусная кислота. Какие химические реакции следует провести, чтобы различить эти вещества? Решение. Спирт (этанол) можно отличить по действию веществ на индикаторы. Например, кислоты окрашивают синий лакмус в красный цвет, спирт – нет. Различить муравьиную и уксусную кислоту легко, так как муравьиная кислота проявляет некоторые свойства альдегидов. Например, она вступает в реакцию «серебряного зеркала» (уксусная – нет): НСООН + Ag2O → CO2↑ + 2Ag + H2O. Пример 30.3. Какой объем уксусной эссенции плотностью 1,07 г/мл надо взять для приготовления столового уксуса объмом 200 мл и плотностью 1,007 г/мл? Массовая доля уксусной кислоты в уксусной эссенции равна 80 %, в столовом уксусе – 6 %. Решение. Определяем массу раствора уксуса, который надо приготовить: m = V∙ ρ; m = 200 ∙ 1,007 = 201,4 г. Рассчитаем массу уксусной кислоты, которая содержится в уксусе: m (CH3COOH) = m ∙ ω (CH3COOH) = 201,4 ∙ 0,06 = 12,1 г. Вычисляем массу уксусной эссенции m′, которая содержит уксусную кислоту массой 12,1 г: 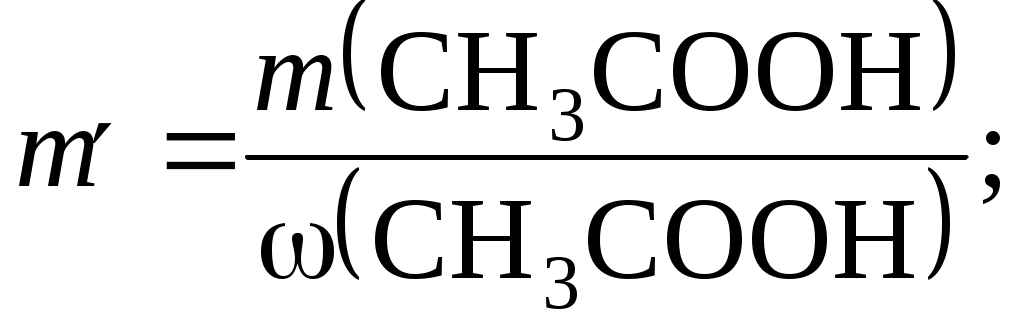 Находим объем уксусной эссенции: Задачи и упражнения для самостоятельного решения 30.1. Составить уравнения реакций, при помощи которых можно осуществить следующие превращения: С2Н4 → С2Н5СОН → С3Н7ОН → С3Н7СООН. 30.2. Сколько изомерных карбоновых кислот может соответствовать формуле С5Н10О2? Написать структурные формулы этих изомеров. (Ответ: 4 изомера). 30.3. При окислении муравьиной кислоты получили газ, который пропустили через избыток раствора гидроксида кальция. При этом образовался осадок массой 20 г. Какая масса муравьиной кислоты взята для окисления? (Ответ: 9,2 г). 30.4. В четырех пробирках находятся следующие вещества: пропионовая кислота, раствор формальдегида, раствор фенола в бензоле, метанол. При помощи каких химических реакций можно различить эти вещества? 30.5. Составить уравнения реакций, с помощью которых можно осуществить следующие превращения: CH4 → CH3Cl → CH3ОH → HCOH → HCOOH → CO2. 30.6. Какие массы растворов уксусной кислоты с массовой долей СН3СООН 90 и 10 % надо взять для получения раствора массой 200 г с массовой долей кислоты 40 %? (Ответ: раствора с массовой долей 90 % − 75 г; 10 % − 125 г). 30.7. Сколько изомерных карбоновых кислот может соответствовать формуле С6Н12О2? Написать структурные формулы этих изомеров. (Ответ: 9 изомеров). 30.8. Назвать вещества Х и Y и составить уравнения реакций, с помощью которых можно осуществить следующие превращения: а) метанол → Х → формиат натрия; б) уксусный альдегид → Y → ацетат кальция. 30.9. Какой объем воды надо прибавить к 300 мл 70 %-го раствора уксусной кислоты (ρ = 1,07 г/мл), чтобы получить 30 %-й раствор? (Ответ: 428 мл). 30.10. Написать уравнения реакций, с помощью которых можно осуществить следующие превращения: СаС2 → С2Н2 → СН3СОН → СН3СООН. 30.11. Рассчитать объем оксида углерода (II) (условия нормальные), который потребуется для получения раствора муравьиной кислоты массой 16,1 кг. Массовая доля НСООН в растворе, который требуется получить, равна 40 %. (Ответ: 3136 л). 30.12. Написать структурные формулы следующих кислот: а) 3-метил-2-этилгексановая кислота; б) 4,5-диметилоктановая кислота; в) 2,2,3,3-тетраметилпентановая кислота. 30.13. Рассчитать массу бутановой кислоты, которая образуется при окислении бутанола-1 массой 40,7 г. (Ответ: 48,4 г). 30.14. Какой объем 20 %-го раствора гидроксида калия плотностью 1,2 г/мл потребуется для полной нейтрализации 22,2 г пропионовой кислоты? (Ответ: 70 мл). 30.15. Написать уравнение реакции диссоциации бутановой кислоты и реакции получения натриевой соли этой кислоты. 30.16. Написать уравнения реакций, с помощью которых можно осуществить следующие превращения: пропионовая кислота ← этилен → этанол → уксусная кислота. 30.17. К раствору муравьиной кислоты массой 36,8 г добавили избыток окислителя. Газ, полученный в результате окисления, пропустили через избыток баритовой воды Ba(OH)2, в результате чего получили осадок массой 39,4 г. Определить массовую долю кислоты в исходном растворе. (Ответ: 25 %). 30.18. На нейтрализацию 3,7 г одноосновной предельной кислоты израсходовано 100 мл 0,5 М раствора КОН. Написать структурную формулу этой кислоты. 30.19. На нейтрализацию 30 г смеси раствора уксусной кислоты и фенола израсходовано 100 мл 2 М раствора NaOH, а при действии бромной воды на эту смесь образовалось 33,1 г осадка. Определить массовую долю (%) кислоты и фенола в растворе. (Ответ: 20 % кислоты и 31,3 % фенола). 30.20. Определить массовую долю хлоруксусной кислоты, полученной при пропускании хлора в 75 %-й раствор уксусной кислоты. (Ответ: 82,5 %). Лабораторная работа 31 Распознавание высокомолекуляных материалов Цель работы: изучить свойства высокомолекулярных соединений. Задание: выполнить химический эксперимент по установлению свойств высокомолекулярных соединений. Выполнить требования к результатам опытов, оформить отчет. Теоретическое введение Полихлорвиниловые изделия размягчаются при 50–60 °С, легко свариваются в небольшом пламени. При нагревании выделяется хлороводород, который можно обнаружить по образованию белого дыма (NH4Cl), поднеся к пробирке стеклянную палочку, смоченную раствором аммиака. Если накаленную медную проволоку прижать к образцу, а затем внести его в пламя горелки, то пламя окрашивается в ярко-зеленый цвет. При горении образцов наблюдается обильное выделение копоти. Разбавленные кислоты и щелочи заметного действия на полихлорвинил не оказывают; в концентрированных неорганических кислотах он сжимается и чернеет. Аминопласты окрашены в светлые тона, при нагревании не плавятся, горят с трудом, почти без копоти, не растворимы ни в одном из растворителей. При разложении образуют летучие продукты щелочного характера, окрашивающие индикаторную бумагу в синий цвет. Капрон начинает плавиться при температуре 216 °С. С трудом загорается голубоватым пламенем и быстро гаснет. При нагревании разлагается с выделением аммиака. Из расплавленного капрона можно вытянуть тонкие нити. По отношению к щелочам и разбавленным кислотам капрон устойчив; в концентрированных кислотах растворяется. Каучук – эластичный материал, из которого путем специальной обработки получают резину. Сырой каучук липок, непрочен, при небольшом понижении температуры становится хрупким. Для увеличения эластичности и повышения прочности, износоустойчивости, стойкости к агрессивным средам каучук подвергают вулканизации путем нагревания в присутствии серы с различными наполнителями (сажа, мел, оксид цинка и др.). В процессе вулканизации линейные макромолекулы каучука сшиваются между собой дисульфидными мостиками (–S–S–) и образуется пространственный полимер – резина. Резина отличается от каучука большей эластичностью и прочностью. Она устойчива к действию температуры и растворителей. Выполнение работы Опыт 1. Обнаружение поливинилхлорида Поместить в пробирку кусочек полимера, нагреть и заметить его размягчение, а затем разложение с выделением газообразного хлороводорода. В последнем убедиться, поднеся к выделяющемуся дыму влажную индикаторную бумажку, а затем стеклянную палочку, смоченную раствором аммиака. Сильно нагреть медную проволоку в пламени спиртовки, затем прижать ее к образцу поливинилхлорида и снова внести в пламя. Наблюдать зеленую окраску пламени. При накаливании проволоки на ее поверхности образуется оксид меди CuO, реагирующий с отщепляющимся HCl с образованием CuCl2 и воды. Зеленая окраска пламени обусловлена хлоридом меди. Опыт 2. Обнаружение аминопластов Внести в пламя кусочек пластмассы и наблюдать за характером горения (запах, копоть, легко или трудно загорается пластмасса, продолжается ли горение, если отвести пламя). Нагреть в пробирке кусочек пластмассы и испытать характер летучих продуктов разложения влажной красной индикаторной бумажкой. В какой цвет она окрасилась? Опыт 3. Обнаружение капрона Внести в пламя кусочек капрона. Обратить внимание на характер горения, запах. Раплавить капрон, поднеся к нему пламя спички, и попробовать вытянуть из капрона тонкие нити спичкой или булавкой. Возможность получить из расплавленного капрона нити резко отличает его от других пластмасс. Налить в 5 пробирок отдельно по 1−2 мл концентрированной серной кислоты (ρ = 1,84 г/мл), концентрированной соляной кислоты, разбавленной серной и соляной кислот, концентрированного раствора NaOH и поместить в пробирки кусочки капрона. Через некоторое время отметить, в каких случаях происходит растворение капрона. Опыт 4. Открытие серы в вулканизованном каучуке Поместить в пробирку несколько кусочков резины и нагреть пробирку на огне. Когда станет заметным разложение резины, поднести к пробирке бумажку, смоченную раствором свинцовой соли. Отметить изменение цвета бумаги, вызванное образованием черного сернистого свинца. Требование к результатам опытов Отметить и записать наблюдения для всех опытов. |
