Лабораторная работа Основные классы неорганических соединений
 Скачать 2.63 Mb. Скачать 2.63 Mb.
|
|
Пример 33.1. Какие вещества можно взять при выполнении следующих реакций: Cu2+ + 2OH− = Cu(OH)2↓; Ag+ + Br− = AgBr↓; Pb2+ + 2Cl− = PbCl2↓. Решение. Обнаружение катионов проводят в растворе, следовательно, исходные вещества должны быть растворимыми сильными электролитами. В результате реакции образовался один осадок, значит, второе образующееся вещество также должно быть растворимым сильным электролитом. Например, CuCl2 + 2NaOH = Cu(OH)2↓ + 2NaCl; AgNO3 + NaBr = AgBr↓ + NaNO3; Pb(NO3)2 + 2NaCl = PbCl2↓ + 2NaNO3. Пример 33.2. При анализе раствора соли металла под действием сульфида аммония выпал осадок белого цвета. Какие катионы может и какие не может содержать исследуемый раствор? Решение. Сульфиды железа, никеля и кобальта черного цвета, значит, в данном растворе катионы этих металлов отсутствуют. Белый цвет осадка свидетельствует о присутствии катионов алюминия или цинка. Задачи и упражнения для самостоятельного решения 33.1. Написать молекулярные и ионные уравнения трех разных качественных реакций на ионы Fe3+. 33.2. Какие вещества можно взять при выполнении следующих реакций: Ag+ + I− = AgI↓; Ni2+ + 2OH− = Ni(OH)2↓; Ba2+ + SO42− = BaSO4↓? 33.3. Написать молекулярные и ионные уравнения реакций образования сульфидов кобальта, никеля и свинца. 33.4. Под действием раствора соляной кислоты на анализируемый раствор выпал белый осадок. О присутствии каких катионов это свидетельствует? Привести уравнения соотетствующих реакций. 33.5. Написать молекулярные и ионные уравнения трех разных качественных реакций, позволяющих обнаружить ионы Mg2+. 33.6. Написать молекулярные и ионные уравнения реакций взаимодействия раствора сульфида аммония с раствором, содержащим катионы Al3+, Fe3+, Cr3+. 33.7. Под действием сероводорода на исследуемый раствор образуется желтый осадок. Катионы какого металла могут присутствовать в растворе? Привести уравнение соответствующей реакции. 33.8. Какие вещества можно взять при выполнении следующих реакций: Sn2+ + S2− = SnS↓; Ca2+ + CO32− = CaCO3↓; Ba2+ + CrO42− = BaCrO4↓? 33.9. При анализе раствора соли металла установлено, что образуется белый осадок под действием и раствора сульфида аммония, и раствора карбоната аммония. Катионы какого металла могут присутствовать в растворе? Привести уравнения соответствующих реакций. 33.10. Написать молекулярные и ионные уравнения трех разных качественных реакций, с помощью которых можно открыть ионы Ag+. 33.11. При анализе раствора соли металла установлено, что под действием раствора сульфида аммония образуется черный осадок, а при взаимодействии с избытком аммиака образуется синий раствор. Катионы какого металла могут присутствовать в растворе? Привести уравнения соответствующих реакций. 33.12. Под действием аммиака на исследуемый раствор образуется зеленый осадок. Какие катионы могут присутствовать в растворе? Привести уравнения соответствующих реакций. 33.13. При анализе раствора соли металла установлено, что под действием раствора соляной кислоты образуется белый осадок, а при взаимодействии с бромидом натрия образуется желтый осадок. Катионы какого металла могут присутствовать в растворе? Привести уравнения соответствующих реакций 33.14. Какие вещества можно взять при выполнении следующих реакций Cu2+ + S2− = CuS↓; Ag+ + Cl− = AgCl↓; Cа2+ + CO32− = CaCO3↓? 33.15. Написать молекулярные и ионные уравнения трех разных качественных реакций, позволяющих обнаружить ионы Ni2+. 33.16. При анализе раствора соли металла установлено, что под действием раствора щелочи образуется белый осадок, растворимый в кислотах и щелочах. При взаимодействии раствора с сульфидом натрия также образуется белый осадок. Катионы какого металла могут присутствовать в растворе? Привести уравнения соответствующих реакций. 33.17. Под действием карбоната аммония на исследуемый раствор образуется белый осадок. Какие катионы могут присутствовать в растворе? Привести уравнения соответствующих реакций. 33.18. При анализе раствора соли металла установлено, что под действием раствора щелочи образуется голубой осадок, а при взаимодействии с сероводородом образуется черный осадок. Катионы какого металла могут присутствовать в растворе? Привести уравнения соответствующих реакций. 33.19. Какие вещества можно взять при выполнении следующих реакций: Zn2+ + S2− = ZnS↓; Fe3+ + 3OH− = Fe(OH)3↓; Pb2+ + CrO42− = PbCrO4↓? 33.20. Написать молекулярные и ионные уравнения трех разных качественных реакций на ионы Zn2+ . Лабораторная работа 34 Качественные реакции на анионы Цель работы: изучить качественные реакции на анионы. Задание: доказать наличие определенных анионов с помощью специфических реакций. Выполнить требования к результатам опытов, оформить отчет, решить задачу. Теоретическое введение Анионы классифицируют по растворимости солей, либо по окислительно-восстановительным свойствам. Так многие анионы (SO42−, SO32−, CO32−, SiO32−, F−, PO43−, CrO42− и др.) имеют групповой реагент BaCl2 в нейтральной или слабокислой среде, т.к. соли бария и этих анионов мало растворимы в воде. Групповым реагентом на ионы Cl−, Br−, I−, SCN−, CN−, S2−и др. служит AgNO3. Для анионов S2−, SO32−, NO2−, C2O42−, играющих роль восстановителей, групповым реагентом будет перманганат калия KMnO4 в кислой среде. Групповым признаком является обесцвечивание раствора. Отдельные ионы могут быть обнаружены с помощью тех или иных специфических реакций. Например, при действии на анионы CO32− сильной кислоты протекает реакция с выделением пузырьков диоксида углерода CO2.. Сульфид-ион при действии сильных кислот переходит в сероводородную кислоту, которая выделяется из раствора в виде газообразного сероводорода H2S. Выполнение работы Опыт 1. Реакция на ион Clˉ Налить в пробирку 1−2 мл раствора хлорида натрия и добавить несколько капель раствора нитрата серебра. Что наблюдается? Опыт 2. Реакция на ион Налить в три пробирки по 1−2 мл растворов: в одну – серной кислоты, в другую – сульфата натрия, в третью – сульфата меди. В каждую пробирку добавить 1−2 мл раствора хлорида бария BaCl2. Что наблюдается? Опыт 3. Реакция на ион Налить в пробирку 1−2 мл раствора фосфата натрия и добавить несколько капель раствора нитрата серебра. Отметить цвет образующегося осадка. Опыт 4. Реакция на ион Поместить в пробирку небольшое количество порошкообразного карбоната кальция и добавить соляной кислоты. Что наблюдается? Требование к результатам опытов Написать молекулярные и ионные уравнения реакций для каждого опыта. Примеры решения задач Пример 34.1. Какие вещества можно взять при выполнении следующих реакций: H+ + S2− = H2S↑; Ag+ + Cl− = AgCl↓; Ba2+ + SO42− = BaSO4↓? Решение. Обнаружение анионов проводят в растворе, следовательно, исходные вещества должны быть растворимыми сильными электролитами. В результате реакции образуется осадок или газ, значит, второе образующееся вещество также должно быть растворимым сильным электролитом. Например, 2HCl + Na2S = H2S↑ + 2NaCl; AgNO3 + NaCl = AgCl↓ + NaNO3; BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl. Пример 34.2. При действии нитрата серебра на исследуемый раствор выпал осадок желтого цвета. Какие анионы может содержать исследуемый раствор? Решение. Катионы серебра образуют желтые осадки при взаимодействии с бромид-, иодид-, хромат-ионами. Задачи и упражнения для самостоятельного решения 34.1. Написать молекулярные и ионные уравнения трех реакций, позволяющих обнаружить в растворе ионы SO42−. 34.2. Какие вещества можно взять при выполнении следующих реакций: 2Ag+ + S2− = Ag2S↓; Ba2+ + CO32− = BaCO3↓; 2H+ + CO32− = H2O + CO2↑. 34.3. Написать молекулярные и ионные уравнения трех реакций образования сульфатов бария, кальция и свинца. 34.4. При анализе раствора под действием раствора нитрата серебра выпал белый осадок. О присутствии каких анионов может это свидетельствовать? Привести молекулярное и ионное уравнения соответствующей реакции. 34.5. Написать молекулярные и ионные уравнения трех реакций, позволяющих обнаружить в растворе ионы CO32−. 34.6. Написать молекулярные и ионные уравнения реакций взаимодействия раствора нитрата бария с раствором, содержащим ионы CO32−, PO43−, SO42−. 34.7. Под действием нитрата серебра на исследуемый раствор образуется черный осадок. О присутствии каких анионов может это свидетельствовать? Привести молекулярное и ионное уравнения соответствующей реакции. 34.8. Какие вещества можно взять при выполнении следующих реакций: а) Zn2+ + S2− = ZnS↓; б) 2Ag+ + CrO42− = Ag2CrO4↓; в) 2H+ + SO32− = SO2↑ + H2O. 34.9. При анализе раствора установлено, что образуется желтый осадок под действием и раствора нитрата бария, и раствора нитрата серебра. Какой анион может присутствовать в растворе? Привести молекулярные и ионные уравнения соответствующих реакций. 34.10. Написать молекулярные и ионные уравнения трех реакций, с помощью которых можно открыть ионы S2−. 34.11. Какие из перечисленных реактивов можно использовать для качественного определения карбонат-ионов: нитрат серебра, нитрат натрия, нитрат бария? Написать молекулярные и ионные уравнения реакций. 34.12. Каким реактивом можно обнаружить в растворе ионы хлора и брома? Привести молекулярные и ионные уравнения соответствующих реакций. 34.13. Какой из перечисленных реактивов можно использовать для качественного определения сульфит-ионов: нитрат калия, нитрат натрия, нитрат бария? Написать молекулярное и ионное уравнения реакции. 34.14. При добавлении раствора кислоты к анализируемому раствору наблюдается выделение газа. Какие анионы могут содержаться в растворе? Привести уравнения соответствующих реакций. 34.15. Какой из перечисленных реактивов можно использовать для качественного определения сульфат-ионов: нитрат калия, нитрат натрия, нитрат бария? Написать молекулярное и ионное уравнения реакции. 34.16. При анализе раствора установлено, что под действием раствора нитрата бария образуется белый осадок, а при взаимодействии раствора с подкисленным раствором перманганата калия наблюдается его обесцвечивание. Какие анионы могут присутствовать в растворе? Привести уравнения соответствующих реакций. 34.17. Какой из перечисленных анионов можно обнаружить с помощью подкисленного раствора перманганата калия: нитрат-, сульфат-, карбонат-, сульфид-ионы? Написать уравнение соответствующей реакции. 34.18. При анализе раствора установлено, что при взаимодействии с нитратом серебра образуется черный осадок, а под действием подкисленного раствора перманганата калия наблюдается обесцвечивание раствора. Какой анион может присутствовать в растворе? Привести уравнения соответствующих реакций. 34.19. Какие вещества можно взять при выполнении следующих реакций: а) Fe3+ + 3SCN− = Fe(SCN)3; б) Ag+ + I− = AgI↓; в) Sr2+ + SO42− = SrSO4↑. 34.20. На наличие какого иона указавает выделение газа при добавлении сильной кислоты в исследуемый раствор: Cl−, NO3−, CO32−? Написать молекулярное и ионное уравнения реакции. Лабораторная работа 35 Количественное определение железа в растворе его соли Цель работы: познакомиться с одним из методов количественного анализа − химическим анализом. Задание: определить количественное содержание железа в исследуемом растворе сульфата железа титриметрическим методом. Выполнить требования к результатам опыта, оформить отчет, решить задачу. Теоретическое введение Количественный анализ − совокупность методов, с помощью которых определяют содержание (массы, концентрации и т.п.) или количественные соотношения компонентов в анализируемом образце. Все методы количественного анализа делятся на две большие группы: инструментальные и химические, в основе которых лежит химическая реакция. К химическим методам относятся гравиметрические и титриметрические методы анализа. Гравиметрический анализ состоит в определении массы и содержания какого-либо элемента, иона или химического соединения в анализируемом объекте. Определяемый компонент осаждают из раствора в виде какого-либо малорастворимого соединения, которое затем отделяют от раствора. Титриметрические методы анализа основаны на измерении объема раствора реагента с точно известной концентрацией, затраченного на взаимодействие с определенным объемом анализируемого вещества. Раствор, концентрация которого (обычно титр раствора) точно известна, называется титрованным. Титром называется масса вещества, содержащегося в 1мл (см3) титрованного раствора. Определение проводят способом титрования, т.е. постепенного приливания титрованного раствора к раствору анализируемого вещества, объем которого точно измерен. Титрование прекращается при достижении точки эквивалентности, т.е. достижения эквивалентности реагента титруемого раствора и анализируемого компонента. Одной из разновидностей титриметрического анализа является окислительно-восстановительное титрование, суть которого заключается в титровании раствора восстановителя титрованным раствором окислителя или в титровании раствора окислителя титрованным раствором восстановителя. Определение железа и его соединений основано на титровании раствора, содержащего ионы Fe2+ (восстановителя), раствором перманганата калия (окислителя) известной концентрации. Реакция протекает по уравнению 2KMnO4 + 10FeSO4 + 8H2SO4 → 2MnSO4 + K2SO4 + 5Fe2(SO4)3 + 8H2O. Выполнение работы В мерную колбу вместимостью 100 мл налить точно отмеренный объем исследуемого раствора сульфата железа (II). Отмерить мерным цилиндром 10 мл 2 н. раствора серной кислоты и прилить в колбу, добавляя туда же небольшими порциями дистиллированную воду и постоянно перемешая раствор круговыми движениями колбы. Довести объем воды в колбе до метки и еще раз тщательно перемешать приготовленный рабочий раствор. Наполнить бюретку 0,05 н. раствором перманганата калия KMnO4 и установить уровень раствора на нулевое деление бюретки. Провести ориентировочное титрование соли железа (II) перманганатом калия. Для этого взять пипеткой 10 мл раствора из мерной колбы и перенести в коническую колбу для титрования. Затем прибавлять к нему небольшими порциями раствор перманганата калия из бюретки до неисчезающего в течение 30 секунд обесцвечивания титруемого раствора. Первые капли раствора перманганата калия обесцвечиваются довольно медленно. Как только образуется в растворе немного ионов Mn2+, являющихся катализатором для данной реакции, дальнейшее обесцвечивание перманганата до конца титрования происходит почти мгновенно. Зная ориетировочный объем перманганата, провести 3 точных титрования. Результаты не должны отличаться более, чем на 0,05 мл. Взять среднее значение для проведения расчетов. Данные опыта занести в табл. 35.1: Таблица 35.1 Данные опыта и результаты расчетов
Требования к результатам опыта 1. Рассчитать молярную концентрацию эквивалентов раствора соли железа по закону эквивалентов: сэк (FeSO4) · V (FeSO4) = сэк (KMnO4) · V (KMnO4) , откуда 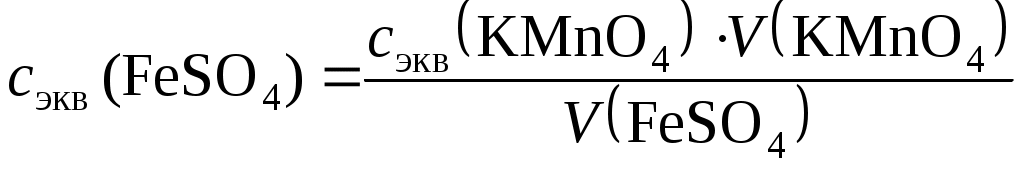 где сэк (FeSO4) и сэк (KMnO4) – молярные концентрации эквивалентов растворов; V (FeSO4) и V (KMnO4) − объемы реагирующих растворов. 2. Рассчитать, какому количеству металлического железа соответствует содержание FeSO4 в объеме исследуемого раствора по формуле m (Fe) = Mэк (Fe) · сэк (FeSO4), где Mэк (Fe) – молярная масса эквивалентов железа. 3. Рассчитать титр раствора FeSO4 по формуле где Мэк (FeSO4) – молярная масса эквивалентов FeSO4; сэк (FeSO4) – молярная концентрация эквивалентов FeSO4. Примеры решения задач Пример 35.1. Вычислить молярную массу эквивалентов и эквивалент KCrO2 как восстановителя, если KCrO2 окисляется до K2CrO4. Решение. При окислении KCrO2 степень окисления хрома повышается с +3 до +6. Молярная масса эквивалентов восстановителя равна частному от деления молярной массы восстановителя на число отданных электронов: Мэк (KCrO2) = 123 / 3 = 41 г/моль; эквивалент KCrO2 равен ⅓ KCrO2. Пример 35.2. Найти нормальность раствора NaOH, если нa титрование 20 мл 0,1 н. раствора щавелевой кислоты израсходовано 21мл NaOH. Решение. Поскольку вещества взаимодействуют в эквивалентных количествах, то можно записать н.к ∙ Vк = н.щ ∙ Vщ где н.к. – нормальность раствора кислоты, Vк − объем кислоты; н.щ – нормальность раствора щелочи, Vщ – объем щелочи. Следовательно, нормальность NaOH равна н.щ = н.к.∙ Vк / Vщ = 0,1∙20 / 21 = 0,952. Таким образом, для титрования был использован 0,952 н. раствор NaOH. Задачи и упражнения для самостоятельного решения 35.1. На титрование 20 мл 0,1 М раствора HCl потребовалось 16 мл КОН. Чему равна молярная концентрация КОН? (Ответ: 0,125 моль/л). 35.2. Вычислить титры растворов: а) 0,05 М NaCl; б) 0,004 н. Ca(OH)2; в) 0,5 н. HNO3. (Ответ: а) 0,00292 г/мл; б) 0,148∙10−3 г/мл; в) 0,0315 г/мл). 35.3. Чему равна масса осадка, образующегося при сливании 250 мл раствора карбоната натрия с молярной концентрацией 0,1 моль/л и 200 мл хлорида бария с молярной концентрацией 0,15 моль/л? (Ответ: 4,925 г). 35.4. При гравиметрическом определении свинца в сплаве получено 1,4642 г PbSO4. Какова масса свинца в сплаве? (Ответ: 1 г). 35.5. Вычислить титры растворов: а) 1 н. H2SO4, б) 1 M H3PO4, в) 0,1 н. расвора КОН. (Ответ: а) 0,049 г/мл; б) 0,098 г/мл; в) 0,0056 г/мл). 35.6. На осаждение гидроксида железа (Ш) из 15 мл раствора FeCl3 пошло 10 мл 0,1 н. щелочи. Вычислить массу образовавшегося осадка гидроксида железа (Ш). (Ответ: 0,0356 г). 35.7. На нейтрализацию 10 мл соляной кислоты неизвестной концентрации пошло 12 мл 0,1 н. раствора NaOH. Определить нормальность и титр раствора соляной кислоты. (Ответ: 0,12 н.; 4,38∙10−3 г/мл). 35.8. Написать уравнения реакций взаимодействия перманганата калия KMnO4 с сульфитом натрия Na2SO3 в: а) кислой среде, б) нейтральной среде и вычислить эквивалент и молярную массу эквивалентов в каждом случае. (Ответ: а) 1/5 KMnO4; 31,6 моль/л; б) 1/3 KMnO4; 52,7 моль/л). 35.9. Вычислить нормальность одномолярного раствора дихромата калия K2Cr2O7 в окислительно-восстановительном титровании, сопровождающимся образованием сульфата хрома (Ш). (Ответ: 6 н.). 35.10. Для осаждения в виде AgCl всего серебра, содержащегося в 100 мл раствора AgNO3, потребовалось 50 мл 0,2 н. раствора соляной кислоты HCl. Какова нормальность раствора AgNO3? Какая масса AgCl выпала в осадок? (Ответ: 0,1 н.; 1,433 г). 35.11. Какая масса HNO3 содержалась в растворе, если на нейтрализацию его потребовалось 35 мл 0,4 н. раствора NaOH? Каков титр раствора NaOH? (Ответ: 0,882 г; 0,016 г/мл). 35.12. 25 мл КОН нейтрализуется 20,5 мл 0,2 н. раствора соляной кислоты. Чему равна нормальность раствора КОН? (Ответ: 0,164 н.). 35.13. Навеска 5,912 г хлорида натрия растворена в 2 л раствора. Чему равны молярная концентрация эквивалентов и титр этого раствора? (Ответ: 0,05 моль/л; 0,002956 г/мл). 35.14. Сколко граммов H2SO4 содержится в растворе, если на нейтрализацию израсходовано 20 мл раствора КОН, титр которого равен 0,0046 г/мл? (Ответ: 0,805 г). 35.15. Для нейтрализации 20 мл 0,1 н. раствора NaOH расходуется 30 мл соляной кислоты. Чему равна молярная концентрация эквивалентов HCl? (Ответ: 0,067 моль/л). 35.16. На нейтрализацию 31 мл 0,16 н. раствора щелочи требуется 217 мл раствора серной кислоты. Чему равна нормальность и титр серной кислоты? (Ответ: 0,023 н.; 0,0011 г/мл). 35.17. Какой объем 2 М раствора соляной кислоты HCl потребуется для нейтрализации 14 г гидроксида калия КОН, содержащихся в 1 л раствора? Чему равна молярная концентрация эквивалентов такого раствора? (Ответ: 125 мл; 0,25 моль/л). 35.18. Определить содержание железа в 1 л раствора сульфата железа (II), если на титрование 10 мл его пошло 5 мл 0,1 н. раствора перманганата калия KMnO4. (Ответ: 75,9 г). 35.19. Какова молярная концентрация эквивалентов раствора NaCl, если на титрование 20 мл его израсходовано 18,3 мл 0,1 н. раствора нитрата серебра AgNO3. (Ответ: 0,0915 моль/л). 35.20. Вычислить, сколько процентов кристаллизационной воды содержалось в BaCl2∙2H2O, если навеска хлорида бария до высушивания составляла 1,5723 г, а после высушивания 1,3395 г. (Ответ: 14,8 %). ЗАКЛЮЧЕНИЕ Настоящее учебно-практическое пособие написано коллективом авторов на основе многолетнего опыта работы кафедры химии Иркутского государственного технического университета. Оно охватывает основные разделы химии, предусмотренные действующими учебными программами по данной дисциплине, и представляет собой практическое руководство к выполнению лабораторных работ. Материал систематизирован и изложен в форме, удобной для изучения и усвоения. Использование пособия в учебном процессе будет способствовать закреплению теоретических знаний студентов о химических веществах, их свойствах, превращениях, а также о явлениях, которыми сопровождаются превращения одних веществ в другие. Поможет овладеть способами безопасного обращения с химическими веществами и лабораторным оборудованием. Позволит приобрести навыки самостоятельного выполнения химического эксперимента, обобщения и анализа результатов работы, формулирования выводов, составления отчетов. Выполнение заданий, предлагаемых после каждой темы, требует серьезной работы с учебником и стимулирует самостоятельную работу студента. Полученные в курсе химии знания необходимы студентам при изучении последующих курсов, таких как сопротивление материалов, материаловедение, основы теплопередачи, теоретические основы различных технологических процессов в электротехнике, энергетике, машиностроении, в строительстве и других направлениях подготовки бакалавров. БИБЛИОГРАФИЧЕСКИЙ СПИСОК 1. Глинка Н. Л. Общая химия. – М. : Интеграл-Пресс, 2009. –727 с. 2. Коровин Н. В. Общая химия. – М. : Высш. шк., 2008. – 558 с. 3. Задачи и упражнения по общей химии / под ред. Н. В. Коровина. – М. : Высш. шк., 2008. – 255 с. 4. Глинка Н. Л. Задачи и упражнения по общей химии. – М. : Интеграл-Пресс, 2009. – 240 с. 5. Ахметов Н.С. Общая и неорганическая химия. – М. : Высш. шк., 2006. – 743 с. 6. Артеменко А.И. Органическая химия. – М. : Высш. шк., 2007. – 605 с. 7. Васильев В.П. Аналитическая химия. Кн. 1. – М. : Дрофа, 2005. – 366 с. Приложение А Каждый студент должен выполнить лабораторные работы, предусмотренные программой. Результаты выполненной лабораторной работы следует оформить в виде отчета. Требования к оформлению отчета по лабораторной работе Отчета оформляется на бумаге формата А 4 вручную или на компьютере. При работе на компьютере: размер шрифта – 14; интервал между строк – одинарный; поля – везде по 2 см, внизу – 2,5 см; нумерация страниц – внизу посредине; абзацный отступ – 1,25 см; размещение текста – по ширине. Содержание отчета: титульный лист (образец прилагается); цель работы; задание; краткое теоретическое введение к данной работе; название опытов; оформление результатов опытов в соответствии с предъявляемыми требованиями. Защита лабораторной работы осуществляется на занятии, следующем после ее выполнения. При защите студент должен представить отчет по лабораторной работе, составленный по предложенной выше схеме, пояснить все приведенные расчеты и выводы, выполнить свой вариант задания по теме лабораторной работы (решить задачу или составить уравнения химических реакций). Образец оформления титульного листа ИрГТУ КАФЕДРА ХИМИИ И ПИЩЕВОЙ ТЕХНОЛОГИИ Отчет по лабораторной работе (номер и название работы) Выполнил студент группы…. Фамилия, инициалы Проверил преподаватель Фамилия, инициалы Иркутск 2012 Приложение Б Таблица 1 Стандартные энтальпии образования ∆fН°298, энтропии S°298 и энергии Гиббса образования ∆fG°298 некоторых веществ при 298 К (25 °С)
Таблица 2 Плотность раствора соляной кислоты при 15 °С
Таблица 3 Растворимость некоторых солей и оснований в воде
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 2−
2−