Ига. Лекции 1 Основы фармакотерапии
 Скачать 343.02 Kb. Скачать 343.02 Kb.
|
|
ФУНКЦИОНАЛЬНЫЕ ИЗМЕНЕНИЯ, ВЫЗЫВАЕМЫЕ ЛЕКАРСТВЕННЫМИ СРЕДСТВАМИ В ОРГАНИЗМЕ В 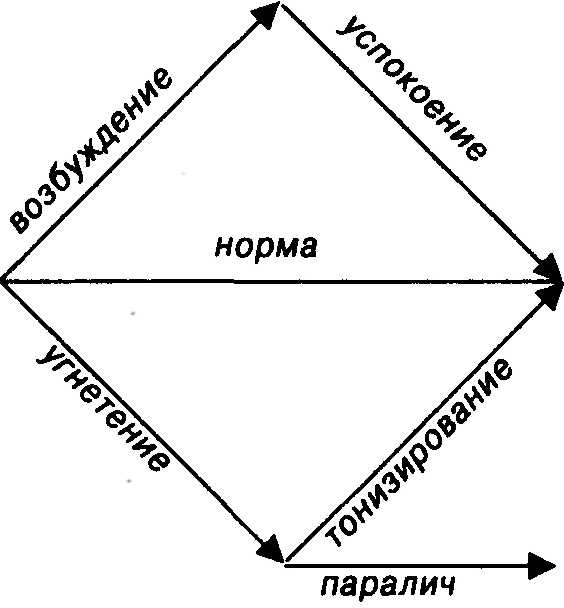 озбуждение — повышение функции выше нормы: положительное возбуждение — сокращение миометрия под влиянием препаратов спорыньи, примененных в большой дозе для остановки маточного кровотечения; отрицательное возбуждение — судороги при отравлении стрихнином, камфорой. озбуждение — повышение функции выше нормы: положительное возбуждение — сокращение миометрия под влиянием препаратов спорыньи, примененных в большой дозе для остановки маточного кровотечения; отрицательное возбуждение — судороги при отравлении стрихнином, камфорой.Успокоение — возврат возбужденной функции к норме: снижение температуры тела жаропонижающими средствами при лихорадке, уменьшение боли под влиянием анальгетиков. Угнетение — снижение функции ниже нормы: положительное угнетение — утрата сознания, подавление рефлексов и снижение тонуса скелетных мышц при наркозе; отрицательное угнетение — торможение дыхательного центра при действии наркозных, снотворных средств, наркотических анальгетиков. Тонизирование — возврат угнетенной функции к норме: улучшение деятельности дыхательного и сосудодвигательного центров при дыхательной недостаточности, коллапсе, шоке под влиянием камфоры, кофеина и других аналептиков; усиление сокращений декомпенсированного миокарда у больных, получающих сердечные гликозиды. Паралич — прекращение функции: положительный паралич — обратимое устранение болевой чувствительности при действии сильных местных анестетиков, полное расслабление скелетной мускулатуры, вызываемое миорелаксантами; отрицательный паралич — необратимый паралич дыхательного центра после его возбуждения атропином и аналептиками в токсических дозах. Все лекарственные средства имеют терапевтические, токсические и летальные (смертельные) дозы. Терапевтические дозы: минимальная (пороговая) терапевтическая доза — минимальное количество лекарственного средства, вызывающее терапевтический эффект; средняя терапевтическая доза — диапазон доз, в которых лекарственное средство оказывает оптимальное профилактическое или лечебное действие у большинства больных; максимальная терапевтическая доза — максимальное количество лекарственного средства, не оказывающее токсическое действие. Токсические дозы: минимальная токсическая доза — доза, вызывающая слабо выраженные симптомы интоксикации или отравление в 10 % наблюдений; средняя токсическая доза — доза, вызывающая интоксикацию средней тяжести или отравление в 50 % наблюдений; максимальная токсическая доза — доза, вызывающая тяжелую интоксикацию или интоксикацию в 100 % наблюдений, но при этом не возникают летальные исходы. Летальные дозы: минимальная летальная доза (ДЛ10) — доза, вызывающая гибель в 10 % наблюдений; средняя летальная доза (ДЛ50) — доза, вызывающая гибель в 50 % наблюдений; максимальная летальная доза (ДЛ 100) — доза, вызывающая гибель всех отравленных животных. В эксперименте терапевтические, токсические и летальные дозы вычисляют с помощью математических расчетов. Препараты списков А и Б имеют высшие разовые и суточные дозы. Широта терапевтического действия — диапазон между средней и максимальной терапевтическими дозами. Терапевтический индекс — отношение эффективной дозы ЭД50 к летальной дозе ДЛ50. Для достижения быстрого терапевтического эффекта лекарственные средства иногда назначают в ударных дозах (антибиотики, сульфаниламиды). Препараты, способные к кумуляции, применяют в поддерживающих дозах. В педиатрической практике лекарственные средства дозируют в расчете на массу или поверхность тела ребенка. Зависимость действия лекарственных средств от дозы может быть не только количественной, но и качественной. Ацетилхолин в малых дозах возбуждает М-холинорецепторы; в дозах, в 10 раз больших, — также Н-холинорецепторы. Натрия оксибутират в малых дозах оказывает обезболивающее и седативное, в средних дозах — противосудорожное и снотворное, в больших дозах — наркозное действие. СОВМЕСТИМОСТЬ ЛЕКАРСТВЕННЫХ СРЕДСТВ При медикаментозном лечении часто используют сочетания лекарственных средств для усиления действия одного препарата другим, ограничения дозы каждого из них, ослабления побочных эффектов; при полисиндромных проявлениях заболевания-для воздействия на ряд механизмов патогенеза, корригирования возникших сдвигов, облегчения всех имеющихся жалоб; при наличии нескольких заболеваний - для одновременного лечения каждого из них. Поскольку известны побочные эффекты, свойственные тем или другим лечебным препаратам, существует возможность профилактики этих нежелательных последствий лечения путем назначения защитных препаратов: лечение глюкокортикоидами следует проводить под защитой антибиотиков, антацидов, анаболических средств; противомикробные антибиотики ввиду опасности развития дисбактериоза сочетать с нистатином или другими противогрибковыми препаратами. Успехи дифференцированной фармакотерапии все более увеличивают перечень возможных и желательных направлений лечения. Но терапевтическая активность угрожает обернуться полипрагмазией с ее многочисленными опасностями, наиболее очевидной из которых является несовместимость препаратов. Различают три рода несовместимости лекарственных прописей: физическую (или физико-химическую), химическую и фармакологическую. К числу физических несовместимостей относят те, которые зависят от разной степени растворимости препаратов, коагуляции коллоидных систем и расслоения эмульсий, отсыревания и расплавления порошков, адсорбционных явлений (табл. 3). Таблица 3. Образование осадка при совмещении алкалоидных препаратов (в 1% растворе) с другими лекарственными веществами [Муравьев И. А., Козьмин В. Д., КудринА. Н., 1978]
Химическая несовместимость возникает в результате реакций, которые происходят при соединении растворов в одном объеме. Они предотвращаются раздельным введением препаратов. Значительно многообразнее и сложнее варианты фармакологической несовместимости, обусловленной взаимодействием эффектов лекарств при одновременном их применении. Сведения по поводу физической и химической несовместимости включены в рецептурные справочники, бюллетени, таблицы. Прописи контролируют при оформлении рецептом в аптеках. Тем не менее в повседневной практике из-за недостаточной осведомленности врачей и медицинского персонала нередко допускаются отклонения от утвержденных рекомендаций с отрицательными последствиями для больного. При одновременном приеме больным нескольких таблеток возможна не только их фармакологическая несовместимость, но и химическое взаимодействие в желудочно-кишечном тракте в условиях, когда пищеварительные соки и иные ингредиенты химуса становятся биологическими катализаторами возникающих реакций. Фармакологическая несовместимость имеет различные причины и формы. Антагонистическая (или абсолютная) несовместимость возможна в тех случаях, когда препараты имеют разнонаправленное влияние на процессы, протекающие в клетке, ткани, органе или целом организме, и эффект одного подавляется эффектом другого. Этот вид несовместимости с успехом используется при лечении отравлений, когда препарат вводят в качестве антидота: например, атропин при отравлении ингибиторами холинэстеразы, фосфорорганичес-кими веществами, мухомором (мускарин), пилокарпином; наоборот, пилокарпин, прозерин, физостигмин - при отравлении атропином. Несовместимость возникает и между синергистами в связи с тем, что непропорционально возрастает опасность передозировки или умножения побочного действия. Одновременное назначение р-адреноблокатора, дигоксина и резерпина вызывает брадикардию, нарушения проводимости, угрожает развитием аритмий; введение строфантина на фоне лечения другими препаратами сердечных гликозидов может вызвать асистолию или фибрилляцию желудочков сердца; применение аминогликозидов канамицина, гентамицина, неомицина на фоне стрептомицина приводит к поражению VIII пары черепных нервов, безвозвратной потере слуха, иногда к развитию почечной недостаточности (относительная несовместимость, сходная с эффектом передозировки). Фармакокинетическая несовместимость возникает в связи с теми изменениями, которые один из препаратов вносит в условия всасывания, выведения или циркуляции в организме другого (других) препарата. Назначение мочегонных петли нефрона (фуросемид, урегит) отрицательно сказывается на терапии аминогликозидами: быстрее снижается их концентрация в крови и в тканях, возрастает нефротоксический эффект. Наоборот, стрептомицин, нарушая механизм секреции пенициллина канальцевым эпителием, удлиняет сроки его терапевтической концентрации в крови (благоприятное фармакокинетическое потенцирование). Выделяют также метаболическую (всегда дозозависимую, относительную) несовместимость лекарств, которая изучена на примере сочетанного применения фенобарбитала и антикоагулянтов: фенобарбитал способствует ускоренному метаболизму последних и резкому ослаблению их действия. Таблица 4. Несовместимые сочетания препаратов
В других случаях в основе метаболической несовместимо-сти лежат угнетение процессов разрушения лекарственного вещества, снижение клиренса, повышение концентрации в плазме крови, сопровождающееся развитием признаков передозировки. Так, ингибиторы моноаминоксидазы (ипразид, ниламид) тормозят метаболизм катехоламинов. тирамина, серотонина, вызывая гипертензивные реакции. Классификация антибактериальных средств (по Manten - Wisse)
Большую остроту приобрела проблема сочетанной антибактериальной терапии. Получены, в том числе полусинтетически, десятки тысяч антибиотиков, различающихся по своим лечебным характеристикам. Показания к сочетанной противо-микробной терапии определяются многими соображениями: 1) возможностью повышения терапевтической эффективности; 2) расширением спектра антибактериального действия при неуточненном возбудителе; 3) уменьшением побочного действия по сравнению с адекватной монотерапией; 4) снижением опасности возникновения резистентных штаммов микробов. Однако при применении одновременно двух или нескольких препаратов возможны четыре формы взаимодействия: индиф-ференция, суммарное действие, потенцирование и антагонизм. Индифференция состоит в том, что один препарат не оказывает отчетливого влияния на антибактериальное действие другого. Суммарное (или аддитивное) действие имеет место тогда, когда результат является суммой монотерапевтических эффектов. Если степень антибактериальной активности сочетания препаратов оказывается большей, чем суммарное действие компонентов, говорят о потенцировании (или синергиз-ме). Но нередко эффект комплексного применения антибиотиков оказывается меньшим, чем одного из ингредиентов: имеет место антагонизм действия препаратов. Одновременное применение антибиотиков, между которыми возможен антагонизм, является прямой ошибкой врача. Уже в 50-е годы был сформулирован принцип сочетания антибиотиков в зависимости от типа их действия на возбудителя - бактерицидного или бактериостатического (см. классификацию). При сочетании антибиотиков, оказывающих бактерицидное действие, как правило, достигается эффект си-нергизма или аддитивное действие. Сочетание бактериоста-тических антибиотиков ведет к аддитивному действию или' индифференции. Сочетание же бактерицидных антибиотиков с бактериоста-тическими препаратами чаще всего нежелательно. Летальность от менингококкового сепсиса у детей при попытках единовременного применения пенициллина и левомицетина возрастала по сравнению с результатами, получаемыми при лечении тем или другим из этих препаратов в отдельности. Если микроорганизм более чувствителен к компоненту с бактериостатическим действием, может появиться синергизм, но когда он чувствителен к бактерицидному действию, как правило, наступает антагонизм, бактериостатический препарат снижает эффективность бактерицидного. И в венерологии, и при лечении острых пневмоний одновременное применение сульфаниламидов и пенициллина сопровождалось неблагоприятными результатами по сравнению с эффектом, полученным при энергичном лечении одними пенициллина-ми: «обрывающего» действия при применении бактерицидного антибиотика (абортивное течение пневмонии при раннем назначении пенициллина) не наступает. При моноинфекциях сочетанное лечение антибиотиками редко бывает обоснованным, при смешанных заражениях оно может быть ценным, но только если соблюдаются условия рационального сочетания антибиотиков и учтены все показания и противопоказания. К настоящему времени установлено, что ни широкий спектр активности антибиотика, ни мегадозы, ни комбинации антибиотиков или последовательная замена одних другими проблемы успешного лечения бактериальных заболеваний не решают, пока за этим скрывается попытка лечить вслепую, методом проб и ошибок. Необходимо точное, прицельное, узконаправленное лечение на основе определения видовой и индивидуальной чувствительности возбудителя к лечебному агенту, надежной и своевременной этиологической диагностики заболевания. Антибиотики не следует без необходимости совмещать с жаропонижающими, снотворными, глкжокортикоидными препаратами (это противоречит рекомендации применять глюкокортикоиды «под защитой» антибиотиков, что находит объяснение в приоритетном значении в одних случаях задач антибактериальной, в других - гпюкокортикоидной терапии). Хорошо изученная на моделях антибиотиков проблема сочетанного лечения касается и других разделов химиотерапии внутренних болезней. С одной стороны, приобретает все большее значение полихимиотерапия. Она необходима при онкологических заболеваниях, гемобластозах, где отход от комплексной программы чаще всего означает нарушение системы лечения, срыв лекарственно-обусловленной ремиссии и гибель больного. Тщательно разрабатывается комплексный подход к терапии хронических заболеваний. С другой стороны, нарастает необходимость все более настойчивой борьбы со случайными, произвольными комбинациями фармакологических препаратов. Смертельно опасным считают одновременное применение морфина и анаприлина, но последствия зависят от суммарной дозы и ее адекватности состоянию больного. Избегают назначения анаприлина одновременно с изоптином (ве-рапамилом), анаприлина с ингибиторами моноаминоксидазы, релаксантов на фоне приема хинидина. Просчеты в применении медикаментозной терапии, несмотря на попытки ее индивидуализации, а часто именно из-за некритичного варьироэа-ниь приводят к многочисленным осложнениям. В США за 10 лет (1961-1970) госпитализировано в связи с осложнениями медикаментозного лечения 15 млн человек, экономические потери превысили таковые от инфекционных заболеваний. Тем не менее лучшие из сложных, многокомпонентных лекарственных прописей не без оснований получили распространение и апробированы лечебной практикой. Они характеризуются сбалансированностью ингредиентов, и их «упрощение» не всегда бывает безвозмездным. К числу таких препаратов относятся, например, применяемые при бронхиальной астме солутан, теофедрин, антастман, в гастроэнтерологии - викалин и слабительные коктейли, в гепатологии - Лив 52 и эссенциале. Монотерапия даже наиболее современными препаратами часто оказывается лишь первой ступенью лечения. Ей на смену затем приходит более эффективное всесторонне рассчитанное комплексное лечение больного. Иногда эта комплексность достигается включением физиотерапевтических и иных немедикаментозных средств лечения, но чаще в первую очередь речь идет о комбинации фармакологических препаратов. Широкое распространение получипа система ступенчатого подхода к лечению больных с прогрессирующими формами артериальной гипертензии. На смену монотерапии, которую в свое время предпочитали проводить салуретиками тиазидового ряда, а ныне варьируют в зависимости от особенностей процесса (мочегонные с включением калийсбере-гающих, препараты раувольфии, р-адреноблокаторы, клофе-лин, антагонисты кальция), затем приходит политерапия. Закономерным является процесс разработки стандартизованных полиингредиентных рецептур. К числу таких прописей относились депрессии, разработанный к 1960 г. А. Л. Мясни-ковым, и более современные формы - адельфан, бринер-дин, триампур и др. Следует различать комплексные препараты, включающие набор тех или иных ингредиентов преимущественно с целью восполнения возникающего в организме дефицита или заместительной терапии, и сочетанное применение фармакоди-намически активных препаратов. К числу первых относятся инфузионные растворы сложного электролитного состава, поливитаминные и полиаминокислотные рецептуры. К числу вторых-сложные рецептуры синергично действующих препаратов. Рациональный подбор комплексного препарата во втором случае значительно сложнее, но и прописи первого рода требуют строгого соблюдения оптимальных соотношений (табл. 5). При поддерживающем, длительном лечении значение приобретают развитие толерантности к тому или иному препарату, снижение его эффективности. Наряду с другими методами преодоления этого феномена (прерывистый курс, ритм приемов) большое значение имеет правильное использование политерапии. Таблица 5. Фармакологическая несовместимость витаминов при длительном их введении в повышенных дозах [Я. Б. Максимович, Е. А. Лвгеда]
Для проведения поддерживающей терапии создаются специальные лекарственные формы, отвечающие ряду условий, в том числе комплексные, обладающие достаточной длительностью действия, допускающие прием в течение дня одной таблетки. Иногда полиингредиентные таблетки делают по необходимости многослойными (мексаза, панзинорм). Одна из задач создания официальных комплексных фармакологических форм-предупреждение произвольного, ограниченного лишь прямыми противопоказаниями использования случайных комплексов лекарств. Конечный результат полипрагмазии всегда отличается от ожидаемой суммы искомых эффектов, поскольку многообразны формы взаимодействия этих эффектов в организме и труднопредсказуемы побочные действия. Повышенная осторожность необходима при лечении детей, беременных женщин, а также при включении в комплекс внутривенных, капельных, внутримышечных и иных парентеральных введений. Особенности фармакотерапии у детей и лиц пожилого возраста. До середины 20 в. особенности Ф. изучались в основном у детей, и лишь в 60-х гг. в рамках возрастной фармакологии выделилось гериатрическое направление. Фармакотерапия у детей отличается более сложным подходом к определению ее тактики, т.к. по характеру взаимодействия с большинством лекарственных средств организм ребенка приближается к взрослому организму лишь к 12—14 годам. Различия в состоянии систем, реагирующих с лекарством и определяющих его транспорт, метаболизм и выведение в разные периоды постнатального развития ребенка, столь существенны, что исключают какую-либо стандартизацию в тактике Ф. у детей без учета степени развития этих систем на данный возрастной период. Более всего особенности взаимодействия организма с лекарственным средством выражены у новорожденных и грудных детей. Для биодоступности препаратов в энтеральных лекарственных формах существенное значение в эти периоды имеют богатство кровеносной и лимфатической васкуляризации желудка и кишечника, низкая кислотность желудочного сока (в 3—4 раза ниже, чем у взрослых), высокая проницаемость пор кишечной стенки для крупных молекул. В целом эти особенности облегчают пассивный транспорт лекарственных средств, особенно алкалоидов (кофеина и др.), в то время как биодоступность лекарств, требующих активного транспорта, у грудных детей снижена (хуже всасываются, например, тетрациклин, рибофлавин, ретинол). Количество альбуминов в плазме новорожденных и грудных детей меньше, чем у взрослых, при этом многие лекарственные средства менее прочно связываются белками и легче вытесняются естественными метаболитами, например билирубином. Это создает условия для повышенной десорбции (освобождение от связи с белком) лекарственных средств, связываемых белками (дигоксин, сульфаниламиды и др.), и увеличения свободной фракции препарата в крови с соответствующим возрастанием действия вплоть до токсического, что особенно важно учитывать при гипербилирубинемии новорожденных и при сочетанном применении лекарственных средств, конкурентно связываемых белками плазмы. Некоторые препараты тем медленнее выводятся из крови, чем младше ребенок. Так, период полувыведения из крови сибазона у недоношенных новорожденных в 2 раза длительнее, чем у доношенных, и в 4 раза длительнее, чем у детей 4—8 лет. Распределение лекарственных средств в организме ребенка происходит по тем же закономерностям, что у взрослого, но проникновение большинства их в различные органы, включая головной мозг, у новорожденных и грудных детей выше, чем у детей старшего возраста, из-за незавершенного развития гистогематических барьеров. Этим обусловлено, в частности, повышенное поступление в мозг различных жирорастворимых лекарственных средств, в т.ч. ряда снотворных, угнетающее действие которых на мозг новорожденных более выражено, чем у взрослых. В то же время многие из этих лекарственных средств в меньшей степени сорбируются тканью мозга, т.к. у новорожденных она содержит меньше липидов. Особенности кинетики водорастворимых лекарственных средств определяются большим объемом внеклеточной воды в организме новорожденных и грудных детей, а также высоким темпом обмена внеклеточной воды (почти в 4 раза более высоким, чем у взрослых), что способствует более быстрому выведению препаратов. Метаболическая инактивация лекарственных средств у детей ограничена в связи с меньшей массой паренхимы печени, низкой активностью окислительных ферментов и системы детоксикации путем образования конъюгатов с глюкуроновой кислотой, завершающей свое становление только к 12 годам. У новорожденных установлены также качественные отличия в биотрансформации ряда лекарственных средств (например, аминазина, сибазона, промедола), характеризующиеся образованием метаболитов, не обнаруживаемых у детей старшего возраста и у взрослых. Обилие исключений из установленных у взрослых закономерностей требует знания особенностей биотрансформации отдельных препаратов. Известно, например, что у новорожденных и грудных детей значительно замедлен метаболизм амидопирина, бутадиона, сибазона, левомицетина, морфина и ряда других препаратов. Достаточно обоснованным следует считать положение, согласно которому у детей скорость метаболизма лекарственных средств, завершающегося образованием конъюгатов с серной кислотой, существенно не отличается от таковой у взрослых, и для лекарственных средств, инактивируемых в результате образования конъюгатов с глюкуроновой кислотой, метаболизм тем медленнее, чем меньше возраст ребенка. Выведение лекарств почками у новорожденных и детей первого года жизни в целом замедлено как из-за более низкой, чем у взрослых, клубочковой фильтрации (по выделению креатинина — примерно в 2 раза) и меньшей проницаемости базальной мембраны почечных клубочков, так и вследствие незавершенного развития ферментных систем, обеспечивающих экскрецию в канальцах почек лекарств и их метаболитов. Некоторые препараты, например бензилпенициллин, у детей уже в возрасте 2—3 мес. выводятся с такой же скоростью, как и у взрослых. При выборе лекарства, кроме особенностей его фармакокинетики у детей, учитывают и особенности его фармакодинамики, которые зависят от уровня развития систем, определяющих реализацию фармакологического эффекта в данном возрасте ребенка. Так, например, гипотензивное действие ганглиоблокаторов у детей первых двух лет жизни проявляется слабо, у грудных детей ослаблен гипертензивный эффект эфедрина при выраженном влиянии на АД мезатона и т.п. Терапевтическую значимость ожидаемого фармакологического эффекта соотносят с риском нежелательных действий препарата, вероятность и характер которых не одинаковы у детей разного возраста и у взрослых. Так, например, по сравнению с детьми старшего возраста у детей первых 3 мес. жизни вероятность развития гемолиза и метгемоглобинемии вследствие применения нитрофуранов, викасола и других препаратов значительно выше, что обусловлено высоким содержанием в их крови фетального гемоглобина. Вероятность токсического действия препаратов в эквивалентных (на единицу массы тела) дозах у новорожденных и грудных детей для некоторых лекарственных средств ниже (адреналин, стрихнин), для других — выше (морфин, левомицетин, тетрациклин и др.). С учетом нежелательных действий лекарственных средств И.В. Маркова и В.И. Калиничева (1980) выделяют группы препаратов, применение которых у новорожденных не более опасно, чем в других возрастных группах (пенициллины, макролиды, нистатин, кофеин, фенобарбитал и др.); лекарственные средства, используемые с осторожностью (атропин, аминазин, амидопирин, сердечные гликозиды, эуфиллин, гентамицин, линкомицин); средства, противопоказанные новорожденным (левомицетин, тетрациклин, канамицин, мономицин, налидиксовая кислота, сульфаниламиды, салицилаты, морфин и морфиноподобные анальгетики). Определение дозы препарата у детей не может быть ограничено поиском критериев эквивалентности дозе взрослого человека (по массе тела, поверхности тела и др.), так как метаболизм и выведение лекарственных средств у. детей могут качественно отличаться от таковых у взрослых. Средние дозы препаратов определяют из клинического опыта их применения в разных возрастных группах детей. На основании такого опыта устанавливают общие закономерности дозирования в единицах массы (граммах, миллиграммах), объема (каплях, миллилитрах), активности на 1 кг массы тела или 1 м2 поверхности тела либо на 1 месяц или 1 год жизни ребенка для отдельных лекарственных средств (анаприлин, эуфиллин и др.), а в более сложном выражении — в миллиграммах на 1 кг массы тела для отдельных возрастных периодов (с учетом возрастных изменений систем метаболизма препаратов и реактивности организма ребенка). Выбор критериев эффекта и средств контроля лекарственного действия у детей во всех возрастных группах ограничен в основном объективными признаками динамики патологического процесса, синдрома или симптома, т.к. субъективные критерии (информативность жалоб больного) значительно менее ценны, чем у взрослых, а у детей первого года жизни вообще отсутствуют. Ограничено также применение объективных инструментальных средств контроля, требующих активного участия больного в исследовании (определенная поза, произвольная задержка или усиление дыхания и др.). Все это создает трудности для обеспечения контролируемой Ф., особенно у детей раннего возраста. Соответственно повышается значение непрерывного клинического наблюдения за малейшими отклонениями в состоянии различных функций и поведении ребенка на фоне применения лекарственного средства, особенно в ожидаемые сроки его фармакологического действия. Отмена лекарственных средств у детей производится по тем же обоснованиям, что и у взрослых. Фармакотерапия у лиц пожилого и старческого возраста приобретает особенности по мере изменений, которые претерпевают при старении организма обмен веществ, барьерные функции тканей, системы метаболизма и выведения лекарств, а также чувствительность к лекарственным средствам различных органов и реактивность организма в целом. Недостаточная осторожность в выборе и дозировании лекарственных средств для больных пожилого возраста является, по-видимому, одной из причин большей частоты у них побочных действий (по данным разных исследователей, у лиц старше 70 лет побочные действия лекарственных средств наблюдаются в 3—7 раз чаще, чем у больных 20—30 лет). Биодоступность лекарств, применяемых энтерально в пожилом возрасте, уменьшается из-за снижения секреторной, моторной и всасывательной функций желудочно-кишечного тракта. На распределение препаратов влияет характерное для лиц пожилого и старческого возраста снижение содержания воды в организме и количества альбуминов в крови, уменьшение массы большинства органов, числа функционирующих кровеносных сосудов и сужение их просвета, изменение проницаемости гистогематических барьеров. Масса паренхимы печени у лиц старше 70 лет уменьшена, антитоксическая функция печени снижена, активность окислительных ферментов ослаблена. С этим связано замедление метаболизма лекарственных средств, в частности тех, инактивация которых завершается образованием сульфатов. Сокращается и скорость выведения лекарственных средств почками в связи с ослаблением энергозависимой экскреции через эпителий канальцев, уменьшением числа функционирующих нефронов (у лиц старше 70 лет их становится на 30— 50% меньше), снижением эффективности почечного плазмотока и скорости клубочковой фильтрации. Тактики Ф. у лиц пожилого и старческого возраста должна предусматривать: ограничение выбора лекарственных средств малотоксичными: назначение более высоких доз при начальном применении препаратов в энтеральных лекарственных формах; снижение дозы препаратов (особенно при парентеральном введении), выделяемых почками либо замедленно метаболизируемых в печени. Дозы некоторых лекарственных средств (нейролептики, кардиотонические средства, диуретики и др.), рекомендуемых лицам пожилого и старческого возраста для начального применения, составляют в среднем 1/2 дозы взрослого человека среднего возраста. Однако эти положения распространяются далеко не на все лекарственные средства (например, витамины, многие антибиотики и сульфаниламиды могут применяться в обычных дозах), поэтому для выработки рациональной тактики фармакотерапии следует учитывать своеобразие фармакологических эффектов, которое у лиц пожилого и старческого возраста определяется изменениями чувствительности к определенным лекарственным средствам и даже качественными изменениями реакций на отдельные препараты. У лиц пожилого и старческого возраста установлены закономерные особенности реакций на лекарственные средства, действующие на ц.н.с., что связывают, в частности, с нарастанием по мере старения организма дистрофических изменений в нейронах, с уменьшением числа нервных клеток и количества аксонов, а также со снижением функциональной активности ц.н.с. Показано, что для проявления возбуждающего действия на ц.н.с. фенамина, стрихнина, эфедрина у лиц пожилого возраста необходимы большие дозы этих препаратов, чем у лиц среднего возраста. К лекарственным средствам, угнетающим ц.н.с., в частности к барбитуратам и другим снотворным средствам. нейролептикам разных групп, включая резерпин, наркотическим анальгетикам, некоторым производным бензодиазепина (хлозепид) и др., отмечается, наоборот, повышенная чувствительность. Прямой фармакологический аффект этих препаратов достигается меньшими дозами и нередко сочетается с выраженными проявлениями нежелательного действия (угнетение дыхания, мышечная релаксация, возбуждение рвотного центра), применение же этих лекарственных средств в дозах, являющихся терапевтическими для лиц среднего возраста, часто приводит к интоксикации. Т.о., следует соблюдать особую осторожность при применении у лиц пожилого возраста даже малотоксичных снотворных и седативных средств (описаны, например, отравления бромидами), тем более нейролептиков. У лиц пожилого возраста чаще, чем в других возрастных группах, возникает необходимость в применении кардиотонических, гипотензивных и диуретических средств. Клинические наблюдения указывают на повышенную чувствительность миокарда лиц пожилого возраста к токсическому действию сердечных гликозидов. Это делает предпочтительным выбор малокумулирующих препаратов, медленные темпы начальной дигитализации и требует более частого контроля адекватности подобранной дозы. При выборе гипотензивных средств учитывают повышенную опасность резкого снижения АД и пртостатического коллапса при применении ганглиоблокаторов, симпатолитиков, а также нежелательное влияние на ц.н.с. ряда препаратов (резерпин, дегидралазин). Под влиянием салуретиков у лиц пожилого возраста может возникать более выраженная потеря калия (на единицу объема диуреза) при худшей, чем у лиц среднего возраста, переносимости этих потерь и способности к восстановлению электролитного баланса. В то же время нередко отмечается повышенная чувствительность к действию антагонистов альдостерона, вследствие чего они могут применяться в меньших дозах. Имеются основания считать, что повышению эффективности и снижению нежелательных последствий Ф. улиц пожилого и старческого возраста способствует одновременное применение витаминных комплексов, в частности витаминов В1, В6, В15. Особенности фармакотерапии у беременных женщин и кормящих матерей. Предотвращение нежелательных влияний на плод и на грудного ребенка лекарственных средств, проникающих через плаценту или выделяемых с молоком матери, занимает центральное место в тактике Ф. у беременных женщин и кормящих матерей. Особенности фармакотерапии у беременных женщин во многом определяются прогнозом влияния лекарственного средства на развивающийся плод. Плацентарный барьер проницаем в разной степени для подавляющего большинства лекарственных средств. Попадая в кровь и ткани плода, препарат может обусловить: фармакологический эффект; эмбриотоксическое действие, нарушение развития плода, тератогенное действие. Фармакологический эффект в организме плода в зависимости от дозы препарата может существенно отличаться от наблюдаемого у беременной женщины. Так, назначение беременной антикоагулянтов непрямого действия в дозах, которые вызывают у нее умеренное снижение протромбина, может обусловить множественные кровоизлияния в тканях плода. Количественные и качественные особенности фармакологического эффекта в организме плода определяются несовершенным развитием его систем, взаимодействующих с лекарственными средствами, особенностями распределения их в тканях (например, в головном мозге плода мезатона накапливается в 3 раза больше, чем у беременной), метаболизма и выведения. Эмбриотоксическое действие в наибольшей степени присуще лекарственным средствам, инактивируемым путем их метаболизма, т.к. энзимная активность микросом печени у плода низкая. Несовершенным метаболизмом объясняются высокая токсичность для плода левомицетина, морфина, барбитуратов короткого действия (гексенал, тиопентал-натрий) при меньшей токсичности барбитуратов длительного действия (барбитал, фенобарбитал), которые выводятся из организма преимущественно в неизмененном виде. Своеобразной формой необычного действия лекарственных средств, вытесняющих связанный с белком билирубин, является так называемая желтуха мозговых ядер. Она наблюдается у плода при назначении беременным длительно или в высоких дозах лекарственных средств, связываемых белками плазмы (сульфаниламиды, сибазон, гидрокортизон и др.), и объясняется слабостью гематоэнцефалического барьера у плода и непрочной связью билирубина с белком плазмы. Опосредованное влияние лекарственных средств на развитие плода имеет разные формы. К ним относятся, например, нарушения дыхания плода вследствие снижения плацентарного кровотока или гипоксемии при применении беременными женщинами адреномиметиков, вызывающих спазм сосудов, средств, связывающих гемоглобин (нитриты), препаратов, провоцирующих у беременной обострение бронхиальной астмы (ацетилсалициловая кислота и др.); дефицит витаминов группы В при применении антибиотиков, диуретиков, слабительных средств; дефицит кальция при применении тетрациклина; синдром гиперкортицизма за счет вытеснения кортизола препаратами, связываемыми белками плазмы. Тератогенное действие лекарственных средств в наибольшей степени проявляется в так называеые критические периоды эмбриогенеза — период имплантации (первая неделя после зачатия), период плацентации (9—12-я недели) и особенно в период органогенеза (3—6-я недели беременности). Со II триместра беременности вероятность тератогенного действия лекарственных средств снижается, но полностью не исключена, т.к. тонкие процессы функциональной дифференцировки тканей плода продолжаются. Полагают, что тератогенное действие некоторых препаратов объясняется их способностью включаться в обмен веществ плода из-за сходства их химического строения с естественными метаболитами (например, тератогенную активность галидомида связывали со сходством его с рибофлавином). В экспериментах на животных аномалии развития плода вызывает большое число лекарственных средств, но поскольку установлены и видовые различия, ценность экспериментальных данных для прогноза тератогенного влияния отдельных препаратов у человека не высока. Из средств, влияющих на ц.н.с., тератогенная активность обнаружена, кроме талидомида, у производных фенотиазина (вызывают различные аномалии развития у животных и фокомелию у человека), резерпина, мепротана, хлозепида; экспериментально установлена высокая тератогенная активность некоторых витаминных препаратов, в частности ретинола (расщепление неба у 100% животных, анэнцефалия у 50%. возможны микрофтальмия, отсутствие хрусталика), никотиновой кислоты, а также бензилпенициллина (синдактилия у 45% животных), адренокортикотропного гормона, кортизона, цитостатических средств. Т.о., с учетом влияния лекарственных средств на плод любая фармакотерапия в I триместре беременности имеет относительные противопоказания в связи с неполными в настоящее время данными о тератогенной активности препаратов. В последующие периоды беременности остаются противопоказания к препаратам с эмбриотоксическим действием и нарушающим нормальное развитие плода, а также к лекарственным средствам, влияющим на родовую деятельность. Ф. осуществляется в этот период только по серьезным показаниям, включая возникновение болезней, которые сами по себе нарушают течение беременности и развитие плода. Наиболее часто необходимость в применении лекарственных средств у беременных женщин возникает в связи с инфекционными болезнями, а также с флеботромбозами, нередко осложняющими течение беременности, артериальной гипертензией, отеками. При выборе препаратов в этих случаях учитывают их сравнительную опасность для плода в данный период беременности. Из антибактериальных средств в первом триместре беременности преимущества имеют ампициллин, не обладающий тератогенной активностью, оксациллин, плохо проникающий через плацентарный барьер, сочетание этих препаратов (ампиокс), а также Цефалоспорины. Однако в высоких дозах эти препараты, как и сульфаниламиды, могут обусловить появление у плода «желтухи мозговых ядер». Относительно плохо проникает через плацентарный барьер эритромицин (концентрации в плазме плода в 5 раз меньше, чем в плазме матери). В I триместре беременности противопоказаны сульфаниламиды пролонгированного действия, т.к. они обладают тератогенной активностью. Во все периоды беременности следует исключить применение тетрациклина и левомицетина, обладающих выраженным эмбриотоксическим действием. Из антикоагулянтов предпочтителен гепарин, который не проходит через плацентарный барьер и потому безвреден для плода. Непрямые антикоагулянты противопоказаны не только из-за опасности геморрагий у плода, их применение в первом триместре беременности угрожает также аномалиями развития. Гипотензивные средства и диуретики часто применяют при токсикозе второй половины беременности, когда тератогенное действие маловероятно. Предпочтительнее введение метилдофы, реже октадина, при гипертензивных кризах внутривенно — апрессина (40—100 мг) и дихлотиазида (150—200 мг) в виде однократных вливаний (следует помнить, что длительное применение дихлотиазида обусловливает развитие у плода гипергликемии, гипербилирубинемии, тромбоцитопении). Резерпин, биотрансформация которого замедлена даже у новорожденного, в суточной дозе для беременной более 0,5 мг может обусловить гиперсекрецию в носу и бронхах плода и вследствие этого обструкцию дыхательных путей. Применения ганглиоблокаторов избегают из-за угрозы мекониевой непроходимости у плода. Из диуретических средств тератогенной активностью обладает фуросемид, но во второй половине беременности его применение практически не ограничивают. При использовании дихлотиазида у беременных с преэклампсией учитывают возможность повышения при этом уровня мочевой кислоты в крови. Особенности фармакотерапии у кормящих матерей сводятся к снижению опасности нежелательного действия препаратов, принимаемых матерью, на грудного ребенка. Попадают при кормлении в организм ребенка и могут оказать токсическое действие препараты, применяемые для обмывания сосков, в частности растворы борной кислоты (кумулируют в тканях ребенка, приводят к метаболическому ацидозу и поражению почек) и ацетата свинца (угроза свинцовой интоксикации с развитием энцефалопатии). Женщины, применяющие такие растворы, должны перед кормлением ребенка тщательно обмывать соски водой. Выделение разных лекарственных средств молочной железой различно; концентрация некоторых из них (например, тиоурацила) в грудном молоке может быть в несколько раз большей, чем в плазме крови матери, что может обусловить и фармакологические эффекты, и токсическое действие на организм ребенка. Даже небольшое количество лекарственных средств, проникающее в грудное молоко, не всегда безопасно как в отношении токсического действия (из-за несовершенства метаболизма лекарственных средств в организме грудного ребенка), так и вследствие возможной сенсибилизации организма ребенка с формированием лекарственной аллергии (Лекарственная аллергия). Противопоказаны кормящим матерям соли лития, тиоурацил, налидиксовая кислота, амантадин, препараты золота, радиоактивные препараты кальция, йода. Чем меньше возраст грудного ребенка, тем более противопоказано лечение матери изониазидом (нарушает усвоение витамина В6), левомицетином (токсическое действие), тетрациклинами (нарушение развития у ребенка зубов, скелета); с осторожностью должны применяться сульфаниламиды, салицилаты. При необходимости использования кормящей матерью этих препаратов длительно или в высоких дозах целесообразно переводить ребенка на искусственное вскармливание. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
