|
|
часть_1_2012. Лекции по биологии в 2х кн. Ч. I. Цитология и генетика Под ред проф. Т. В. Викторовой. Уфа, 2012. 192 с., ил
Глава 13
Медицинская генетика. Популяционно-статистический, цитогенетический и молекулярно-генетические методы. Полимеразная цепная реакция синтеза ДНК Популяционно-статистический метод это метод изучения генетической структуры популяций.
Возможности метода:
Метод позволяет оценить распространенность наследственных заболеваний в популяции, рассчитать частоты аллелей и генотипов, определить частоту гетерозиготных носителей мутаций.
Дает возможность охарактеризовать мутационный процесс, оценить роль наследственности и среды в формировании генетической структуры популяции, в возникновении болезней.
Позволяет охарактеризовать демографические процессы в популяциях человека, выявить источники происхождения мутаций (по градиенту частот), определить основные направления миграций населения по спектру мутаций.
На основе изучения распространения генов среди населения различных географических регионов (геногеография) дает возможность установить центры происхождения различных этнических групп и их миграции, определить степень риска появления той или иной наследственной патологии в конкретном регионе.
Популяция – это совокупность особей одного вида, длительно населяющих одну территорию, относительно изолированных других групп особей данного вида, свободно скрещивающихся между собой и дающих плодовитое потомство.
Совокупность всех аллельных вариантов генов популяции называется генофондом.
По численности особей популяции могут быть большие и малые. Большие человеческие популяции включают более 4 тыс. чел. Малые подразделяются на демы и изоляты. Демы – имеют численность от 1,5 до 4 тыс. чел. Изоляты – наименьшие популяции людей численностью до 1,5 тыс. чел. В них часто встречаются кровно-родственные браки, на долю внутригрупповых браков приходится более 90%. Приток генов из вне – менее 1%.
Существенным моментом при использовании популяционно-статистического метода является генетический анализ популяций. Он
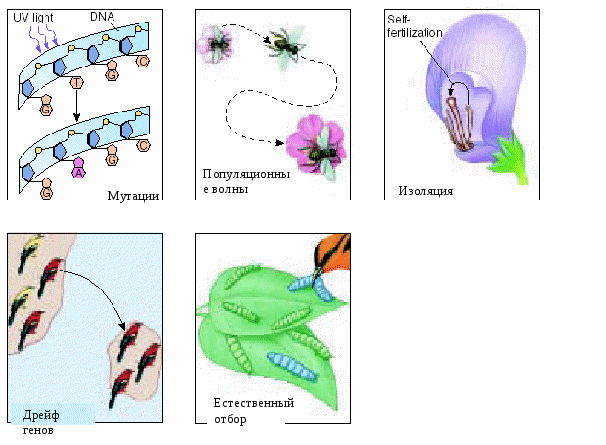
Рис. 12.2. Движущие силы эволюции.
начинается с изучения распространенности в популяции того или иного признака (наследственного заболевания, фенотипа, генотипа, аллеля и т.д.). Частота признака, т.е. количество особей, обладающих данным признаком, по отношению к общему числу особей, выражается в долях единицы или в %. Н-р: ФКУ выявлено у 7 из 7000 новорожденных. Следовательно, частота заболевания составляет 7:7000 или 0,0001, или 1 случай на 10 тыс. н/р.
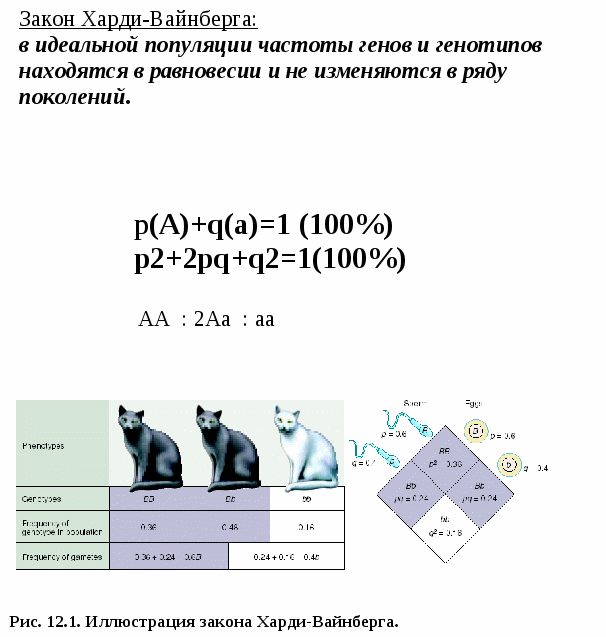
Основой для выяснения генетической структуры популяций является закон Харди-Вайнберга (1908) или закон поддержания генетического равновесия в популяции. Харди (Английский математик), Вайнберг (немецкий врач). Они сформулировали закон поддержания генетического равновесия в популяции.
Закон Харди-Вайнберга:
в идеальной популяции частоты генов и генотипов находятся в равновесии и не изменяются в ряду поколений.
Основные положения закона Харди-Вайнберга (рис.12.1):
частота аллелей в популяции – величина постоянная. p+q=1 (100%)
Частота генотипов также величина постоянная и может быть выражена формулой: (p+q)2 = p2+2pq+q2=1, или АА+2Аа+аа=1. Эта формула дает возможность рассчитать частоту встречаемости в конкретной популяции гетерозиготных носителей рецессивных аллелей.
Н-р: частота ФКУ 1:10000 нр (частота генотипа аа). Следовательно, q2 = 1/10000, q=1/100. Т.к. р+q=1, то p=1-q = 99/100. Частота гетерозиготных носителей = 2pq = 2 x 1/100 x 99/100 = 1/50. В данной популяции каждый 50 – носитель мутации гена.
Закон Харди-Вайнберга выполняется в следующих условиях:
Популяция должна быть большой (т.е. близкой к идеальной).
Имеются условия для случайной встречи гамет, т.е. полная панмиксия – отсутствие ограничений в выборе партнера.
Отсутствует мутационный процесс.
Нет притока генов (иммиграции).
Нет отбора.
В реальных популяциях происходят различные генетические процессы, изменяющие частоты доминантных и рецессивных генов. Это 5 основных факторов: 1 – мутации, 2 – случайные колебания частот генов (миграции), 3 – изоляция, 4 - дрейф генов, 5 – естественный отбор (рис.12.2). Эти 5 факторов – основные движущие силы эволюции. Поскольку в больших
популяциях эти факторы незначительно меняют частоты генов, в них сохраняется закон Х-В.
Мутации – изменяют частоту генов в популяции. Доминантные мутации проявляются уже в первом поколении и сразу же подвергаются действию естественного отбора. Рецессивные мутации сначала накапливаются в популяции (т.к. не проявляются в гетерозиготном состоянии) и только с появлением рецессивных гомозигот подвергаются действию естественного отбора. Насыщенность популяций мутациями называется генетическим грузом.
Случайные колебания частот генов в малых популяциях. Пример. Теоретически рождение мальчика или девочки равновероятно, но в малых выборках (семья) в силу случайных причин это равновесие может нарушаться. Случайным колебаниям частот генов способствует миграция населения. Иммиграция поставляет новые аллели и комбинации генотипов, эммиграция – изменяет соотношение различных генотипов в популяции. Повышение уровня гетерозиготности является одной из причин акселерации.
Изоляция – это ограничение свободы скрещивания. Различают несколько типов изоляции: географическая (горы, реки, проливы, большие расстояния), генетическая (неполноценность гибридов), экологическая (обитание в различных экологических нишах при разных температурах), морфофизиологические (различия в строении половых органов), социальная (принадлежность к определенному слою общества, национальные традиции), этологическая (религиозные мотивы ограничения браков) и т.д. В малых популяциях часто наблюдается инбридинг – кровно-родственные браки между родственниками 2 и 3 степени (1 – 50%, 2 – 25%, 3 – 12,5%, 4 – 6,3%). Эти браки нежелательны, т.к. они приводят к инбредной депрессии, поскольку у родственников высокая степень вероятности гетерозиготности по одному и тому же рецессивному патологическому гену.
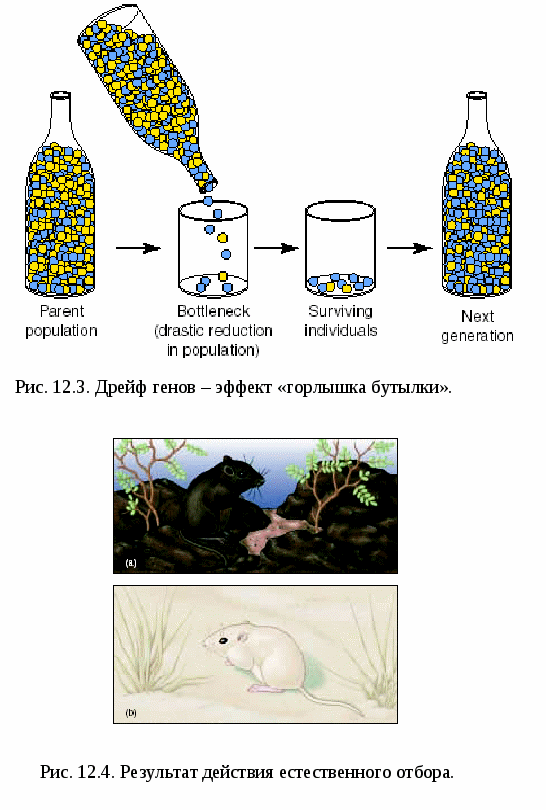
Дрейф генов – генетико-автоматический процесс, характеризующийся случайным резким увеличением частот каких-либо генов. Этот эффект наблюдается при резком увеличении численности какой-либо небольшой группы особей, частоты генов в которой существенно отличаются от исходной популяции. Примером дрейфа генов является эффект «горлышка бутылки» (рис.12.3).
Естественный отбор. Элиминирует из популяции менее удачные комбинации генов и генотипов и избирательно сохраняет наиболее выгодные для существования комбинации, тем самым изменяя частоту генов (рис.12.4). Интенсивность естественного отбора даже в современных человеческих популяциях довольно высокая. Почему? Спонтанные аборты
Культивирование клеток крови человека (чаще лимфоцитов венозной крови) на питательных средах.
Стимуляция митозов фитогемагглютинином (ФГА).
Добавление колхицина (разрушает нити веретена деления) для остановки митоза на стадии метафазы.
Обработка клеток гипотоническим раствором (хромосомы расходятся и лежат отдельно друг от друга).
Приготовление препаратов на предметных стеклах.
Окрашивание хромосом.
Цитогенетический анализ хромосомных препаратов.
Рис. 12.5. Этапы цитогенетического анализа хромосом.
составляют около 50% всех зачатий, мертворождения – 3%, ранняя детская смертность – 2%, не вступает в брак около 20% людей, бесплодны – 10% браков. Т.о. около 75% людей не вносят вклад в генофонд будущих поколений!
Цитогенетический метод (рис. 12.5)
Главная задача цитогенетического метода – кариотипирование, т.е. точная идентификация хромосом. В медицинской цитогенетике главная задача – ответить на вопросы: нормален ли хромосомный набор и в чем состоит найденное отклонение. Специфичность кариотипа определяется общим числом, размером и формой хромосом.
Основные цитогенетические методы включают изучение метафазных хромосом или интерфазных ядер.
Изучение метафазных хромосом
Отправным моментом в изучении хромосом человека служит получение клеточной популяции с высокой митотической активностью (культивирование). Существуют прямые и непрямые методы культивирования. При прямом методе для исследования берут клетки, активно делящиеся в организме. Источником таких клеток является на практике костный мозг. Этот метод имеет сравнительно узкое применение, преимущественно в цитогенетических исследованиях новообразований кроветворной системы. Непрямые методы связаны с предварительным культивированием выделенных из организма клеток в питательной среде in vitro. Чаще всего их источником служит периферическая кровь. В присутствии стимулятора митозов фитогемагглютинина в культуре автивному размножению повергаются лимфоциты. Другой тканью для получения размножающихся клеток служит кожа. Для культивирования берут небольшой кусочек ее поверхностного слоя, при этом размножению подвергаются фибробласты подкожной соединительной ткани. Широко используются также разные ткани абортированных эмбрионов человека, клетки амниотической жидкости. Для получения достаточного количества делящихся клеток культуры выдерживают в термостате (инкубаторе) при 370 С в течение 48-72 часов.
Первой манипуляцией с размножающимися клетками при приготовлении препаратов хромосом является воздействие на клетки колхицином. Примененные в конечной концентрации 0,05-0,5мкг/мл эти агенты останавливают митотическое деление на стадии метафазы, обеспечивая тем самым накопление метафазных пластинок и способствуя последующему разбросу хромосом на предметном стекле благодаря дезорганизации митотического веретена деления и укорочению хромосом.

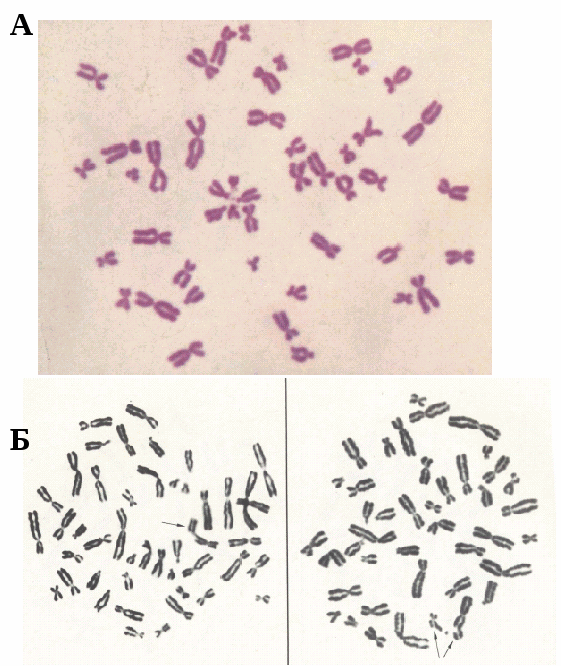
Рис. 12.6. Метафазные хромосомы:
А - Рутинная окраска метафазных хромосом,
Б - Анализ хромосомных аберраций.
Оптимальная продолжительность действия колхицина составляет 1,5-2 ч. для культур лимфоцитов и 5-6 ч. для культур фибробластов. При более продолжительном действии метафаз накапливается больше, однако, они становятся менее пригодными для анализа из-за чрезмерной конденсации хромосом.
Вторая обязательная манипуляция при приготовлении препаратов хромосом – воздействие на клетки гипотоническим раствором с целью разобщения хромосом набора. Для этого используются разные по составу и концентрации солей растворы, обработку ими культур проводят при комнатной температуре или при +37оС. Чаще всего применяют 0,55% (0,07М) раствор хлорида калия, в котором лимфоциты инкубируют в течение 5-10 мин. Используя также инкубацию в течение 15-30 мин. в 0,95-1% растворе цитрата натрия.
Следующей процедурой является фиксация. Обязательным компонентом применяющихся фиксаторов служит ледяная уксусная кислота, которую смешивают с метиловым или этиловым (абсолютным) спиртом в соотношении 1:3. Саму процедуру фиксации проводят в разных вариантах, при этом важно проведение клеток через несколько смен фиксатора. Ответственной манипуляцией, от которой зависит качество препарата, является нанесение взвеси фиксированных клеток на предметное стекло. Ее основное назначение – получить на предметном стекле хороший разброс, так чтобы все хромосомы метафазной пластинки лежали раздельно. В настоящее время стандартной стала методика получения высушенных на воздухе препаратов.
Методы окраски хромосом
Рутинная окраска хромосом (рис. 12.6)..
Для равномерной окраски хромосом по длине используют основные красители: азуры, основной фуксин, орсеин и др. До окраски высушенные препараты можно хранить неограниченно долгое время. Чаще всего применяют краситель Романовского-Гимзы, который разводят водопроводной водой, или азур-эозин. Эти красители дают интенсивное окрашивание хромосом. Сравнительно часто практикуется окраска карболовым фуксином. Рутинная окраска позволяет охарактеризовать число и морфологию хромосом, выявить некоторые структурные нарушения, в частности, поломки, межхромосомные обмены с образованием дицентрических хромосом, крупные транслокации.
Дифференциальная окраска хромосом (рис. 12.7).
Около четверти века назад в практику хромосомного анализа стали широко входить методы дифференциального окрашивания хромосом.
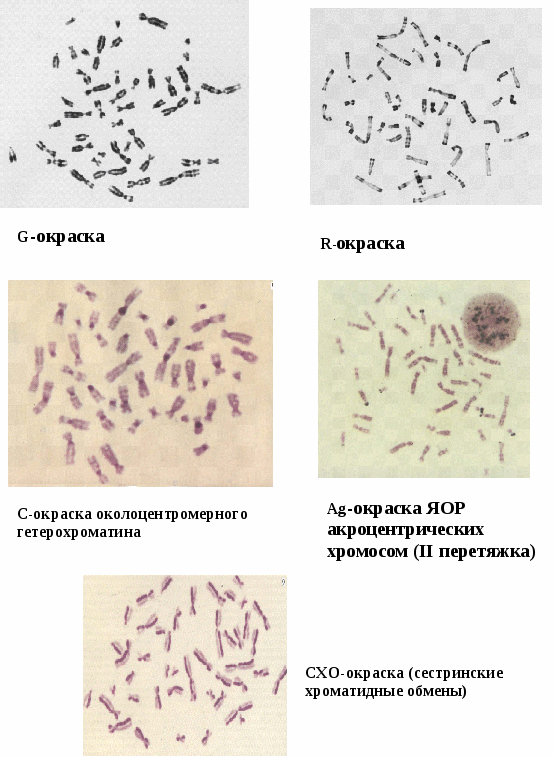
Рис. 12.7. Способы дифференциальной окраски метафазных хромосом.

Впервые метод был предложен Касперссоном, который показал, что при обработке препаратов митотических хромосом с помощью флуорохрома акрихиниприта во флуоресцентном микроскопе видны поперечные светящиеся полосы (бэнды), расположение которых характерно для каждой хромосомы. Этот прием цитологического анализа в сочетании с генетическими наблюдениями уже в настоящее время позволил начать составление хромосомных карт человека, то есть находить места расположения генов на определенных участках хромосом. Молекулярные механизмы такой специфической окраски до сих пор еще не ясны, многие исследователи способность отдельных участков хромосом к окрашиванию связывают с их химическими различиями и неравномерной конденсацией разных участков по длине хромосомы.
Основные способы дифференциальной окраски хромосом.
Q-окраска (флуоресцентная с использованием флюорохромов. Большинство флюорохромов имитирует зеленое, а иногда оранжевое и даже красное свечение. Для исследования хромосом в этих случаях применяют мощные рутинно-кварцевые лампы. Из флюорохромов чаще всего используют производные акридина (акрихин и акрихин-иприт). акрихина иприта). Рисунок каждой хромосомы, окрашенной Q-методом, специфичен по числу, размерам и положению по-разному светящихся сегментов, что и обеспечивает идентификацию всех хромосом. Q-окраска является индикатором хроматина с повышенным содержанием AT-пар оснований, поскольку они интенсивнее флюоресцирует в соответствующих участках хромосомы.
G-окраска Методики, с помощью которых получают G-окраску хромосом, разнообразны. Общим для всех них является:
Во-первых, определенная предварительная обработка препаратов хромосом перед окрашиванием; чаще всего применяется предварительная обработка трипсином.
Во-вторых, использование для окрашивания нефлюоресцирующих основных красителей (азуры, метиленовый синий);
По числу, величине и расположению выявляющихся сегментов рисунок G-окраски аналогичен рисунку при Q-окраске. На G-окрашенных хромосомах наблюдаются изменения рисунка линейной дифференцированности хромосом, связанные со степенью митотической конденсации хромосомы.
R-окраска. Рисунок при R-окраске противоположен рисунку при G–окраске. Ключевым моментом выполнения R-окраски является нагревание препаратов хромосом при высокой температуре (78-90С). Окрашивание
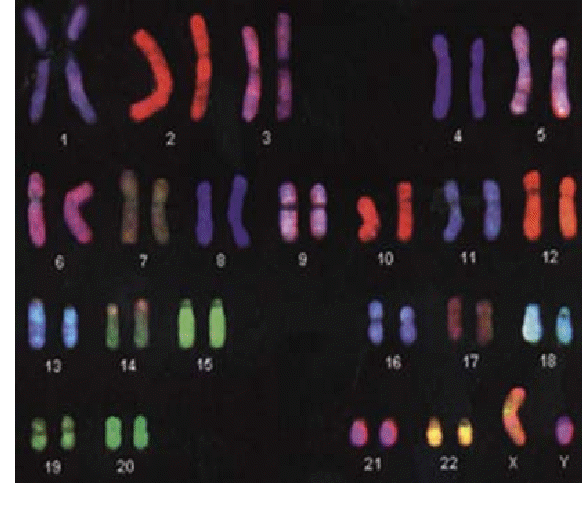
Рис. 12.8. FISH-окраска хромосом (флуоресцентная гибридизация in situ) – надежный способ диагностики любых хромосомных транслокаций.
препаратов можно проводить как смесью красителей Романовского-Гимзы, так и акридиновым оранжевым.
С-окраска. Метод основан на кратковременном воздействии на препараты хромосом щелочью. В отличие от предыдущих трех типов дифференциальной окраски при С-окраске в каждой хромосоме человека краситель воспринимает лишь центромерный и околоцентромерный районы во всех хромосомах и длинное плечо Y-хромосомы. По локализации выделяют 4 типа С-гетерохроматина: собственно центромерный, присущий всем хромосомам, гетерохроматин вторичных околоцентромерных перетяжек аутосом 1, 9 и 16, гетерохроматин коротких плеч акроцентрических аутосом, гетерохроматин длинного плеча Y хромосомы. Позволяет лучше, чем какой-либо другой метод, оценивать хромосомный полиморфизм. Используется для уточнения характера хромосомных перестроек, особенно помогая в идентификации перицентромерных инверсий.
Помимо дифференциальной окраски в цитогенетике используют избирательную окраску хромосом. Избирательная окраска – окраска отдельных районов индивидуальных хромосом. Чаще всего метод используется для выявления ядрышкообразующих районов, которые расположены в коротких плечах всех десяти акроцентрических хромосом. В настоящее время применяют метод, основанный на использовании нитрата серебра и проведении процедуры серебрения при нагревании. Называют эту пробу Ag-окраской, что отражает использование соединений серебра. На удачных препаратах хромосомы окрашены в желтый цвет. В коротких плечах акроцентрических хромосом четко выявляются темно-коричневые или черные точечные образования – гранулы серебра. Хотя тонкие механизмы окраски ядрышкообразующих районов хромосом пока не известны, однако установлено, что красяшимся субстратом при Ag-окраске являются не ДНК рибосомных генов и не рРНК, а кислые белки, по-видимому, входящие в структуру ядрышка и связанные с рРНК (рибонуклеопротеиды, являющиеся продуктом активности хромосомы). Поэтому метод серебрения позволяет выявить не всякий ЯО, а лишь функционирующий в предшествующей митозу интерфазе, а интенсивность их окрашивания соответствует интенсивности функционирования.
FISH-окраска (рис.12.8).. В цитогенетике млекопитающих последние годы ознаменованы стремительным развитием новых методов исследований, в основе которых лежит флуоресцентная in situ гибридизация нуклеиновых кислот. Десять-пятнадцать лет назад

возможности исследователя были практически сведены к изучению морфологии и дифференциальной окрашиваемости хромосом и их отдельных районов. Развитие методов, способных на цитологических препаратах визуализировать интересующие последовательности ДНК, резко изменило ситуацию. Метод флуоресцентной in situ гибридизации (FISH) оказался крайне эффективным инструментом изучения генома человека и других видов млекопитающих, реорганизации хромосом в ходе эволюции, анализа хромосомных перестроек как при малигнизации клеток, так и при врожденных патологиях. Гибридизация in situ дала начало огромному числу методических разработок, которые уже нашли широкое применение в практической медицине, а современная хромосомная диагностика продвинулась значительно дальше самых смелых фантазий цитологов 80-х годов. Значительную роль в развитии новых вариантов FISH сыграл приход новых методов регистрации микроскопических изображений. Замена фотонасадок CCD-камерами (CCD-камерами с высоким уровнем разрешения, охлаждаемыми CCD-камерами с длительным временем накопления сигнала и т.д.) с соответствующим компьютерным обеспечением не просто упростила и ускорила процесс регистрации микроскопических изображений, но и предоставила экспериментатору принципиально новые возможности обработки изображений, записанных в цифровом формате. Такой метод хромосомного анализа позволяет выявлять и идентифицировать любые транслокации материала негомологичных хромосом. Окраска хромосомы более чем одним цветом свидетельствует о наличии транслокации. Цвет хромосомных районов позволяет однозначно определить хромосомы, которые были вовлечены в данные хромосомные перестройки. Имеются в наличии коммерчески доступные наборы меченых ДНК проб и необходимых систем детекции. Метод позволяет проводить быструю идентификацию значительной части внутри- и межхромосомных перестроек.
Классификации хромосом (рис. 12.9)
Для того, чтобы было легче разобраться в сложном комплексе хромосом человека, предлагалось множество способов их классификации (по форме, по размерам и т.д.). В 1960 г. в г. Денвере (Англия) была принята единая классификация хромосом человека, которой до сих пор пользуются все цитогенетики. Согласно Денверской классификации для анализа хромосомы группируются попарно (гомологи) в порядке уменьшения размера и делятся на 7 групп, которые обозначают буквами латинского алфавита от А до G. Как видно на кариограмме, половые Х- хромосомы относятся к группе С. Y-хромосома – к группе G. Для точной идентификации дифференциально окрашенных хромосом используется, так называемая, Парижская номенклатура, принятая в Париже в 1979 году.
Изучение интерфазных ядер.
Это экспресс-метод определения X-полового хроматина в интерфазных ядрах клеток слизистой оболочки полости рта (обнаружение телец Барра) или в сегментоядерных лейкоцитах (барабанные палочки)). Для выявления полового хроматина клетки окрашиваются с применением основных красителей (орсеин, краситель Романовского-Гимзы и др.).
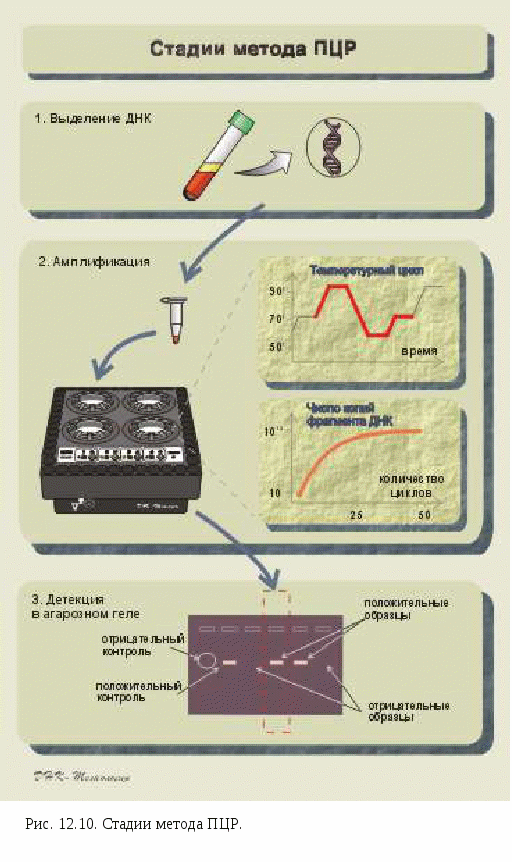
Молекулярно-генетические методы
Нарушения активности ферментов при наследственных заболеваниях выявляются при помощи биохимических методов. Локализация соответствующих повреждений в самом наследственном материале, т.е. в структуре ДНК, может быть выявлена молекулярно-генетическими методами. Это исследование проводится на образцах ДНК. Ранее для молекулярно-генетического анализа использовался метод гибридизации нуклеиновых кислот (комплементарное соединение с мечеными фрагментами ДНК - «зондами». ДНК-зондом может быть одна радиоактивная нить ДНК, несущая мутацию). Специфичность гибридизации нуклеиновых кислот позволяет обнаружить единственный ген среди десятков тысяч. Для широкого применения методов рекомбинантной ДНК необходимо создание библиотек радиоактивных зондов всех последовательностей ДНК генома человека.
|
|
|
 Скачать 13.87 Mb.
Скачать 13.87 Mb.