Лекция Историческая справка и основные положения аналитической химии
 Скачать 287.62 Kb. Скачать 287.62 Kb.
|
|
Титрование Принцип титрования: к раствору анализируемого вещества неизвестной концентрации (пробе) добавляют раствор реагирующего с ним вещества известной концентрации (титранта) до тех пор, пока не будет получен сигнал индикатора, свидетельствующий о прекращении реакции (достижении конечной точки титрования). Следует различать экспериментально наблюдаемую конечную точку титрования и истинную точку эквивалентности, соответствующую стехиометрическим соотношениям реагирующих веществ. В идеальном случае обе точки совпадают, однако на практике между ними существует различие (погрешность титрования). Для большинства титриметрических определений допустима погрешность не более ±0,1%. точки зрения способа осуществления различают следующие виды титрований: Прямое титрование: пробу титруют раствором титранта. Инверсное титрование: определенное количество титранта титруют раствором пробы до достижения точки эквивалентности. Обратное титрование: титрант добавляют к пробе в избытке и затем оттитровывают не прореагировавший титрант. Заместительное титрование: к пробе добавляют не сам титрант, а какой- либо вспомогательный реагент, взаимодействующий с определяемым веществом и дающий эквивалентное количество продукта реакции; последний оттитровывают. Косвенноетитрование:анализируемоевещество предварительно переводят в другое соединение, которое и оттитровывают; по результатам титрования этого соединения рассчитывают количество определяемого вещества. 45 Кривые и диаграммы титрования Ход реакции титрования может быть изображен графической моделью, называемой кривой титрования, отражающей зависимость между концентрацией компонентов и каким-либо свойством системы с титруемым веществом — титрантом. По мере добавления титранта в системе происходит изменение количественного соотношения исходных веществ и продуктов реакции и вследствие этого изменение свойства системы. В титриметрии строят логарифмические кривые координатах «логарифм свойства - концентрация». По оси абсцисс откладывают либо объѐм, либо % добавленного титранта, либо степень оттитровывания*; по оси ординат — свойство системы = СτVτ/C0V0 Практическое значение для анализа имеет область кривой титрования, называемая скачком титрования, в которой происходит резкое (скачкообразное) изменение свойства системы. Это связано с тем, что в области скачка происходит изменение концентрации реагирующих веществ на несколько порядков. Началом скачка титрования считают момент добавления 99,9% титранта (т. е. недотитровано 0,1% анализируемого вещества), концом скачка — добавление 100,1% (т. е. вещество перетитровано на 0,1%). При визуальном фиксировании точки конца реакции с помощью вводимых в систему индикаторов необходимо провести предварительный расчет области скачка титрования, чтобы правильно выбрать индикатор (интервал перехода окраски индикатора должен полностью или частично укладываться в пределы скачка титрования). Величина скачка титрования определяется константой равновесия реакции, концентрациями реагирующих веществ (обычно скачок тем больше, чем больше концентрация), температурой, природой титруемого вещества и титранта (их константами диссоциации или устойчивости, значениями стандартных окисли-тельно-восстановительных потенциалов, растворимостью), присутствием в системе посторонних веществ и т. п. Знание пределов скачка титрования может существенно помочь в выборе условий проведения реакции и концентрации титранта. Величина скачка титрования должна быть достаточно большой. Увеличить ее можно введением в систему веществ, реагирующих с компонентами, которые определяют свойства системы. Таким путем можно осуществить реакции, не протекающие в обычных условиях. Численное значение свойства в точке эквивалентности необходимо знать для того, чтобы оценить погрешность анализа. Положение точки эквивалентности по отношению к началу и концу скачка титрования зависит от стехиометрического соотношения реагирующих компонентов. Если в уравнении реакции между А и В стехиометрические коэффициенты равны, то точка эквивалентности будет находиться посередине скачка титрования, в противном случае, она будет смещена в ту или иную сторону. некоторых случаях более удобна линейная модель хода реакции титрования, называемая диаграммой титрования. Линейные модели получают в системе координат, в которой на оси ординат отложены равновесные концентрации. Если константы равновесия реакции достаточно велики, то на  За степень оттитровывания τ при практически полном протекании реакции можно принять отношение концентрации добавленного титранта к общей концентрации титруемого вещества. 46 графике получаются две прямые, пересекающиеся в точке эквивалентности (рис. 3). Линейные диаграммы кислотно-основного титрования позволяют получать дополнительную информацию для разработки методики анализа. На рис.2 приведено сопоставление концентрационно-логарифмической диаграммы, построенной по способу с логарифмической кривой титрования 0,1 н. раствора муравьиной кислоты раствором NaOH. Следует иметь в виду, что реальные кривые и диаграммы титрования несколько отличаются от теоретически рассчитанных. Полный расчет процесса титрования с учетом всех параметров, меняющихся в ходе реакции, сложен и требует применения вычислительной техники. 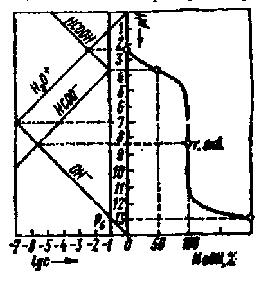 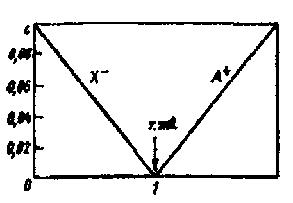 Рис.2 Рис.3 Индикация Теоретические кривые титрования служат для выбора индикатора, с помощью которого будет фиксироваться конец реакции. Очевидно, что чем ближе интервал перехода окраски индикатора к рН точки эквивалентности, тем точнее будет установлена эта точка. Однако важны и другие факторы, например четкость изменения окраски, устойчивость растворов индикаторов и др. В общем случае при выборе индикатора следует придерживаться следующих правил: 1) предпочтение следует отдавать индикатору, у которого значение рТ близко к значению рН в точке эквивалентности; 2) величина интервала перехода рН окраски индикатора должна полностью или большей своей частью входить в пределы скачка титрования; 3) при титровании слабых кислот нельзя применять индикаторы с интервалами перехода, лежащими в кислой области; 4) при титровании слабых оснований нельзя применять индикаторы с интервалами перехода, лежащими в щелочной области; 5) при титровании сильных кислот и оснований можно применять практически любые индикаторы, однако при титровании разбавленных электролитов с концентрацией меньше 0,01 н. следует выбирать индикатор, придерживаясь правила 2, так как скачок титрования становится малым. При работе с индикаторами, интервал перехода окраски которых лежит в кислой области, следует помнить, что на результаты определения может оказать влияние угольная кислота, получающаяся при поглощении анализируемым раствором CO2 из воздуха. Поэтому при особо точных определениях рекомендуется раствор предварительно нагреть до кипения, чтобы удалить CO2. некоторых случаях конец реакции титрования может быть установлен непосредственно по какому-либо аналитическому эффекту, сопровождающему реакцию. Например, при перманганато-метрическом титровании бесцветных анализируемых растворов точку эквивалентности определяют по розовой окраске, 47 появляющейся от добавления 1 капли избытка раствора KMnO4. Такое титрование называют безиндикаторным. Однако в большинстве случаев в химических методах анализа прибегают к введению в исходную систему титруемого вещества — титрант другой системы — индикаторной, реагирующей с исходной. Эта вторичная реакция, сопровождающаяся определенным аналитическим эффектом (изменением окраски, выпадением осадка), начинает протекать только тогда, когда основная прошла уже почти полностью. Значение, при котором наблюдается резкое изменение окраски индикатора, называют показателем индикатора или показателем титрования рТ. Кислотно-основные индикаторы представляют собой слабые органические кислоты или основания, т.е. сопряженную пару, кислотная и основная форма которых различается по цвету. Индикаторы более слабые кислоты или основания, чем титруемые вещества, поэтому они вступают в реакцию с титрантом только после того, как основная масса анализируемого вещества уже прореагирует. Изменение окраски индикатора наступает при определенном значении рН раствора:
Если у раствора рН<(рК Ind — 1), то цвет обусловлен кислотной формой индикатора, при рН>(рК Ind +1) — щелочной формой. Таким образом, переход окраски индикатора осуществляется в определенном интервале рН . Изменение окраски индикаторов связано с изменением их структуры. Кислотно-основные индикаторы должны удовлетворять следующим требованиям: быть чувствительными, чтобы расход индикатора был как можно меньше; равновесие между обеими формами должно устанавливаться быстро; обе формы (или одна у одноцветных индикаторов) должны быть интенсивно окрашены; интервал перехода окраски индикатора не должен быть большим. Наряду с индивидуальными индикаторами применяют их смеси с нейтральными красителями. Окислительно-восстановительные (оксред-инликаторы) — это органические соединения, изменение окраски которых связано с процессами окисления и восстановления: Indox + ne → Indred Окисленная Indox и восстановленная Indred формы имеют различную окраску. Область изменения окраски определяется в зависимости от потенциала системы как = E Indred ± 0,059/n Окраска индикатора должна меняться быстро и обратимо. Если индикатор реагирует медленно, то можно пропустить конечную точку титрования. Если же индикатор будет изменяться необратимо, то может не произойти резкого изменения окраски во всем объеме раствора. На изменение окраски оксред-индикаторов большое влияние играет рН растовра. Например: перманганат калия— в кислой среде. 48 Металлоиндикаторы (металлохромные индикаторы) используют в комплексометрическом титровании. Это красители, которые образуют с ионами металлов (Mл+) окрашенные комплексы MInd, менее стойкие, чем комплекс того же металла с ЭДТА. Краситель и его комплекс различаются по окраске. Интервал перехода окраски определяется в зависимости от константы устойчивости комплекса как рХ=рКус±1. Изменение окраски происходит в тот момент, когда при титровании ЭДТА комплекс индикатора с металлом полностью разрушается, замещаясь более прочным комплексом металла с титрантом, и раствор приобретает окраску свободного индикатора. Наиболее распространенными металлоиндикаторами являются эриохром черный T (кислотный хромоген черный специальный или хромоген специальный ET—00) и мурексид. Осадительные индикаторы. По достижении точки эквивалентности основной реакции титрования начинается вторичная — выпадение осадка, образуемого индикатором с титрантом. Например, при осадительном титровании галогенидов (Cl-, Вг-) по методу Мора индикатором служит K2CrO4 . Хромат-ионы образуют с титрантом AgNO3 осадок кирпично-красного цвета Ag2CrO4 свидетельствующий об окончании реакции между галогенидом и AgNO3. Адсорбционные индикаторы отличаются от всех описанных тем, что изменение окраски происходит на поверхности коллоидно-дисперсной фазы. Такая фаза в процессе титрования адсорбирует ионы, находящиеся в растворе в избытке, заряжаясь положительно (при адсорбции катионов) или отрицательно (при адсорбции анионов). Присутствующие в растворе молекулы красителя-индикатора могут адсорбироваться под действием электростатических сил на заряженной поверхности осадка. При этом осуществляется деформация электронной системы молекулы и появляется определенная окраска. В точке эквивалентности происходит перезарядка поверхности осадка, определяемая избытком ионов титранта; при этом изменение заряда приводит к новой деформации электронной системы индикатора и его цвет меняется, что и указывает на окончание основной реакции. Адсорбционные индикаторы применяются обычно при титровании по методу осаждения. Они действуют в определенном интервале значений рН и чувствительны к присутствию в растворе посторонних ионов. Специфические индикаторы реагируют только с данным веществом. Например, в йодометрии специфический индикатор — крахмал; он образует с йодом смешанные адсорбционные и комплексные соединения (клатраты) ярко-синего цвета. Специфический индикатор на Fe3+ — роданид аммония, образующий с этими ионами комплексные соединения красной окраски. Таких индикаторов известно не много, но химики проводят постоянную работу по их изысканию и синтезированию. Синтез часто идет в направлении использования смешанных индикаторов, которые или содержат действующий реагент и индифферентный краситель, сужающий интервал перехода окраски индикатора и изменяющий его окраску, или представляют собой смесь нескольких индикаторов с совпадающими интервалами переходов. 49 4. Вычисления в титриметрическом анализе основе вычислений в объѐмном анализе лежит принцип: вещества реагируют друг с другом всегда в эквивалентных количествах. Поэтому используют нормальную концентрацию. При одинаковых нормальностях растворы взаимодействуют равными объѐмами, без остатка. точке эквивалентности произведение нормальности на объѐм раствора есть величина постоянная для обоих реагирующих веществ: H1V1= H2V2 Ход вычисления зависит от того, выполняют ли титрование методом пипетирования или методом отдельных навесок. Метод пипетирования состоит в том,что навеску анализируемого веществарастворяют в мерной колбе, доводят объѐм до метки и берут для титрования определенные (аликвотные) порции раствора с помощью пипетки. По методу отдельных навесок каждую навеску анализируемого веществарастворяют в произвольном объѐме воды и титруют весь полученный раствор. Вычисление результатов при титровании по методу пипетирования При этом используют уравнение титрования H1V1 = H2V2. Задача:В мерную колбу ѐмкостью 100 мл перенесли 0,6504 г продажной щавелевой кислоты, растворили и довели объѐм раствора до метки. Пипеткой брали по 10,00 мл полученного раствора и тировали 0,1026 н. раствором гидроксида натрия, расход которого в среднем составил 9,85 мл. Определите процентное содержание H2C2O4•2H2O в продажной щавелевой кислоте. Решение: 1.Вычислим нормальность раствора щавелевой кислоты по уравнению титрования: H1V1 = H2V2. HH2C2O4•2H2O = 9,85•0,1026/10,00 = 0,1011 Найдем содержание щавелевой кислоты в 100 мл раствора: m = N•Э•V = 0,1011•63,03•0,1= 0,6372 г. Вычислим содержание H2C2O4•2H2O в %
х%= (0,6372 • 100)/0,6504= 97,97% Ответ: 97,97%. Вычисление результатов при титровании по методу отдельных навесок В этом случае уравнение титрования не может быть использовано, так как навеску анализируемого вещества растворяют в произвольном объѐме воды. Вычисляют результат исходя из того, что при титровании вещества взаимодействуют эквивалентными количествами. 50 Задача:Каково процентное содержаниеH2C2O4•2H2Oв образце щавелевойкислоты, если на титрование 0,1500 г его пошло 25,60 мл 0,09002 н. едкого натра? Решение: 1.Определим количество эквивалентов едкого натра, которое содержится в 25,60 мл раствора: nэ= N•V/1000 = 0,09002•25,60/1000 = 0,002305 моль 2.Но при титровании один эквивалент вещества взаимодействует с одним эквивалентом другого, а это означает, что в реакции участвовало также 0,002305 моль щавелевой кислоты. Вычислим массу щавелевой кислоты по формуле: m=nэ•Э = 0,002305•63,03 = 0,1453 г H2C2O4•2H2O Вычислим содержание H2C2O4•2H2O в % 0,1500 г образца ▬▬▬▬▬ 100% 0,1453 г H2C2O4 ▬▬▬▬▬ Х % Х%=(0,1453 • 100)/0,1500 = 96,86% Ответ: 96,86%. Вычисление результатов при выражении концентрации раствора через титр по определяемому веществу При массовых определениях одного и того же вещества используют этот способ. Вычислив однажды титр рабочего раствора по определяемому веществу, находят затем количество вещества простым умножением титра на затраченный объѐм раствора. Титр по определяемому (ТВ/А)показывает с какой массой(г)анализируемоговещества (А) реагирует с 1 мл стандартного раствора (В). ТВ/А = Сн(В)•Э(А)/1000 = Т(В)•Э(А)/Э(В) Задача:Вычислите титр рабочего раствора по определяемому веществу: 1н. NaOH; TNaOH/H2SO4 Решение: TNaOH/H2SO4= 1•49/1000=0,0490г/мл. Это означает, что 1 мл рабочего раствора NaOH соответствует 0,0490 г оттитрованной серной кислоты. Задача: Дан титр рабочего раствора. Найдите титр данного раствора по определяемому веществу – серной кислоте. Решение:ТNaOH= 0,004000г/мл;TNaOH/H2SO4= 0,004000 • 49/40=0,0049 г/мл Задача:На титрование раствораH2SO4израсходовано5,00мл раствора КОН TКOH/H2SO4 = 0,004900г/мл. Определите массу серной кислоты в растворе. Решение: m= TКOH/H2SO4 •V= 0,004900 • 5,00= 0,0245 г. Ответ: 0,0245 г. 51 | ||||||||||||||||
