Объемный титриметрический анализ. Объемный титриметрический анализ.Кислотно -основное титрованиее.. Лекция 1 план требования при изучении курса
 Скачать 240.3 Kb. Скачать 240.3 Kb.
|
|
Кислотно-основные индикаторы Существует несколько теорий, позволяющих объяснить изменение окраски индикатора при изменении рН раствора. Ионная теория индикаторов Индикаторы – сложные органические соединения, как правило из класса красителей, содержащих в своей структуре определенные группы. В соответствии с ионной теорией индикаторов, созданной в 1894 г, кислотно-основные индикаторы представляют собой слабые органические кислоты или основания. В случае слабой кислоты можно записать реакцию диссоциации такого вещества в следующем виде: HInd ↔ H+ + Ind– У этих индикаторов молекулярная (HInd) и ионная форма (Ind–). имеют разные окраски. а)H+ - красная б) ОН- - желтая Если равновесие реакции сдвинуто в правую сторону, то в растворе преобладает окраска, соответствующая ионной форме индикатора. Если влево – молекулярной. Существуют двухцветные индикаторы, у которых окрашены обе формы, и одноцветные, у которых окрашена только одна форма. Например, в нейтральной среде, раствор метилового-оранжевого, являющегося относительно сильной кислотой (Кд = 2·10–4, рК = 3,7), имеет желтую окраску, так как в растворе преобладает ионная форма. HInd ↔ H+ + Ind– красная желтая форма форма В нейтральном растворе фенолфталеина – слабой кислоты (Кд = 6,3·10–10, рК = 9,2), равновесие сдвинуто влево и молекулярная форма преобладает над ионной, поэтому раствор бесцветен: HInd ↔ H+ + Ind– бесцветная красная форма форма Константу электролитической диссоциации индикатора выражают формулой: HInd ↔ H+ + Ind– 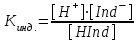 Итак, окраска индикатора становится заметной, если [Ind–]/[HInd] как 1/10 или [Ind–]/[HInd] как 10/1. Подставим эти соотношения в константу электролитической диссоциации: 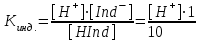 Прологарифмируем это выражение: [H+] = K∙0,1 pH =-lg Kинд ∙ 0,1 pH = pKинд + 1 желтый lg Kинд = lg [H+] + lg 1 – lg10 = –lg Kинд = –lg [H+] – lg 1 + lg10 или pKинд = pH – 0 + 1 = pH + 1; pH = pKинд – 1. 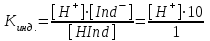 Прологарифмируем это выражение: [H+] = K10 pH = lg Kинд10 pH = pKинд – 1 красный Таким образом, рН = рКинд ± 1. lg Kинд = lg [H+] + lg 10 – lg1 = –lg Kинд = –lg [H+] – lg 10 + lg1 или pKинд = pH –1 + 0 = pH – 1; pH = pKинд + 1. Таким образом, рН = рКинд ± 1. Так как Кинд является величиной постоянной, то прибавление в раствор кислоты ведет к увеличению [H+] и [HInd] и уменьшению [Ind–], т.е. к усилению окраски, свойственной молекулярной форме индикатора. Прибавление в раствор щелочи вызывает обратное действие – усиление окраски, свойственной ионной форме индикатора. Таким образом, окраска индикатора зависит от рН среды. Чем более слабой кислотой является индикатор, тем меньше его Кинд, тем при более высоком значении рН он изменяет свой цвет. Так рК метилового-оранжевого равен 3,7, а фенолфталеина – 9,2; поэтому метиловый оранжевый меняет свою окраску при более низком значении рН раствора (3,1 – 4,4), а фенолфталеин – при более высоком (8,0 – 10,0). Интервал перехода окраски индикатора Вместо интервала перехода окраски индикатора в объемном анализе часто пользуются показателем титрования (рТ) - это та величина рН при которой заканчивается титрование с данным индикатором. Значение величины рТ приблизительно совпадают с pKинд В соответствии с хромофорная теорией индикаторов в молекуле индикатора содержатся следующие группы: 1) сопряженные саязи -СН= СН – СН = СН- 2) бензольные или нафталиновые кольца хромофорные группы (группы несущие цвет) азо группы (–N=N–); нитро группы N ; нитрозо группы (–N=О) аусохромные группы (группы усиливающие цвет) - ОН- гидроксогруппы -СН3 – метильная группа -С - карбонильная группа. В соответствии с хромофорная теорией окраска индикатора изменяется за счет внутримолекулярных перегруппировок в молекуле индикатора, которые происходят за счет изменения рН раствора и приводят к образованию других групп. –N=N– → –N – N Индикатор выбирают так, чтобы интервал перехода окраски попадал в скачок на кривой титрования. Интервалы перехода некоторых индикаторов
Метиловый красный можно использовать для титрования сильной кислоты сильным основанием, а фенолфталеин и для титрования сильной кислоты сильным основанием и для титрования слабой кислоты сильным основанием. Для получения точных и воспроизводимых результатов анализа необходимо соблюдать определенные условия при титровании. При выборе индикатора следует: 1. Если есть возможность использовать спиртовые растворы, так как они более чувствительны к изменению окраски. 2.Для одноцветных индикаторов следует строго соблюдать количество добавленного индикатора. Для титрования следует брать одно и то же количество индикатора. Не следует забывать о том, что индикаторы применяемые в методе нейтрализации, сами являются слабыми кислотами или основаниями. На их нейтрализацию также расходуется некоторое количество раствора. 3.Всегда следует титровать до появления одного и того же оттенка окраски раствора, используя по возможности одинаковые объемы титруемого раствора. 4. Необходимо выбирать такой индикатор, который изменяет свой цвет вблизи точки эквивалентности. 5. В случае если отсутствует скачок на кривой титрования, в этом случае готовят раствор свидетель с рН равным рН в точке эквивалентности, добавляют индикатор и титруют до того цвета, который получается в растворе свидетель. | |||||||||||||||||||||||||||||||
