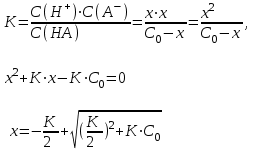Объемный титриметрический анализ. Объемный титриметрический анализ.Кислотно -основное титрованиее.. Лекция 1 план требования при изучении курса
 Скачать 240.3 Kb. Скачать 240.3 Kb.
|
|
Kw = C(H+)·C(OH–) = 10–7 ·10–7 = 10–14 Кислотность или щёлочность раствора можно выразить с помощью десятичного логарифма, взятого со знаком «минус». Эта величина называется водородным показателем и обозначается pH. pH = – lg C(H+) В кислом растворе pH < 7; в нейтральном растворе pH = 7; в щелочном растворе pH > 7. По аналогии с понятием «водородный показатель» (pH) вводится понятие «гидроксильный» показатель (pOH). pOH = – lg C(OH–) Связь между pH и pOH легко вывести логарифмированием уравнения ионного произведения воды. Kw =C(H+)·C(OH–) = 10–14 - lg КW =- lgС(H+) – lg С(OH–) -lg 10-14 = - lgС(H+) – lg С(OH–) 14 = - lgС(H+) – lg С(OH–) 14 = pH + pOH p – обозначает -lg КW =1 ∙ 10 -14 рН =рОН = 7 (чистая вода). Методы кислотно-основного титрования Характеристика метода Методы нейтрализации основаны на применении реакций нейтрализации. Основным уравнением процесса нейтрализации в водных растворах является взаимодействие ионов гидроксония (или водорода) с ионами гидроксила, сопровождающееся образованием слабодиссоциированных молекул воды: H3O+ + OH– → 2H2O или H+ + OH– → H2O Методы нейтрализации позволяют количественно определять кислоты (с помощью титрованных растворов щелочей), основания (с помощью титрованных растворов кислот) и другие вещества (гидролизующие соли), реагирующие в стехиометрических количествах с кислотами и основаниями в водных растворах (например, соли аммония, реагирующие со щелочами, карбонаты, реагирующие с кислотами). Применяя специальные приемы титрования, методами нейтрализации можно определять содержание многих солей, дифференцированно титровать смеси сильных, слабых и очень слабых кислот, а также смеси оснований и солей в неводных растворах. Основными рабочими растворами в этом методе являются раствор кислоты ( HCl или H2SO4) и раствор щелочи ( KOH или NaOH). Эти вещества не отвечают требованиям, которые предъявляются стандартным веществам, и поэтому их титрованные растворы нельзя приготовить, исходя из точной навески вещества, раствор которой разбавляют до определенного объема; концентрацию таких растворов устанавливают путем титрования. В качестве стандартных веществ при установке титров кислот чаще всего применяют тетраборат натрия (буру) Na2B4O7·10H2O или безводный карбонат натрия (соду). Эти вещества могут быть получены практически свободными от примесей, строго отвечающими своим формулам. Растворы этих веществ обладают сильнощелочной реакцией и могут титроваться кислотами. Для установки титра щелочей чаща всего пользуются щавелевой кислотой H2C2O4·2H2O или янтарной кислотой H2C4H4O4. Обе кислоты – твердые кристаллические вещества, которые после перекристаллизации получаются достаточно чистыми, строго соответствующими своей формулам. Янтарная кислота в качестве стандартного вещества удобнее щавелевой, так как она не содержит кристаллизационной воды, и можно не опасаться ее выветривания при хранении. Растворы, применяемые в кислотно-основном титровании, не имеют окраски, поэтому для визуального фиксирования конечной точки титрования (точки эквивалентности) применяют кислотно-основные индикаторы. Равновесия в растворах сильных кислот и сильных оснований В разбавленных растворах сильные кислоты и сильные основания диссоциируют практически нацело: Сильная кислота: C C C HCl → H+ + Cl- H+ - ион водорода Cl- - анион С(H+) = CHCl (моль/л) pH = - lgС(Н+ Сильные основания: NaОН → Na+ + ОН- С(ОН-) = СNaОН рОН = - lg С(ОН-) рН = 14 – рОН = 14+ lg СNaОН Равновесие в растворах слабых кислот и оснований Слабые электролиты диссоциируют частично, процесс их диссоциации обратим: Согласно закону действующих масс: Со-х х х HAn ↔ H+ + An– 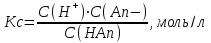 Если начальную концентрацию кислоты принять равной С0, а концентрацию продиссоциировавшей кислоты считать равной х, тогда в результате протекания реакции диссоциации в растворе останется (С0 – х) моль/л молекул кислоты и образуется х моль/л ионов водорода С(Н+) = х и х моль/л анионов кислоты (С(Аn–) = х. Эти концентрации для участников реакции называются равновесными. Для определения равновесных концентраций необходимо решить следующее квадратное уравнение:
Степень диссоциации НАn (α) равна: 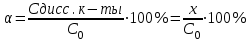 Если К<10-6 , то х<<С0 и в знаменателе уравнения можно пренебречь величиной х: 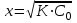 х = С(Н+) Рассчитывать можно и через дискриминант Д = b2 – 4a·c В случае, когда в растворе находится слабое основание, например гидроксид аммония NH4OH, в растворе в равновесии будут находиться его молекулы (C0 – х), гидроксид-ионы ОН– (х) и ионы аммония NH4+ (х). Диссоциацию этого вещества в водном растворе и соответствующую константу диссоциации можно представить следующим образом: NH4OH ↔ NH4+ + OH– 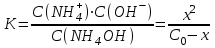 К ∙Со- К∙ х = х2 х2 + К х – КС = 0; К К х = - ---- + √ (----- )2 + К ∙С 2 2 х =[OH–] рОН = –lg [OH–] ; рН = 14 – рОН . Равновесие в растворах слабых многоосновных кислот и оснований Co –х х+у х-у H2An ↔ H+ + HAn- х-у у+х у HAn- ↔ H+ + An2- [Н+]∙ [HAn-] (х+у) ∙ (х-у) К1 = -------------------------- = -------------------------- [H2An] Co –х [Н+]∙ [An2-] (у+х) ∙ у К2 = -------------------------- = --------------------- [НAn-] х-у Диссоциация в основном протекает по I ступени. Причины протекания диссоциации по I ступени: отщепление иона Н+ легче протекает от нейтральной частицы H2An, чем от отрицательной заряженной частицы HAn- ионы водорода образующиеся при диссоциации по I ступени подавляют диссоциацию по II ступени, если К1 / К2 > 104, то диссоциацией по II ступени можно пренебречь; если К1 / К2 < 104, то следует учитывать диссоциацию по I и II ступени. если х >> у, тогда х+ у ≈ х; х – у ≈ х К1 = х2 / Co –х х ∙у К2 = ------ = у х α1 = х/С ; х = [Н+]; α1 = [Н+]/С; α2 = у/С; у = К2 ; α2 = К2/С а) Кислоты, у которых К2 очень мала, а К1 достаточна велика Фосфорная кислота: К1 = 1,1∙ 10 -2; К2 = 2,0 ∙ 10-7; К3 = 3,6 ∙10-13 К1/К2 = 1,1∙ 10 -2 /2,0 ∙ 10-7 = 5,5 ∙104 К2/К3 = 2,0 ∙ 10-7/ 3,6 ∙10-13 =3,3 ∙105 Для щавелевой К1/К2 = 1000 К1 = 5,6∙ 10 -2 К2 = 5,4 ∙ 10-5 для винной К1/К2 = 10. б) Кислоты, у которых следует учитывать диссоциацию по по I и II ступени: H2An ↔ H+ + HAn- I уравнение HAn- ↔ H+ + An2- II уравнение [Н+]∙ [HAn-] К1 = -------------------------- [H2An] [Н+]∙ [An2-] К2 = ------------------------ [НAn-] по II уравнению [Н+] ≠ [An2-], так как часть ионов Н+ связываясь с HAn- образуют H2An, то есть идет процесс обратный I уравнению [An2-] = [Н+] + [H2An] К2 ∙ [НAn-] из II уравнения [An2-] = --------------- [Н+] [Н+] ∙[НAn-] из I уравнения [H2An] = ------------------ К1 [Н+] ∙[НAn-] [НAn-] [Н+] + ---------------- = К2 ----------; К1 [Н+] К1 ∙[Н+]2 + [Н+]2 ∙[НAn-] = К2 ∙ К1 ∙[НAn-] [Н+]2 ∙ (К1+ [НAn-]) = К2 ∙ К1 ∙[НAn-] К2 ∙ К1 ∙[НAn-] [Н+]2 -------------------- К1+ [НAn-] К1+ [НAn-] ≈ [НAn-] [Н+]2 = К1∙ К2 [Н+] = √ К1∙ К2 Для более точных расчетов: К1∙ К2∙С [Н+] = √ ------------ К1 + С Яблочная: К1 = 3,5∙ 10 -4 ; К2 = 8,9 ∙ 10-6 Лимонная: К1 = 8,5∙ 10 -4 ; К2 = 1,8 ∙ 10-5 ; К3 = 4,0 ∙10-7 Многоосновные кислоты можно рассматривать и как смесь кислот. Если К1>> К2, то это смесь более сильной и менее сильной кислоты. В этом случае наличие [Н+] ионов сильной кислоты подавляет диссоциацию слабой кислоты. Равновесие в растворах слабых кислот очень малой концентрации HAn ↔ H+ + An- Н2О↔ H+ + ОН- [Н+]∙ [An-] К = -------------------------- [HAn] [Н+]=[An-] + [ОН-] [ОН-] = Кw/ [Н+] К∙ [HAn] [An-] = ------------ [Н+] Кw К∙ [HAn] [Н+] = ------ + ------------ [Н+] [Н+] [Н+]2 = Кw + К∙ [HAn] [Н+]2 = Кw + К∙ С [Н+] = √Кw + К∙ С Расчет концентрации ионов Н+ и рН в буферных растворах. Буферными растворами – это растворы, в которых концентрация ионов водорода не изменяется или изменяется незначительно при их разбавлении или при добавлении небольших количеств сильной кислоты или сильного основания. Многие реакции в растворе протекают в желаемом направлении только при определенной кислотности, и изменение рН часто приводит к изменению направления реакции и к появлению новых продуктов взаимодействия. Особенно это важно при протекании химических реакций в биологических системах.
Буферным действием обладает: - сильная кислота или сильное основание Пример 1. 100 мл 0,01 М раствор HCl рН= 2 добавили 1 мл 0,1 М р-ра НCl 0,1∙ 0,01 + 0,001· 0,1 [Н+] = ------------------------ = 1,089∙ 10-2 рН = - lgС(Н+) = - lg 1,089∙ 10-2 =1,98 0,101 Пример 2. Добавили 1 мл 0,1 М раствора NaOH HCl + NaOH →NaCl + H2O 0,1∙ 0,01 - 0,001· 0,1 [Н+] = ------------------------ = 0,89∙ 10-2 рН = - lgС(Н+) = - lg 0,89∙ 10-2 =2,0506 0,101 Буферные растворы состоят: - слабой кислоты и ее соли, либо из слабого основания и ее соли НСООН формиатный буфер НСООNa CH3COOH ацетатный буфер CH3COONa NH4OH аммиачный буфер NH4Cl средней и кислой солями Na2CO3 карбонатный буфер NaHCO3 двумя кислыми солями NaH2PO4 фосфатный буфер NaHPO4 Рассмотрим буферный раствор, образованный слабой уксусной кислотой и ее солью ацетатом натрия (ацетатный буферный раствор). Запишем реакции диссоциации этих веществ: Cк – х х х CH3COOH ↔ CH3COO– + H+ Сс Сс Сс CH3COONa → CH3COO– + Na+ Обозначим начальную концентрацию кислоты Ск. Если продиссоциировало х моль/л кислоты, то осталось (Ск – х) CH3COOH и образовалось х моль/л CH3COO– и х моль/л H+. Если начальная концентрация соли Cс, то в результате ее полной диссоциации образуется столько же ионов CH3COO– и Na+. Запишем выражение константы диссоциации уксусной кислоты: 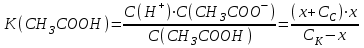 Выразим х: 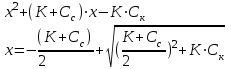 Обычно, х<<Сс и х<<Ск, тогда (х + Сс) ≈ Сс, а (Ск– х) ≈ Ск. Тогда уравнение примет следующий вид: 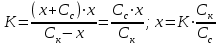 уравнение Гендерсона уравнение Гендерсона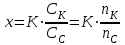 х = С(Н+) х = С(Н+)После логарифмирования получим: рН =рК + lg (Ccоли/Ск-ты) Механизм буферного действия При добавлении в раствор сильной кислоты, которая практически нацело диссоциирована, резко повышается концентрация ионов водорода и рН такого раствора должен также резко уменьшится. Но появившийся избыток ионов водорода по принципу Ле-Шателье смещает положение равновесия диссоциации слабой кислоты влево, т.е. свободные ионы водорода связываются с анионами кислоты из соли, образуя слабую кислоту, соответственно свободных ионов водорода в таком растворе практически не остается и рН раствора изменяется незначительно Н+ +СН3СООН → СН3СООН CH3COOH ↔ CH3COO– + H+ (равновесие смещается влево) При добавлении в раствор сильного основания, резко увеличивается концентрация гидроксогрупп, которые начинают связываться с ионами водорода слабой кислоты с образованием воды. Равновесие диссоциации кислоты смещается в таком случае вправо, рН раствора также изменяется незначительно CH3COOH + ОН- → CH3COO– + H2О CH3COOH ↔ CH3COO– + H+ (равновесие смещается вправо) | |||||||||||||||||||||||||||||||