Иммунную система. Иммунная система. Общие понятия. Лекция Иммунная система общие понятия
 Скачать 0.69 Mb. Скачать 0.69 Mb.
|
|
Фагоцитоз - явление поглощения и переваривания клетками (макрофагами, нейтрофилами) корпускулярного материала (бактерий, крупных вирусов, отмирающих собственных клеток организма или чужеродных клеток, таких, например, как эритроциты различных видов, а также инертных частиц, таких как лизосомы, китайская тушь и т.п.). Фагоцитоз (поедание клеткой) — процесс поглощения клеткой твёрдых объектов, таких как клетки эукариот, бактерии, вирусы, остатки мёртвых клеток и т. п. Вокруг поглощаемого объекта образуется большая внутриклеточная вакуоль (фагосома). Размер фагосом — от 250 нм и больше. Путем слияния фагосомы с первичной лизосомой образуется вторичная лизосома. В кислой среде гидролитические ферменты расщепляют макромолекулы, оказавшиеся во вторичной лизосоме. Продукты расщепления (аминокислоты, моносахариды и прочие полезные вещества) транспортируются затем через лизосомную мембрану в цитоплазму клетки. Фагоцитоз распространен очень широко. У высокоорганизованных животных и человека процесс фагоцитоза играет защитную роль. Фагоцитарная деятельность лейкоцитов и макрофагов имеет огромное значение в защите организма от попадающих в него патогенных микробов и других нежелательных частиц. Фагоцитоз впервые описал русский ученый И.И. Мечников. 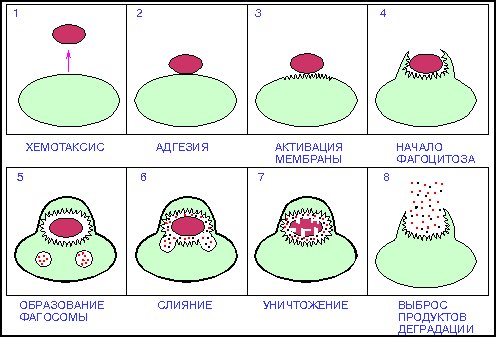 Схема фагоцитоза ХЕМОТАКСИС — (от хемо... и таксисы), перемещение свободно передвигающихся организмов под влиянием химических веществ. Может быть положительным (движение направлено к источнику химического раздражителя) и отрицательным (от источника). Адгезия (прилипание) может осуществляться двумя способами: неспецифическим (в результате случайных встреч) и специфическим, который зависит от предсуществующих рецепторов (молекул межклеточной адгезии ) на поверхности клетки. Адгезия клеток - способность клеток слипаться друг с другом и с различными субстратами. Адгезия веществ на клеточной поверхности приводит к локальной инвагинации (впячиванию) мембраны, завершающейся образованием пиноцитарного пузырька очень небольшого размера (приблизительно 0,1 микрона). Несколько слившихся пузырьков формируют более крупное образование - пиносому. На следующем этапе пиносомы сливаются с лизосомами , содержащими гидролитические ферменты, которые разрушают полимерные молекулы до мономеров. В тех случаях, когда процесс пиноцитоза реализуется через рецепторный аппарат, в пиносомах до слияния с лизосомами наблюдается отсоединение захваченных молекул от рецепторов, которые в составе дочерних пузырьков возвращаются на клеточную поверхность. Поглощение клеткой жидкости и растворенных веществ с помощью небольших пузырьков. Фагоциты - макрофаги, моноциты, гранулоциты - мигрируют в очаг воспаления, проникая в ткани сквозь стенки капилляров, поглощают и переваривают антиген. Фагоциты - от слов phagos - пожирающий + kitos - клетка. Нейтрофилы являются главными "профессиональными фагоцитами" наряду с макрофагами , но значительно уступают им по размерам и времени жизни. Неспецифический иммунный барьер опосредован в первую очередь фагоцитами полиморфноядерными (нейтрофилы) и мононуклеарными ( макрофаги), причем одна и та же клетка способна поглощать и убивать любой инфицирующий агент. Фагоциты представлены двумя популяциями: мононуклеарными фагоцитами (моноцитами / макрофагами) и полиморфноядерными гранулоцитами. Фагоциты обладают широким набором функций, играющих важную роль в поддержании низкого уровня инфицирования организма, в развитии специфического иммунитета в удалении денатурированных белков, остатков умерших клеток, тканей и различных продуктов из очага воспаления или инфицирования [ Leslie ea 1984 , Ward ea 1988 ]. Кроме того, макрофаги (МФ), равно как и ПМЛ, в процессе активации продуцируют значительное количество биологически активных соединений, оказывающих существенное влияние на условия жизнедеятельности организма [ Allison ea 1984 , Bass ea 1987 , Cannon ea 1987 , Рецептор-опосредованный эндоцитоз — активный специфический процесс, при котором клеточная мембрана выпучивается внутрь клетки, формируя окаймлённые ямки. Внутриклеточная сторона окаймлённой ямки содержит набор адаптивных белков (адаптин, клатрин, обуславливающий необходимую кривизну выпучивания, и др. белки). Макромолекулы, связывающиеся со специфическими рецепторами на поверхности клетки, проходят внутрь со значительно большей скоростью, чем вещества, поступающие в клетки за счет пиноцитоза. Внешняя сторона мембраны при этом включает специфические рецепторы (например, ЛПНП-рецептор). При связывании лиганда из окружающей клетку среды окаймлённые ямки формируют внутриклеточные везикулы (окаймлённые пузырьки). Рецептор-опосредованный эндоцитоз включается для быстрого и контролируемого поглощения клеткой соответствующего лиганда (например, ЛПНП). Эти пузырьки быстро теряют свою кайму и сливаются между собой, образуя более крупные пузырьки — эндосомы. После чего эндосомы сливаются с первичными лизосомами, в результате чего формируются вторичные лизосомы. Например, когда животной клетке необходим холестерин для синтеза мембраны, она экспрессирует ЛПНП-рецепторы на плазматической мембране. Богатые холестерином и эфирами холестерина ЛПНП, связавшиеся с ЛПНП-рецепторами, быстро доставляют холестерин в клетку. -воспаление – повреждении кожных покровов – наиболее доступные ворота для инфекционных агентов. Проникшие патогенные агенты индуцируют комплексную реакцию воспаления, которая направлена на локализацию и уничтожение микроорганизмов в месте внедрения. Наиболее характерные признаки воспалительной реакции - это усиление кровотока, возрастание проницаемости капилляров, приток лейкоцитов В формировании воспалительного ответа принимает участие также целый набор медиаторов . Среди них медиаторы, выделяемые микроорганизмами и поврежденной тканью, вазоактивные медиаторы, выделяемые лейкоцитами, а также группа медиаторов плазмы крови. Белки острой фазы воспаления, продуцируемые после инфицирования или повреждения ткани, а также при онкогенезе и беременности, обладают антимикробным действием, способствуют фагоцитозу, активации комплемента, формированию и ликвидации воспалительного очага. Белки острой фазы продуцируются в печени при действии цитокинов. Основную массу белков острой фазы составляют С-реактивный белок и сывороточные амилоиды А и Р. Другие группы белков острой фазы составляют факторы свертывания крови, металлосвязывающие белки, ингибиторы протеаз, компоненты комплемента и некогорые другие. При воспалении содержание в крови большинства белков многократно возрастает, и определение С-реактивного белка входит в число общепринятых методов диагностики воспалительных процессов. С-реактивный белок (С-РБ) получил название вследствие способности присоединять и преципитировать С-полисахарид Str. pneumoniae. Далее было установлено, что С-реактивиый белок присоединяется к фосфатидилхолину — компоненту клеточной мембраны любых клеток. Он способен присоединяться к микроорганизмам, активированным лимфоцитам, поврежденным клеткам разных тканей, активируя при этом комплемент. Присоединяясь к нейтрофильным фагоцитам, С-РБ усиливает фагоцитоз и элиминацию объектов фагоцитоза. Вместе с этим С-РБ подавляет продукцию супероксида и освобождение из гранул фагоцитов ферментов, защищая тем самым ткани от повреждения. Натуральные киллеры как фактор неспецифической защиты.Естественные клетки-киллеры (ЕК) — это лимфоцитоподобные клетки, обладающие естественной цитотоксичностью по отношению к клеткам-«мишеням». ЕК являются клетками с эффекторной противоопухолевой, противовирусной и противопаразитьарной активностью. Они способны спонтанно, без предварительного контакта с антигеном, убивать опухолевые клетки, а также клетки, зараженные некоторыми вирусами или паразитами По-видимому, основной функцией ЕК является противоопухолевый «надзор». Эта система неспецифической клеточной защиты является филогенетически более древней по сравнению со специфическими Т-клеточными механизмами иммунитета. Морфологически ЕК представляют собой большие гранулосодержащие лимфоциты. ЕК фагоцитарной функцией не обладают . Среди лейкоцитов крови человека ЕК составляют 2—12%. Их участие в неспецифическом иммунном ответе состоит в способности оказывать прямое цитотоксическое действие на злокачественно- трансформированные и вирус-инфицированные клетки, а также клетки, поглотившие некоторые внутриклеточные бактериальные патогены. Иммунитет специфический: общее представление Характерная особенность специфического (приобретенного, адаптационного) иммунитета отражена уже в самом названии этой формы иммунной защиты. Ф.Бернет определил иммунитет как реакцию организма, направленную на дифференциацию всего "своего" от всего "чужого". В понятие защиты от "чужого" входят представления о том, что специфический иммунитет проявляется всегда, когда конкретный организм приходит в контакт с тем или иным антигенно чужеродным материалом, будь то микроорганизмы, трансплантаты, мутационно измененные собственные клетки или простые химические соединения, которым приданы иммуногенные свойства. Специфичность ответа реализуется через синтез антител и формирование клонов лимфоцитов, которые способны взаимодействовать только с одной из множества антигенных детерминант, чужеродных для данного организма. Упрощенная формула иммунологической специфичности – одно антитело, один клон присутствующих лимфоцитов. Во всех реакциях приобретенного иммунитета ведущая роль принадлежит лимфоцитам, поскольку они специфически распознают конкретный возбудитель, где бы он ни находился, внутри или вне клеток, в тканевой жидкости или в крови. Существуют разные типы лимфоцитов, но основные популяции две: T-лимфоциты (или T-клетки) и B-лимфоциты (или B-клетки). Специфичность ответа B-лимфоцитов реализуется через синтез антител, молекулы которых способны специфически распознавать определенные молекулы-мишени ( антигены ), и формирование клонов лимфоцитов , способных взаимодействовать только с одной из множества антигенных детерминант, чужеродных для данного организма. Упрощенная формула иммунологической специфичности: один антиген - одно антитело, один клон предсуществующих лимфоцитов. T-лимфоциты, точнее разные их субпопуляции вместе, обладают широким набором активностей. Одни T-клетки участвуют в регуляции дифференцировки B-лимфоцитов и образования антител. Другие взаимодействуют с фагоцитами, помогая им в разрушении поглощенных ими микробных клеток. Третья группа T-лимфоцитов распознает и разрушает клетки, инфицированные вирусами. Антигенами могут служить молекулы на поверхности клеток микроорганизмов либо образуемые ими токсины. Второй характерной особенностью приобретенного иммунитета является его индуцибельность. Индуцибельность является характерной особенностью приобретенного иммунитета. В условиях нормы выраженность и функциональная активность клона лимфоцитов незначительны. Специфические антитела либо полностью отсутствуют, либо их количество крайне мало. В то же время контакт организма с антигеном провоцирует как усиленную продукцию соответствующих антител, так и нарастание и функциональное созревание специфического клона клеток.В условиях нормы выраженность и функциональная активность клона лимфоцитов незначительны. Специфические антитела либо полностью отсутствуют, либо их количество крайне мало. В то же время контакт организма с антигеном провоцирует как усиленную продукцию соответствующих антител, так и нарастание и функциональное созревание специфического клона клеток. Третий существенный признак иммунной системы связан со способностью сохранять память о первой встрече с антигеном. Именно это свойство специфического иммунитета лежит в основе вакцинации. В настоящее время выделяют различные уровни изучения специфического иммунитета – молекулярный, клеточный, органный, организменный, популяционный. Объектом изучения на молекулярном уровне являются иммуноглобулины (антитела). Антитела (иммуноглобулины) - сложные белковые агрегаты, которые состоят из четырех взаимосвязанных между собой цепей молекул белков: двух одинаковых коротких (легких) цепей и двух одинаковых длинных (тяжелых). Темные участки - связи между белковыми молекулами. N - обозначение начала молекулы белка, C - обозначение конца молекулы белка. У всех антител С-концы молекул белков одинаковы (их называют константными), а N-концы отличаются. У них существует два свойства: гетерогенность и вари абельность. Гетерогенность определяет свойства иммуноглобулинов, обусловленные константной (C) областью H-цепи, т.е. теми структурными особенностями, которые позволяют делить всю группу этих белков на классы, подклассы , аллотипы и типы легких цепей . Гетерогенность подразумевает также различия в функциональной активности разных классов иммуноглобулинов з Вариабельность - это индивидуальная характеристика иммуноглобулинов , относящихся к одному и тому же классу или подклассу . Она определяется специфической антигенсвязывающей активностью. Активный центр антител ( антигенсвязывающий участок ) формируется взаимодействием VH- и VL-доменов . Вариабельность в последовательности аминокислотных остатков этих доменов и определяет меняющуюся специфичность антител . а исключением их свойства специфического взаимодействия с антигеном .. 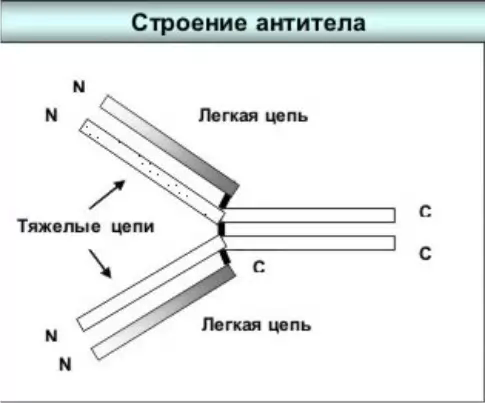 Классификация иммуноглобулинов. Принято различать пять классов иммуноглобулинов с несколькими подклассами: А, М, G, Е, D. Каждый класс иммуноглобулинов имеет отличия по величине молекулярной массы, коэффициента седиментации и их участию в иммунных реакциях (см. табл. 16.4). Антитела иммуноглобулина IgG играют ведущую роль в защите от многих вирусных (например, корь, оспа, бешенство) и бактериальных инфекций, преимущественно вызываемых грамположительной микрофлорой, а также от столбняка и малярии. Антирезусные гемолизины, антитоксины (например, дифтерийный, стафилококковый) обладают вируснейтрализующим действием. IgG-антите- ла свое губительное действие осуществляют с помощью комплемента, опсонизации, активации фагоцитоза. Значение сывороточных IgA изучено недостаточно. По-видимому, они являются основным источником для синтеза секреторного IgA. Последний же образуется лимфоид- ными клетками слизистых оболочек пищеварительной и дыхательной систем и таким образом участвует в систе ме местного иммунитета, препятствуя инвазии в орган и im патогенных агентов (вирусов, бактерий). Это так называв мая первая линия защиты организма от инфицирования. Иммуноглобулины М включают антитела против грамш рицательных бактерий (например, шигелл, брюшного тифа), вирусов, а также гемолизины системы АВО, ревма тоидный фактор, противоорганные антитела. Антитела, относящиеся к классу IgM, обладают высокой агглютинм рующей активностью и способны активировать компле мент по классическому пути. IgD-иммуноглобулины обнаруживаются в ткани минда лин и аденоидов, что позволяет предполагать о их роли и местном иммунитете. IgD активирует комплемент по а/п. тернативному типу и обладает антивирусной активное тью. Описано острое лихорадочное заболевание по типу ревматической лихорадки (увеличение лимфатически\ узлов, полисерозит, артралгии и миалгии) в сочетании i гипериммуноглобулинемией D. Иммуноглобулины IgE (реагины) участвуют в аллерги ческих реакциях немедленного типа, активируют макро фаги и эозинофилы, что может усиливать фагоцитоз или активность микрофагов (нейтрофилов). Основным методом распознавания специфической сенсибилизации к самым разным аллергенам является исследование общего или суммарного IgE сыворотки крови, а также титром иммуноглобулин-Е-антител в отношении конкретных аллергенов быта, пищевых веществ, пыльцы растений. Динамика содержания иммуноглобулинов в крови детей. В течение первых 4—6 месяцев материнские иммуноглобулины пол ностью разрушаются и начинается синтез собственных. В-лимфоциты синтезируют преимущественно IgM иммуноглобулины, уровень которых достигает максимальных значений лишь к 10-12 годам. Низкое содержание секреторного IgA обнаруживается у детей 1-го года жизни в секретах гонкой и толстой кишках, а также в фекалиях. В смывах из носа детей 1-го месяца жизни секреторный IgA отсутствует и очень медленно нарастает в последующие месяцы (до 2 лет). Этим объясняют более легкую заболеваемость детей раннего возраста респираторными инфекциями. Иммуноглобулины D в сыворотке крови у новорожденных имеют концентрацию 0,001 г/л. Затем она нарастает после 6-й педели жизни и достигает значений, свойственных взрослым, к 5—10 годам. Быстрая восприимчивость детей к различным заболеваниям (органов дыхания, пищеварения, гнойничковым поражениям кожи) объясняется низким содержанием иммуноглобулинов в течение 1-го года жизни. С увеличением контакта между детьми на 2-м году жизни, на фоне относительно низкого уровня иммуноглобулинов в этот период, наблюдается особенно высокая их заболеваемость по сравнению с детьми других периодов детства. В сыворотке крови новорожденного содержится незначительное количество иммуноглобулинов IgE. Их концентрация нарастает с возрастом, что в большой степени коррелирует с началом появления аллергических заболеваний. Иммуноглобулины IgM обнаруживаются к 3 месяцам жизни, затем их титр увеличивается, но более заметно — в 2—2,5 года. У новорожденных содержание стафилококкового антитоксина равно уровню его у взрослого человека, а затем его титр снижается. Вновь его достоверное повышение наблюдается к 24—30 месяцам жизни. Динамика уровня стафилококкового антитоксина в крови ребенка позволяет предполагать, что первоначально высокий его уровень обусловлен трансплацентарной передачей его от матери. Собственный же синтез происходит позднее, чем и объясняется большая частота гнойничковых поражений кожи (пиодермии) у детей раннего возраста. Динамика становления гуморального звена иммунитета. У детей раннего возраста она прослеживается по появлению антител при инфекционных заболеваниях. Так, при заболевании детей кишечными инфекциями антитела к их возбудителям у детей первых 6 месяцам жизни обнаруживаются редко, в возрасте от 6 до 12 месяцев — лишь у 1/3 больных, а у детей на 2-м году жизни — почти у 60%. При заболевании острыми респираторными инфекциями (аденовирусная, парагрипп) сероконверсия у детей 1-го года жизни обнаруживается лишь у 1/3 переболевших ими, а на 2-м году — уже у 60%. Местная специфическая форма защиты ог вредного влияния пищевых антигенов имеется в желудочно-кишечном тракте. Она состоит из клеточного и секреторного компонентов. Основную функциональную нагрузку несет димерный IgA (SIgA). Содержание этого иммуноглобулина в слюне и пищеварительных секретах намного выше, Основные функции SIgA в отношении пищевых антигенов заключаются в препятствовании всасыванию макромолекул из желудочно-кишечного тракта (иммунное исключение) и регуляции проникновения пищевых белков через эпителий слизистой оболочки во внутреннюю среду организма. Относительно небольшие антигенные молекулы, пенетрирующие эпителиальную поверхность, стимулируют местный синтез SIgA, который препятствует последующему внедрению антигенов путем формирования комплекса на мембране. Однако желудочно-кишечный тракт новорожденного лишен этой специфической формы защиты. У грудного ребенка сроки минимально достаточного созревания могут колебаться от 6—8 месяцев до 1,5 лети более. Таков срок формирования «кишечного блока». До этого срока обеспечение системы местной секреторной защиты и блокирования пищевых антигенов осуществляется только молозивом и молоком матери. Окончательное же созревание секреторного иммунитета может произойти и после 10—12 лет. чем в сыворотке; при этом от 50 до 96% его синтезируется местно. |
