|
Сборник лекции. Химическая технология - лекция. Лекция Общие вопросы химической технологии. Лекции 2, Принципы создания ресурсосберегающих технологий
5), а также термической диссоциацией аммиака
и других побочных реакций. Кроме того с ростом температуры возрастает унос катализатора в виде летучего оксида PtO2. Для улавливания Pt под сетки кладут поглотитель на основе CaO, который улавливает более 50% платины. Учет действия указанных противоположных факторов приводит к выбору оптимальной температуры 830 – 930С (в зависимости от совокупности других параметров). Следует иметь в виду, что положение оптимума температуры зависит от давления. При повышении давления он смещается в область более высоких температур, хотя само значение максимального выхода снижается из-за увеличения удельного веса реакции (6) с ростом давления.
Давление является фактором ускорения процесса, так как является движущей силой внешней диффузии. Вместе с тем, с ростом давления наблюдается снижение выхода оксида азота (II). Поэтому давление является оптимальной величиной, сочетающей взаимно противоположные требования увеличения производительности и уменьшения габаритов установки и повышение выхода NO. Следует также иметь ввиду, что при повышении давления существенно возрастает унос мельчайших частиц платины с газами, что удорожает товарную кислоту, т.к. платина имеет высокую стоимость, а процесс ее улавливания из нитрозных газов после контактного аппарата весьма сложен и не обеспечивает полноту компенсации потерь. На современных установках большой мощности оптимум давления составляет 0,4 – 0,7 МПа.
Состав газовой смеси. При выборе соотношения O2 : NH3 руководствуются зависимостью выхода NO от этого соотношения (рисунок 1), связанной с лимитированием процесса диффузией кислорода к поверхности катализатора. Оптимальными значениями O2 : NH3 является величина 1,8 – 2,0, что соответствует содержанию аммиака в аммиачно-воздушной смеси 9,5 – 10,5 (об. %). Следует учитывать, что при обычной температуре смесь аммиака с воздухом взрывается в интервале 16 – 27 (об. %), а при увеличении температуры и давления предел взрываемости расширяется.
Время контакта. Высокая селективность катализаторов позволяет в условиях оптимальных давлений, температур и соотношения O2 : NH3 достигать 97 – 98% выхода NO при практически полной конверсии аммиака. Поскольку NO при увеличении времени контактирования может далее разлагаться на элементарные N2 и О2, то за время контакта выбирается то минимальное время, при котором достигается практически полная конверсия и которое обеспечивает минимальный объем реактора в условиях практически полного превращения NH3. Это время составляет (1 – 2)10-1 с.
Окисление оксида азота (II) до диоксида.
Нитрозные газы, полученные при окислении аммиака содержат NO и другие оксиды азота, кислород, азот и пары воды. Для получения азотной кислоты оксид азота (II) окисляют до диоксида.
Процесс окисления NO кислородом воздуха описывается уравнением
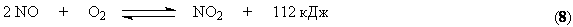
В соответствии с принципом Ле Шателье равновесие этой реакции сдвигается вправо при повышении давления и снижении температуры. Практически равновесие образования диоксида азота при 100С почти полностью смещено вправо. Константа скорости процесса также увеличивается с понижением температуры. Такое аномальное поведение системы связано с тримолекулярным характером процесса (см. раздел «Химическая кинетика» курса «Физическая химия»). В связи с требованиями смещения равновесия и ускорения процесса температуру необходимо понижать. Однако имеется нижний предел температуры, определяемый прогрессивным возрастанием энергетических затрат, связанных с использованием хладагентов. Вместе с тем понижение температуры обусловливает частичное превращение NO2 в димер
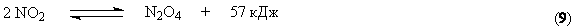
На практике процесс осуществляется при температуре 10 – 50С.
Давление является фактором ускорения основной реакции и фактором смещения ее равновесия в сторону целевого продукта. Однако одновременно рост давления обусловливает смещение равновесия димеризации в правую сторону. Чрезмерное повышение давления нецелесообразно, так как приводит к росту энергетических затрат на компримирование, а также образованию и выпадению в конденсат значительных количеств N2O4 и HNO3. На практике работают при давлениях 0,40 – 0,45 МПа. Выходящие после реакции контактные газы содержат NO2, N2O4, O2, N2O, NO, N2O3, пары воды.
Время контакта и степень превращения. Реакция окисления протекает самопроизвольно без каких-либо внешних ускорителей. В то же время общий третий порядок реакции обусловливает резкое снижение скорости с увеличением степени конверсии. Поэтому в качестве реактора окисления используют полый цилиндрический аппарат, работающий в режиме вытеснения. При этом резкое снижение скорости с ростом степени превращения реагентов не позволяет осуществить процесс до их полного превращения. Поэтому его проводят до оптимальной степени превращения 92%. Этой величине соответствуют времена контакта порядка нескольких секунд.
Соотношение реагентов необходимо поддерживать в соответствии с требованиями стехиометрии, т.е. 2 : 1. При этом достигается максимальная производительность процесса.
Абсорбция диоксида азота.
Все оксиды азота, за исключением NO взаимодействуют с водой с образованием азотной кислоты. Поглощение оксидов азота с водой протекает через две макростадии – физическое растворение этих газов в воде и последующее их химическое взаимодействие с водой с образованием азотной и азотистой кислот. Азотистая кислота является малоустойчивым соединением и распадается на азотную кислоту, оксид азота (II) и воду.
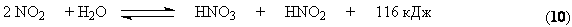
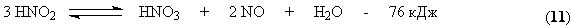
Суммарно взаимодействие NO2 с водой можно представить уравнением
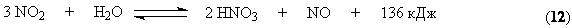
Образующийся NO снова окисляется до NO2

Из двух макростадий – физическое растворение и химическая реакция вторая протекает значительно быстрее и ее скорость определяется скоростью массопереноса газовой фазы в жидкую. Разложение азотистой кислоты происходит сравнительно медленно. Образующийся NO частично окисляется в растворе кислородом, но его большая часть взаимодействует с кислородом уже в газовой фазе по реакции (13). Одновременно с абсорбцией и протеканием химических реакций в растворе в газовой фазе так же частично протекают те же реакции, приводящие к образованию азотной кислоты. При взаимодействии паров воды и NO2 в газовой фазе происходит образование кислотного тумана.
Степень поглощения диоксида азота водными растворами азотной кислоты определяется такими факторами как температура, давление, концентрация кислоты. При понижении температуры и концентрации кислоты и повышении давления степень превращения диоксида азота растет. При концентрации азотной кислоты выше 65% поглощение практически прекращается.
Следует также отметить, что степень окисления NO зависит от свободного объема, а количество поглощаемых оксидов азота – от поверхности контакта фаз. Поэтому одно из основных требований, предъявляемых к абсорбционной аппаратуре – создание максимального свободного объема при одновременно сильно развитой поверхности поглощения. Поэтому реактор образования азотной кислоты – абсорбционная колонна с копачковыми или ситчатыми тарелками. Пространство между тарелками работает как газофазный окислитель основного количества выделившегося NO. Барботаж в новом слое жидкости на тарелке обеспечивает интенсивный массообмен с газом, способствуя поглощению компонентов газофазной смеси и тем самым образованию HNO3 и жидкофазному окислению NO. Достаточно большой объем газовой фазы между тарелками позволяет достичь высоких степеней газофазного окисления NO в NO2, можно считать, что в абсорбционной колонне протекает превращение, описываемые следующим брутто-уравнениями:
Для отвода избыточного тепла на тарелках установлены плоские змеевидные холодильники с циркулирующей в них водой.
Технология процесса.
Современные установки, работающие под повышенным давлением (от 0,2 до 1 МПа) разработаны по принципу энерготехнологических схем, в которых энергия отходящих газов (связанная с их высокой температурой и давлением) и теплота реакции окисления аммиака, используются для сжатия воздуха и нитрозных газов, а также получения технологического пара. Этими же схемами предусмотрено более полное использование низкопотенциальной энергии. Принципиальная технологическая схема получения разбавленной азотной кислоты под повышенным давлением приведена на рисунке 2
А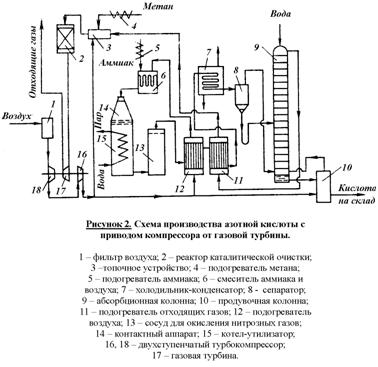 тмосферный воздух проходит тщательную очистку в двухступенчатом фильтре (1). Очищенный воздух сжимается двухступенчатым воздушным компрессором (16, 18). В первой ступени (18) воздух сжимается до 0,35 МПа, при этом он нагревается до 165 – 175С за счет адиабатического сжатия. После охлаждения воздух направляется на вторую ступень сжатия (16), где его давление доводят до 0,7 – 0,8 МПа. тмосферный воздух проходит тщательную очистку в двухступенчатом фильтре (1). Очищенный воздух сжимается двухступенчатым воздушным компрессором (16, 18). В первой ступени (18) воздух сжимается до 0,35 МПа, при этом он нагревается до 165 – 175С за счет адиабатического сжатия. После охлаждения воздух направляется на вторую ступень сжатия (16), где его давление доводят до 0,7 – 0,8 МПа.
Основной поток воздуха после сжатия нагревают в подогревателе (12) до 250 – 270С теплотой нитрозных газов и подают на смешение с аммиаком в смеситель (6).
Газообразный аммиак, полученный испарением жидкого аммиака, после очистки от влаги, масел и катализаторной пыли через подогреватель (5) при температуре 150С также направляют в смеситель (6). Смеситель совмещен в одном аппарате с поронитовым фильтром. После очистки аммиачно-воздушную смесь с содержанием аммиака не более 10% подают в контактный аппарат (14) на окисление аммиака. Конверсия аммиака протекает на Pt-Pd-Rh-сетках при 870-900С причем степень конверсии составляет 97 – 98%. Нитрозные газы при 890 – 910С поступают в котел-утилизатор (15), расположенный под контактным аппаратом. В котле за счет тепла контактных газов протекает испарение химически очищенной деаэрированной воды, питающей котел-утилизатор. При том получается пар с давлением 1,5 МПа и температурой 230С, который поступает потребителю.
После котла-утилизатора нитрозные газы поступают в окислитель нитрозных газов (13). Он представляет собой полый аппарат в верхней части которого установлен фильтр из стекловолокна для улавливания платинового катализатора. Частично окисление нитрозных газов происходит уже в котле-утилизаторе (до 40%). В окислителе (13) степень окисления нитрозных газов доводят до 85%. За счет реакции окисления нитрозные газы нагреваются до 300 – 335С. Эта теплота используется в подогревателе воздуха (12). Охлажденные в теплообменнике (12) нитрозные газы поступают для дальнейшего охлаждения в теплообменник (11), где происходит снижение их температуры до 150С и нагрев хвостовых газов до 110 – 125С. Затем нитрозные газы направляют в холодильник-конденсатор (7), охлаждаемый оборотной водой. При этом конденсируются водяные пары и образуется слабая азотная кислота. Нитрозные газы отделяют от сконденсировавшейся азотной кислоты в сепараторе (8), из которого азотную кислоту направляют в абсорбционную колонну (9) на одну из средних тарелок, с соответствующей концентрацией кислоты. Нитрозные газы направляют в нижнюю часть колонны (9). Сверху в нее подают охлажденный конденсат. Образующаяся в верхней части азотная кислота низкой концентрации перетекает на нижние тарелки и по мере их прохождения укрепляется за счет поглощения новых порций нитрозных газов. При выходе из нижней части колонны концентрация кислоты достигает 55 – 58%, причем содержание растворенных в ней оксидов азота достигает 1%. Поэтому кислота направляется в продувочную колонну (10), где подогретым воздухом из нее отдуваются оксиды азота, а отдутая кислота направляется на склад. Воздух после продувочной колонны подается в нижнюю часть абсорбционной колонны (9).
Степень абсорбции оксидов азота достигает 99%. Выходящие из колонны хвостовые газы с содержанием оксидов азота до 0,11% при температуре 35С проходят подогреватель (11), где нагреваются до 110 – 145С и поступают в топочное устройство (камера сжигания) (3) установки каталитической очистки. Здесь газы нагреваются до температуры 390 – 450С за счет горения природного газа, подогреваемого в подогревателе (4), и направляемого в реактор с двухслойным катализатором (2), где первым слоем служит оксид алюминия. Очистку осуществляют при температурах 690 – 700С. Энергия, вырабатываемая турбиной за счет теплоты хвостовых газов, используется для привода турбокомперессора (18). Затем газы направляют в котел-утилизатор и выбрасывают в атмосферу. Содержание оксидов азота в очищенных выхлопных газах составляет 0,005 – 0,008%, содержание СО2 – 0,23%. Таким образом данный агрегат полностью автономен по энергии.
Производство серной кислоты.
Среди минеральных кислот, производимых химической промышленностью, серная кислота по объему производства и потребления занимает первое место. Объясняется это двумя причинами: ее дешевизной по сравнению со всеми другими кислотами, и ее свойствами. Серная кислота не дымит, в концентрированном виде не разрушает черные металлы, в то же время является одной из сильных кислот, в широком диапазоне температур
(– 40… – 20 260 – 336,5С) находится в жидком состоянии.
Безводная серная кислота (моногидрат) представляет собой тяжелую маслянистую жидкость, которая смешивается с водой с выделением большого количества теплоты. Плотность H2SO4 при 0С равна 1,85 г/см3, а температура кристаллизации 10,7С.
Крупнейшими потребителями серной кислоты являются производства минеральных удобрений: суперфосфата, сульфата аммония.
Многие кислоты (фосфорная, уксусная, соляная, концентрированная азотная и др.) и соли производятся в значительной части при помощи серной кислоты.
Серная кислота широко применяется в производстве цветных и редких металлов, а также в металлообрабатывающей промышленности. Получение ряда красителей (для тканей), лаков и красок (для зданий и машин) лекарственных веществ и некоторых пластмасс также связано с применением серной кислоты. При помощи серной кислоты производят этиловый и другие спирты, некоторые эфиры, ПАВ, ряд ядохимикатов для борьбы с вредителями сельского хозяйства и сорными травами.
Разбавленные растворы серной кислоты и ее солей применяют в текстильной, а также в других отраслях легкой промышленности. В пищевой промышленности серная кислота применяется для получения крахмала, патоки и ряда других продуктов. В электротехнике она используется в качестве электролита в аккумуляторах. Серную кислоту используют для осушки газов и при концентрации кислот. Наконец, серную кислоту применяют как компонент реакционной среды в процессах нитрования, в частности, при получении взрывчатых веществ.
При нитровании, в производстве этилового спирта из этилена, при концентрировании азотной кислоты и в других процессах применяют серную кислоту концентрацией от 92 до 98%, а выводят из процесса разбавленную 50 – 80%-ную кислоту. Чтобы возвратить ее в новый цикл, полученные водные растворы упаривают.
Сырьевая база производства серной кислоты – серосодержащие соединения, из которых можно получить диоксид серы. В промышленности около 80% серной кислоты получают из природной серы и железного (серного) колчедана. Значительное место в сырьевом балансе занимают отходящие газы цветной металлургии. Некоторые производства используют в качестве сырья сероводород, образующийся при очистке серы в нефтепереработке. Первый обжиг серосодержащего сырья для получения диоксида серы.
Производство серной кислоты включает в себя следующую последовательность стадий:
Обжиг серного колчедана или серы.
Окисление диоксида серы.
Абсорбция триоксида серы.
Исходные вещества – минеральное сырье – содержит примеси, поэтому выходящие со стадии обжига газы подвергаются очистке. Первая стадия – обжиг, специфичен для каждого вида сырья, и далее она будет рассматриваться для колчедана и серы как наиболее распространенных исходных веществ. Стадии окисления и абсорбции в основном одинаковы в разных способах получения серной кислоты. Поэтому эти стадии будут рассмотрены как типовые процессы.
Обжиг серосодержащего сырья.
Обжиг колчедана (пирита) является сложным физико-химическим процессом и включает в себя ряд последовательно или параллельно протекающих реакций:
Термическая диссоциация
|
|
Газофазное горение серы
|
|
Горение пирротина
|
|
Или суммарно:
|
|
При небольшом избытке или недостатке кислорода образуется смешанный оксид железа
Обоснование роли параметров и их выбор.
Температура. Термическое разложение пирита начинается уже при температурах около 200С и одновременно воспламеняется сера. При температурах выше 680С интенсивно протекают все три реакции.
В промышленности обжиг ведут при 850 – 900С, когда общая скорость процесса лимитируется массопереносом окислителя (кислорода) к поверхности пирита и продуктов разложения в газовую фазу. В общем виде движущая сила этого процесса может быть выражена уравнением
( |
|
|
 Скачать 1.71 Mb.
Скачать 1.71 Mb.
 тмосферный воздух проходит тщательную очистку в двухступенчатом фильтре (1). Очищенный воздух сжимается двухступенчатым воздушным компрессором (16, 18). В первой ступени (18) воздух сжимается до 0,35 МПа, при этом он нагревается до 165 – 175С за счет адиабатического сжатия. После охлаждения воздух направляется на вторую ступень сжатия (16), где его давление доводят до 0,7 – 0,8 МПа.
тмосферный воздух проходит тщательную очистку в двухступенчатом фильтре (1). Очищенный воздух сжимается двухступенчатым воздушным компрессором (16, 18). В первой ступени (18) воздух сжимается до 0,35 МПа, при этом он нагревается до 165 – 175С за счет адиабатического сжатия. После охлаждения воздух направляется на вторую ступень сжатия (16), где его давление доводят до 0,7 – 0,8 МПа.