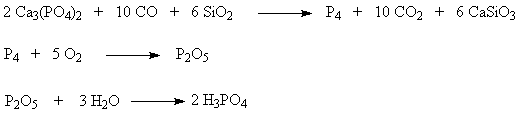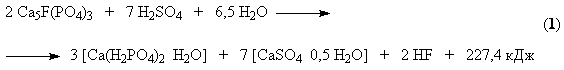Сборник лекции. Химическая технология - лекция. Лекция Общие вопросы химической технологии. Лекции 2, Принципы создания ресурсосберегающих технологий
 Скачать 1.71 Mb. Скачать 1.71 Mb.
|
Рисунок. 1. Функциональная схема производства экстракционной фосфорной кислоты. 30%) разлагается фосфорной кислотойОбразующийся монокальцийфосфат в отличие от сульфата кальция не сразу выпадает в осадок. Он постепенно насыщает раствор фосфорной кислоты, после чего начинает выкристаллизовываться в виде Ca(H2PO4)2H2O и протекает значительно медленнее, чем реакция (1), что объясняется низкой активностью фосфорной кислоты и кристаллизацией твердых фаз. Она начинается в суперфосфатных камерах и длится в течение 5 – 20 суток хранения суперфосфата на складе. Для получения твердого продукта более высокого качества суперфосфат перед дозреванием подвергают нейтрализации твердыми добавками (известняком, фосфоритной мукой и т.п.) и гранулируют. Производство двойного суперфосфата. Двойной суперфосфат – концентрированное фосфорное удобрение. Получаемое разложением природных фосфатов фосфорной кислотой. Оно содержит 42 – 50 % усвояемого P2O5, что в 2-3 раза больше, чем в простом суперфосфате. В отличие от последнего двойной суперфосфат почти не содержит балласта – сульфата кальция. Процесс протекает по уравнению (2). Азотнокислое разложение фосфатов. Получение сложных удобрений. Прогрессивным направлением в переработке фосфатного сырья является метод азотнокислого разложения апатитов и фосфоритов. Этот метод позволяет использовать азотную кислоту не только как средство разложения фосфоритов, но и дополнительный источник питательных элементов. На основе азотнокислого разложения фосфатов обычно получают сложные NP – или NPK-удобрения. В основе процесса разложения фосфатов азотной кислотой лежит реакция в результате которой образуется азотнокислая вытяжка, раствор, содержащий нитрат кальция и свободную фосфорную кислоту. Существует ряд методов дальнейшей переработки азотнокислой вытяжки. Во многих процессах вытяжку нейтрализуют аммиаком получая фосфаты аммония (NP-удобрения). Если перед гранулированием нейтрализованной пульпы к ней добавляют соли калия (KCl, K2SO4), то получают тройное NPK-удобрение – нитроаммофоску. Во многих процессах азотнокислой переработки фосфатов нитрат кальция, образующийся в реакции (3), удаляют из реакционной смеси выпариванием. Разработка таких схем дает возможность комплексной переработки фосфатного сырья и создания практически безотходных производств, исключающих сброс отходов, в частности фосфогипса. Азотнокислый метод разложения фосфатов позволяет наряду с получением NPK-удобрений попутно выделять из сырья такие ценные продукты как стронций, редкоземельные элементы и др., находящие применение в различных отраслях промышленности (электроника, металлургия и т.д.). Производство азотных удобрений. Важнейшими видами минеральных удобрений являются азотные удобрения: аммиачная селитра, карбамид, сульфат аммония, водные растворы аммиака и др. Азотные удобрения отличаются друг от друга по содержанию азота, по форме соединений азота (нитратные, аммонийные, амидные), фазовому состоянию (твердые и жидкие). Производство аммиачной селитры. Аммиачная селитра или нитрат аммония (NH4NO3) – кристаллическое вещество белого цвета, содержащее 35% азота в аммонийной и нитратной формах, обе формы легко усваиваются растениями. Гранулированную аммиачную селитру применяют в больших масштабах перед посевом и для всех видов подкормок. В меньших масштабах ее используют для производства взрывчатых веществ. Аммиачная селитра хорошо растворима в воде и обладает большой гигроскопичностью. Это является причиной того, что гранулы удобрения расплываются, теряют свою кристаллическую форму, происходит слеживание удобрений – сыпучий материал превращается в твердую монолитную массу. Для получения практически не слеживающейся аммиачной селитры применяют ряд технологических приемов. Во-первых, гранулирование. Суммарная поверхность однородных гранул меньше поверхности такого же количества мелкокристаллической соли, поэтому гранулированные удобрения медленнее поглощают влагу из воздуха. Иногда аммиачную селитру сплавляют с менее гигроскопичными солями, например, сульфатом аммония, фосфатами аммония, хлоридом калия, нитратом магния. В основе процесса производства аммиачной селитры лежит гетерофазная реакция взаимодействия газообразного аммиака с раствором азотной кислоты Процесс лимитируется растворением газа в жидкости. Для уменьшения диффузионного торможения необходим интенсивный режим перемешивания реакционной массы. Тепло реакции рационально использовать для испарения воды из растворов нитрата аммония. Возможен вариант получения плава нитрата аммония путем использования концентрированной азотной кислоты и предварительного подогрева ингредиентов (плав содержит 95 – 96% NH4NO3). В настоящее время наиболее распространены схемы с частичным упариванием раствора за счет тепла нейтрализации. Нейтрализацию осуществляют в аппарате ИТН (использование тепла нейтрализации) (рисунок 1). Аппарат состоит из двух цилиндров (внешний и внутренний). Во внутренний подается газообразный аммиак и разбрызгивается азотная кислота. Внутренняя часть представляет собой реакционное пространство, внешняя – зона испарения. Отвод тепла из зоны реакции необходим не только для выпаривания раствора, но и во избежании перегрева и разложения азотной кислоты и аммиачной селитры. Соковый пар, образующийся как результат испарения воды из реакционного раствора используется для подогрева реагентов и упаривания реакционного раствора. Схема установки представлена на рисунке 2. Р 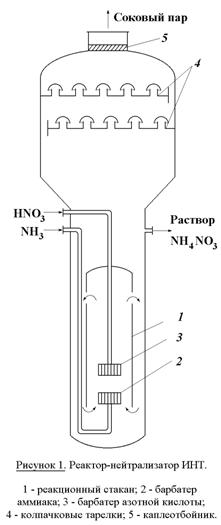 аствор аммиачной селитры (60-80%) поступает в донейтрализатор (5). Сюда добавляют аммиак как нейтрализующий агент, а также вещества уменьшающие слеживаемость удобрений (нитраты кальция и магния). Выпарку проводят в 2 или 3 ступени с использованием в качестве греющих агентов сокового пара из аппарата ИТН, вторичного пара выпарки и свежего насыщенного пара. Для простоты на схеме показан один выпарной аппарат (6). В выпарной установке плав доводят до содержания в нем NH4NO3 98 – 99%. Гранулирование производят путем разбрызгивания плава в полой железобетонной башне (8) высотой 30 – 35 м. Падающие капли застывают в гранулы в потоке холодного воздуха, поступающего противотоком с помощью вентиляторов. Окончательная сушка осуществляется горячим воздухом во вращающемся сушильном барабане (на схеме не показано). аствор аммиачной селитры (60-80%) поступает в донейтрализатор (5). Сюда добавляют аммиак как нейтрализующий агент, а также вещества уменьшающие слеживаемость удобрений (нитраты кальция и магния). Выпарку проводят в 2 или 3 ступени с использованием в качестве греющих агентов сокового пара из аппарата ИТН, вторичного пара выпарки и свежего насыщенного пара. Для простоты на схеме показан один выпарной аппарат (6). В выпарной установке плав доводят до содержания в нем NH4NO3 98 – 99%. Гранулирование производят путем разбрызгивания плава в полой железобетонной башне (8) высотой 30 – 35 м. Падающие капли застывают в гранулы в потоке холодного воздуха, поступающего противотоком с помощью вентиляторов. Окончательная сушка осуществляется горячим воздухом во вращающемся сушильном барабане (на схеме не показано).Д 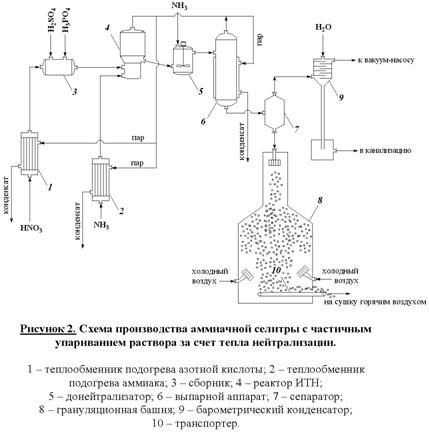 ля улучшения физических свойств аммиачной селитры целесообразно изготовление на ее основе сложных и смешанных удобрений. Смешением аммиачной селитры с известняком получают известково-аммиачную селитру, с сульфатом аммония – сульфонитрат аммония. Нитрофоску можно получить сплавлением аммиачной селитры с солями фосфорной кислоты и калия. На основе аммиачной селитры выпускают также жидкие удобрения, растворяя ее в аммиачной воде. ля улучшения физических свойств аммиачной селитры целесообразно изготовление на ее основе сложных и смешанных удобрений. Смешением аммиачной селитры с известняком получают известково-аммиачную селитру, с сульфатом аммония – сульфонитрат аммония. Нитрофоску можно получить сплавлением аммиачной селитры с солями фосфорной кислоты и калия. На основе аммиачной селитры выпускают также жидкие удобрения, растворяя ее в аммиачной воде.Электрохимические производства. Основные направления применения электрохимических процессов. Электролиз раствора хлорида натрия. Теоретические основы процесса и технология. Электрохимическая промышленность, базирующаяся на электрохимических процессах – одна из крупнейших отраслей народного хозяйства. Она включает электролиз водных растворов, расплавленных сред и производство химических источников тока (аккумуляторы, гальванические элементы, топливные элементы и т.д.). Основные направления применения электрохимических производств. При электролизе водных растворов и расплавленных сред могут быть получены самые разнообразные химические продукты. Электролизом водных растворов натрия и калия получают такие многотоннажные химические продукты, как водород, хлор, гидроксиды натрия и калия. Методом электролиза водных растворов осуществляют энергохимический синтез многих неорганических и органических веществ – гипохлоритов, хлоратов, перхлоратов, хлорной кислоты, перманганатов, диоксида марганца, а также адипонитрила, антидетонаторов, например, тетраэтилсвинца, гидрохинона, фторпроизводных ряда органических соединений и др. На электролизе водных растворов основаны гидроэлектрометаллургия и гальванотехника. Гидроэлектрометалургия – это извлечение металлов из водных растворов их солей путем электролиза. Электролиз обычно служит завершающей стадией ряда металлургических процессов. Электрохимическими методами получают и рафинируют медь, цинк, кадмий, марганец, хром, свинец, олово, благородные металлы. Гальванотехника применяется в металлообрабатывающей промышленности для нанесения на металлические изделия покрытий из металлов или сплавов. Эти покрытия наносят с целью защиты металла от коррозии, повышения твердости и сопротивления механическому износу, с декоративной целью, а также для изготовления точных металлических копий с различных предметов (гальванопластика). С развитием новых отраслей техники (атомная энергетика, ракетостроение, радиоэлектроника и др.) перед гальванотехникой становится более сложные задачи, например, высокая стойкость покрытий в экстремальных условиях, определенные магнитные характеристики, высокая жаростойкость, сверхпроводимость, равномерность свойств покрытия на сложно-профилированной поверхности и др. Электролиз расплавленных сред используют в металлургии для производства и рафинирования металлов, которые не могут быть получены электролизом водных растворов – целого ряда легких, тугоплавких, благородных и редких металлов, а также сплавов. В настоящее время такие материалы как алюминий, магний, натрий, литий, калий, титан и многие другие получают только электролизом расплавленных сред. Электролиз расплавов используют также для получения фтора и бора. Важнейшая область электрохимии – получение и эксплуатация химических источников тока. Химические источники тока подразделяются на первичные и вторичные. К первичным относятся источникам энергии, которые могут быть использованы лишь однократно. К ним относятся батареи и гальванические элементы. Вторичные источники тока – аккумуляторы, работоспособность которых восстанавливается пропусканием электрического тока (в направлении, противоположном тому, в котором ток протекал при разрядке). В топливных элементах «топливо», т.е. восстановитель и окислитель непрерывно и раздельно подводятся к электродам, в результате чего химическая энергия преобразуется в электрическую. Масштабы применения химических источников тока весьма велики. Все самолеты и автомобили с двигателями внутреннего сгорания снабжены аккумуляторами, приводящими в действие двигатель. Различные электронные устройства, например, транзисторные приемники, часы работают за счет малогабаритных батарей. Большие перспективы имеет электрохимическая энергия, т.е. применение электрохимических топливных элементов в энергоустановках – автотранспорте, электростанциях и т.д. Электрохимические методы все более широко внедряются в технику очистки сточных вод, в частности для опреснения сильно минерализированных вод электролизом с регенерацией индивидуальных солей, кислот и щелочей. Электрохимические методы развиваются в промышленности опережающими темпами по сравнению с химическими в связи с их очевидными преимуществами. В электрохимических процессах аппаратура во многих случаях проще и компактнее по сравнению с альтернативными химическими процессами, электрохимические методы получения ряда продуктов характеризуются меньшим числом производственных стадий и операций, более дешевым сырьем и большей глубиной его превращения, одновременным образованием (причем в раздельном виде) ценных продуктов. Эти преимущества часто обусловливают более низкую себестоимость получаемой продукции. Одно из главных достоинств электрохимических методов – чистота получаемых продуктов. Основной недостаток электрохимических процессов – высокая энергоемкость, поэтому энергетические затраты составляют главную статью себестоимости продуктов. Поэтому для электрохимических производств особенно важно снижение энергопотребления путем совершенствования технологии, а также рационального, экономичного использования электроэнергии. Электролиз раствора хлорида натрия Электролиз раствора NaCl – наиболее простой и экономичный метод одновременного получения трех важнейших химических продуктов – хлора, водорода и гидроксида натрия с использованием дешевого и доступного природного сырья. Это самое крупномасштабное электрохимическое производство. Суммарная реакция в электролизере может быть выражена уравнением Хлор применяют в больших масштабах как сырье для производства хлорорганических растворителей и пластмасс, синтетических каучуков, химических волокон, ядохимикатов. В металлургии хлор применяется для хлорирующего обжига руд, в текстильной и целлюлозно-бумажной промышленности – для очистки и отбеливания целлюлозы, бумажной массы и тканей. Большие количества хлора идут на очистку и стерилизацию сточных вод и питьевой воды. Гидроксид натрия используется в производстве многих химических продуктов, прежде всего в промышленном органическом синтезе, в целлюлозно-бумажном производстве, в производстве искусственных волокон, в металлургии (производство алюминия), в нефтехимической промышленности и др. О значении водорода как топлива будущего и химическом реагенте говорилось раньше. Электролиз раствора NaCl осуществляется двумя методами, различными по характеру электродных процессов и по аппаратурному оформлению: 1. электролиз с твердым катодом и фильтрующей диафрагмой; 2. электролиз без диафрагмы с жидким ртутным катодом. Газообразные продукты – хлор и водород при любом способе отличаются высокой чистотой. При электролизе с ртутным катодом и третий продукт – раствор гидроксида натрия имеет высокую концентрацию NaOH и является химически чистым. Благодаря чистоте получаемых продуктов, простому и компактному аппаратурному оформлению, а также одностадийности процесс электролиза раствора NaCl является единственным в мире способом производства хлора и основным способом получения гидроксида натрия. Электролиз раствора NaCl с твердым катодом и фильтрующей диафрагмой. При реализации этого процесса на катоде в соответствии с значениями электродных потенциалов протекают следующие процессы: 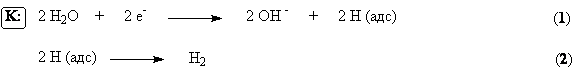 Материалами для катода служит сталь, на которой водород выделяется с относительно невысоким перенапряжением (0,3 В). В реальных условиях электролиза (концентрированный раствор NaCl, содержащий NaOH, температура 90С) фактический потенциал выделения водорода составляет около – 0,845 В. Снижение потенциала до 0,3 – 0,4 В можно достичь применением пористых графитовых катодов, для упрочнения и гидрофобизации пропитанных политетрафторэтиленом и активированных солями меди или серебра. Накапливающиеся в катодном пространстве гидроксид-ионы образуют нейтральные молекулы гидроксида натрия На аноде выделяется хлор: Материалом анода служит оксидно-рутениевая система (композиция из оксидов рутения и титана, нанесенных на титановую основу), обладающая прочностью и химической инертность по отношению к кислороду являющемуся побочным продуктом, образующемся на аноде: Кроме того, в объеме электролита анодного пространства в результате гидролиза хлора идут побочные химические реакции: Образующийся в результате этой последовательной реакции гипохлорит анион претерпевает анодное окисление Побочные реакции снижают выход по току основных продуктов и повышают расходные коэффициенты по энергии. Поэтому условия электролиза и концентрация электролитов должны обеспечивать минимальное протекание побочных реакций и достижение максимального выхода по току целевых продуктов. Для этого электролиз реализуют в электролизерах непрерывного действия с вертикальными фильтрующими диафрагмами при противотоке движения электролита и OH –ионов. Схема электролизера представлена на рис. 1. К 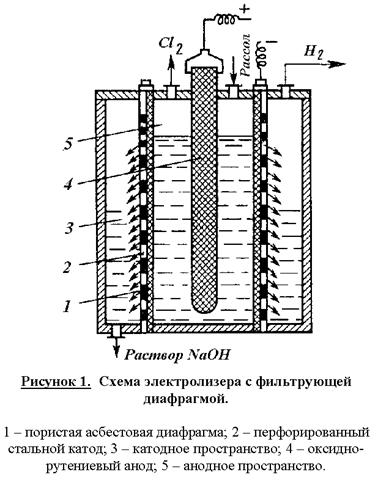 орпус ванны в этой конструкции разделен на катодное и анодное пространства пористой диафрагмой из асбеста, модифицированного полимерными веществами. Диафрагма плотно прилегает к перфорированному стеклянному катоду. В современных электролизерах катоды имеют гребенчатую разветвленную форму с целью развития поверхности. В анодном пространстве расположен оксидно-рутениевый анод. Очищенный рассол подают в анодное пространство и вследствие гидростатического давления он фильтруется через диафрагму и катод в катодное пространство. Из катодного пространства непрерывно отводят водород и раствор гидроксида натрия, а из анодного – хлор. В образующемся хлор-газе содержится 95 – 96% Cl2. Хлор-газ охлаждают до 20С (при этом конденсируется вода) и дополнительно сушат промывкой концентрированной серной кислотой. Катодный продукт – раствор гидроксида натрия содержит 120 – 140 г/л NaOH и 170 – 180 г/л неразложившегося NaCl. Раствор выпаривают, при этом NaCl переходит в твердую фазу, т.к. его растворимость резко снижается с увеличением концентрации NaOH. После выпарки и плавки щелоков получают безводны гидроксид натрия, содержащий 92 – 95% NaOH и 2 – 4% NaCl. орпус ванны в этой конструкции разделен на катодное и анодное пространства пористой диафрагмой из асбеста, модифицированного полимерными веществами. Диафрагма плотно прилегает к перфорированному стеклянному катоду. В современных электролизерах катоды имеют гребенчатую разветвленную форму с целью развития поверхности. В анодном пространстве расположен оксидно-рутениевый анод. Очищенный рассол подают в анодное пространство и вследствие гидростатического давления он фильтруется через диафрагму и катод в катодное пространство. Из катодного пространства непрерывно отводят водород и раствор гидроксида натрия, а из анодного – хлор. В образующемся хлор-газе содержится 95 – 96% Cl2. Хлор-газ охлаждают до 20С (при этом конденсируется вода) и дополнительно сушат промывкой концентрированной серной кислотой. Катодный продукт – раствор гидроксида натрия содержит 120 – 140 г/л NaOH и 170 – 180 г/л неразложившегося NaCl. Раствор выпаривают, при этом NaCl переходит в твердую фазу, т.к. его растворимость резко снижается с увеличением концентрации NaOH. После выпарки и плавки щелоков получают безводны гидроксид натрия, содержащий 92 – 95% NaOH и 2 – 4% NaCl.Благодаря противотоку электролита и ионов OH -, последние практически не попадают в анодное пространство и побочные реакции ( |