Сборник лекции. Химическая технология - лекция. Лекция Общие вопросы химической технологии. Лекции 2, Принципы создания ресурсосберегающих технологий
 Скачать 1.71 Mb. Скачать 1.71 Mb.
|
|
5), (7) – (9), за которые они ответственны, предельно минимизированы. Электролиз раствора хлорида натрия с ртутным катодом. На ртутном катоде электродные реакции (1) и (2) идут с большим перенапряжением – потенциал разряда составляет 1,7 – 1,8 В. Натрий выделяется на ртутном катоде с большим эффектом деполяризации и потенциал разряда Na + на ртути много ниже стандартного и равен 1,23 В. Явление деполяризации ртутного катода обеспечивается тем, что разряд ионов натрия происходит с образованием химического соединения – амальгамы натрия которая непрерывно отводится с поверхности анода, растворяясь в избытке ртути. На перфорированном графитовом (или оксидно-рутениевом) аноде выделяется хлор Амальгаму натрия, содержащую 0,1 – 0,3% Na выводят из электролизера и разлагают нагретой водой в отдельном реакторе-разлагателе. В разлагателе идет электрохимическая реакция, соответствующая процессу в короткозамкнутом гальваническом элементе NaHg n [NaOH] С в котором амальгама служит катодом 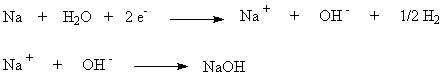 С 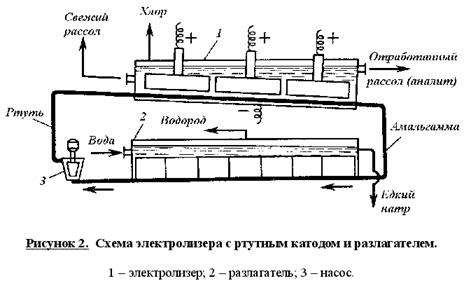 хема электролизера с ртутным катодом представлена на рисунке 2. хема электролизера с ртутным катодом представлена на рисунке 2.Глубоко очищенный концентрированный раствор NaCl подают в наклонный удлиненный электролизер, по дну которого самотеком, противотоком рассолу, движется ртуть, служащая катодом. Над ртутью расположен горизонтальный оксидно-рутениевый (или перфорированный графитовый) анод, погруженный в рассол. Анодная жидкость, содержащая непрореагировавший NaCl, выводится из электролизера совместно с хлор-газом, от которого отделяется в сепараторах и продувочных колоннах (на схеме не показаны). Хлор подают на осушку, а обесхлоренный рассол после очистки от ртути и примесей насыщается каменной солью и возвращается в электролизер. Амальгама натрия из электролизера перетекает в наклонный реактор-разлагатель, где движется противотоком дистиллированной воде, подаваемой в количестве, обеспечивающем получение 45%-ого раствора NaOH. На дне разлагателя размещены гребенчатые графитовые плиты, образующие с амальгамой короткозамкнутый гальванический элемент NaHg n [NaOH] С. Отводимый гидроксид натрия отделяют в сепараторах от водорода и передают потребителям. Ртуть, вытекающую из разлагателя, ртутным насосом перекачивают в электролизер. Поскольку на стадии электролиза щелочь не образуется, то в процессе с ртутным катодом исключены побочные реакции (5), (7) – (9) и процесс характеризуется высоким выходом по току и энергии. Однако, метод электролиза с ртутным катодом требует особо тщательной очистки исходного циркулирующего рассола, так как примеси магния, железа, кальция и других металлов снижают перенапряжение водорода на ртутном катоде, что может привести к нарушению катодного процесса и взрывам. Электролиз с ртутным катодом дает высококонцентрированные, химически чистые растворы гидроксида натрия, которые необходимы для целого ряда потребителей, прежде всего в производстве искусственных волокон, при синтезе и подготовки ионообменных материалов и др. Но использование ртути вредно для здоровья людей. Для получения химически чистых растворов NaOH начали применять электролиз раствора NaCl с ионообменной (катионообменной) мембраной, разделяющей катодное и анодное пространства. Этот метод более сложен по аппаратурному оформлению и эксплуатации аппаратуры, но значительно безопаснее, чем ртутный. Мембранный метод электролиза, так же как и диафрагменный, может считаться малоотходным технологическим процессом. Лекция 21. Химическая переработка нефти.???????????????????????????????????????????? Производство метанола. Метанол – бесцветная жидкость (tкип = 65С) с запахом, подобным запаху этанола. Смешивается в любых соотношениях с водой и многими органическими жидкостями. Он горюч, дает с воздухом взрывоопасные смеси (6,0-34,7%) и представляет большую опасность в связи с высокой токсичностью. Является сырьем для получения формальдегида и полимеров на его основе, используется для получения сложных эфиров (метилметакрилат, диметилфталат, диметилсульфат) и применяется как метилирующий агент (синтез метиламинов), используется как растворитель, компонент моторных топлив и экстрагент. Теоретические основы процесса. Реакция получения метанола экзотермична и обратима. В качестве катализаторов используют оксидные цинк-хромовые (ZnO Cr2O3), медь-хромовые (CuO Cr2O3) и цинк-медь-хромовые катализаторы. Механизм образования метанола представляют схемой Побочными реакциями, осложняющими процессы, являются реакции образования диметилового эфира высших спиртов метана и диоксида углерода Обоснование выбора параметров процесса. Температура является фактором увеличения производительности процесса, однако с ее ростом равновесие основной реакции смещается в нежелательную левую сторону. Это обусловливает экстремальный характер зависимости производительности от температуры. Кроме того, с ростом температуры возрастает удельный вес реакций метанообразования. Это особенно нежелательно, т.к. накопление метана в реакционном потоке в результате многократной рециркуляции приводит к снижению производительности процесса из-за разбавления реагентов и смещения равновесия в левую сторону. Учет всех приведенных факторов обусловливает необходимость выбора оптимальной температуры, сочетающей высокую производительность процесса с благоприятными условиями для равновесия и минимальным образованием побочных продуктов. На практике при использовании активных катализаторов на основе CuO Cr2O3 и ZnO CuO Cr2O3 с добавками промоторов работают в диапазоне температур 250 - 300С. Давление является фактором смещения равновесия в сторону целевого продукта и фактором увеличения производительности процесса. Однако с ростом давления увеличиваются энергозатраты на компримирование. Поэтому используются оптимальные давления, сочетающие высокую производительность процесса при относительно невысоких энергозатратах. При использовании указанных катализаторов диапазон оптимальных давлений составляет 5-10 МПа. Следует при этом учитывать, что давление является фактором, взаимозаменяемым с температурой. Так, увеличение температуры и вызываемое этим смещение равновесия в сторону реагентов требует одновременно и повышение давления. Производство метанола. Метанол – бесцветная жидкость (tкип = 65С) с запахом, подобным запаху этанола. Смешивается в любых соотношениях с водой и многими органическими жидкостями. Он горюч, дает с воздухом взрывоопасные смеси (6,0-34,7%) и представляет большую опасность в связи с высокой токсичностью. Является сырьем для получения формальдегида и полимеров на его основе, используется для получения сложных эфиров (метилметакрилат, диметилфталат, диметилсульфат) и применяется как метилирующий агент (синтез метиламинов), используется как растворитель, компонент моторных топлив и экстрагент. Теоретические основы процесса. Реакция получения метанола экзотермична и обратима. В качестве катализаторов используют оксидные цинк-хромовые (ZnO Cr2O3), медь-хромовые (CuO Cr2O3) и цинк-медь-хромовые катализаторы. Механизм образования метанола представляют схемой Побочными реакциями, осложняющими процессы, являются реакции образования диметилового эфира высших спиртов метана и диоксида углерода Обоснование выбора параметров процесса. Температура является фактором увеличения производительности процесса, однако с ее ростом равновесие основной реакции смещается в нежелательную левую сторону. Это обусловливает экстремальный характер зависимости производительности от температуры. Кроме того, с ростом температуры возрастает удельный вес реакций метанообразования. Это особенно нежелательно, т.к. накопление метана в реакционном потоке в результате многократной рециркуляции приводит к снижению производительности процесса из-за разбавления реагентов и смещения равновесия в левую сторону. Учет всех приведенных факторов обусловливает необходимость выбора оптимальной температуры, сочетающей высокую производительность процесса с благоприятными условиями для равновесия и минимальным образованием побочных продуктов. На практике при использовании активных катализаторов на основе CuO Cr2O3 и ZnO CuO Cr2O3 с добавками промоторов работают в диапазоне температур 250 - 300С. Давление является фактором смещения равновесия в сторону целевого продукта и фактором увеличения производительности процесса. Однако с ростом давления увеличиваются энергозатраты на компримирование. Поэтому используются оптимальные давления, сочетающие высокую производительность процесса при относительно невысоких энергозатратах. При использовании указанных катализаторов диапазон оптимальных давлений составляет 5-10 МПа. Следует при этом учитывать, что давление является фактором, взаимозаменяемым с температурой. Так, увеличение температуры и вызываемое этим смещение равновесия в сторону реагентов требует одновременно и повышение давления. Кумольный способ получения фенола. Фенол С6Н5ОН представляет собой кристаллическое вещество (tпл=420С, tкип=181,40С) В свежеперегнанном виде он бесцветен,. Но при хранении приобретает глубокий оранжевый или красный цвет. Основные направления его применения – производство фенолоальдегидных полимеров, синтетических волокон капрон и нейлон, эпоксидных полимеров и поликарбонатов. Его используют также в качестве промежуточного продукта в производстве красителей, лекарственных и взрывчатых веществ, гербицидов. Алкилированием фенола получают антиокислительные присадки и промежуточные продукты для синтеза неионогенных ПАВ. Наиболее прогрессивным способом получения фенола является кумольный, основанный на реализации следующих стадий: 1. Окисление изопропилбензола (кумола) в гидропероксид 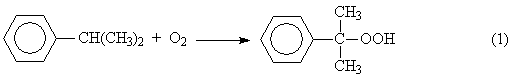 2. Разложение получаемого гидропероксида на фенол и ацетон 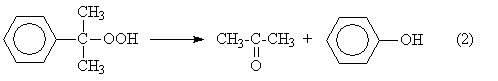 Суммируя уравнения (1) и (2) получаем результирующее уравнение процесса 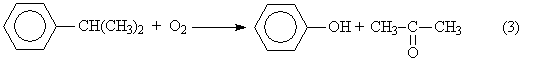 Можно видеть, что в правой части суммарного уравнения (3) фигурируют только фенол и ацетон, которые являются ценными товарными продуктами. С другой стороны, в этом процессе требуется дешёвое и доступное сырьё (изопропилбензол и воздух). Это и делает кумольный способ получения наиболее экономичным среди всех известных способов получения фенола. Рассмотрим основные закономерности протекания стадий окисления и разложения гидропероксида изопропилбензола. Окисление изопропилбензола (кумола) Окисление изопропилбензола представляет собой типичный свободно-радикальный процесс с вырожденным разветвлением цепей. В отсутствие каких-либо посторонних инициирующих агентов зарождение цепей осуществляется посредством бимолекулярного взаимодействия молекул кислорода и изопропилбензола 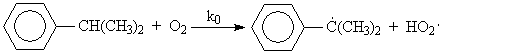 Эта реакция характеризуется высоким энергетическим барьером и протекает крайне медленно. Низкая скорость инициирования не может обеспечить концентрацию свободных радикалов на уровне, вызывающем заметное протекание цепного процесса. Поскольку гидропероксид изопропилбензола легко распадается по слабой кислород-кислородной связи 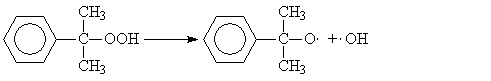 его накопление в ходе процесса приводит к лавинообразному увеличению скорости генерирования свободных радикалов, а значит, и скорости окисления изопропилбензола. Такой характер процесса обусловливает наличие некоторого индукционного периода реакции, который можно определить как время, в течение которого в системе накапливается количество гидропероксида, обеспечивающее заметное протекание цепного процесса. В связи с этим естественным способом сокращения индукционного периода является добавление в исходный изопропилбензол некоторое количество гидропероксида или окисленной реакционной массы. Индукционный период процесса может быть значительно больше по причине присутствия в реакционной массе ингибиторов свободно-радикального окисления таких как серосодержащие органические соединения, фенолы и др. В этом случае индукционный период определяется как время, в течение которого в системе разрушается ингибитор J-H за счёт его взаимодействия с радикалами цепи R + J-H RH + J Образующиеся при этом радикалы J малоактивны и не способны дальше продолжать цепь. В связи с отмеченной причиной увеличения индукционного периода важной технологической задачей является очистка исходного сырья от веществ, являющихся ингибиторами или способных при окислении давать ингибиторы. Обычные катализаторы жидкофазного окисления (соли марганца, кобальта и др.) в данном случае нельзя использовать в качестве инициирующих агентов, так как они вызываеют заметное разложение гидропероксида в побочный продукт – диметилфенилкарбинол. 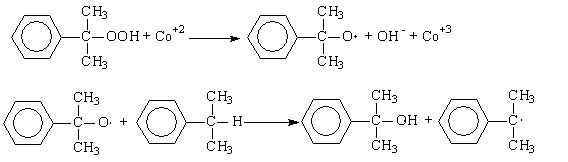 Процесс окисления изопропилбензола в гидропероксид осложняется образованием побочных продуктов: ацетофенона и диметилфенилкарбинола. Механизм основной и побочных реакций может быть представлен следующей схемой 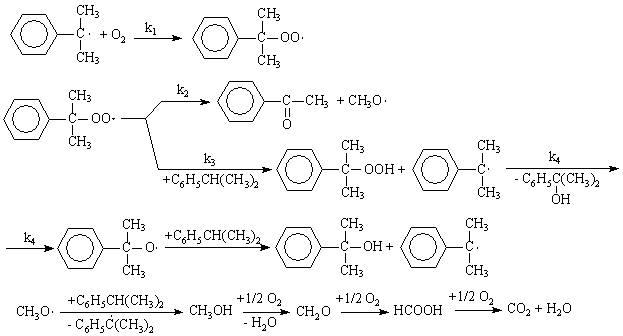 В соответствии с представленной схемой дифференциальная селективность процесса по гидропероксиду выразится уравнением
В условиях стационарности однако поскольку удельный вес ацетофенона в этом процессе невелик, членом r2 в последнем равенстве можно пренебречь Тогда соотношение концентраций выразится уравнением 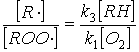 Подставляя последнее выражение в уравнение (4), имеем окончательно  Анализ этого уравнения показывает, что селективность реакции падает с понижением парциального давления кислорода и ростом глубины превращения (что соответствует накоплению гидропероксида и уменьшению концентрации углеводорода). В соответствии с более низкими энергиями активации реакции развития цепей основного процесса по сравнения с побочными Е4>E1 и E2>E3 селективность процесса растёт с понижением температуры, однако при этом понижается его скорость. Это обусловливает необходимость выбора оптимальной температуры. На практике процесс проводят при температурах 105-120С. Если процесс осуществляется в каскаде реакторов, то температуру процесса ступенчато понижают при переходе от одного реактора к другому. Такое решение позволяет при сохранении скорости процесса (за счёт увеличения концентрации гидропероксида) увеличить селективность процесса. Увеличение давления приводит к росту скорости и селективности процесса. В то же время давление ограничивается сверху в связи с более жёсткими условиями работы оборудования, увеличением расходов на компримирование, расширением пределов взрываемости паро-газовой смеси над реакционной массой. На практике работают с давлением 0,3-0,5 МПа. Время реакции определяется значением оптимальной конверсии. Увеличение конверсии (соответствующие накоплению ROOH и исчерпыванию RH) приводит в соответствии с уравнением ( |

