|
|
Лекция орг-хим 8. Лекция Оксосоединения (альдегиды и кетоны) Учебные вопросы
Первый представитель альдегидов формальдегид – газообразное вещество, ацетальдегид – уже легколетучая жидкость, следующие гомологи – жидкости, температуры кипения которых по мере увеличения числа атомов углерода в молекулах закономерно возрастают. Высшие по числу углеродных атомов – альдегиды – твердые вещества. Формальдегид и ацетальдегид хорошо растворяются в воде, растворимость последующих гомологов постепенно падает. Низшие альдегиды обладают резкими характерными запахами. Среди кетонов при нормальных условиях нет газообразных веществ: уже ацетон – жидкость; высшие кетоны – твердые вещества. Для кетонов характерен не очень сильный, и даже приятный запах, на чем основано применение некоторых из них в парфюмерии. Низшие кетоны смешиваются с водой. Химические свойства Благодаря наличию в молекулах альдегидов и кетонов карбонильной группы эти вещества очень активны в химических реакциях. При этом альдегиды гораздо более реакционноспособны, чем кетоны. В карбонильной группе кислород более электроотрицателен, чем углерод, поэтому -электроны двойной связи смещены к кислороду. Эта связь значительно поляризована, чем объясняется активность карбонильной группы (I): R 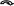 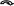 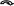 >С+=О- RCH=O RC =O (I) (II) (III) Алкильные остатки обладают электродонорными свойствами (способностью подавать электроны). В альдегидах смещение электронов от алкила к карбонильному углероду (II) уменьшает его частичный положительный заряд (+). Поэтому реакционная способность карбонильной группы в уксусном альдегиде СН3—СН=О уже несколько меньше, чем в муравьином СН2=О, в котором карбонильный углерод не связан с алкилом. В ряду альдегидов реакционная способность уменьшается по мере усложнения алкильных радикалов. В кетонах под влиянием двух алкилов (III) положительный заряд карбонильного углерода и, следовательно, активность карбонильной группы еще более уменьшены. Реакции окисления Альдегиды и кетоны различно относятся к действию окислителей. Альдегиды окисляются очень легко; это обусловлено тем, что в их молекулах при уже окисленном углеродном атоме карбонильной группы имеется водород, который под действием различных окислителей (и даже кислорода воздуха) окисляется, образуя группу – ОН. Таким образом, альдегидная группа превращается в карбоксильную, и альдегиды, следовательно, окисляются в карбоновые кислоты с таким же, как в исходном альдегиде, числом углеродных атомов: [O] R—C—H R—C—OH II II Например: [О] [О] Н—С—Н Н—С—ОН ; СН3—С—Н СН3—С—ОН II II II II О О О О муравьиный муравьиная уксусный уксусная альдегид кислота альдегид кислота Кетоны окисляются значительно труднее, в их молекулах при уже окисленном углероде карбонильной группы нет водорода, и в этом отношении они напоминают третичные спирты. Поэтому они не окисляются слабыми окислителями. Под действием сильных окислителей они распадаются: разрывается углеродная цепь около карбонильной группы с одной или другой стороны, в результате образуются кислоты (иногда и кетоны) с меньшим числом углеродных атомов. Например:
СН3 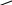 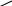 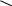 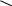 2[О] 5 4 О О 2[О] 5 4 О О  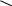 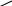 O CH3 СН3—С + С—СН—СН3 O CH3 СН3—С + С—СН—СН3 5  4 3II 2 1 а кислота ОН НО кислота 4 3II 2 1 а кислота ОН НО кислота СН3—СН2—С—СН—СН3 — СН3 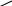 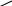 а б 2[О] 5 4 3 О а б 2[О] 5 4 3 О |
|
|
 Скачать 180 Kb.
Скачать 180 Kb.