  Cl 2KOH OH Cl 2KOH OH   C C C=O +H2O C C C=O +H2O Cl -2HCl OH Реакция ускоряется в присутствии щелочей. Из дигалогенпроизводных с галогеном при первичном углероде образуются альдегиды:
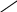 2HOH OH -2H2O 2HOH OH -2H2O 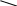 СН3—СНСl2 CH3—CH CH3—CH=O СН3—СНСl2 CH3—CH CH3—CH=O NaOH OH 1,1-дихлорэтан уксусный альдегид
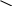  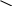 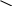 СН3 2НОН CH3 OH -2H2O CH3 СН3 2НОН CH3 OH -2H2O CH3 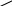  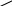 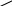 CCl2 C C=O CCl2 C C=O CH3 NaOH CH3 OH CH3 2,2-дихлорпропан
Гидратация ацетиленовых углеводородов Как было указано, присоединение воды к углеводородам с тройной связью (реакция Кучерова) приводит к образованию карбонильных соединений. Из ацетилена при этом образуется альдегид (уксусный), а из его гомологов получаются кетоны.
Сухая перегонка кальциевых солей карбоновых кислот При нагревании без доступа воздуха кальциевые соли карбоновых кислот разлагаются, образуя кетоны. Так, из уксуснокислого кальция получают ацетон:      О О  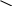 CH3—C—O t CH3 CH3—C—O t CH3  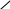   Ca C=O + CaCO3 Ca C=O + CaCO3   CH3—C—O CH3 CH3—C—O CH3  О ацетон О ацетон уксуснокислый кальций Смешанные кетоны получают из смесей кальциевых солей двух различных кислот. Такую смесь можно представит как смешанную соль. Например, чтобы получить метилэтилкетон, надо взять кальциевую соль уксусной и пропионовой кислот: O O II II 3СН3—С—О—Са—О—С—СН2—СН3 3СаСО3 + кальциевая соль уксусной и пропионовой кислот 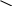 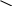 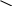 СH3 CH3 CH3—CH2 СH3 CH3 CH3—CH2 +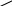   C=O + C=O + C=O C=O + C=O + C=O CH3—CH2 CH3 CH3—CH2 метилэтилкетон диметилкетон диэтилкетон Как видно из уравнения, наряду со смешанным кетоном в качестве побочных продуктов образуются два симметричных кетона. Если исходить из смеси, в которой одна из кальциевых солей – соль муравьиной кислоты, то могут быть получены соответствующие альдегиды. Например: O O O II II II СН3—С—О—Са—О—С—Н СН3—С—Н + СаСО3 кальциевая соль муравьиной и уксусный альдегид уксусной кислот Не трудно понять, что в качестве побочных продуктов при этом образуется муравьиный альдегид Н2С=О и симметричный кетон (в данном случае диметилкетон). В описанных реакциях могут быть использованы и бариевые соли кислот.
Оксосинтез В промышленности значительное количество альдегидов получают присоединением окиси углерода и водорода к углеводородам ряда этилена. Например, из пропилена может быть получена смесь масляного и изомасляного альдегидов: СН3—СН2—СН2—СН=О промышленности значительное количество альдегидов получают присоединением окиси углерода и водорода к углеводородам ряда этилена. Например, из пропилена может быть получена смесь масляного и изомасляного альдегидов: СН3—СН2—СН2—СН=О СН3—СН=СН2 + СО + Н2 масляный альдегид пропилен СН3—СН—СН3 изомасляный СН=О альдегид Исходную смесь газов под высоким давлением пропускают над нагретым катализатором, содержащим Со. В качестве сырья используют этиленовые углеводороды из газов переработки нефти, а также водяной или синтез-газ. Образующиеся альдегиды могут быть восстановлены в соответствующие первичные спирты или окислены в кислоты. Метод получения кислородсодержащих соединений из этиленовых углеводородов, окиси углерода и водорода называют оксосинтезом.
Отдельные представители альдегидов и кетонов Формальдегид СН2=О (муравьиный альдегид, метаналь). Представляет собой бесцветное горючее вещество с острым раздражающим запахом. Ткип. = –19,2 оС, Тпл. = –92 оС, Температура самовоспламенения 430 оС, область воспламенения 7,73 % объемных. (Тушить тонкораспыленной водой, воздушно-механической пеной на основе ПО-11.) Растворим в воде, обычно используется в виде 33-40 % водного раствора, который называют формалином. Газообразный формальдегид самопроизвольно полимеризуется, образуя тример состава (СН2О)3, Тпл.= 62 оС, циклического строения, подобный тримеру уксусного альдегида, но не содержащий боковых метилных групп. При длительном стоянии водных растворов формальдегида, особенно при низких температурах, а также при упаривании в них осаждается белый осадок – полимер формальдегида состава (СН2О)n, который называют параформальдегидом (или параформом). Он представляет собой смесь низкомолекулярных полиформальдегидов с величиной n от 10 до 50. При нагревании до 140-160 оС параформальдегид деполимеризуется и превращается в газообразный формальдегид; процесс ускоряется в присутствии кислот. В промышленности формальдегид обычно получают из метилового спирта; пары спирта в смеси с воздухом пропускают через контактный аппарат с раскаленной медной спиралью: О2 2СН3—ОН 2СН2=О + 2Н2О метанол Cu формальдегид Образующийся формальдегид улавливают в воду. Другой важный способ получения формальдегида заключается в неполном окислении кислородом воздуха метана, входящего в состав природных газов. Процесс ведут в присутствии катализаторов (соединения Mn и Cu) при температуре около 400 оС: СН4 + О2 СН2=О + Н2О Формальдегид получается в смеси с другими кислородсодержащими соединениями. Его отделяют ректификацией. Вырабатывают формальдегид в больших количествах. Он применяется в производстве пластмасс. Полиформальдегид с большим молекулярным весом – ценный синтетический материал, используемый в качестве заменителя металлов. В кожевенной промышленности формальдегид применяется для дубления кожи, в медицине и санитарии – для дезинфекции. В с/х формальдегид используется для протравливания семян перед посевом (уничтожают паразитические споры). Так как формальдегид образуется при неполном сгорании различных органических веществ, то он содержится в дыме угля, дерева; на этом основано консервирующее действие дыма при получении мясных и рыбных копченостей. Ацетальдегид СН3—СН=О (уксусный альдегид, этаналь). Представляет собой бесцветную легколетучую, легковоспламеняющуюся жидкость с сильным характерным запахом прелых яблок. Ткип.= +20,8 оС, Тпл.= —122,6 оС. (Температура воспламенения –38 оС, температура самовоспламенения 185 оС; область воспламенения 4-55 % объемных. Тушить водой.) Хорошо растворим в воде. В присутствии капли серной кислоты полимеризуется, образуя жидкий тример состава (С2Н4О)3 – так называемый паральдегид. При низких температурах получается кристаллический тетрамер состава (С2Н4О)4 – так называемый метальдегид. Оба полимера при нагревании с серной кислотой деполимеризуются. В промышленности ацетальдегид получаю главным образом из ацетилена (по реакции Кучерова), а также каталитическим дегидрированием этилового спирта. По новому промышленному способу его синтезируют (с выходом до 95%), окисляя этилен кислородом воздуха при помощи катализатора, содержащего хлориды меди и палладия: 0,5О2 СН2=СН2 CH3—CH=O CuCl2 + PdCl2 Используют ацетальдегид для многих промышленных синтезов. Особенно важно окисление его в уксусную кислоту, превращение в этилацетат (по реакции Тищенко); может быть восстановлен в этиловый спирт. Ацетон СН3—СО—СН3 (диметилкетон). Бесцветная, легковоспламеняющаяся жидкость с довольно приятным запахом, Ткип. = 56,1 оС, Тпл.= —94,3 оС. Смешивается с водой. Раньше ацетон получали вместе с метиловым спиртом и уксусной кислотой при сухой перегонке дерева. В настоящее время главный промышленный способ получения ацетона – каталитическое дегидрирование вторичного пропилового спирта; последний в свою очередь получают гидратацией пропилена, добываемого из газов крекинга. Ацетон является ценным растворителем (в производстве лаков, искусственного шелка, взрывчатых веществ) и исходным веществом в синтезе разнообразных органических соединений. В последнее время в технике большое значение приобрело применение ацетона для получения так называемого кетена. Для этой цели ацетон подвергают пиролизу, пропуская его пары над нагретой до 500-600 оС окисью алюминия: 500-600 оС СН3—С=О CH2=C=O + CH4 Al2O3 кетен ацетон CH3 Кетен – газообразное вещество, очень реакционноспособное. Применяется для получения уксусного ангидрида и ряда других ценных продуктов, в частности, очень хорошего пищевого консерванта – сорбиновой кислоты. (Твоспл.= —18 оС; минимальная темп. самовоспл. 465 оС; область воспл. 2,2-13,0 % объемн.; температурные пределы воспламенения: нижний —20 оС; верхний 6 оС. Тушить - тонкораспыленной водой, омыленной химической пеной, воздушно-механической пеной на основе ПО-11.) Метилэтилкетон СН3СОС2Н5 (этилметилкетон, бутанон-2). Бесцветная легковоспламеняющаяся жидкость. Тпл.= -86,40 оС, Ткип. 79,60 оС; растворимость в воде 22,6 % вес. Температура воспламенения = —6 оС; температура самовоспламенения 514 оС; область воспламенения 1,9-10,0 % объемных; температурные пределы воспламенения : нижний – —110 оС, верхний – 200 оС. Максимально взрывоопасное содержание кислорода при разбавлении паровоздушной смеси углекислым газом - 14,05 % объемных; азотом - 11,3 % объемных. Циклогексанон С6Н10О (анон). Легковоспламеняющаяся бесцветная маслянистая жидкость с запахом мяты. Тпл. = —31,2 оС; Ткип.= 155,7 оС; В воде труднорастворим. Темп. воспламенения 40 оС; Темп. самовоспламенения 495 оС; область воспламенения 0,92-3,5 % объемных; температурные пределы воспламенения: нижний- 31 оС, верхний- 57 оС. Тушить тонкораспыленной водой, пеной. О II 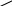 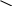 C C CH2 CH2 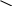  CH2 CH2 CH2 CH2 CH2
ЛИТЕРАТУРА
Писаренко А.П., Хавин З.Я. Курс органической химии. М., Высшая школа,
1975. 510 с.
Нечаев А.П. Органическая химия. М., Высшая школа, 1976. 288 с.
Артеменко А.И. Органическая химия. М., Высшая школа, 2000. 536 с.
Березин Б.Д., Березин Д.Б. Курс современной органической химии. М., Высшая школа, 1999. 768 с.
Ким А.М. Органическая химия. Новосибирск, Сибирское университетское издательство, 2002. 972 с.
|
 Скачать 180 Kb.
Скачать 180 Kb.