Лекции биохимия. Лекция Предмет и методы биохимии. Строение, свойства и биологические функции углеводов и липидов
 Скачать 2.08 Mb. Скачать 2.08 Mb.
|
|
СТРОЕНИЕ БЕЛКОВЫХ МОЛЕКУЛ Первый белковый препарат был выделен из пшеничной муки в 1728 году Я.Б.Беккари и назван клейковиной. В 1809-10 г.г. появились первые сведения об элементном составе, а в 1836 г. предложена первая эмпири-ческая формула белков. В дальнейшем довольно активно многими иссле-дователями проводилось изучение продуктов распада белковых веществ и появлялось все больше и больше сведений о том, что основными про-дуктами гидролитического разложения белков являются аминокислоты. К 1899 г. уже было известно 13 аминокислот, большинство из которых были идентифицированы как продукты гидролиза белков. Основополагающий вклад в разработку теории строения белков внесли работы Э.Фишера, который в 1901 г. предположил и затем экспери-ментально обосновал положение о том, что белковые молекулы постро-ены из аминокислот, остатки которых соединены пептидными связями. Образующиеся таким путем полимеры обычно называют полипептидами, а учение о построении белковых молекул из аминокислот, соединенных пептидными связями, - полипептидной теорией строения белков. В образовании пептидной связи участвуют α-аминокислоты, которые взаимодействуют своими аминными и карбоксильными группами, при этом высвобождаются молекулы воды. У диаминомонокарбоновых кислот пептидную связь может образовать только аминогруппа, находящаяся в α-по-ложении, а у моноаминодикарбоновых кислот - карбоксильная группа, имеющая в α-положении аминогруппу. Углеводородные радикалы амино-кислотных остатков, соединенных пептидными связями, остаются в виде боковых радикалов. Так, например, из аланина, аспарагиновой кислоты и лизина образуется трипептид: 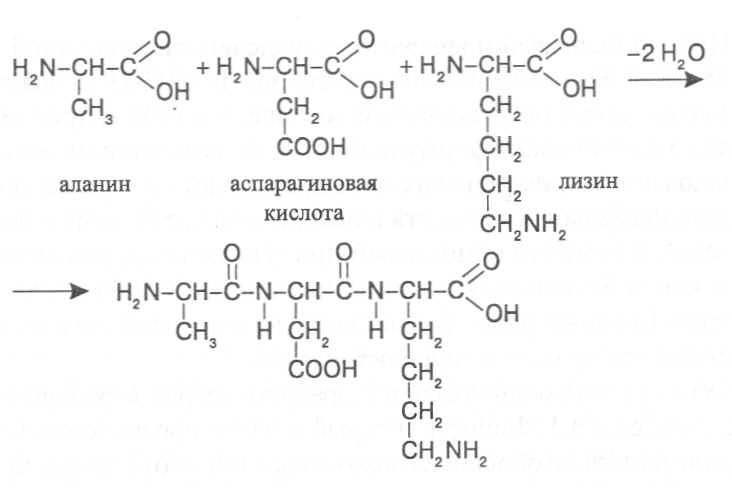 Название пептида составляется из названий образующих его амино-кислот, при этом аминокислота, имеющая свободную карбоксильную группу, записывается в конце формулировки, а у других аминокислот окончание изменяют на "ил" и их перечисляют в названии пептида в том порядке, в котором они находятся в структурной формуле полученного соединения. В соответствии с этим выше представленный трипептид имеет название - аланиласпарагиллизин. Методом рентгеноструктурного анализа показано, что атомные группировки пептидной связи расположены в одной плоскости, образуя преимущественно транс-конфигурацию относительно связи C-N, которая в значительной мере имеет характер двойной связи, и вращение вокруг этой связи сильно ограничено.  В целом пространственное построение полипептидной цепи можно представить как последовательность плоских структур, образуемых эле-ментами пептидной связи, которые соединены через α-углеродные атомы аминокислотных радикалов. Поскольку связи у α-углеродных атомов не являются двойными, вокруг них возможно вращение расположенных в плоскости пептидной связи группировок. Если поменять порядок соединения аминокислот в пептиде, то мы получим несколько изомеров. Чаще всего в состав белковых полипепти-дов могут входить 100-400 аминокислотных остатков, которые, соединяясь пептидными связямми в определенном порядке, могут давать огромное число изомерных молекул, способных выполнять разнообразные биологи-ческие функции. В общем виде строение полипептида можно выразить следующей формулой: 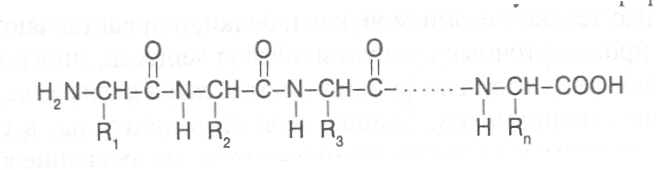 В этой формуле аминокислотные остатки соединены связями -СО-NH-, которые и называют пептидными, а R1, R2, R3...Rn - радикалы амино-кислотных остатков, содержащие различные группировки атомов и обра-зующие боковые ответвления в молекуле полипептида. На противоположных концах полипептидной цепи имеются свобод-ная аминная и свободная карбоксильная группы, по которым определяют направленность полипептида. Аминокислота на конце полипептидной цепи, имеющая свободную аминогруппу в α-положении, называется N-концевой аминокислотой, а аминокислота на противоположном конце полипептида, имеющая свободную карбоксильную группу, не использованную для образования пептидной связи, - C-концевой аминокислотой. Определение N- и C-концевых аминокислот имеет важное значение для выяснения строения белковой молекулы, так как позволяет установить в ней число полипептидных цепей. Большинство известных белков содержат в молекуле более одной полипептидной цепи и этим существенно отличаются от обычных пептидов, имеющих одну полипептидную цепь и более низкую молекулярную массу. Однако чёткую границу между пептидами и белками провести довольно трудно; и те, и другие имеют вполне определенную пространственную структуру и выполняют свою биохимическую функ-цию. Основными критериями следует считать степень полимерности молекулы, обеспечи-вающую ей необходимые коллоидные, осмотические, буферные и другие свойства, характерные для белков, а также способность формировать определённую пространственную структуру. Самая низкая степень полимерности известных белков составляет не менее 50 аминокислотных остатков в одной молекуле. Вместе с тем известны некоторые белки, молекулы которых насчитывают свыше тысячи аминокислотных остатков. Пептиды в различных организмах очень часто синтезируются с по-мощью тех же механизмов, как и белки, и представляют собой важные промежуточные продукты обмена веществ, многие из них выполняют регуляторные функции и относятся к физиологически активным соеди-нениям. Однако известны пептиды, в синтезе которых принимают участие аминокислоты, не входящие в состав белков, они способны образовывать циклические структуры. К таким пептидам относятся антибиотики грами-цидин, циклоспорин, тироцидин и токсины бледной поганки. К пептидам, выполняющим регуляторные функции, относятся многие гормоны человека и животных (окситоцин, вазопрессин, адренокортикотропный гормон и некоторые другие). Из растительных пептидов наиболее хорошо изучен глютатион, структура которого была выяснена в 1945 г. Ф.Гопкинсом. Молекула глю-татиона включает остатки трёх аминокислот - глутаминовой кислоты, цис-теина и глицина. Глицин и цистеин соединены пептидной связью, а цистеин и глутаминовая кислота - псевдопептидной (или изопептидной) связью, которая образуется при взаимодействии аминогруппы цистеина с карбоксильной группой глутаминовой кислоты, не имеющей в α –положе-нии аминогруппы и в составе белковых полипептидов обычно находящейся в составе бокового радикала. H2N-CH-CH2-CH2-CO-NH-CH-CO-NH-CH2-COOH │ │ COOH CH2SH глютатион Высокая биологическая активность глютатиона обусловлена его спо-собностью участвовать в восстановительных реакциях, так как под дей-ствием фермента он может легко отщеплять водород от сульфгидрильной группы (-SH) и переходить в восстановленную форму, образуя димеры, связанные дисульфидными (-S-S-) связями. Схематически образование окисленных димеров глютатиона можно представить следующим образом: фермент R-SH + HS-R ¾¾® R-S-S-R + фермент - H2 Глютатион содержится во всех растительных клетках и оказывает влияние на активность многих ферментов, катализирующих превращения белков. Учитывая высокую биологическую активность многих пептидов, разрабатываются технологии их химического синтеза с целью получения искусственных гормонов, антибиотиков, различных медицинских препа-ратов. Как показывают опыты, путем химического синтеза можно полу-чать полипептидные цепи, содержащие до 100 аминокислотных остатков. Особенно значительные успехи достигнуты в результате сочетания хими-ческого и ферментативного синтезов. Так, например, из природных поли-пептидов путем частичного гидролиза выделяют пептидные фрагменты нужного состава, а затем их соединяют с помощью химических реакций или ферментативного синтеза, получая таким образом биологически активные пептидные препараты. После того, как была сформулирована и экспериментально подтвер-ждена полипептидная теория строения белков, следующим этапом было определение структурных формул белков, показывающих последова-тельность соединения аминокислотных остатков в белковых молекулах. Впервые это удалось выполнить Ф.Сенгеру в 1954 г., применившему новые подходы в химической идентификации концевых аминокислот у различных пептидов, которые могут быть получены при частичном гидролизе полипептидов изучаемого белка. Сопоставление аминокислотных последовательностей перекрываю-щихся фрагментов полипептидных цепей гормона поджелудочной железы- инсулина позволило ему с достаточно высокой точностью определить последовательность соединения аминокислотных остатков в молекуле этого белка. Как оказалось, молекула инсулина состоит из двух полипептидных цепей, в одной из которых содержится 30 аминокислотных остатков, в другой - 21. Полипептидные цепи в двух положениях соединены дисуль-фидными связями, которые образуются при взаимодействии сульфгид-рильных групп (-SH) цистеиновых радикалов точно по такому же меха-низму, как у димеров глютатиона. Положение этих цистеиновых остатков в полипептидных цепях инсулина показано на рисунке 5. Следует учитывать, что нумерацию аминокислотных остатков в по-липептидах принято исчислять в направлении от N-концевой аминокислоты к С-концевой. В короткой цепи инсулина образуется еще одна дисульфидная связь между остатками цистеина в 6-м и 11-м положениях. В длинной цепи N-концевая аминокислота - фенилаланин, С-концевая аминокислота - аланин; в короткой цепи N-концевая аминокислота – глицин, С-концевая - аспарагин. Таким образом, на примере инсулина мы видим, что молекула белка может быть построена не из одного полипептида и разные полипептидные цепи в молекуле белка могут соединяться дисульфидными связями за счёт цистеиновых остатков. Вслед за инсулином были расшифрованы аминокислотные последо-вательности различных пептидов и белков: окситоцина, вазопрессина, РНК-полимеразы, пепсина, трипсина, лизоцима, цитохромов, гемоглоби-на, папаина и многих других полиаминокислотных соединений. Уже к 1975 г. насчитывалось 600 белков с известными аминокислотными после-довательностями, к 1985 г. - свыше 2500. В настоящее время работа по анализу аминокислотных последовательностей в белках почти полностью автоматизирована и число таких белков уже значительно превышает 20 тысяч. ПЕРВИЧНАЯ СТРУКТУРА БЕЛКОВ. Последовательность соедине-ния аминокислот в полипептидных цепях белковой молекулы принято называть первичной структурой белка. Она определяется последователь-ностью нуклеотидов конкретного участка ДНК, кодирующего данный полипептид и называемого геном. Замена даже одной аминокислоты в структуре белка может сущест-венно изменить его функцию. Поэтому полипептиды можно рассматривать как "отпечатки" кодирующих их генов и использовать для распознавания генотипов, а также установления между ними генетического родства. Так, например, в короткой полипептидной цепи инсулина человека в положениях 8, 9 и 10 находится последовательность аминокислот Thr-Ser-Ile, в инсулине овцы - Ala-Gly-Val, в инсулине коровы - Ala-Ser-Val, в инсулине собаки - Thr-Ser-Ile, то есть такая же аминокислотная последовательность, как и у человека, что свидетельствует о меньшем филогенетическом различии между этими организмами. В других исследованиях, связанных с изучением аномальных форм гемоглобина, установлено, что во многих случаях замена в одной из его полипептидных цепей хотя бы одной аминокислоты на другую вызывает нарушение физиологической функции этого белка, которое приводит к серьезным клиническим последствиям для организма человека. ВТОРИЧНАЯ СТРУКТУРА БЕЛКОВ. Полипептидная цепь, вклю-чающая последовательность аминокислотных остатков, характерную для данного белка, формирует вполне определённую пространственную структуру, которую обычно называют конформацией белковой молекулы. Пространственное же строение каждого отдельного участка полипептид-ной цепи представляет собой вторичную структуру белка. Формирование вторичной структуры белковых молекул зависит от физико-химических параметров аминокислотных остатков и их последова-тельности в полипептидной цепи. Как уже было отмечено, атомные груп-пировки пептидной связи располагаются в одной плоскости, а каждая такая плоскостная структура соединяется с соседней через α-углеродные атомы аминокислотных радикалов ковалентными связями, вокруг которых возможно вращение плоскостных структур пептидных связей. Угол пово-рота по каждой из этих связей для каждого аминокислотного остатка вполне определенный, зависящий от строения аминокислотного радикала. Если на конкретном участке молекулы полипептида группируются аминокислотные остатки с близкими углами вращения по указанным связям, то и формируется однотипная вторичная структура. В стабилизации вторичной структуры полипептида важную роль играют водородные связи, возникающие между группировками пептидных связей по следующей схеме: ═N-H.....O=C═ Одна из разновидностей вторичной структуры белка - α-спираль, ко-торая была установлена в 1951 г. Л.Полингом и Р.Кори методом рент-геноструктурного анализа. При формировании α-спирали происходит спи-ралевидное закручивание полипептидной цепи, которое стабилизируется за счет образования водородных связей, возникающих в определённом порядке между NH- и CO-группами пептидных связей, находящихся в соседних витках спирали (рис. 6). NH-группа пептидной связи каждого аминокислотного остатка соединяется водородной связью с CO-группой пептидной связи другого аминокислотного остатка, удалённого в полипеп-тидной цепи от первого на 4 аминокислотных остатка, считая по направ-лению цепи назад. Водородные связи ориентированы вдоль оси спирали, при этом атомы кислорода, соединенные двойной связью с атомами углерода, об-ращены от атомов углерода по спирали вперед, а атомы водорода, сое-диненные с атомами азота, обращены от атомов азота по спирали назад. Боковые радикалы аминокислот также ориентированы вдоль оси спирали по направлению, противоположному направлению полипептидной цепи (направление полипептидной цепи принято считать от N-конца к C-концу). Внутри α-спирали не образуется полости, так как всё пространство пол-ностью занято группировками пептидных связей и α-углеродных атомов. На поверхности α-спирали находятся боковые радикалы аминокислот, которые могут взаимодействовать как между собой, так и с веществами окружающей среды. Большинство известных белков образуют α-спираль, у которой спи-ралевидное закручивание полипептидной цепи происходит по направлению движения часовой стрелки. Расчеты показывают, что на каждый виток спирали приходится 3,6 аминокислотных остатка, а ход спирали при удлинении цепи на один аминокислотный остаток равен 0,15 нм. Диаметр условной цилиндрической поверхности, на которой находятся α-углеродные атомы аминокислотных радикалов, составляет 1,01 нм (рис. 7). Спиралевидная конфигурация вторичной структуры является основ-ной для фибриллярных белков, как например, белка волос, шерсти, перьев, рогов - кератина. Однако длина спирализованных участков глобулярных белков небольшая и обычно составляет несколько витков (3-4 оборота α-спирали). Спирализация полипептидной цепи возникает в том случае, когда на определенном её участке группируются остатки α-аланина, лейцина, фенилаланина, тирозина, триптофана, цистеина, метионина, гистидина, аспарагина, глутамина, валина. Довольно часто в структуре глобулярных белков встречаются изгибы и петли, поворачивающие пептидную цепь на определенный угол. Наиболее характерной формой такой структуры является так называемый b-изгиб, поворачивающий пептидную цепь на 180˚. Обычно b-изгиб включает 3-4 аминокислотных остатка, ключевым из которых является остаток аминокислоты глицина. Остатки аминокислоты пролина вызывают излом образующейся α-спирали с отклонением от оси спирали на угол 20˚-30˚. Это объясняется тем, что азот пролина, входящий в структуру пептидных группировок, не связан с атомом водорода и поэтому не образует водородной связи.  Есть аминокислоты, которые, исходя из строения радикала, форми-руют другой тип вторичной структуры (серин, изолейцин, треонин, лизин, аргинин, аспарагиновая и глутаминовая кислоты), его называют b-структу-рой. В b-структуре водородные связи образуются между CO- и NH-груп-пами, находящимися в соседних отрезках полипептидной цепи, которые имеют параллельную или противоположную направленность; в соответ-ствии с этим и b-структуры называют параллельными или антипараллель-ными. В двух соседних цепях, формирующих b-структуру, в образовании водородных связей участвует половина CO- и NH-групп, что связано с че-редованием пространственного расположения аминокислотных радикалов. Боковые радикалы соседних аминокислотных остатков находятся в транс-положении по отношению к пептидной группировке, поэтому в образовании водородных связей с соседней полипептидной цепью участвует каждая вторая пептидная группа. Оставшиеся свободными СО- и NН-группы могут образовывать водородные связи с аналогичными группами еще одной цепи с противоположной стороны, а она со следующей пептидной цепью и т. д. Таким образом, с помощью водородных связей могут быть соединены несколько пептидных цепей (2-10) протяженностью до 8 аминокислотных остатков вдоль каждой из цепей, а у некоторых даже больше. Отходящие в противоположные стороны от каждой полипептидной цепи радикалы аминокислотных остатков образуют поверхности, имеющие складчатое строение. Складки этих поверхностей определяются углами связей α-углеродных атомов аминокислотных остатков (рис. 8). Очень часто поверхность b-структуры закручивается под определенным углом, образуя уже супервторичную структуру. Вторичная структура полипептидов в виде α-спирали и b-структур относится к структурам, которые периодически повторяют в простран-стве свои конфигурации, в связи с чем их называют регулярными структурами. Однако практически в каждой белковой молекуле имеются участки с вполне определенной пространственной конфигурацией, но она не повторяется в других участках. Такие разновидности вторичной структуры белка принято называть нерегулярными структурами. Каждый белок в зависимости от первичной структуры, определяющей набор и последовательность аминокислотных остатков в его полипептидных цепях, имеет вполне определенные группировки аминокислот на отдельных участках молекулы, которые в зависимости от их физико-химических параметров способны формировать тот или иной тип вторичной структуры. Поэтому в данном белке в соответствии с последовательностью соединения аминокислот на каждом участке реализуется совершенно определённый тип вторичной структуры. Известно очень мало белков, имеющих на всех участках молекулы одинаковую вторичную структуру. К таким белкам относятся кератин (структурный белок шерсти, перьев, рогов) и коллаген (белок сухожилий), имеющие конфигурацию молекулы в виде α-спирали. Другим примером являются белки шелка (фиброин) и семян канавалии (конканавалин А), образующие преимущественно b-структуры. Большинство же белков формируют смешанный тип вторичной структуры, включающий на конкретных участках молекулы и α-спираль, и b-структуры, и нерегурные структуры. Так, например, в белке миоглобине 79% составляющих его аминокислотных остатков образуют вторичную структуру в виде α-спирали, 16% приходится на участки с нерегулярной структурой и 5% участвуют в образовании b-изгибов. В растительном белке папаине 28% вторичной структуры представлено α-спиралями, 14% - b-структурами, 17% -b-изгибами и 41% - нерегулярными структурами. 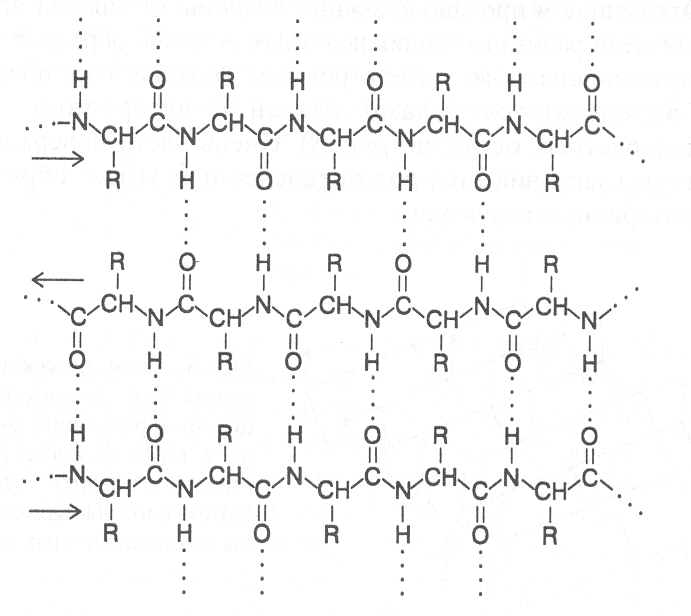 Участок антипараллельной b-структуры 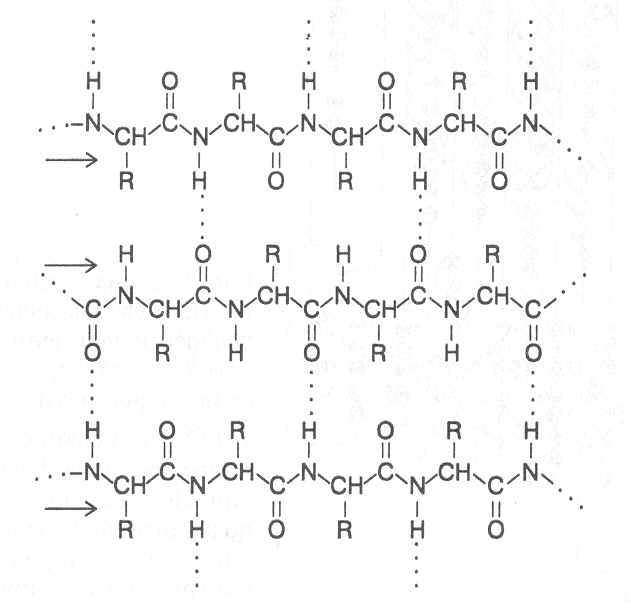 Участок параллельной b-структуры (стрелками показаны направления полипептидных цепей) На рисунке 9 показана схема возможного образования вторичных структур на одном из участков полипептидной цепи ферментного белка глицеральдегидфосфатдегидрогеназы. Как видно из представленной схемы, последовательности аминокислотных остатков 9 ® 22, 33 ® 45, 78 ® 81, 85 ® 88, 95 ® 98, 100 ® 112, 129 ® 133 образуют спиралевидную вторичную структуру, тогда как аминокислотные последовательности 1®7, 26®32, 56®75, 90®94, 115®120, 126®128, 142® 147 образуют b-структуры, другие аминокислотные остатки участвуют в формировании изгибов и нерегулярных структур. ТРЕТИЧНАЯ СТРУКТУРА БЕЛКОВ. Порядок размещения в пространстве всех атомных группировок полипептидной цепи принято называть третичной структурой белковой молекулы. Впервые понятие о третичной структуре белков было сформулировано в 1958 г. Д.Кендрью на основе рентгеноструктурного анализа пространственной конфигурации белка миоглобина, в результате чего удалось выяснить трёхмерную структуру этого белка. В процессе дальнейших исследований было установлено, что в построении третичной структуры белка важную роль играют некова-лентные взаимодействия между радикалами аминокислотных остатков, находящимися на поверхности вторичных структур, а также дисульфидные связи, возникающие в результате взаимодействия сульфгидрильных групп (-SH) остатков аминокислоты цистеина. При формировании третичной структуры реализуются три типа нековалентных взаимодействий: образова-ние водородных связей, электростатические и гидрофобные взаимодей-ствия. Водородные связи соединяют между собой функциональные группы боковых цепей аминокислотных остатков: R-OH....O=C-R R-O....H-N-R R-C=O....H-N-R ׀ ׀ ׀ ׀ ׀ ОH Н Н NН2 Н Насыщенность белковой молекулы водородными связями весьма велика – не менее 90% от возможного их образования. Важное значение для стабилизации третичной структуры белков имеют также водородные связи, которые образуют группировки полипептидов с молекулами воды, формирующими жидкую фазу белкового раствора. Между заряженными группировками аминокислотных остатков возникают силы электростатического взаимодействия: R-COO‾....H3N⁺-R Формированию компактной пространственной структуры в значи-тельной степени способствуют гидрофобные взаимодействия между неполярными группировками боковых радикалов аминокислот, входящих в состав полипептидной цепи. В результате гидрофобных взаимодействий происходит отталкивание молекул воды от поверхности гидрофобных группировок и сближение последних, вследствие чего полипептидная цепь свертывается в виде глобулы. При этом большая часть гидрофобных радикалов оказывается внутри глобулы и таким образом защищается от контакта с молекулами воды, а гидрофильные радикалы, наоборот, находятся на поверхности белковой глобулы, они образуют водородные связи с молекулами воды и стабилизируют пространственную структуру белка. К аминокислотам, имеющим гидрофобные радикалы, относятся глицин, лейцин, изолейцин, валин, аланин, фенилаланин, цистеин, метионин. Гидрофильные радикалы имеют аминокислотные остатки треонина, серина, триптофана, тирозина, аспарагина и аспарагиновой кислоты, глутамина и глутаминовой кислоты, лизина, гистидина. Образующаяся в результате гидрофобных взаимодействий простран-ственная структура полипептида имеет довольно плотную упаковку, вследствие чего её очень часто называют гидрофобным ядром белковой молекулы. Вокруг ядра формируется оболочка из гидрофильных аминокислотных остатков, в которые могут быть включены и гидрофоб-ные радикалы, образующие гидрофобные выходы на поверхность белко-вой глобулы. За счет формирования таких структур обеспечивается спе-цифичность взаимодействия белковой молекулы с веществами окружающей среды. В состав гидрофильной оболочки, окружающей гидрофобное ядро, входят также молекулы воды, связанные водородными связями с полярными группировками белковой молекулы. У многих белков важным фактором стабилизации третичной структуры являются дисульфидные связи, которые образуются при взаимодействии остатков цистеина по такому же механизму, как и при формировании димеров глутатиона. Однако образование дисульфидных связей не является обязательным условием стабильности третичной структуры белка, так как известно довольно много белков, формирующих устойчивую простран-ственную структуру только за счет нековалентных взаимодействий. При формировании третичной структуры белка может возникать не одно, а два и более гидрофобных ядра, включающих достаточно большие отрезки одной и той же полипептидной цепи. Между этими ядрами образуются впадины и полости, имеющие существеннное значение для функционирования белка. Третичная структура полипептидов складывается из элементов вторичной структуры. Так, в составе ряда белков третичная структура представлена только α-спиралями, которые размещаются в пространстве в виде параллельных участков. Вместе с тем известны белки, построенные в основном из b-структур, свернутых в пространстве под определенным углом. Однако у многих белков пространственная конфигурация молекулы формируется в виде смешанных структур, включающих определенные сочетания α-спиралей и b-структур. При этом довольно часто внутренняя часть молекулы полипептида представлена b-структурами, которые на поверхности окружены α-спиралями. На рисунке 10 показана третичная структура ферментных белков триозофосфатизомеразы и лизоцима. В молекуле триозофосфатизомеразы в центральной части представлены b-слои, которые окружены α-спиралями. В лизоциме часть третичной структуры (в верхней части рисунка) образована в виде b-структур, а другая часть (в нижней части рисунка) представлена α-спиралями. Для существующих в природе белков установлено строгое соответствие между первичной и третичной структурами полипептидов. Последовательность аминокислотных остатков в полипептидной цепи предопределяет ее пространственную конфигурацию. Этот принцип подтверждается в опытах по конструированию аминокислотных последовательностей полипептидов, способных формировать простран-твенную структуру заданного типа. ЧЕТВЕРТИЧНАЯ СТРУКТУРА БЕЛКОВ. Многие белки представяют собой сложные молекулы, образующиеся при нековалентном взаимодей-ствии двух или нескольких полипептидов, каждый из которых имеет свою третичную структуру. Такие белки принято называть олигомерами, а образующие их полипептиды - полипептидными субъединицами белка. Способ совместной упаковки и размещения в пространстве полипептидных субъединиц олигомерных белков называют четвертичной структурой белка. Впервые четвертичную структуру белка установили методом рентгеноструктурного анализа при изучении пространственной конфигура- ции молекул гемоглобина (Перутц М., 1959). В этих исследованиях было определено, что молекула гемоглобина состоит из четырех субъединиц: двух α-полипептидных цепей по 141 аминокислотному остатку в каждой и двух b-цепей по 146 аминокислотных остатков в каждой. Субъединицы гемоглобина размещаются впространстве симметрично, занимая вершины тетраэдрической структуры (рис. 11). В молекуле гемоглобина наблюдается более сильное взаимодействие между разными субъединицами и относительно слабее выражена связь между одноименными субъединицами, вследствие чего формируются довольно устойчивые димеры разных субъединиц (ab), из которых уже формируется структура тетрамерной молекулы за счет более слабых взаимодействий. Такой порядок взаимодействия субъединиц гемо-глобина приводит к образованию совершенно однотипных молекул a2b, тогда как другие сочетания субъединиц неустойчивы. Если характер взаимодействия между всеми субъединицами олиго-мерного белка одинаковый, то возможно возникновение молекул с разным набором полипептидов. Так, например, у тетрамера, молекулы которого образуются из двух типов субъединиц А и Б, формируются олигомеры следующего состава: А4, А3Б, А2Б2, АБ3, АБ4. Все они представляют собой структурно близкие белки, выполняющие одну и ту же функцию в орга-низме. Молекулы олигомерного белка, построенные из разных полипеп-тидных субъединиц и выполняющие одну и ту же биологическую функ-цию, принято называть множественными молекулярными формами, или изоформами, данного белка. Соединение полипептидных субъединиц в олигомерные молекулы происходит за счет нековалентных взаимодействий. Важную роль играют водородные связи, которые образуются между накладывающимися эле- ментами b-структур, входящих в состав белковых субъединиц, а также в результате взаимодействия радикалов аминокислот, имеющих группи- ровки: -CОOH, -OH, =NH, -NH2. При рассмотрении третичной структуры белков было показано, что в поверхностной оболочке, окружающей гидрофобное ядро, также содер-жится много гидрофобных радикалов аминокислот, которые в результате сближения поверхностей третичных структур двух субъединиц вступают в гидрофобные взаимодействия, что вносит существенный вклад в форми-рование четвертичной структуры белков. Причем у некоторых белков гидрофобные взаимодействия являются главными факторами формирова-ния их четвертичной структуры. Так, например, у ряда регуляторных белков имеются характерные последовательности аминоислотных остатков, в которых с определенной частотой встречается гидрофобный радикал лейцина (в одном и том же положении через каждые 2 витка α-спирали). В результате взаимодействия двух субъединиц происходит гидрофобное совмещение их спиралевидных конфигураций и образование двойной спирали, соединяющей данные субъединицы в одну молекулу. Такой тип гидрофобного взаимодействия между полипептидами белка получил название "лейциновых петель". Важными факторами формирования четвертичной структуры белков являются электростатические взаимодействия между заряженными груп-пировками соседних субъединиц, представленными радикалами дикарбо-новых (аспарагиновая и глутаминовая кислоты) и диаминомонокарбоно-вых (лизин, аргинин) кислот. Таким образом, в результате совместного действия всех указанных факторов образуется достаточно устойчивая простран-ственная структура олигомерной молекулы белка. Наиболее часто четвертичная структура белков представлена диме-рами, тримерами, тетрамерами и гексамерами, хотя и известны белки, содержащие в молекуле 8, 12, 24 и более субъединиц. Биологическая роль четвертичной структуры белков заключается в том, что путем соединения сравнительно небольших структурных элементов оказывается возможным формирование более сложных структур, обеспечивающих белку большую лабильность, способность выполнять конкретную биологическую функ-цию, возможность совмещения в одной пространственной структуре нес-колько функционально активных центров. КОНФОРМАЦИЯ БЕЛКОВЫХ МОЛЕКУЛ В клетках живого организма при определенной температуре, pH и концентрации физиологической среды белковые молекулы образуют тер-модинамически наиболее устойчивую в этих условиях пространственную структуру, обеспечивающую выполнение белком его биологической функ-ции. Такую пространственную структуру называют нативной конформа-цией белковой молекулы. При изменении физиологических условий молекулы белков могут обратимо изменять свою нативную конформацию, при этом изменяется и их биологическая активность. Обратимые изменения нативной конформации белков (перестройка их пространственной структуры) имеют важное значение для регуляции ферментативной активности, транспорта ионов и метаболитов через мембраны, регулирования проницаемости клеточных мембран. Как указывалось ранее, образование пространственной структуры белков определяется генетически детерминированной последователь-ностью соединения аминокислотных остатков в полипептидных цепях. Следовательно, нативная конформация белка зависит от его первичной структуры. Но вместе с тем для формирования нативной конформации белка требуется и весь набор факторов внутренней физиологической среды данной клетки (определенный pH, присутствие определенных ионов и других кофакторов). Построение пространственной структуры белковой молекулы проис-ходит в процессе ее синтеза по мере удлинения полипептидной цепи, что, вероятно, и предопределяет последовательность взаимодействия группиро-вок при формировании вторичной и третичной структуры синтезируемого полипептида. В специальных опытах показано, что в белковой молекуле имеются аминокислотные остатки, которые являются активными инициа-торами нековалентных взаимодействий, облегчающих формирование про-межуточных структур в процессе перехода белка к нативной конфор-мации. В правильном построении пространственной структуры белковых молекул участвуют специализированные белки - шапероны. Особенно много таких белков синтезируется в стрессовых условиях. Они образуют комплексы с полипептидными цепями, предотвращая их агрегацию в процессе формирования вторичной и третичной структуры. Один из участков белка-шаперона нековалентно связывается с развернутой полипептидной цепью, а другой присоединяет АТФ. При гидролизе АТФ шаперон переходит в другое конформационное состояние и его комплекс с формирующим пространственную структуру полипептидом распадается. Известны и другие белки - катализаторы формирования простран-ственной структуры полипептидов. Так, в клетках высших организмов обнаружен фермент протеиндисульфидизомераза, катализирующий пра-вильное образование дисульфидных связей при формировании третичной структуры полипептидов. Он прелставляет собой димерный белок, содер-жащий в активном центре остатки аминокислоты цистеина. В построении нативной конформации белка лимитирующей стадией может быть переход группировок пептидных связей из цис- в транс-конфигурацию. Особенно медленно проходит цис-транс-изомеризация группировок пептидных связей, образованных иминогруппой пролина. Для ускорения таких превращений в клетках организмов имеется специальный фермент пролил-цис-транс-изомераза. Характерные особенности пространственной конфигурации гомоло-гичных белковых молекул, выполняющих одну и ту же функцию у разных организмов, определяются наличием одинаковых аминокислотных остатков в ключевых положениях, сильно влияющих на конформацию молекулы, тогда как в других положениях могут находиться разные аминокислотные остатки. Но они слабее влияют на конформацию молекулы. Весьма характерное строение имеют мембранные белки, которые, как правило, содержат трансмембранные фрагменты в виде α-спиралей; от них отходят внемембранные полипептиды, обеспечивающие связь с окружающей физиологической средой. Трансмембранные полипептидные фрагменты могут быть образованы и в виде b-структур. Основные функции мембранных белков - транспорт молекул и ионов через мембрану, межклеточные взаимодействия, образование ионных каналов, передача внешних сигналов в клетку и др. Под влиянием сильно действующих факторов (высокая температура, экстремальные значения pH, присутствие катионов тяжелых металлов, применение органических растворителей и детергентов) может происхо-дить разупорядочивание системы водородных связей, электростатических и гидрофобных взаимодействий в молекулах белков, что вызывает су-щественное изменение их вторичной и третичной структуры, приводящее к утрате нативной конформации. При этом белок уже не может выполнять свойственную ему биологическую функцию. Необратимое изменение пространственной структуры белковых молекул, которое сопровождается потерей их нативных свойств, называют денатурацией белков. Наглядным примером денатурации является тепловая денатурация белков. При повышении температуры возрастает амплитуда колебаний атомов, что приводит к разрыву водородных связей и ослаблению элек-тростатических взаимодействий в молекулах белков, в результате чего происходит необратимое свертывание и осаждение белков из раствора. Большинство белков подвергаются денатурации при температуре 70–80˚C. Однако некоторые белки отличаются довольно высокой термостабиль-ностью. Так, например, ферменты термофильных бактерий сохраняют каталитическую активность при температуре 80˚C. Известны вещества, стабилизирующие нативную структуру белковых молекул, и их присутствие в растворе повышает температуру дена-турации белков. К таким веществам относятся водорастворимые соли, содержащие катионы кальция (Ca2+). Денатурация белков может происходить в сильно кислой или сильно щелочной среде. В сильно кислой среде практически полностью подавляется диссоциация карбоксильных групп аминокислотных радикалов дикарбо-новых кислот и заряд белковой молекулы определяется положительными зарядами радикалов диаминомонокарбоновых кислот, взаимное отталкива-ние которых вызывает разрыв водородных связей и ослабление электростатических взаимодействий, стабилизирующих третичную структу-ру молекулы. В результате белки утрачивают нативную конформацию и подвергаются коагуляции (осаждению). В сильно щелочной среде (pH>11) утрачивается положительный заряд радикалов диаминомонокарбоновых кислот и заряд белковой моле-кулы определяется отрицательными зарядами карбоксильных групп ди-карбоновых аминокислот, взаимное отталкивание которых вызывает раз-рыв водородных связей и ослабление электростатических взаимодействий в молекуле, вследствие чего происходит существенное изменение про-странственной структуры и денатурация белка. Сильным денатурирующим действием обладают катионы тяжелых металлов, трихлоруксусная, хлорная, вольфрамовая и некоторые другие кислоты, которые образуют с белками нерастворимые соли. Некоторые органические растворители (спирт, ацетон, формамид) способны взаимодействовать с гидрофобными радикалами аминокислотных остатков белков и с молекулами воды, вызывая ослабление гидрофобных взаимодействий и разрыв водородных связей, стабилизирующих третичную структуру полипептидов, в результате чего происходит денатурация белковых молекул. Установлено, что денатурация белков в растворе или во влажном состоянии происходит значительно легче и быстрее, чем в высушенном состоянии, и это используется при разработке технологий сушки биоло-гического материала и различных растительных продуктов (зерна, макарон, овощей и фруктов). Сведения о денатурации белков также учитываются при выпечке хлеба и кондитерских изделий, приготовлении консервов и других пищевых продуктов. |
