Лекции биохимия. Лекция Предмет и методы биохимии. Строение, свойства и биологические функции углеводов и липидов
 Скачать 2.08 Mb. Скачать 2.08 Mb.
|
|
РАЗМЕРЫ И ФОРМЫ БЕЛКОВЫХ МОЛЕКУЛ Определенные представления о пространственном строении и форме белковых молекул были получены в исследованиях с использованием электронного микроскопа. У многих белков форма молекул компактна и представляет шарообразные или вытянутые в виде эллипсоида частицы диаметром 10-30 нм. Другие белковые молекулы вытянуты в виде нитей диаметром 5-15 нм и длиной несколько сотен нм, третьи образуют палоч-ковидные структуры диаметром 10-20 нм и длиной 100-300 нм. Наиболее точные сведения о пространственном строении белков были получены методом рентгеноструктурного анализа, с помощью которого изучают структуру белковых молекул в кристаллическом состоянии. Как было выяснено, в белковых кристаллах полностью сохраняется нативная конформация молекулы, которая стабилизируется большим количеством криталлизационной воды. Длинные нитевидные формы белковых молекул принято называть фибриллярными белками. Они содержат длинные параллельные полипептидные цепи, скрепленные поперечными связями (рис.12). Эти белки отличаются высокой механической прочностью и обычно выполняют структурную функцию. К фибриллярным белкам относятся коллаген сухожилий, миозин мышц, фиброин шелка, кератин волос и перьев. Молекулы со сферической формой называют глобулярными белками. Их полипептидные цепи свернуты в глобулы, имеющие форму эллипсоида вращения разной степени вытянутости. К глобулярным белкам относятся ферменты, регуляторные и транспортные белки, запасные растительные белки. Между глобулярными и фибриллярными конформациями белковых молекул имеется много переходных форм, характерных для многих белков. В связи с большими различиями формы белковых молекул и высокой степенью их полимерности существенные трудности возникают при определении молекулярных масс белков, поэтому для этих целей разра-ботаны специальные методы исследований. Для хорошо растворимых и очищенных от примесей белков молекулярные массы могут быть опреде-лены с довольно высокой точностью по изменению осмотического давления белкового раствора. Между молекулярной массой белков и величиной осмотического давления их растворов наблюдается обратная заисимость. Для кристаллических форм хорошо очищенных белков молекулярные массы с высокой степенью точности определяют методом рент-геноструктурного анализа. При определении молекулярных масс белков очень часто исполь-зуется метод седиментационного анализа, основанный на измерении ско-рости седиментации (осаждения) молекул белков под действием большой центробежной силы, возникающей при высокоскоростном центри-фугировании белкового раствора. Первая установка для высокоскоростного центрифугирования (ультрацентрифуга) была сконструирована Т. Сведбергом и Д.Б.Никольсом в 1923 г. В современных ультрацентрифугах можно создавать центробежное ускорение более 500000 g. Под действием центробежной силы молекулы белка, равномерно распределенные в растворе, начинают перемещаться с определенной скоростью в направлении действия центробежной силы, образуя удаляющуюся от центра вращения границу раздела между осаждающимися белками и чистым растворителем. Положение границы раздела через определённые промежутки времени регистрируется с помощью оптической системы и на основе этих результатов определяется коэффициент седиментации , который и выражает скорость седиментации белков. По мере возрастания молекулярной массы белка коэффициент се-диментации увеличивается, однако строго прямой зависимости между этими показателями не наблюдается, так как скорость седиментации зави-сит также от формы молекул. Значение коэффициента седиментации принято выражать в специальных единицах - сведбергах, которые обозначают символом S. Один сведберг (1S) численно равен 1×10-13 секунды. Для большинства расти-тельных белков коэффициенты седиментации находятся в пределах 1-20S. На основе коэффициентов седиментации и диффузии белковых мо-лекул рассчитаны молекулярные массы многих белков, выделенных из различных объектов: рибонуклеаза 12640 α-амилаза 97600 гемоглобин 64500 каталаза 247500 глиадин пшеницы 27500 эдестин конопли 300000 альбумин яйца 44000 уреаза сои 483000 зеин кукурузы 50000 пепсин 35500 Для определения молекулярных масс полипептидов, входящих в состав олигомерных белков, находит широкое применение метод электро-фореза заряженных частиц в полиакриламидном геле, который позволяет проводить очень точное разделение полипептидов под воздействием электрического поля. Под влиянием электрического поля заряженные молекулы полипеп-тидов движутся к аноду или катоду через пористый носитель, которым является полиакриламидный гель, образующийся при совместной полиме-ризации акриламида и бисакриламида в определенной буферной среде. Этот гель сильно гидратирован и имеет поры определенных размеров в зависимости от соотношения акриламида и бисакриламида. Скорость дви-жения заряженных частиц в пористом носителе зависит от величины заряда, молекулярной массы и пространственной конфигурации молекул, поэтому в результате электрофореза разделяемые частицы, различающиеся по электрическому заряду и пространственным параметрам, распреде-ляются в полиакриламидном геле в виде узких зон, которые окрашиваются специальным красителем. Размеры окрашенных зон точно указывают концентрацию выделенных при электрофорезе полипептидов, а их общее число - наличие в изучаемой смеси разных полипептидов (рис. 13). СВОЙСТВА И МЕТОДЫ ИЗУЧЕНИЯ БЕЛКОВ В зависимости от состава аминокислотных группировок белковые молекулы, находясь в растворенном состоянии, могут вступать в различ-ные химические реакции, с помощью которых можно проводить качес-твенные тесты на наличие тех или иных группировок в молекуле белка, а также проводить качественные реакции для обнаружения белков. Так, например, при взаимодействии белков с крепкой азотной кислотой обра-зуется жёлтое окрашивание, которое свидетельствует о наличии радика-лов ароматических аминокислот. Такая качественная реакция на белки получила название ксантопротеиновой реакции. При добавлении к щелочному раствору белка небольшого коли-чества медного купороса происходит образование комплексного соединения катионов меди (Cu2+) с пептидными группировками белка, окрашивающего раствор в сине-фиолетовый цвет. Эту реакцию называют биуретовой, так как такое же окрашивание с катионами меди дает биурет, имеющий группировку -CО-NН- . В молекулах белков в составе аминокислотных радикалов имеются аминные и карбоксильные группы, которые, как и в аминокислотах, в зависимости от реакции среды могут образовывать анионы или катионы, способные в электрическом поле двигаться соответственно к аноду или катоду. При определенном значении pH, индивидуальном для каждого типа белков, устанавливается равенство положительных и отрицательных зарядов и суммарный заряд молекулы становится равным нулю. Такое состояние белковой молекулы называют изоэлектрической точкой. При pH физиологической среды ниже pH изоэлектрической точки белка белковая молекула заряжена положительно за счет заряда аминных групп, присоединяющих катионы водорода. Если же pH среды выше pH изоэлектрической точки белка, белковая молекула заряжена отрицательно вследствие диссоциации карбоксильных групп. И в том, и в другом случае все молекулы данного белка имеют одинаковый по величине заряд, кото-рый обусловливает взаимное отталкивание молекул, вслебствие чего они легче удерживаются в растворе. В изоэлектрической точке между молекулами белка нет электрос-татического отталкивания и они легко переходят в осадок. Вследствие того, что белки в изоэлектрической точке имеют минимальную растворимость, для их выделения применяется специальный прием, называемый изоэлектрическим осаждением. Значение pH изоэлектрической точки белков зависит от их ами-нокислотного состава, определяющего число свободных аминных и карбоксильных групп в молекуле. При увеличении в белке содержания остатков дикарбоновых кислот pH изоэлектрической точки смещается в кислую сторону, а при возрастании количества остатков диамино-монокарбоновых кислот - в щелочную сторону. Растворимость белков зависит от степени гидратации белковой молекулы, которая определяется наличием на её поверхности гидро-фильных группировок, способных образовывать с молекулами воды водо-родные связи или вступать в электростатические взаимодействия. В результате таких взаимодействий вокруг белковой молекулы формируется гидратная оболочка, включающая несколько слоев молекул воды и удер-живающая белковую молекулу в растворенном состоянии. Если под воз-действием каких-либо факторов убрать гидратную оболочку вокруг бел-ковых молекул, то они вступают в межмолекулярные взаимодействия между собой, образуя более крупные агрегаты, способные осаждаться из раствора. При насыщении белкового раствора некоторыми органическими растворителями (спирт, ацетон) или солями, которые сильнее связывают молекулы воды, чем белки, происходит обезвоживание белковых молекул, вследствие чего они в результате агрегации образуют более крупные частицы и выпадают в осадок. Для предотвращения денатурации осаждение белков органическими растворителями проводится при пониженной температуре (-5˚C). Выделенные таким способом белки после удаления органического растворителя снова можно растворить в воде или слабом рстворе соли, при этом белки сохраняют свои нативные свойства. Процесс осаждения белков в насыщенных растворах нейтральных солей называют высаливанием. Высаливание белков очень часто приме-няется для выделения и очистки ферментов и других белковых препа-ратов. Сухие препараты белков или сухая растительная масса, содержащая белки, способны впитывать воду, при этом происходит увеличение объема и может создаваться очень сильное давление. Такие свойства белков назы-вают набуханием. Процессы набухания белков играют важную роль при прорастании семян и учитываются при разработке технологий хранения и переработки растительной продукции (набухание белков при созревании теста, приготовлении кондитерских изделий; набухание зерна при его замачивании и др.). Белковые молекулы вследствие крупных размеров не способны диффундировать через биологические мембраны, которые свободно про-ницаемы для молекул воды и низкомолекулярных незаряженных веществ. Благодаря этому свойству белков возможна локализация ферментов и катализируемых ими реакций в замкнутых межмембранных отсеках растительной клетки - компартментах. КЛАССИФИКАЦИЯ БЕЛКОВ Огромное разнообразие белков по составу и строению молекул, физико-химическим свойствам и выполняемым функциям не позволяет создать единой классификации белковых веществ. По составу молекул белки подразделяют на два больших класса - протеины и протеиды. Протеины - это типичные полипептиды, образованные только из аминокислот. Протеиды имеют в своем составе полипептидные группировки, с которыми прочно связаны другие соединения неаминокислотной (небелковой) природы. ПРОТЕИНЫ. Молекулы протеинов заметно различаются по физико- химическим свойствам и это положено в основу их классификации по группам растворимости или выполняемым функциям. Растворимые в воде протеины называют альбуминами. Типичными представителями альбуминов являются белок куриного яйца - овальбумин, водорастворимые белки зерна пшеницы, ржи, ячменя - лейкозины, легуме-лин из зерна гороха и других зернобобовых культур. Альбумины содержатся во всех тканях растений и обладают высокой биологической активностью, так как к ним относятся многие белки-фер-менты, белковые ингибиторы ферментов, белки-антивитамины, многие регуляторные белки. Белки, растворимые в растворах нейтральных солей, называют гло-булинами. Чаще всего для извлечения глобулинов используют 5-10% рас-творы NaCl или KCl. Глобулины содержатся во всех клетках и тканях живых организмов и выполняют жизненно важные функции. К глобулинам относятся многие ферментные и регуляторные белки, а также запасные белки семян и других органов растений. Многие растительные глобулины выделены в кристаллическом виде и хорошо изучены. Так, из семян сои выделен гли-цинин, из фасоли - фазеолин, из гороха - легумин, из конопли - эдестин, из люпина - конглютин, из картофеля - туберин. В семенах злаковых растений накапливается очень много запасных белков, растворяющихся в 70% водном растворе этанола, их называют проламинами. Синтез в семенах проламинов - генетическая особенность злаковых растений, тогда как в других растениях эти белки не образуются. Они также не синтезируются в вегетативных органах растений (в том числе и злаковых). Название проламины этой группе белков было дано вследствие того, что при их гидролизе образуется много аминокислоты пролина и аммиачного азота. Проламины - основные белки клейковины пшеницы и других злако-вых растений. Проламин пшеницы называют глиадином, проламин кукуру-зы - зеином, проламин овса - авенином, проламин ячменя - гордеином, про-ламин ржи - секалином. Белки, не растворимые в воде, водных растворах солей и спирта, но хорошо растворяющиеся в щелочных растворах (0,1-0,2% раствор NaOH), называют глютелинами. Они содержатся в любых растительных клетках, но особенно их много в семенах злаковых растений. Глютелины входят в состав клейковины. В семенах эти белки выполняют роль запасных веществ, а в листьях глютелины по-видимому являются структурными белками. Наиболее хорошо изучены глютелины пшеницы - глютенины и глютелины риса - оризенины. Альбумины, глобулины, проламины и глютелины растений состоят из большого набора индивидуальных белков. Методом электрофореза каждая из этих групп белков может быть разделена на 20-30 компонентов, различающихся по электрофоретической подвижности, а методом изо-электрофокусирования - на несколько десятков белковых компонентов. В хромосомах клеточных ядер содержатся водорастворимые белки - гистоны, играющие важную роль в образовании структуры хроматина, так как связаны с ДНК. Они имеют высокую концентрацию основных ами-нокислот - лизина и аргинина (25-30%), поэтому относятся к щелочным белкам, у которых очень сильно выражены свойства оснований. Основная функция гистонов - упаковка молекул ДНК в ядрах клеток высших организмов. Гистоны H2a, H2б, H3 и H4, взаимодействуя с ДНК, образуют упорядоченные ядерные структуры - нуклеосомы, связь между которыми обеспечивают гистоны H1. Гистоны, богатые аргинином (H3 и H4), у разных организмов очень мало отличаются по их аминокислотным последовательностям, а богатый лизином гистон H1 по составу аминокислот проявляет довольно высокую видовую специфичность. К протеинам также относятся склеропротеины, представляющие бел-ки, которые нерастворимы в воде и большинстве других растворителей. Они выполняют структурную функцию, образуя длинные параллельные полипептидные цепи, соединенные поперечными связями в прочные структуры. К этой группе белков относятся коллаген сухожилий, миозин мышц, кератин волос, эластин кровеносных сосудов, фиброин шелка. ПРОТЕИДЫ. В зависимости от химической природы небелковой части протеиды разделяют на несколько групп: гликопротеиды, хромопротеиды, липопротеиды, флавопротеиды, металлопротеиды, нуклеопротеиды и др. Гликопротеиды. В составе молекул гликопротеидов к белку через аминокислотные остатки присоединены моносахариды или их производные - манноза, галактоза, глюкозамин, глюкуроновая кислота и др. К гли-копротеидам относятся многие ферменты, мембранные белки, защитные белки иммуноглобины и лектины, некоторые запасные белки (вицилин семян фасоли), белок внеклеточного матрикса - ламинин, некоторые ядовитые белки (рицин клещевины). Липопротеиды. Они образуются при соединении белков с липидами и являются основными компонентами цитоплазматических, хлоропластных и митохондриальных мембран. При образовании мембранных липопротеидов к C или N-концам полипептидных цепей белка присоединяется гликолипидная или липидная группировка, которая делает эту часть мо-лекулы белка гидрофобной и поэтому способной к взаимодействию с липидными компонентами мембраны. Липидная часть липопротеида обычно представлена фосфатидилинозитом и диацилглицерином. Нуклеопротеиды. Соединения белков с нуклеиновыми кислотами, играют важную роль в процессах жизнедеятельности организмов, связанных с передачей наследственной информации. Они являются главным веществом хромосом, рибосом и пластидных факторов наслед-ственности. Фосфопротеиды. Это белки, в которых к остаткам серина, треонина, тирозина, имеющим HO-группы, сложноэфирной связью присоединяются остатки ортофосфорной кислоты. Фосфорилирование белков играет важную роль в регулировании активности ряда ферментов: гликогенфосфорилаз (катализирующих фосфоролиз гликогена), гликогенсинтетаз (катализирую-щих синтез гликогена), синтетаз жирных кислот, пируватдегидрогеназы, многих ферментов, образующих систему клеточного деления. Фосфорили-рованию могут подвергаться также и другие белки – регуляторные, защитные, транспортные, запасные. Металлопротеиды. Имеют в своем составе группировки, содержа-щие атомы металлов. К ним относятся белки, обладающие каталитичес-кими свойствами: цитохромы, пероксидаза, каталаза, глобины (осу-ществляющие связывание и перенос кислоода), в состав которых входит железо; аскорбинатоксидаза, фенолоксидазы, тирозиноксидаза, пластоцианин, содержащие медь; нитратредуктаза, содержащая молибден; нитрогеназа, содержащая молибден и железо; многие другие ферменты. Известны белки-ферменты, имеющие в своем составе производные витаминов и нуклеотидные группировки, в связи с чем такие белки можно назвать витаминопротеидами и нуклеотидопротеидами. Более подробно они будут рассмотрены в главе "Ферменты". АМИНОКИСЛОТНЫЙ СОСТАВ БЕЛКОВ Систематические исследования аминокислотного состава белков были начаты во второй половине девятнадцатого века, когда были разработаны химические методы определения аминокислот в белковых гидролизатах. Однако значительные успехи в аминокислотном анализе полипептидов были достигнуты после разработки хроматографических методов изучения органических веществ. В современных исследованиях для определения аминокислотного состава белков применяется метод ионообменной хроматографии с использованием аминокислотных анализаторов, которые в автоматическом режиме разделяют смесь аминокислот, полученных в результате гидролиза белков, на ионообменнике, производят их окрашивание и измерение оптической плотности окрашенного раствора, после чего данные спектрофото-метрических измерений выводятся на регистрирующее устройство. Гидролиз белков проводится в кислой или щелочной среде, а также с помощью протеолитических ферментов. В ходе гидролиза пептидные связи, соединяющие аминокислотные остатки в белке, расщепляются и образуется смесь свободных аминокислот. Как показали исследования, белки разных видов растений, а также разных органов одного и того же растения могут заметно различаться по содержанию аминокислот (табл. 3 и 4). В альбуминах по сравнению с проламинами существенно выше концентрация аргинина, глицина, лизина, метионина и триптофана, но значительно меньше содержание лейцина, пролина, тирозина, фенил-аланина. В специфическом белке эндосперма пшеницы - пуротионине пол-ностью отсутствуют гистидин, метионин и триптофан, но повышено со-держание лизина (15%) и аргинина (18%). Белки зерна зернобобовых и семян масличных культур по амино-кислотному составу близки к глобулинам, так как на 60-70% состоят из 3. Средний аминокислотный состав белков некоторых растительных продуктов (%)* .
Аланин 3,8 8,0 5,9 6,5 3,5 Аргинин 4,4 4,3 4,3 6,5 4,0 Аспарагиновая кислота 5,3 6,0 8,4 10,0 7,2 Валин 4,5 4,4 4,5 5,3 6,2 Гистидин 2,4 2,3 3,0 2,5 3,2 Глицин 4,1 3,2 3,4 5,4 1,9 Глутаминовая кислота 30,4 23,8 21,3 11,5 15,0 Изолейцин 2,9 2,6 2,8 5,3 6,6 Лейцин 7,2 11,9 11,7 8,9 9,9 Лизин 2,8 2,4 3,3 6,2 6,6 Метионин 1,4 2,1 2,7 1,7 2,4 Пролин 10,7 9,5 6,2 5,1 8,6 Серин 4,2 4,3 4,0 4,6 5,9 Тирозин 2,6 3,1 3,4 4,0 5,1 Треонин 2,8 3,2 3,6 5,4 4,6 Триптофан 1,4 0.6 1,0 1,6 1,4 Фенилаланин 4,3 4,1 5,8 6,8 4,9 Цистин (цистеин) 2,2 2,3 2,5 0,9 0,8 ________________________________________________________________ *Вследствие потерь при гидролизе выход аминокислот не равен 100%. этих белков. Аминокислотный состав белков клубней картофеля, корне-плодов, овощей, плодов и ягод, вегетативной массы растений довольно близок к альбуминам и глобулинам, поскольку эти белки составляют 65-75% общей массы белков указанных растительных продуктов. Растительные белки - источники незаменимых аминокислот для человека и сельскохозяйственных животных, так как являются основными компонентами пищи или корма. Под действием пищеварительных фер-ментов белки корма гидролизуются до аминокислот, которые затем по-ступают в кровь и используются для синтеза белков организма животных. Потребность животного организма в незаменимых аминокислотах определяется средним аминокислотным составом синтезируемых белков и, кроме того, учитывается коэффициент использования каждой амино-кислоты, зависящий от химического состава корма, а также особенностей пищеварительной системы и обмена веществ организма данного вида животных. Этот показатель обычно выражают в г в расчете на 100 г белка корма и он выражает необходимую пропорцию аминокислот в кормовом белке. Если содержание незаменимых аминокислот в кормовом белке точно соответствует установленной пропорции (то есть потребности), то все они 4. Аминокислотный состав очищенных растительных протеинов (%).
Аланин 6,9 4,8 3,4 8,8 5,4 Аргинин 9,1 10,6 7,0 1,3 7,5 Аспарагиновая кислота 4,6 10,9 12,2 4,9 7,6 Валин 5,1 6,3 4,3 3,6 6,4 4,2 Гистидин 2,6 2,5 2,3 1,0 2,2 Глицин 6,3 5,5 3,6 1,1 4,1 Глутаминовая кислота 21,2 14,0 20,8 23,4 17,7 Изолейцин 3,1 3,3 5,1 3,3 5,8 4,2 Лейцин 6,0 6,5 6,3 18,6 9,3 4,8 Лизин 6,5 4,7 4,2 0,2 4,0 4,2 Метионин 1,7 1,1 1,3 0,9 1,9 2,2 Пролин 4,9 4,2 4,9 9,2 5,4 Серин 4,5 6,2 6,5 4,9 4,8 Тирозин 3,1 3,1 3,9 5,0 3,8 Треонин 4,6 5,1 4,5 2,8 4,1 2,8 Триптофан 1,5 1,1 1,4 0,1 1,2 1,4 Фенилаланин 3,3 4,5 4,9 6,9 5,6 2,8 Цистин (цистеин) 2,4 2,3 1,4 1,0 0,5 ________________________________________________________________ полностью используются для синтеза белков животного организма и такой кормовой белок называют полноценным. Если же в кормовом белке хотя бы одной аминокислоты содержится недостаточно, то она будет лимитировать синтез белков в животном организме и для образования определённой массы животного белка потребуется восполнять недостаток этой аминокислоты добавлением дополнительного количества корма, что вызы-вает перерасход корма и увеличение затрат на создание одной единицы животноводческой продукции. Кроме того, другие аминокислоты в таких условиях оказываются в избытке и должны превращаться в организме в другие органические вещества. Кормовые белки с низким содержанием незаменимых аминокислот принято называть неполноценными белками. По средним нормам питания человеку необходимо потреблять 8-10 г полноценного белка в расчете на 1 МДж обменной энергии, содержащейся в пище, коровам - 8-12 г, свиньям - 10-14 г, птице - 12-15 г. (Обменная энергия - часть общей энергии, доступная для использования в процессе обмена веществ организма). Для каждого вида организмов с учетом их возраста и физиологи-ческого состояния определены оптимальные нормы содержания незаме-нимых аминокислот в кормовых белках. Наиболее часто в качестве эталона полноценных пищевых и кормовых белков используются нормативы, разработанные экспертами Продовольственной и сельскохозяйственной организации ООН (ФАО) и Всемирной организации здравоохранения (ВОЗ). В таблице 4 приведен эталон аминокислотной шкалы, рекомендуемый ФАО/ВОЗ для кормовых белков при кормлении крупного рогатого скота. Пищевая биологическая ценность такого белка принимается за 100%, а другие белки в опытах или с помощью расчетов сравнивают с эталоном. Более высокую биологическую ценность имеют белки животного происхождения: белок яйца и казеин молока - 100%, белки мяса и рыбы - 95%. Из растительных белков наиболее полноценными являются альбу-мины, их биологическая ценность составляет 85-95%. В альбуминах имеется некоторый дефицит по содержанию метионина и изолейцина. Биологическая ценность глобулинов составляет 80-90%, в них имеется значительный дефицит по метионину и меньший - по изолейцину и триптофану. Последнее не относится к глобулинам сои, в которых отмечается лишь некоторый недостаток метионина. Биологическая ценность глютелинов - 70-80%, в них понижена кон-центрация триптофана, метионина и лизина. Меньший дефицит по указанным аминокислотам имеют оризенины, у которых биологическая ценность составляет около 90%. К неполноценным белкам относятся проламины, имеющие биологическую ценность 40-50%. В этих белках очень мало содержится триптофана, лизина и метионина и понижена концентрация валина и изолейцина. Проламины - специфические белки зерна злаковых растений, поэтому у них суммарный белок зерновок так же, как и проламины, имеет довольно низкую биологическую ценность: белок зерна кукурузы - 52-58%, пшеницы, ячменя и проса - 60-70%, ржи и овса - 70-75%. Суммарные белки зерна зернобобовых и семян масличных культур, клубней картофеля, корнеплодов, овощей, плодов и ягод, а также вегетативной массы кормовых трав и других растений вследствие повышенной концентрации глобулинов и альбуминов характеризуются довольно высокой биологической ценностью - 80-90%. Для оценки биологической ценности белков очень часто используют показатель - индекс незаменимых аминокислот, который рассчитывают по формуле: 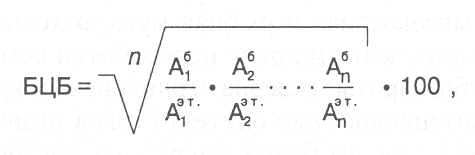 где числитель - содержание незаменимых аминокислот в оцениваемом белке, знаменатель - содержание тех же аминокислот в эталонном белке (по ФАО/ВОЗ), n - число аминокислот, 100 - пересчет в проценты. Указанный способ определения биологической ценности белков удобен тем, что позволяет использовать данные аминокислотного анализа. Более точные результаты по оценке биологической ценности белков дают методы, основанные на использовании живых организмов. Одним из таких методов является расчет показателя "эффективность белка", который выражается отношением привеса животных к массе потреблённого кормового белка. В этом случае оценка биологической ценности белка производится по интенсивности роста опытных животных. Для взрослых животных биологическую ценность белка корма оп-ределяют по методу Томаса и Митчелла, который основан на учете отно-шения азота корма, отложенного в теле животного, к общему количеству переваренного азота. Если содержание белков в растительной массе, используемой для кормления животных, ниже, чем требуется по нормам кормления, то во избежание перерасхода корма и повышения себестоимости животновод-ческой продукции количество белка в корме балансируют путем введения белковых добавок с повышеным содержанием незаменимых аминокислот. По такому же принципу контролируется содержание в кормовом белке незаменимых аминокислот, недостающее до нормы количество какой-либо аминокислоты балансируют добавлением в корм чистых препаратов дефицитных аминокислот или белковой массы с более высоким содер-жанием данной аминокислоты по сравнению с принятым эталоном. В нашей стране и за рубежом разрабатываются и реализуются научные программы, связанные с созданием новых генотипов растений, отлича-ющихся повышенным содержанием белков с улучшенным аминокислотным составом. Примером тому может служить создание высоколизиновых гибридов кукурузы, у которых уровень урожайности примерно такой же, как и у обычных гибридов, однако в их зерновках накапливается больше белков с повы-шенным содержанием лизина (на 50-80%) и триптофана (на 30-50%). Высоколизиновые гибриды кукурузы получены от скрещивания обычной кукурузы с генотипами, имеющими гены Опейк-2 и Флаури-2, которые вызывают изменение состава белков зерна: массовая доля спир-торастворимых белков-зеинов, имеющих низкую биологическую ценность, снижается в 2,5-3 раза, а доля других белков (альбуминов, глобулинов и глютелинов) возрастает. В результате таких изменений белкового комплекса зерна биологическая ценность суммарного белка зерна значительно повышается. Использование зерна высоколизиновой кукурузы для кормления животных позволяет существенно повысить их продуктивность и сократить затраты кормового белка на создание одной единицы животноводческой продукции на 20-25%. Во многих лабораториях проводится селекционно-генетическая работа по улучшению аминокислотного состава белков зерна ячменя на основе скрещиваний с высоколизиновыми формами Хайпроли и Ризо 1508, а также поиск генетических источников высокого содержания белков с улучшенным аминокислотным составом для пшеницы, проса, тритикале и других злаковых культур. Определенные надежды возлагают на новые методы создания ценных генотипов растений, основанные на использовании достижений гене-тической и клеточной инженерии. Так, например, путем направленного мутагенеза в ген спирторастворимого белка зерна кукурузы α-зеина введены дополнительные кодоны лизина и в результате включения такого модифицированного гена в генотип кукурузы были получены линии с повышенным содержанием лизина в белках зерна. В 1986 г. Дж.М.Джейнс с помощью ферментов синтезировал ген, кодирующий структуру белка с высокой концентрацией незаменимых аминокислот (80%). В настоящее время разрабатываются способы вве-дения этого гена в генотипы злаковых растений. Вопросы для повторения: 1. Каковы основные характеристики моноаминомонокарбоновых, моноаминодикарбоновых и диаминомонокарбоновых кислот? 2. Какие стереоизомеры аминокислот синтезируются в живых организмах? 3. В чём состоят структурные и биологические особенности протеиногенных аминокислот? 4. Что выражает понятие "незаменимые аминокислоты"? 5. В виде каких форм находятся аминокислоты в растворе и как они взаимо-действуют с кислотами, основаниями, азотистой кислотой, формальдегидом? 6. Какие образуются продукгы при взаимодействии аминокислот с редуцирующими сахарами и кислородом воздуха и как они влияют на товарные свойства растительной продукции? 7. В зависимости от каких факторов изменяется концентрация аминокислот в растительных тканях? 8. Из каких структурных компонентов состоят ри-бонуклеотиды и дезоксирибонуклеотиды? 9. Какие конформации молекул имеют разные нуклеотиды? 10. Как образуются нуклеозиды и их фосфорнокислые эфиры? 11. Каковы химические свойства нуклеотидов и какие они выполняют биологические функции? 12. Как называют нуклеотиды и их ди- и трифосфаты? 13. Каковы структурные особенности пуриновых и пиримидиновых оснований, входящих в состав нуклеотидов? 14. Каковы функции белков в живых организмах и сколько их содержится в различных растительных продуктах? 15. В чём состоят основные положения полипептидной теории стоения белков? 16. Чем отличаются белки от пептидов? 4. Какие имеются сведения о первичной структуре белков? 17. Как формируется вторичная, третичная и четвертичная структура белков? 18. В чём состоят особенности структуры олигомерных белков? 19. Чем отличаются нативная и денатурированная конформации белковых молекул? 20. Какие известны катализаторы формирования пространственной структуры полипеп-тидов? 21. Как происходит денатурация белков? 22. Как определяются размеры и форма белковых молекул и какие имеются сведения об этих показателях? 23.Какие применяются методы изучения физико-химических свойств белков? 24. Какие принципы положены в основу классификации белков и какие известны разновидности белковых групп в соответствии с современной классификацией? 25. Как определяют аминокислотный состав белков? 26. Как различаются растительные белки по содержанию аминокислот? 27. Как определяют биологическую полноценность белков? 28. Какие имеются сведения о биологической ценности растительных белков? 29. Какие разрабатываются методы создания генотипов растений с повышенным содержанием незаменимых аминокислот в белках? |
