МЯДЕЛЕЦ ОБЩ.ГИСТ.. Литература для медицинских вузов все факультеты о. Д. Мяделец основы цитологии, эмбриологии и общей гистологии
 Скачать 4.75 Mb. Скачать 4.75 Mb.
|
|
II стадия миогистогенеза — миосимпластическая. В эту стадию миоблас ты располагаются в виде цепочек и сливаются друг с другом. Образуются миосимпласты. В их цитоплазме в результате сборки из синтезированных сократимых белков появляются миофибриллы, которые лежат на периферии. Центральное положение занимают ядра. После слияния миобластов в миосимпласты деление ядер не происходит, увеличение длины миосимн ластов идет за счет присоединения новых миобластов, а толщины — за счет синтеза сократительного аппарата. III стадия — стадия миотубул, или мышечных трубочек. В эту стадию в симпластах увеличивается число миофибрилл, которые еще лежат на периферии волокна, а ядра располагаются в центре. Число миотубул может увеличиваться за счет их продольного расщепления. С миотубулами сливаются все новые миосателлитоциты, и длина их увеличивается. IV стадия — стадия зрелого мышечного волокна. В эту стадию объем миофибрилл увеличивается до такой степени, что они занимают основную массу волокна, смещаясь в центр и сдвигая ядра на периферию Сильно развивается гладкий эпдоплазматический ретикулум (СПР), увеличиваются в размерах митохондрии, а пластинчатый комплекс, хорошо развитый в миобластах и миосимпластах, значительно редуцируется. СТРОЕНИЕ МЫШЕЧНОГО ВОЛОКНА. Мышечные волокна (рис. 12.6) являются структурно-функциональным элементом скелетной мышечной ткани. Имеют длину до 20—30 см, толщину 100 мкм. Состоят из двух частей: 1) симпластической; 2) миосателлитоцитов. Симпластическая часть (симпласт) снаружи покрыта сарколеммой и содержит множество (до нескольких тысяч) ядер. Сарколемма состоит из толстой базальной мембраны и плазмолеммы мышечного волокна. Между базальной мембраной и плазмолеммой в отдельных участках имеются углубления (полости), в которых лежат миосателлитоциты. При световой микроскопии эти клетки неотличимы от клеток соединительной ткани. При электронной микроскопии видно, что они окружены своей плазмолеммой, имеют слабо развитые органеллы. Миосателлитоциты — камбий скелетной мышечной ткани. За счет их идет репарация мышечного волокна. Протоплазму волокна называют саркоплазмой. В ней находится большое количество органелл общего значения (за исключением центриолей): митохондрий (саркосомы), лизосом. Комплекс Гольджи развит относительно слабо. Развита гладкая ЭПС, которая называется саркоплазмати-ческим ретикулумом (СПР), а гранулярная ЭПС, напротив, слабо развита. Имеются включения гликогена и липидов, используемые для получения энергии, а также пигментные включения миоглобина. Миоглобин является железосодержащим пигментом, аналогичным гемоглобину. Он способен связывать кислород, что способствует процессам окислительного фосфорилирования и образования АТФ. Особенно в больших концентрациях миоглобин содержится в красных мышечных волокнах, обеспечивая их цвет (см. ниже). В отдельных участках плазмолемма мышечного волокна отдает внутрь саркоплазмы впячивания в виде трубочек, которые проходят перпендикулярно волокну через всю его толщину. Они называются Т-трубоч-ками (от лат. transversus — поперечный). Т-трубочки окружают каждую миофибриллу, чему способствует их интенсивное ветвление и соединение с соседними трубочками. К Т-трубочкам с обеих сторон подходят продольные цистерны СПР (L- цистерны, от лат. longitudinale — продольный). Подойдя к Т-трубочкам, L-цистерны сливаются и образуют поперечные терминальные цистерны (Т-цистерны). Вместе с Т-трубочками терминальные цистерны образуют триады — особую мембранную систему, играющую важную роль в инициации мышечного сокращения (рис. 12.6 б). Между мембранами Т-трубочек и терминальных цистерн имеются специализированные контакты, через которые возможен транспорт кальция. Саркоплаз-матический ретикулум при помощи ферментов (кальций-транспортирую-щие АТФазы) за счет активного транспорта накапливает ионы Са2.  Основную часть волокна занимают органеллы специального значения — миофибриллы. В одном волокне их может насчитываться до 2000. Диаметр миофибрилл может доходить до 2 мкм, длина равна длине мышечного волокна. В каждой миофибрилле при стандартной световой микроскопии обнаруживается исчерченеюсть — светлые и темные диски (рис. 12.7 а). В поляризованном микроскопе темные диски имеют двойное лучепреломление и поэтому называются анизотропными, или А-дисками. Светлые диски не имеют двойного лучепреломления и называются изотропными, или I-дисками. Посередине 1-диска проходит полоска, которая называется Z-линией (телофрагма). Z-линия имеет зигзагообразный ход на продольном сечении миофибриллы, а на поперечном разрезе представляет собой четырехугольную решетку, в узлах которой закрепляются актиновые фи-ламенты. В центре А-диска находится светлая полоска Н, а посередине ее проходит темная линия М, или мезофрагма. Участок миофибриллы, лежащий между двумя соседними Z-линиями, называется саркомером. Саркомер - структурно-функциональная единица миофибриллы. В его состав последовательно входят: Z-линия, 1/2 диска I, диск А, 1/2 диска I, вторая Z-линия. Каждый саркомер состоит из тонких актиновых и толстых миозиновых филаментов. Миофиламенты образованы сократительными белками (рис. 12.7, 12.8). В состав актиновых филаментов входит белок актин, а также белки тропонин и тропомиозин (рис. 12.8 I). Молекулы актина имеют гранулярное строение (G-актин) и, соединяясь вместе, образуют длинные цепи (фибриллярный, F-актин). В актиновых филамеитах таких цепей две, они образуют двойную спираль. В бо- роздках между спиральными цепями актина лежат молекулы тропомиозина, также образуя две спирали. К молекулам тропомиозина на равных расстояниях друг от друга прикрепляются молекулы тропонина. Тропонино-вый комплекс состоит из трех глобулярных субъединиц: Т, I, С (сокращенно они обозначаются TnT, Tnl, TnC). ТпТ осуществляет прикрепление тро-понинового комплекса к троиомиозину. ТпС отвечает за связывание с ионами Са2+. Tnl препятствует взаимодействию миозиновых головок с актином. Тропониновый комплекс прикреплен к молекулам тропомиозина с интервалами 40 нм. Диаметр тонких филаментов 5 им (рис. 12.8 II). 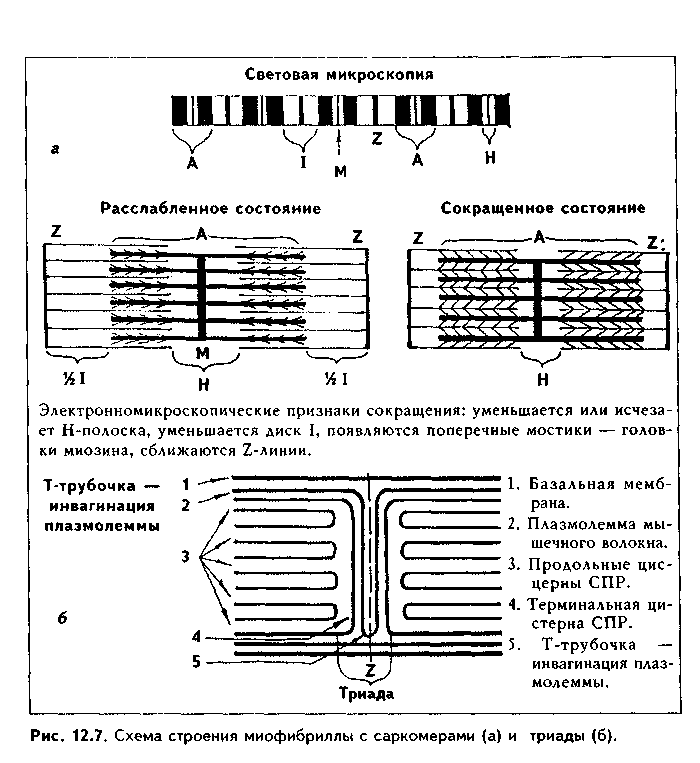 Толстые филаменты имеют диаметр 12 нм и содержат белок миозин. Каждая молекула миозина состоит из двух частей: головки и хвоста и может сгибаться в двух местах (шарнирные участки). Головка миозина имеет .АТФ-азную активность и способна расщеплять АТФ с образованием энергии, идущей как на сокращение, так и на осуществление расслабления. Молекулы миозина соединяются в пучки и формируют толстую филамен-ту, напоминающую ламповую щетку: головки миозина в ней выступают за пределы основного стержня. Головки миозина "торчат" из стержня только в периферических отделах миозиновых филаментов. В центральной их части они отсутствуют (так называемый гладкий, "оголенный" участок). В этом миозиновые филаменты скелетных мыщц отличаютсят от таковых в гладких миоци-тах. Последние содержат головки миозина на всем протяжении. 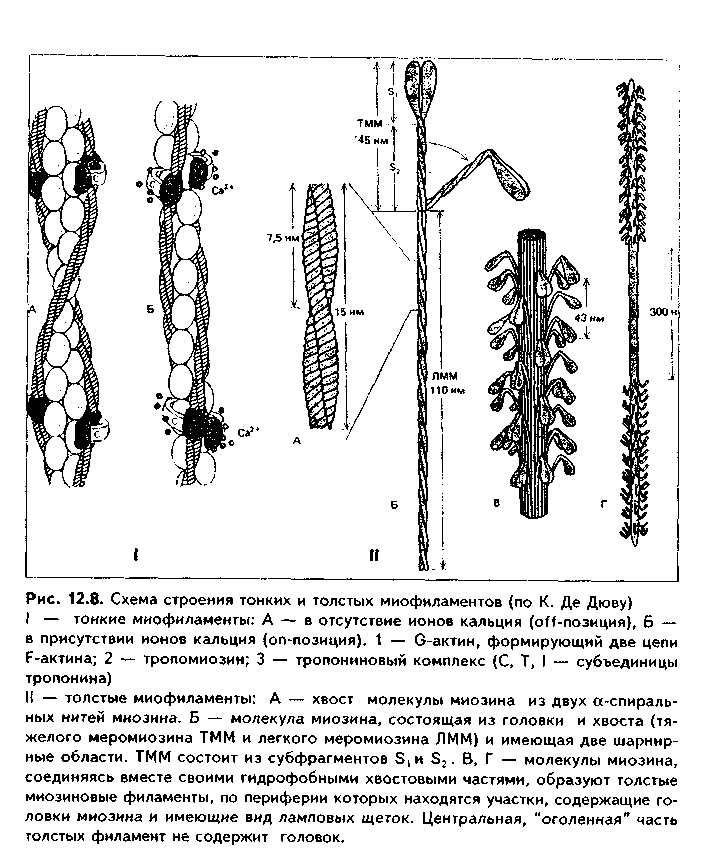 Кроме миозина, составляющего основную массу толстых филаментов, в их состав входят белки титин, небулин, миомезин и С-белок. Молекула титина имеет огромные размеры и в виде пружины прикрепляет концы толстых нитей к Z-линиям. Эти молекулы образуют внутри сарко-мера своеобразную решетчатую структуру, которая поддерживает закономерное расположение толстых и тонких филаментов и препятствует перерастяжению миофибрил-лы. Небулин связывает тонкие и толстые филаменты. Миомезин и белок С связывают толстые филаменты в области М-линии. На электронных фотографиях (рис. 12.7 я, 12.9) головки миозина видны в состоянии сокращения в виде поперечных мостиков. В составе саркомера толстые филаменты лежат только в диске А. Тонкие филаменты лежат в диске 1, но концами частично заходят в диск А между миозиновыми филамента-ми. Та часть диска А, которая содержит и актиновые, и миозиновые филаменты, выглядит более темной, а та его часть, которая содержит только миозиновые филаменты, светлее. Это Н-полоска. Линия М в центре Н-по-лоски — место соединения всех миозиновых филаментов друг с другом. В их скреплении участвуют миомезин и С-белок. На поперечном срезе миофибриллы можно видеть, что вокруг одной толстой филаменты в виде шестиугольника, формируя его углы, лежат шесть тонких филамент. Тонкие филаменты неподвижно прикреплены к Z-линиям.  В состав их входят белки а-актинин, десмин, виментин. МЕХАНИЗМ МЫШЕЧНОГО СОКРАЩЕНИЯ. Общепринятой теорией является модель мышечного сокращения X. Хаксли, или теория скольжения нитей (1954). Суть ее в следующем (рис. 12.10, 12.11). Нервный импульс проходит по нервному волокну и передается на постси-наптическую мембрану нервно-мышечного синапса, которой является плазмолемма мышечного волокна. Затем возбуждение идет по Т-трубоч-кам внутрь мышечного волокна и передается на лежащие рядом терминальные цистерны. Из цистерны СПР после их возбуждения выходят ионы Са2+, т.к. мембраны СПР после деполяризации становятся для них проницаемыми. В отличие от гладких миоцитов, в которых кальций активирует миозиновые филаменты, в скелетной мышечной ткани основной точкой приложения кальция являются тонкие филаменты. На них кальций открывает активные центры для связывания головок миозина: ионы Са2+ мигрируют к молекулам тропонина (ТпС) и связываются с ними (рис. 12.8). Тропонин Tnl в состоянии расслабления закрывает активные центры на актиновых филаментах. При связывании Са2+ изменяется конфигурация тропонина, и эти актиновые центры «открываются». При этом головки миозина, обладающие адгезивностью, приобретают возможность взаимодействовать с молекулами актина. Они изгибаются в шарнирных областях и присоединяются к молекулам актина, совершая при этом своеобразные гребковые движения и создавая тянущее усилие. Далее они отсоединяются от активных участков и вновь присоединяются, но в новом месте. Акт присоединения—отсоединения идет со скоростью 500 раз в секунду. Это вызывает скольжение толстых филамент вдоль тонких. С активными центрами актиновых филамент взаимодействие головок миозина осуществляется поочередно. 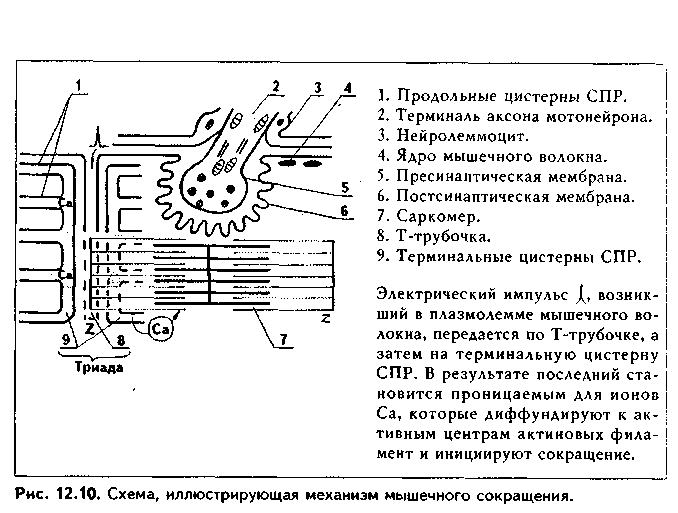 Для возвращения головки миозина в исходное положение необходима энергия АТФ, которая распадается благодаря АТФ-азной активности миозина. После наступления смерти выработка АТФ резко снижается и головки миозина не могут отсоединиться от актиновых филамент. Это проявляется в сокращении мышц (трупное окоченение). 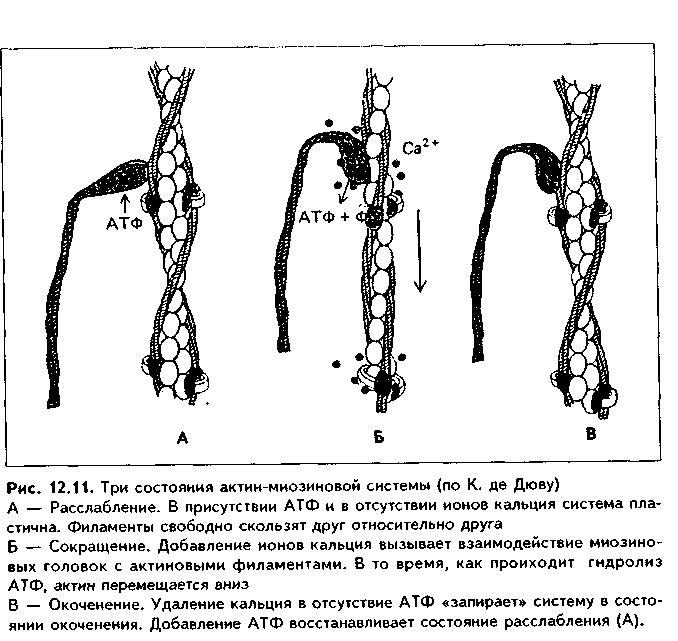 Его наступление зависит от длительности агонии, температуры внешней среды и других условий, но относительно постоянно для каждого комплекса условий. Разрешение трупного окоченения также происходит в определенные временные интервалы в результате процессов аутолиза. Трупное окоченение может быть насильственно разрушено. Все эти обстоятельства используются в судебно-медицинской практике для установления времени наступления смерти и решения ряда других вопросов. При отсутствии нервных импульсов Са2+ вновь откачивается в СПР, и активные центры на актиновых филаментах закрываются тропонином. В электронном микроскопе сокращение проявляется сближением Z-линий, уменьшением или исчезновением размеров I-диска, полоски М в А-диске, а также появлением поперечных мостиков из головок миозина (см. рис. 12.6). Количество поперечных мостиков нарастает по ходу развития сократительного акта, обеспечивая нарастание силы сокращения. Последующее расслабление сопровождается обратным процессом. Удлинение мышц, находящихся в антагонистических отношениях с сокращающимися в данный момент мышцами происходит пассивно в результате отсутствия взаимодействия между миофиламентами и пассивного их скольжения друг по отношению к другу. При помощи особых белков (дистрофии, винкулин, талин, спект-рин и др.) и адгезивных молекул (интегрины, фибронектин и др.) мио-фибриллы связаны с базальной мембраной и через нее — с компонентами межклеточного вещества эндомизия. РЕГЕНЕРАЦИЯ СКЕЛЕТНОЙ МЫШЕЧНОЙ ТКАНИ Физиологическая регенерация. В нормальных условиях функционирования происходит старение и разрушение частей мышечных волокон. Восстановление происходит как за счет внутриклеточной, так и клеточной регенерации. Внутриклеточная регенерация призвана восстанавливать стареющие органеллы и другие части мышечных волокон. Клеточная регенерация включает размножение миосателлитоцитов, превращение их в миобла-сты с последующим включением последних в состав предсуществующих мышечных волокон и дифференцировкой во фрагмент мышечного волокна. Репаративная регенерация. Также осуществляется на внутриклеточном и клеточном уровне благодаря миосателлитоцитам. После повреждения мышечных волокон на ранних стадиях регенераторного процесса в месте повреждения развивается воспалительная реакция. Одновременно происходит разрушение части мышечных волокон на некотором удалении от места повреждения. Клетки воспалительного инфильтрата (нейтрофилы и макрофаги) интенсивно фагоцитируют участки мертвых тканей, микроорганизмы, расчищая зону регенерации. При сильной активации фагоцитов (наблюдается при разможжении тканей с их омертвением) продукты секреции фагоцитов MOi-ут вызывать дополнительное разрушение мышечных волокон. Вещества, образующиеся при разрушении тканей (т.наз. некрогормоны) стимулируют регенерацию. При этом регенерации мышечной ткани предшествует регенерация кровеносных сосудов (реваскуляризация). Регенерация мышечных волокон происходит при тесном сочетании двух процессов: 1) формирования почек роста (внутриклеточная регенерация); 2) деления и дифференцировки миосателлитоцитов (клеточная регенерация). В первом случае на поврежденных отрезках мышечных волокон формируются мышечные почки роста: наплывы саркоплазмы в виде колбооб- разных утолщений (рис. 12.12 а). За счет внутриклеточной регенерации (образование в миофибриллах новых саркомеров, новых органелл и т.д.) почки растут навстречу друг другу. Во втором случае происходит активация миосателлитоцитов вблизи зоны травмы мышечных волокон. Усиленно размножаясь и дифференцируясь, они далее обеспечивают развитие стадий, похожих на стадии миогенеза: 1. Миобластическая Стадия. Из миосателлитов образуются миобласты, которые размножаются митозом (рис. 12.12 б). 2. Миосимпластическая стадия. Миобласты сливаются друг с другом, образуя миосимпласты с миофибриллами в периферических и ядрами в центральных участках. 3. Стадия миотубул (рис. 12.12 в). 4. Стадия зрелых мышечных волокон (рис. 12.12 г). Важно подчеркнуть, что миобласты могут не только сливаться друг с другом и формировать мышечные трубочки, но также включаться в мышечные почки, усиливая и ускоряя их рост навегречу друг другу.  Новообразованные участки мышечных волокон тоньше предсуществую-щих, часто не до конца дифференцированы (содержат ядра, лежащие в центре, как в миотубулах). Правильная дозированная нагрузка на поврежденную мышцу способствует превращению их в полноценные мышечные волокна. УСЛОВИЯ ХОРОШЦЙ РЕГЕНЕРАЦИИ СКЕЛЕТНОЙ МЫШЕЧНОЙ ТКАНИ Полноценная регенерация поперечнополосатой мышечной ткани чаще происходит при небольших повреждениях. В последнее время благодаря методам микрохирургии, позволяющим восстановить сосуды и нервы, удается добиться удовлетворительной регенерации мышц и при массивных повреждениях, что позволяет реплантировать ампутированные при травмах конечности. Условиями хорошей регенерации мышечной ткани являются: 1. Максимальное сближение краев поврежденного мышечного волокна путем их сшивания. 2. Тщательное удаление из зоны регенерации мертвых тканей и препятствие развитию грубой рубцовой соединительной ткани. 3. Тщательное восстановление непрерывности кровеносных сосудов и нервов. Достигается путем их сшивания под операционным микроскопом. 4. Сохранение целостности базальной мембраны мышечных волокон также является важным условием хорошей регенерации мышечных волокон. Она препятствует проникновению в поврежденное мышечное волокно фибробластов и разрастанию соединительной ткани. Сохраненная базаль-ная мембрана способствует ориентации мышечных трубочек, обеспечивает нормальное микроокружение. РОСТ И КОМПЕНСАТОРНО-ПРИСПОСОБИТЕЛЬНАЯ ПЕРЕСТРОЙКА СКЕЛЕТНОЙ МЫШЕЧНОЙ ТКАНИ. В онтогенезе происходят существенные изменения со стороны мышечной ткани, связанные с ее ростом и адаптацией к изменяющимся условиям функционирования. Рост мышечной ткани и скелетных мышц происходит за счет двух процессов: 1) утолщения и 2) удлинения миофибрилл и всего мышечного волокна. Утолщение мышечного волокна осуществляется как за счет образования новых миофибрилл, так и за счет их утолщения путем добавления вновь синтезированных миофиламентов к прсдсуществующим мио-фибриллам (гипертрофия миофибрилл). Возможно также увеличение количества миофибрилл путем расщепления предварительно утолщенных предсуществующих миофибрилл, а затем их гипертрофии. Параллельно в волокне идет увеличение содержания саркоплазмы и органелл в ней. Удлинение миофибрилл и мышечного волокна в целом происходит двумя путями: 1) путем пристройки к концам миофибрилл новых сар-комеров и 2) в результате слияния с мышечным волокном все новых и новых миосателлитоцитов. В основе удлинения мышечного волокна лежит также образование все новых компонентов саркоплазмы. Гипертрофия скелетной мышечной ткани и скелетных мышц — это своеобразная адаптация мышечной ткани, которая происходит при длительном возрастании мышечной нагрузки и характеризуется преобладанием анаболических процессов над катаболическими. В основе гипертрофии лежит увеличение числа и размеров (диаметра) миофибрилл, а также компонентов саркоплазмы. При тренировках на физическую выносливость происходит преимущественное увеличение объема саркоплазмы и в особенности митохондрий, а при скоростно-силовых тренировках преимущественное развитие получает миофибриллярный аппарат. Атрофия скелетной мышечной ткани и мышц наблюдается при гиподинамии, денервации и голодании. В некоторых случаях (голодание, гиподинамия) атрофия является своеобразной адаптацией к экстремальным условиям существования. Врожденная атрофия (или правильнее, дистрофия) скелетной мышечной ткани наблюдается при генетических нарушениях. Характеризуется генетическим дефектом синтеза белков дистрофи-нов, сопровождающимся снижением их содержания. Эти белки связывают миофибриллы с сарколеммой и межклеточным веществом эндомизия. Такая связь обеспечивает нормальную биологию мышечных волокон. Снижение содержания дистрофинов проявляется разрушением мышечных волокон и замещением их жировой и волокнистой соединительной тканями. Стимуляция регенерации и гипертрофии скелетной мышечной ткани. Ускорения и полноценной регенерации скелетной мышечной ткани можно добиться следующими способами: 1) путем назначения анаболических гормонов (мужских половых гормонов или их синтетических аналогов, инсулина, гормона роста); 2) путем назначения витаминов. Особое значение имеют витамины, непосредственно участвующие в синтезе белков: витамин В,2, фолиевая кислота, оротовая кислота (калия оротат). 3) В эксперименте показано резкое улучшение регенерации скелетной мышцы при введении в зону повреждения измельченной мышцы ("мышечного фарша"). 4) В последнее время для стимуляции регенерации поврежденной скелетной мышцы стали применять имплантацию культуры миосателлитоцитов. Их удается выделить из мышечной ткани и выращивать культурально. 5) Большое значение имеют досточно ранние дозированные функциональные нагрузки на регенерирующую мышечную ткань. СТРОЕНИЕ СКЕЛЕТНОЙ МЫШЦЫ КАК ОРГАНА. Мышца состоит из множества мышечных волокон, связанных в единое целое соединительной тканью. Количество мышечных волокон в мышцах может сильно варьировать — от нескольких сот тысяч до нескольких миллионов. Между мышечными волокнами лежит РВНСТ, называемая эндомизием. Соеди-нптельпоткапные волокна зндо-мнзия тесно связаны с банальной мембраной мышечного волокна. Несколько мышечных волокон (10—100) окружены более толстыми прослойками РВНСТ — перимизием. Пери-мизий образован сильно разветвлен н ы м и прослой ка ми РВНСТ, отходящими от эпи-мизия. В эндомизии и перими-зии находятся сосуды и нервы, питающие мышцу (рис. 12.13). Снаружи мышца покрыта эпи-мизием — тонким прочным футляром из плотной волокнистой соединительной ткани. С концов к мышце прикрепляются сухожилия. При этом сарколемма на концах мышечных волокон образует многочисленные интердигитацпи, в которые заходят и тесно вплетаются в базальную мембрану коллагеновые волокна сухожилия. ТИПЫ МЫШЕЧНЫХ ВОЛОКОН. Выделяют три основных типа мышечных волокон (рис. 12.14). I тип — красные мышечные волокна. Имеют небольшой диаметр. В них преобладает саркоплазма, в которой много белка миоглобина, обеспечивающего красный цвет волокон. Миофибрилл меньше, чем саркоплазмы, они относительно тонкие. Это медленные (тонические) мышечные волокна. Они содержат много митохондрий, имеют высокую активность окислительно-восстановительных ферментов, запасы питательных веществ (включения липидов) и могут сокращаться в течение длительного времени, но медленно, развивая не очень большую силу сокращений. Красные мышечные волокна содержат много миосателлитоцитов и усиленно кровоснаб-жаются. Из них построены мышцы, выполняющие длительные тонические нагрузки, например, у птиц, совершающих длительные перелеты, это грудные мышцы. НВ тип — белые мышечные волокна. Характеризуются большим диаметром, сильным развитием миофибрилл и меньшим развитием саркоплазмы, в которой содержится меньше, чем в красных волокнах, питательных запасов и митохондрий. В волокнах низкая активность окислительных ферментов, а активность гликолитических ферментов (лактатдегидрогеназы и др.) — напротив, высокая. Содержат большие запасы гликогена. Это быстрые, тетанические, способные вызывать сокращения большой силы, но быстро утомляемые мышечные волокна. Их кровоснабжение относительно слабое. Из этих мышечных волокон построены мышцы, выполняющие быстрые движения и сильные сокращения (мышцы конечностей). Белые мышечные волокна более быстро и выраженно подвергаются гипертрофии, чем красные мышечные волокна.  НА тип. Промежуточный тип мышечных волокон, занимающий и в структурном, и в функциональном отношении среднее положение между первыми двумя. В качестве источника энергии используют как липиды, так и гликоген, в них в одинаковой степени протекают и окислительные, и гликолитические процессы. Способны сокращаться быстро, с большой силой, и вместе с тем устойчивы к утомлению. У каждого человека свое индивидуальное, генетически обусловленное соотношение трех типов мышечных волокон, этим определяются разные физические и спортивные качества и способности. 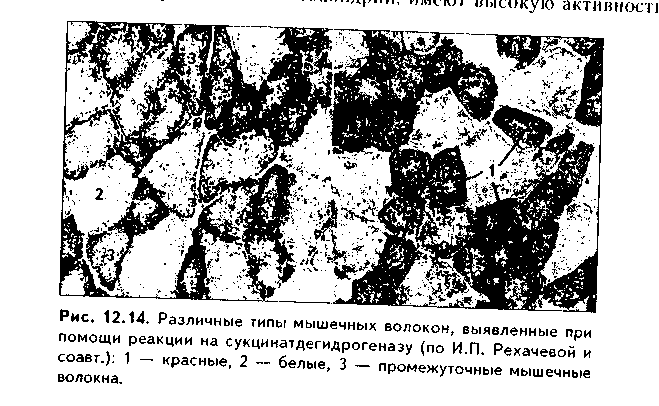 СЕРДЕЧНАЯ МЫШЕЧНАЯ ТКАНЬ РАЗВИТИЕ. Источником развития сердечной мьшючной ткани является миоэпикардиальная пластинка — часть висцерального сплаихпотома в шейном отделе зародыша. Ее клетки превращаются в миобласты, которые активно делятся митозом и дифференцируются. В цитоплазме миобластов синтезируются миофиламенты, формирующие миофибриллы. Вначале миофибриллы не имеют исчерченности и определенной ориентации в цитоплазме. В процессе дальнейшей дифференцировки принимают продольную ориентацию и тонкими миофиламентами прикрепляются к формирующимся уплотнениям сарколеммы (Z-вещество). В результате все возрастающей упорядоченности миофиламентов миофибриллы приобретают поперечную исчерчениость. Образуются кардиоми- оциты. В их цитоплазме нарастает содержание органелл: митохондрий, гра нулярной ЭПС, свободных рибосом. В процессе дифференцировки кардио миоциты не сразу теряют способность к делению и продолжают размножаться. В некоторых клетках может отсутствовать цитотомия, что ведет к появлению двуядерных кардиомиоцитов. Развивающиеся кардиомиоциты имеют строго определенную пространственную ориентацию, выстраиваясь в виде цепочек и образуя друг с другом межклеточные контакты — вставочные диски. В результате дивергентной дифференцировки кардиомиоциты превращаются в клетки трех типов: 1) рабочие, или типичные, сократительные; 2) проводящие, или атипичные; 3) секреторные (эндокринные). В результате терминальной дифференцировки кардиомиоциты к моменту рождения или в первые месяцы постнаталыюго онтогенеза теряют способность к делению. В зрелой сердечной мышечной ткани камбиальные клетки отсутствуют. СТРОЕНИЕ. Сердечная мышечная ткань образована клетками карди-омиоцитами. Кардиомиоциты являются единственным тканевым элементом сердечной мышечной ткани. Они соединяются друг с другом при помощи вставочных дисков и образуют функциональные мышечные волокна, или функциональный симпласт, не являющийся симпластом в морфологическом понятии. Функциональные волокна разветвляются и анастомози-руют боковыми поверхностями, в результате чего образуется сложная трехмерная сеть (рис. 12.15). Кардиомиоциты имеют вытянутую прямоугольную слабоотростчатую форму. Они состоят из ядра и цитоплазмы. Многие клетки (более половины у взрослого индивидуума) являются двуядерными и полиплоидными. Степень полиплоидизации различна и отражает адаптивные возможности миокарда. Ядра крупные, светлые, находятся в центре кардиомиоцитов. Цитоплазма (саркоплазма) кардиомиоцитов обладает выраженной ок-сифилией. В ней содержится большое количество органелл и включений. Периферическую часть саркоплазмы занимают расположенные продольно исчерченные миофибриллы, построенные так же, как в скелетной мышечной ткани (рис. 12.16). В отличие от миофибрилл скелетной мышечной ткани, лежащих строго изолированно, в кардиомиоцитах миофибриллы нередко сливаются друг с другом с образованием единой структуры и содержат сократимые белки, химически отличающиеся от сократимых белков миофибрилл скелетных мышц. СИР и Т-трубочки развиты слабее, чем в скелетной мышечной ткани, что связано с автоматией сердечной мышцы и меньшим влиянием нервной системы. В отличие от скелетной мышечной ткани СПР и Т-трубочки образуют не триады, а диады (к Т-трубочке прилежит одна цистерна СПР). Типичные терминальные цистерны отсутствуют. СПР менее интенсивно аккумулирует кальций. Снаружи кардиоциты покрыты сарколеммой, состоящей из плаз-молеммы кардиомпоцита и базаль-ной мембраны снаружи. Вазальная мембрана тесно связана с межклеточным веществом, в нес вплетаются коллагеновые и эластические волокна. Базальная мембрана отсутствует в местах вставочных дисков. Со вставочными дисками связаны компоненты цитоскелета. Через интегрины цитолеммы они также связаны с межклеточным веществом. Вставочные диски — это место контактов двух кардиомиоцитов, комплексы межклеточных контактов. Они обеспечивают как механическую, так и химическую, функциональную коммуникацию кардиомиоцитов. В световом микроскопе имеют вид темных поперечных полосок (рис. 12.14 б). В электронном микроскопе вставочные диски имеют зигзагообразный, ступеньчатый вид или вид зубчатой линии. В них можно выделить горизонтальные и вертикальные участки и три зоны (рис. 12.1,12.15 6).  1. Зоны десмосом и полосок слипания. Находятся на вертикальных (поперечных) участках дисков. Обеспечивают механическое соединение кардиомиоцитов. 2. Зоны нексусов (щелевых контактов) — места передачи возбуждения с одной клетки на другую, обеспечивают химическую коммуникацию кардиомиоцитов. Обнаруживаются на продольных участках вставочных дисков. 3. Зоны прикрепления миофибрилл. Находятся на поперечных участках вставочных дисков. Служат местами прикрепления актиновых фила-ментов к сарколемме кардиоми-оцита. Это прикрепление происходит к Z-полоскам, обнаруживаемым на внутренней поверхности сарколеммы и аналогичным Z-линиям. В области вставочных дисков обнаруживаются в большом количестве кадгерины (адгезивные молекулы, осуществляющие каль-цийзависимую адгезию кардио-миоцитов друг с другом). Типы кардиомиоцитов. Кардиомиоциты имеют разные свойства в разных участках сердца. Так, в предсердиях они могут делиться митозом, а в желудочках никогда не делятся. Различают три тина кардиомиоцитов, существенно отличающихся друг от друга гак строением, так и функциями: рабочие, секреторные, проводящие. 1. Рабочие кардиомиоциты имеют структуру, описанную выше. 2. Среди предсердных миоцитов есть секреторные кардиомиоциты, которые вырабатывают натрийуретический фактор (НУФ), усиливающий секрецию натрия почками. Кроме этого, НУФ расслабляет гладкие ми-оциты стенки артерий и подавляет секрецию гормонов, вызывающих гипер-тензию (альдостерона и вазопрессина). Все это ведет к увеличению диуреза и просвета артерий, снижению объема циркулирующей жидкости и в результате — к снижению артериального давления. Секреторные кардиомиоциты локализуются в основном в правом предсердии. Следует отметить, что в эмбриогенезе способностью к синтезу обладают все кардиомиоциты, но в процессе дифференцировки кардиомиоциты желудочков обратимо те-ряют эту способность, которая может восстанавливаться здесь при перенапряжении сердечной мышцы.  3. Значительно отличаются от рабочих кардиомиоцитов проводящие (атипичные) кардиомиоциты. Образуют проводящую систему сердца (см. "сердечно-сосудистую систему"). Они в два раза больше рабочих кардиомиоцитов. В этих клетках содержится мало миофибрилл, увеличен объем саркоплазмы, в которой выявляется значительное количество гликогена. Благодаря содержанию последнего цитоплазма атипичных кардиомиоцитов плохо воспринимает окраску. В клетках содержится много лизосом и отсутствуют Т-трубочки. Функцией атипичных кардиомиоцитов является генерация электрических импульсов и передача их на рабочие клетки. Несмотря на автоматизм, работа сердечной мышечной ткани строго регулируется вегетативной нервной системой. Симпатическая нервная система учащает и усиливает, парасимпатическая — урежает и ослабляет сердечные сокращения. РЕГЕНЕРАЦИЯ СЕРДЕЧНОЙ МЫШЕЧНОЙ ТКАНИ. Физиологическая регенерация. Реализуется на внутриклеточном уровне и протекает с высокой интенсивностью и скоростью, поскольку сердечная мышца несет огромную нагрузку. Еще более она возрастает при тяжелой физической работе и в патологических условиях (гипертоническая болезнь и др.). При этом происходит постоянное изнашивание компонентов цитоплазмы кардиомиоцитов и замещение их вновь образованными. При повышенной нагрузке на сердце происходит гипертрофия (увеличение размеров) и гиперплазия (увеличение количества) органелл, в том числе и миофибрилл с нарастанием в последних количества саркомеров. В молодом возрасте отмечаются также полиплоидизация кардиомиоцитов и появление двуядерных клеток. Рабочая гипертрофия миокарда характеризуется адекватным адаптивным разрастанием его сосудистого русла. При патологиии (например, пороки сердца, также вызывающие гипертрофию кардиомиоцитов) этого не происходит, и через некоторое время из-за нарушения питания происходит гибель части кардиомиоцитов с замещением их рубцовой тканью (кардиосклероз). Репаративная регенерация. Происходит при ранениях сердечной мышцы, инфарктах миокарда и при других ситуациях. Поскольку в сердечной мышечной ткани пет камбиальных клеток, то при повреждении миокарда желудочков регенераторные и адаптивные процессы идут на внутриклеточном уровне в соседних кардиомиоцитах: они увеличиваются в размерах и берут на себя функцию погибших клеток. На месте погибших кардиомиоцитов образуется соединительнотканный рубец. В последнее время установлено, что некроз кардиомиоцитов при инфаркте миокарда захватывает только кардиомиоциты сравнительно небольшого участка зоны инфаркта и близлежащей зоны. Более значительное количество кардиомиоцитов, окружающих зону инфаркта, погибает путем апрптоза, и этот процесс является ведущим в гибели клеток сердечной мышцы. Поэтому лечение инфаркта миокарда в первую очередь должно быть направлено на подавление апоптоза кардиомиоцитов в первые сутки после наступления инфаркта. При повреждении миокарда предсердий в небольшом объеме может осуществляться регенерация на клеточном уровне. Стимуляция репаративной регенерации сердечной мышечной ткани. 1) Предотвращение апоптоза кардиомиоцитов назначением препаратов, улучшающих микроциркуляцию миокарда, снижающих свертывание крови, ее вязкость и улучшающих реологические свойства крови. Успешная борьба с постинфарктным апоптозом кардиомиоцитов является важным условием дальнейшей успешной регенерации миокарда; 2) Назначение анаболических препаратов (витаминного комплекса, препаратов РНК и ДНК, АТФ и др.); 3) Раннее применение дозированных физических нагрузок, комплекса упражнений лечебной физкультуры. В последние годы в экспериментальных условиях для стимуляции регенерации сердечной мышечной ткани стали применять трансплантацию миосателлитоцитов скелетной мышечной ткани. Установлено, что введенные в миокард миосателлитоциты формируют скелетные мышечные волокна, устанавливающие тесную не только структурную, но и функциональную связь с кардиомиоцитами. Поскольку замещение дефекта миокарда не инертной соединительной, а проявляющей сократительную активность скелетной мышечной тканью более выигрышно в функциональном и даже в механическом отношении, то дальнейшая разработка этого метода может оказаться перспективной при лечении инфарктов миокарда у людей. ВОЗРАСТНЫЕ ИЗМЕНЕНИЯ МЫШЕЧНЫХ ТКАНЕЙ 1. Гладкая мышечная ткань. В раннем постнатальном онтогенезе отмечается дальнейшая дифференцировка миоцитов в составе оболочек полых органов. При этом наблюдается постепенное увеличение миоцитарных комплексов за счет нарастания как количества миоцитов, формирующих комплексы, так и размеров самих миоцитов. Благодаря этому происходит постепенное увеличение толщины слоев мышечной оболочки органов, достигающее максимума к моменту полового созревания. При старении происходит постепенное уменьшение размеров миоцитарных комплексов, обусловленное усилением апоптотической гибели гладких миоцитов, преобладающей над их воспроизводством. Это ведет к уменьшению толщины слоев мышечной оболочки полых органов. В некоторых случаях может, напротив, происходить разрастание гладкой мышечной ткани (в предстатель-ной железе у мужчин, в мышечной оболочке матки у женщин, во внутренней оболочке артерий при атеросклерозе). 2. Скелетная мышечная ткань. В раннем постнатальном периоде происходит окончательное созревание мышечных волокон, не завершившееся к моменту рождения. В дальнейшем идет постепенное уплотнение мышечных волокон в мышцах за счет увеличения поперечника волокон. В молодом возрасте происходит увеличение объема мышечной ткани за счет возрастания длины и толщины мышечных волокон. Этот процесс существенно ускоряется в подростковом возрасте. При старении в скелетной мышечной ткани наблюдаются явления частичной дегенерации и атрофии мышечных волокон, сопровождающееся разрастанием соединительной ткани. В волокнах нарушается закономерность расположения митохондрий, которые могут гипертрофироваться с появлением гигантских форм либо дегенерируют. Снижается объем саркоплазматической сети. В отдельных мио-фибриллах отмечаются потеря поперечной исчерченности, фрагментация в сочетании с дезорганизацией миофиламентов. В результате разрастания соединительной ткани существенно снижаются упругость и эластичность мышц. В силу всех отмеченных изменений мышцы становятся легко утомляемыми. Сердечная мышечная ткань. У новорожденных детей кардиомиоциты мелкие, округлые, содержат меньше саркоплазмы и миофибрилл, чем у взрослых. Миофибриллы тонкие. В связи с этим миокард у первый год жизни бледен и менее исчерчен, чем у взрослого. После рождения толщина и масса миокарда быстро увеличиваются за счет увеличения размеров кардиомиоцитов. Их форма из округлой становится отростчатой к 4-му году. Увеличивается объем саркоплазмы и миофибрилл. Дефинитивного строения сердечная мышца достигает к половому созреванию При старении происходят дистрофия и атрофия кардиомиоцитов. В кардиомиоци-тах уменьшается ядерно-цитоплазматическое отношение. Снижается плотность ядер. Дистрофически изменяются митохондрии. Уплотняются ба-зальная мембрана и сарколемма. Расширяются канальцы СПР. В кардио-миоцитах появляется пигмент старения липофусцин. Прогрессивно разрастается соединительная ткань, вследствие этого и уменьшения удельного веса кардиомиоцитов сердечная мышца становится дряблой. |
