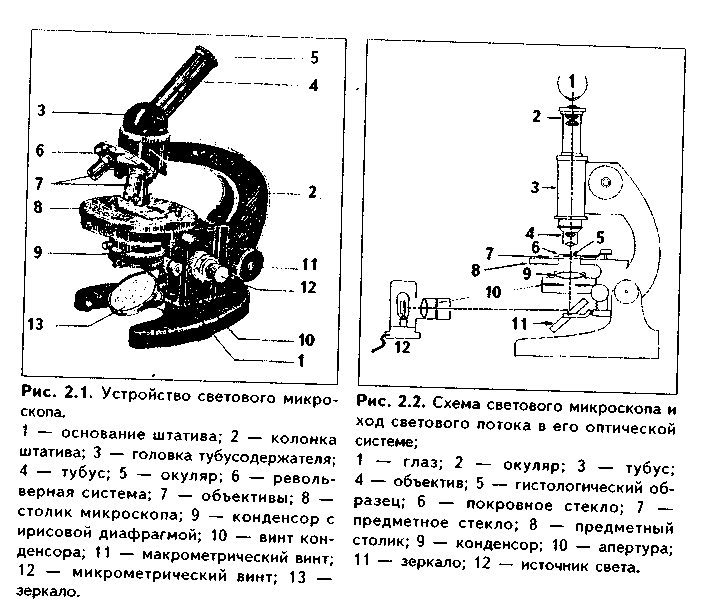
МЯДЕЛЕЦ ОБЩ.ГИСТ.. Литература для медицинских вузов все факультеты о. Д. Мяделец основы цитологии, эмбриологии и общей гистологии
 Скачать 4.75 Mb. Скачать 4.75 Mb.
|
Глава 2к — длина волны.Из формулы следует, что для повышения разрешающей способности микроскопа нужно использовать источник света с очень малой длиной волны. Это подтолкнуло ученых к поиску способов увеличить разрешающую способность микроскопа через уменьшение длины волны источника света (ультрафиолетовая и люминесцентная микроскопия), а также к открытию электронного микроскопа, в котором вместо видимого света стали использовать пучок электронов, имеющий очень короткую длину волны. ВИДЫ СВЕТОВОЙ МИКРОСКОПИИ 1. Стандартный световой микроскоп. В стандартном световом микроскопе для просвечивания гистологических объектов используется видимая часть спектра света. Длина ее волны в среднем равна 0,4 мкм. Следовательно, разрешающая способность светового микроскопа равна примерно 0,2 мкм, а его общее увеличение составляет около 2500 раз (полезное —1500 раз). 2. Ультрафиолетовая микроскопия. В данном случае для просвечивания объекта используется ультрафиолетовая часть спектра, имеющая длину волны 0,2 мкм. Таким образом, разрешающая способность этого микроскопа равна 0,1 мкм, что в 2 раза выше, чем у обычного микроскопа. Так как полученное изображение невидимо для глаза, то оно регистрируется на фотопластинке или люминесцентном экране. 3. Люминесцентная (флуоресцентная) микроскопия. Это метод микроскопии, в котором используется явление люминесценции, или свечения некоторых веществ при воздействии на них коротковолновых лучей. Поглощая коротковолновое излучение, молекулы этих веществ переходят в возбужденное состояние и сами начинают излучать свет, который имеет длину волны большую, чем длина волны возбуждающего света. Такой свет и регистрируется в люминесцентном микроскопе. Коротковолновое излучение и свет люминесценции разделяются при помовш светофильтров. Различают аутолюминесценцию (первичную люминесценцию) и наведенную (вторичную) люминесценцию. При аутолюминесценции гистологический объект испускает свет люминесценции без предварительной обработки. Любая клетка живого организма обладает собственной люминесценцией, которая, однако, в большинстве случаев очень слабая и трудно регистрируется. При наведенной люминесценции объект обрабатывается специальными люминесцирующими красителями, которые связываются с клетками и тканями организма, делая их видимыми. Примером такого красителя является акридиновый оранжевый. Он достаточно прочно связывается с нуклеиновыми кислотами и вызывает красное свечение РНК и зеленое — ДНК. В комплект современных люминесцентных микроскопов включаются фотометрические насадки, позволяющие измерять интенсивность люминесценции, что дает возможность количественного определения связывающего люмииесцирующии краситель вещества. 4. Интерференционная микроскопия. В интерференционном микроскопе падающий на объект световой поток раздваивается. При этом одна его часть идет на объект, а другая — минуя его. Затем два пучка вновь соединяются, и при этом возникает интерференционное изображение объекта. По сдвигу фаз одного пучка относительно другого можно определить точную концентрацию вещества в клетке. Таким образом, интерференционный микроскоп также позволяет осуществлять количественные морфологические исследования. 5. Поляризационная микроскопия. В микроскопах этого типа световой пучок при пом.ощи специальных призм (призмы Николя) разлагается на два луча, поляризованных во взаимно перпендикулярных плоскостях. Проходя через структуры со строгой ориентацией молекул, световые лучи запаздывают относительно друг друга в результате неодинакового их преломления. Далее пучок света пропускается через анализатор, который определяет степень отклонения поляризации света при прохождении через объект. Это позволяет определить характер расположения молекул, например, в миофибриллах, а также наблюдать спиральные или не видимые при других методах исследования структуры. 6. Фазово-контрастная микроскопия — метод изучения клеток в световом микроскопе, который имеет фазово-контрастное устройство. В нем использован принцип неодинакового изменения фаз световых лучей при прохождении их через разные по плотности структуры изучаемого объекта (рис. 2.3). При этом происходит смещение фаз световых волн, что приводит к повышению контрастности структур объекта и позволяет рассматривать неокрашенные и живые клетки. Разновидностью фазово-контрастного микроскопа является темнопольный микроскоп, который дает негативное изображение по сравнению с позитивным фазовоконтрастным изображением. 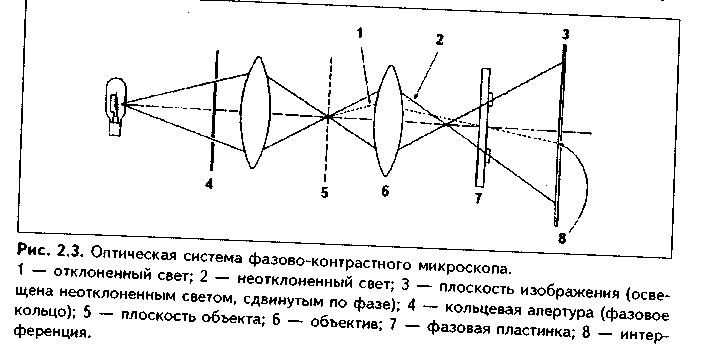 ЭЛЕКТРОННАЯ МИКРОСКОПИЯ И ЕЕ ВИДЫ Электронная микроскопия использует для "просвечивания" морфологических объектов пучок электронов. Пучок электронов испускается электронной пушкой в условиях высокого вакуума и ускоряющего напряжения. Далее этот пучок фокусируется при помощи электромагнитов (электромагнитные линзы). Сфокусированный пучок направляется на изучаемый объект, имеющий структуры с различной электронной плотностью. Пройдя через объект, пучок электронов падает на люмииесцирующий экран, на котором и создает плоскостное изображение структур объекта. Это изображение может быть сфотографировано. Общий вид электронного микроскопа показан на рис. 2.4. Разрешающая способность современных электронных микроскопов равна 0,1 нм (в 200 000 раз выше, чем световых микроскопов), а увеличение — 1 миллион раз. Описанная разновидность электронной микроскопии называется просвечивающей (трансмиссионной). Используя ее, можно изучить тонкое внутреннее строение клеток и межклеточных структур. Сканирующие, или растровые, микроскопы позволяют увидеть трехмерное изображение объекта, его поверхность. Принцип работы растрового электронного микроскопа заключается в том, что пучок электронов последовательно движется по поверхности гистологического объекта, на которую предварительно напылено твердое вещество. Под действием пучка электронов выбиваются вторичные электроны, которые регистрируются телевизионным экраном. Так последовательно "высвечивается" (сканируется) вся поверхность гистологического объекта. Рис. 2.5 демонстрирует изображения объектов, получаемые с помощью трансмиссионного и сканирующего электронных микроскопов. Высоковольтная трансмиссионная электронная микроскопия за счет увеличения ускоряющего напряжения обеспечивает огромную скорость движения электронов. Благодаря этому они значительно глубже, чем при обычной трансмиссионной микроскопии, проникают в изучаемый объект. Высоковольтный микроскоп (рис. 2.6) дает высокую разрешающую способность и позволяет изучать срезы до нескольких микрометров толщиной. 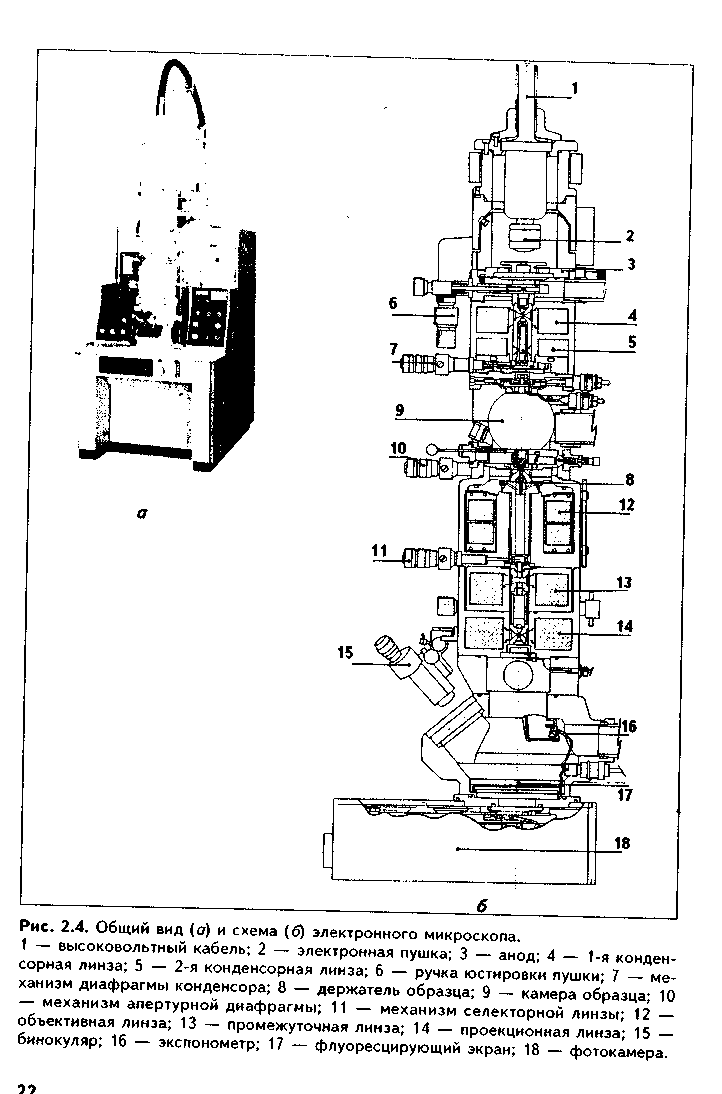  ГИСТОХИМИЯ В основе гистохимических методов исследования лежит использование химических реакций для изучения различных химических компонентов клеток и тканей. Современные гистохимические методы позволяют выявлять в клетках аминокислоты, белки, жиры, углеводы, минеральные вещества и другие продукты. Принцип гистохимических реакций состоит в том, что используются красители, которые избирательно связываются только с теми химическими соединениями клетки, которые необходимо изучить, и окрашивают их, делая видимыми. Важный раздел гистохимии — гистохимия ферментов. При помощи гистохимии ферментов можно определить активность многих ферментов, изучать обмен веществ в клетках и тканях. Активность ферментов при этом определяется по окрашиванию конечного продукта реакции. Поскольку гистохимические методы позволяют оценивать функции клеток и тканей, их относят к морфофункциоиальным методам (рис 2.7). Разновидностью гистохимии является также иммуногистохимия (иммуноцитохимия). Иммуногистохимические методы основаны на реакциях антиген-антитело. Каждая клетка организма имеет свой разнообразный специфический антигенный состав. К любому антигену можно путем иммунизации выработать специфические (моноклональные) антитела, которые затем соединяются с флуорохромом (например, флуоресцеинизотиоциона-том, или сокращенно ФИТЦ). Нанесенные на гистологический объект, такие антитела специфически метят только клетки, несущие антигены, на которые они выработались. Методы иммуногистохимии используются для определения степени дифферепцировки клеток (в процессе дифференцировки происходит последовательная смена поверхностных клеточных антигенов), а также для выявления различных веществ в клетке. В последнее время принципы светомикроскопической гистохимии успешно перенесены в электронную микроскопию. Это привело к возникновение электронномикроскопической цито- и гистохимии и электронной им-муноцитохимии (иммуногистохимии). Эти методы основаны на получении высокоэлектронноплотных продуктов цито- (гисто)химических реакций. Светомикроскопическая и электронномикроскопическая цито- (гисто- иммунохимия также являются морфофункциональными методами, позволяющими изучать не только структуру, но и функции клеток и тканей. ГИСТОАВТОРАДИОГРАФИЯ — метод, основанный на использовании радиоизотопов — веществ, излучающих поток электронов. Для этого изотопами метят различные предшественники синтеза веществ в клетке: нуклеотиды, аминокислоты и другие. Затем эти меченые вещества вводят в клетку (в организм), и они включаются в синтетические процессы. Далее из ткани делают срезы и наносят на них фотоэмульсию, которая под влиянием излучаемых электронов засвечивается. Чем больше засвечивание, тем интенсивнее идет процесс включения изотопов в ткани, тем интенсивнее обмен в клетке. В последнее время разработаны методы электронной цито-(гисто-) ауторадиографии. Так же, как и гистохимические методы, гистоавторадиог-рафия является морфофункциональным методом исследования. ПРИЖИЗНЕННАЯ МИКРОСКОПИЯ КЛЕТОК И ТКАНЕЙ. Для прижизненной (витальной) микроскопии можно использовать метод культуры тканей, когда клетки помещаются на искусственную питательную среду и затем на ней культивируются. На такой среде они растут в виде монослоя. Эти клетки можно затем окрашивать и микроскопировать. Для прижизненного исследования клеток используются также методы витального (прижизненного) окрашивания клеток нетоксичными красителями (метиленовый синий, трипаповый синий, кармин). Эти красители дают не растворы, а эмульсии, которые активно фагоцитируются клетками и визу-  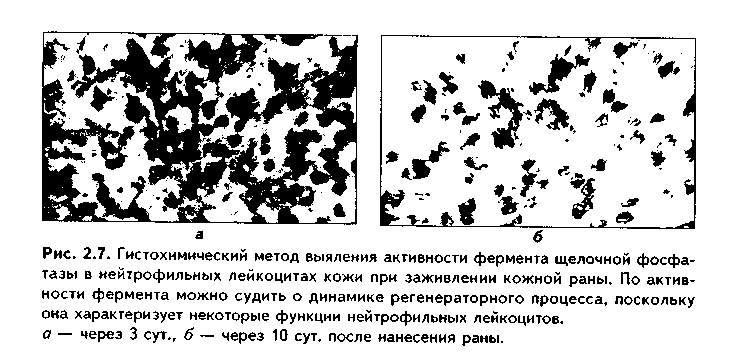 ализируют их. Суправитальная микроскопия основана на связывании красителя живыми тканями, изъятыми из организма. Например, так окрашивают нерные клетки при помощи метиленовОго синего. Таким образом, разница между витальной и суправиталыюй микроскопией заключается в том, что в первом случае окрашивание клеток и тканей идет в живом организме до изъятия из него органа или его части, тогда как во втором случае оно проводится в живом, но изъятом из организма органе (части органа, ткани). Для изучения живых клеток используют также метод цейтраферной съемки (киносъемки). При этом клетки в культуре тканей фотографируют с интервалами в 5 минут. Снятый таким образом фильм демонстрируют с частотой 24 кадра в секунду. При этом за короткое время можно увидеть все изменения, произошедшие с клетками в течение длительного времени. Цейтраферная съемка позволяет, например, проследить изменения, происходящие в клетке при митотическом делении и др. ЦИТОМИКРОХИРУРГИЯ — метод, позволяющий производить на клетке микрооперации — удаление частей клетки, пересадку ядра из одной клетки в другую и т.д. С этой целью используют специальный прибор микроманипулятор. В гистологии широко используют также метод трансплантации тканей. Для этого кусочки органов или тканей пересаживают в различные участки тела животных-реципиентов. Далее изучают поведение трансплантатов, процессы жизнедеятельности в них и взаимоотношения их с тканями реципиента. МЕТОД ГИБРИДИЗАЦИИ. Этот метод основывается на специфическом связывании участков ДНК с комплементарными им маркированными фрагментами РНК или ДНК (так называемые зонды). Метод позволяет выявлять последовательность нуклеотидов в РНК и ДНК и, следовательно, локализацию определенных генов и продуктов их деятельности. МЕТОДЫ КОЛИЧЕСТВЕННОЙ ГИСТОЛОГИИ (МОРФОМЕТРИЯ) В современной гистологии значительный дополнительный объем информации о гистологическом объекте можно получить при помощи количественных методов. Наиболее простым количественным гистологическим исследованием является подсчет гистологических структур в поле зрения микроскопа или на единицу площади среза. К морфометрическим методам относится также определение размеров гистологических объектов с помощью окуляр-микрометра — специальной микролинейки, вставленной в окуляр микроскопа. С морфометрической целью используются и морфо-метрические сетки. На этих сетках имеются точки (узлы). Так, например, наиболее часто используемая морфометрическая сетка Г.Г. Антандилова представляет собой прямоугольник, разделенный на два квадрата. Один из квадратов разделен на 4 более мелких квадрата. В каждом из этих малых квадратов имеется по 25 точек (всего 100 точек). Неразделенный большой квадрат содержит 25 точек. При помощи морфометрической сетки можно определить объемные доли различных структур в гистологическом объекте. Для этого случайным образом накладывают сетку определенное число раз на срез ткани или органа в гистопрепарате и подсчитывают количество точек, выпадающих на различные структуры. Предположим, в препарате соединительной ткани 10 точек выпало на клетки, а на межклеточное вещество пришлось 90 точек. Следовательно, объемная доля межклеточного вещества 90%, а клеток — 10%. Все эти виды морфометрии называются ручной морфометрией. В настоящее время существуют достаточно сложные приборы, которые позволяют автоматически производит!) количественные гистологические и гистохимические исследования. Это так называемые автоматизированные системы анализа изображений (АСАИз). В их состав входят: сканирующий световой или электронный микроскоп; видеокамера, которая осуществляет просмотр объекта по двум координатам, а затем следует преобразование его в цифровую форму; ЭВМ, которая обрабатывает полученную цифровую информацию и представляет данные о характеристиках исследуемого объекта. С помощью светового дисплея исследователь имеет возможность выделить только интересующие его структуры и получить о них цифровую информацию в виде гистограмм и т.д. ЦИТОСПЕКТРОФОТОМЕТРИЯ Это метод изучения химического состава клетки. Он основан на избирательном поглощении теми или иными веществами лучей с определенной длиной волны. По интенсивности поглощения (она зависит от концентрации вещества в клетке) определяют содержание этого вещества. ЦИТОСПЕКТРОФЛУОРИМЕТРИЯ - это метод количественного изучения веществ в клетке по спектрам их флуоресценции. ГИСТОЛОГИЧЕСКАЯ ТЕХНИКА Гистологическая техника — это техника приготовления гистологического препарата. Гистологическим препаратом может быть срез органа, ткани, мазок, отпечаток, пленочный препарат, культура тканей. Во всех случаях гистологический препарат должен отвечать таким требованиям: 1. Быть прозрачным, т.е. пропускать поток света. Для этого изготавливают достаточно тонкие срезы органов, тканей, клеток. 2. Быть контрастным, что достигается окрашиванием препарата. 3. Быть постоянным, т.е. сохраняться длительное время и служить в качестве своеобразного документа. Все эти требования к гистологическому препарату и выполняются в ходе гистологической техники. Гистологическая техника включает в себя несколько этапов: 1. Взятие материала: — во время операции; — от трупов; — от экспериментальных животных; — путем пункционной биопсии; — взятие крови, красного костного мозга путем пункции; — приготовление отпечатков (с полости рта, влагалища и др.). 2. Фиксация материала. Фиксация полученного гистологического материала — это воздействие на него химическими веществами, а также физическими факторами, что препятствует дальнейшему разрушению тканей объекта, сохраняет его структуру. Физические фиксирующие факторы — замораживание (твердой углекислотой, в жидком азоте, кислороде и т.д.), воздействие высокой температуры, рентгеновское облучение. Все эти факторы вызывают гибель бактерий и инактивируют собственные ферменты тканей, способствуя сохранению гистологического материала. Химические фиксаторы также вызывают гибель микробов и собственных ферментов тканей, стабилизируют структуру объекта. Различают простые и сложные химические фиксаторы. Простые фиксаторы состоят из одного химического вещества (например, формалин, спирт, уксусная кислота и др.). Эти фиксаторы, однако, приводят к определенным нарушениям структуры гистологического материала. Так, формалин вызывает сморщивание его, уменьшение в размерах. Уксусная кислота, наоборот, вызывает набухание. Поэтому чаще применяют сложные фиксаторы, в которых отрицательное действие простых фиксаторов нивелируется. Например, фиксатор ФСУ состоит из 4 частей формалина, 1 части спирта и 0,3 частей уксусной кислоты. Этот фиксатор вызывает весьма незначительные изменения структуры объекта. Известно множество и других сложных фиксаторов. 3. Промывка. Для вымывания фиксатора из тканей используют воду или другие вещества (спирт). 4. Обезвоживание. Из объекта удаляют воду путем помещения его в спирты возрастающей концентрации, а затем в хлороформ. 5. Уплотнение материала. Проводится для того, чтобы из объекта можно было приготовить тонкие срезы. Выполняется путем заливки в парафин, целлоидин или целлоидинпарафин. Можно уплотнить материал и путем замораживания в жидком азоте, что используется в гистохимии ферментов. При этом сохраняются интактными все ферменты. 6. Изготовление срезов. Этот этап выполняется при помощи приборов МИКРОТОМОВ (рис. 2.8). В них используются очень острые ножи, которые закрепляются неподвижно. Объект, залитый в парафин, движется вперед в течение каждого цикла (оборота) на определенное расстояние (3—10 мкм), и с его поверхности срезаются срезы такой же толщины (ротационный микротом). В микротомах других конструкций (санные микротомы) неподвижно закрепляется объект, а нож движется свободно вперед-назад в горизонтальной плоскости и после каждого цикла движений опускается на заданную толщину, производя срезы. 7. Удаление из срезов парафина. Срезы помещаются на предметное стекло, подсушиваются и помещаются в растворитель парафина — ксилол, толуол, бензол или в другие вещества. 8. Окрашивание срезов. При помощи окрашивания достигается контрастность препаратов. Для этого используют красители. В зависимости от источника получения они подразделяются на красители животного, растительного происхождения, синтетические. Кроме того, все красители делятся на кислые (образованы кислотами), основные (образованы основаниями) и нейтральные. Примером кислого красителя может служить эозин, являющийся синтетическим красителем. Пример основного красителя — гематоксилин. Он получается из коры некоторых пород деревьев (кампешевое дерево). 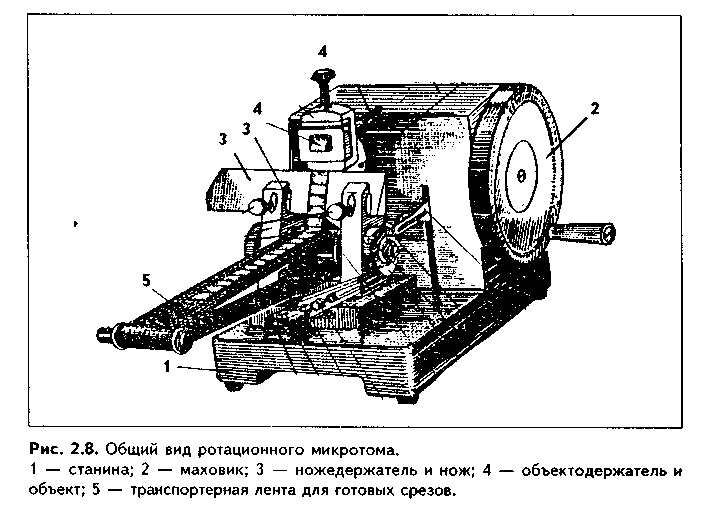 Красители делятся также на цитоплазматические (окрашивают цитоплазму клетки, например, эозин) и ядерные (окрашивают ядро, например, гематоксилин, азур и др.). ТИНКТОРИАЛЬНЫЕ СВОЙСТВА ТКАНЕЙ. Под тинкториальными свойствами понимают способность тканей и клеток окрашиваться красителями. Для обозначения типкториальных свойств используют такие термины: 1. ОКСИФИЛИЯ — это способность клеток и тканей окрашиваться кислыми красителями. Сами структуры при этом имеют основные свойства. Например, эритроциты обладают оксифилией за счет содержания в них основного белка гемоглобина. 2. ЭОЗИНОФИЛИЯ (вариант оксифилии) — способность структур окрашиваться кислым красителем эозином. Эозинофилией обладает цитоплазма многих клеток. 3. АЦИДОФИЛИЯ — то же, что и оксифилия. 4. БАЗОФИЛИЯ — способность структур окрашиваться основными красителями. При этом сами структуры должны иметь кислую реакцию. Например, нуклеиновые кислоты (ДНК и РНК) обладают базофилией, т.к. по химическим законам могут связывать красители-основания. Благодаря этому ядро любой клетки в той или иной степени базофильно. Базофилией обладает также цитоплазма белоксинтезирующих клеток из-за содержащейся в многочисленных рибосомах РНК. 5. ПОЛИХРОМАТОФИЛИЯ — способность структур клетки окрашиваться и кислыми, и основными красителями. Таким качеством обладают, например, гранулы нейтрофильных лейкоцитов. Чаще, однако, в качестве синонима используют термин НЕЙТРОФИЛИЯ. 6. МЕТАХРОМАЗИЯ — способность гистологических структур при связывании красителя изменять его цвет. При этом сами структуры окрашиваются в цвет, который отличается от цвета красителя в растворе. Чаще всего метахромазией обладают углеводные соединения, и появление мета-хромазии говорит о присутствии в клетке или ткани сложных углеводов. 7. АРГЕНТОФИЛИЯ — способность структур окрашиваться солями серебра. 8. ХРОМОФИЛИЯ — способность структур окрашиваться солями хрома. 9. Заключение, или консервация срезов. На срез наносят каплю синтетической среды или канадского бальзама, а затем покрывают покровным стеклом. После высыхания бальзама препарат прозрачен, может быть подвергнут изучению под микроскопом, способен долго храниться и может использоваться как своеобразный документ. ОБРАБОТКА ОБЪЕКТОВ ДЛЯ ТРАНСМИССИОННОЙ ЭЛЕКТРОННОЙ МИКРОСКОПИИ Обработка гистологических объектов для трансмиссионной электронной микроскопии в принципе состоит из тех же этапов, что и описанная выше гистологическая техника: взятия материала, его фиксации, заливки, изготовления срезов и их окрашивания, или контрастирования. Эти этапы имеют свои особенности. Взятый материал не должен превышать размеры 2 мм (обычно берут кусочек органа кубической формы с длиной ребра 1 мм). Фиксируют полученный материал в некоторых альдегидах (глутаральде-гид) с дополнительной фиксацией (постфиксация) в растворе четырехоки-си осмия. При постфиксации происходит одновременное окрашивание структур. Заливка материала производится в синтетические (эпоксидные) смолы: аралдит, эпон и др. Изготовление ультратонких срезов толщиной 30—50 им осуществляется на приборе ультратоме при помощи специальных стеклянных или алмазных ножей. При этом вначале на ультратоме готовят полутонкие срезы, на которых (после их окраски) в световом микроскопе находят необходимые для изучения в электронном микроскопе участки. Далее производят "заточку" объекта — удаляют лишние его участки, оставляя необходимые. Затем готовят окончательные (ультратонкие) срезы. Окрашивание (оно называется контрастированием) осуществляют при помощи солей тяжелых металлов (урана, свинца, осмия и др.). Эти соли в разной степени связываются со структурами объекта, что обеспечивает различную электронную плотность (контрастность) последних. После окрашивания ультратонкие срезы помещают на металлическую сетку и затем изучают в электронном микроскопе. " Для изучения гистологического объекта в сканирующем электронном микроскопе его вначале подвергают фиксации, затем высушивают. Далее на поверхность объекта напыляют металлы, такие, например, как золото, с тем, чтобы они отражали пучок электронов. |