Материаловедение Методы исследования структуры металлов и сплавов
 Скачать 4.45 Mb. Скачать 4.45 Mb.
|
|
Материаловедение 1.Методы исследования структуры металлов и сплавов Определение атомного строения фаз стало возможным после открытия Лауэ (1912 г), показавшего, что атомы в кристалле регулярно заполняют пространство, образуя пространственную дифракционную решетку, и что рентгеновские лучи имеют волновую природу. Дифракция рентгеновских лучей на такой решетке дает возможность исследовать строение кристаллов. В последнее время для структурного анализа, кроме рентгеновских лучей, используют электроны и нейтроны. Соответствующие методы исследования называются электронографией и нейтронографией. Электронная оптика позволила усовершенствовать микроскопию. В настоящее время на электронных микроскопах полезное максимальное увеличение доведено до 100000 раз. 2. Атомно-кристаллическое строение металлов и сплавов Металлы – один из классов конструкционных материалов, характеризующийся определенным набором свойств: • «металлический блеск» (хорошая отражательная способность); • пластичность; • высокая теплопроводность; • высокая электропроводность. Данные свойства обусловлены особенностями строения металлов. Согласно теории металлического состояния, металл представляет собой вещество, состоящее из положительных ядер, вокруг которых по орбиталям вращаются электроны. На последнем уровне число электронов невелико и они слабо связаны с ядром. Эти электроны имеют возможность перемещаться по всему объему металла, т.е. принадлежать целой совокупности атомов. Все металлы, затвердевающие в нормальных условиях, представляют собой кристаллические вещества, то есть укладка атомов в них характеризуется определенным порядком – периодичностью, как по различным направлениям, так и по различным плоскостям. Этот порядок определяется понятием кристаллическая решетка. Элементарная ячейка – элемент объема из минимального числа атомов, многократным переносом которого в пространстве можно построить весь кристалл. Основными параметрами кристалла являются: • размеры ребер элементарной ячейки a, b, c – периоды решетки – расстояния между центрами ближайших атомов. • углы между осями ( ). • координационное число (К) указывает на число атомов, расположенных на ближайшем одинаковом расстоянии от любого атома в решетке. • базис решетки – это количество атомов, приходящихся на одну элементарную ячейку решетки. • плотность упаковки атомов в кристаллической решетке – объем, занятый атомами, которые условно рассматриваются как жесткие шары. Ее определяют как отношение объема, занятого атомами к объему ячейки (для объемно-центрированной кубической решетки – 0,68, для гранецентрированной кубической решетки – 0,74) (рис. 1.1). 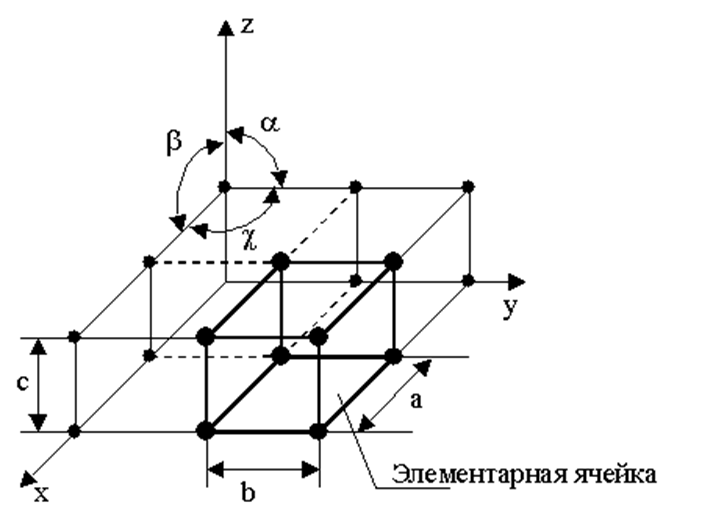 Рис.1.1. Схема кристаллической решетки Типы: a. Объемно-центрированная кубическая b. Гранецентрированная кубическая c. Гексогональная/гексогональная плотноупакованная Изотропия - одинаковость физических свойств во всех направлениях Анизотропия - зависимость свойств от направления Плоскость, проходящая через узлы кристаллической решетки, называется кристаллографической плоскостью. Прямая, проходящая через узлы кристаллической решетки, называется кристаллографическим направлением. Способность некоторых металлов существовать в различных кристаллических формах в зависимости от внешних условий (давление, температура) называется аллотропией или полиморфизмом. Превращение одной модификации в другую протекает при постоянной температуре и сопровождается тепловым эффектом. Видоизменения элемента обозначается буквами греческого алфавита в виде индекса у основного обозначения металла. Некоторые металлы намагничиваются под действием магнитного поля. После удаления магнитного поля они обладают остаточным магнетизмом. 3. Дефекты кристаллического строения. Классификация. Влияние плотности несовершенств кристаллов на механические свойства. Металлы и сплавы, полученные в обычных условиях, состоят из большого количества кристаллов-зерен. Они имеют неправильную форму и различно ориентированы в пространстве. Каждое зерно имеет свою ориентировку кристаллической решетки, отличную от ориентировки соседних зерен, вследствие чего свойства реальных металлов усредняются, и явления анизотропии не наблюдается. В кристаллической решетке реальных металлов имеются различные дефекты (несовершенства), которые нарушают связи между атомами и оказывают влияние на свойства металлов. Различают следующие структурные несовершенства: 1. точечные – малые во всех трех измерениях; 2. линейные – малые в двух измерениях и сколь угодно протяженные в третьем; 3. поверхностные – малые в одном измерении. 4. 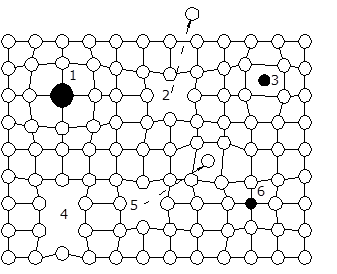 5. Рис.2.1. Схема точечных дефектов в кристалле: 1 – примесный атом 6. замещения; 2 – дефект Шоттки; 3 – примесный атом внедрения; 7. 4 – дивакансия; 5 – дефект Френкеля (вакансия или межузельный атом); 8. 6 – примесный атом замещения. Точечные дефекты вызывают незначительные искажения решетки, что может привести к изменению свойств тела (электропроводность, магнитные свойства), их наличие способствует процессам диффузии и протеканию фазовых превращений в твердом состоянии. Основными линейными дефектами являются дислокации. Дислокация – это дефекты кристаллического строения, представляющие собой линии, вдоль и вблизи которых нарушено характерное для кристалла правильное расположение атомных плоскостей. Виды: 1) Краевая дислокация - линия, вдоль которой обрывается внутри кристалла край “лишней“ полуплоскости. Неполная плоскость называется экстраплоскостью. 2) Винтовая дислокация Винтовая дислокация получена при помощи частичного сдвига по плоскости Q вокруг линии EF (рис. 2.4). 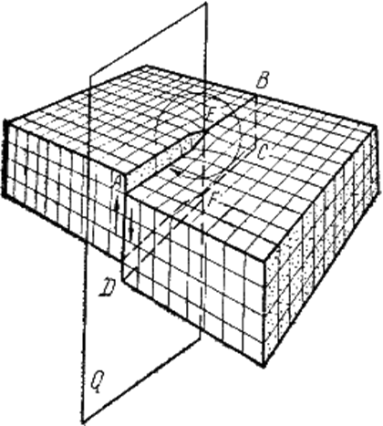 Рис. 2.4. Механизм образования винтовой дислокации На поверхности кристалла образуется ступенька, проходящая от точки Е до края кристалла. Такой частичный сдвиг нарушает параллельность атомных слоев, кристалл превращается в одну атомную плоскость, закрученную по винту в виде полого геликоида вокруг линии EF, которая представляет границу, отделяющую часть плоскости скольжения, где сдвиг уже произошел, от части, где сдвиг не начинался. Вдоль линии EF наблюдается макроскопический характер области несовершенства, в других направлениях ее размеры составляют несколько периодов. Плотность дислокаций в кристалле определяется как среднее число линий дислокаций, пересекающих внутри тела площадку площадью 1 м2, или как суммарная длина линий дислокаций в объеме 1 м3: , 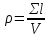 ( ( 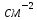 , , 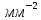 ) )Плотность дислокации в значительной мере определяет пластичность и прочность материала. Поверхностные дефекты – границы зерен, фрагментов и блоков 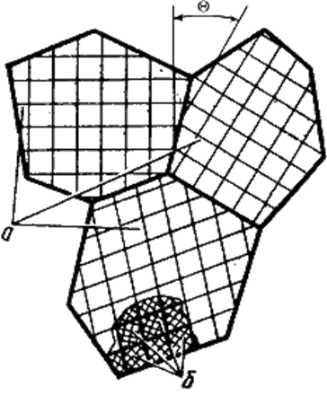 Рис. 2.6. Разориентация зерен и блоков в металле 4. Кривые охлаждения. Первичная и вторичная кристаллизация сплавов С изменением внешних условий свободная энергия изменяется по сложному закону различно для жидкого и кристаллического состояний. Характер изменения свободной энергии жидкого и твердого состояний с изменением температуры показан на рис. 3.1. 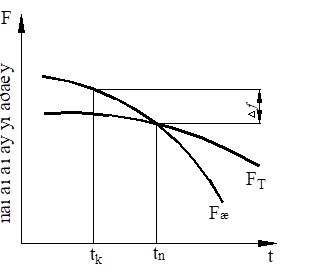 Рис.3.1. Изменение свободной энергии в зависимости от температуры В соответствии с этой схемой выше tп более устойчив жидкий металл, имеющий меньший запас свободной энергии. При температуре tп величины свободных энергий жидкого и твёрдого состояний равны. Температура tп соответствует равновесной температуре кристаллизации данного вещества, при которой обе фазы могут существовать одновременно и бесконечно долго. Для начала процесса кристаллизации необходимо, чтобы процесс был термодинамически выгоден системе и сопровождался уменьшением свободной энергии системы. Это возможно при охлаждении жидкости ниже температуры tп. Температура, при которой практически начинается кристаллизация называется фактической температурой кристаллизации (tk). Охлаждение жидкости ниже равновесной температуры кристаллизации называется переохлаждением, которое характеризуется степенью переохлаждения (Δt): Δt = tп – tк Кристаллизация – это процесс образования участков кристаллической решетки в жидкой фазе и рост кристаллов из образовавшихся центров. 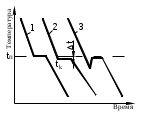 Рис.3.2. Кривая охлаждения чистого металла При соответствующем понижении температуры в жидком металле начинают образовываться кристаллики – центры кристаллизации или зародыши. Минимальный размер способного к росту зародыша называется критическим размером, а зародыш – устойчивым. Центры кристаллизации образуются в исходной фазе независимо друг от друга в случайных местах. Сначала кристаллы имеют правильную форму, но по мере столкновения и срастания с другими кристаллами форма нарушается. Рост продолжается в направлениях, где есть свободный доступ питающей среды. После окончания кристаллизации имеем поликристаллическое тело. Размеры образовавшихся кристаллов зависят от соотношения числа образовавшихся центров кристаллизации и скорости роста кристаллов при температуре кристаллизации. При равновесной температуре кристаллизации ТS число образовавшихся центров кристаллизации и скорость их роста равняются нулю, поэтому процесса кристаллизации не происходит. При небольшой степени переохлаждения образуется крупнозернистая структура. Если степень переохлаждения велика, то появится n2 центров кристаллизации. Т.к. n2 > n1 получится мелкозернистая структура. Кристаллизация сплавов подчиняется тем же закономерностям, что и кристаллизация чистых металлов. Необходимым условием является стремление системы в состояние с минимумом свободной энергии. Основным отличием является большая роль диффузионных процессов, между жидкостью и кристаллизующейся фазой. Эти процессы необходимы для перераспределения разнородных атомов, равномерно распределенных в жидкой фазе. В сплавах в твердых состояниях, имеют место процессы перекристаллизации, обусловленные аллотропическими превращениями компонентов сплава, распадом твердых растворов, выделением из твердых растворов вторичных фаз, когда растворимость компонентов в твердом состоянии меняется с изменением температуры. Эти превращения называют фазовыми превращениями в твердом состоянии. При перекристаллизации в твердом состоянии образуются центры кристаллизации и происходит их рост. Процессы кристаллизации сплавов изучаются по диаграммам состояния. 5. Диаграммы состояний сплавов I и II типов. Диаграмма состояния представляет собой графическое изображение состояния любого сплава изучаемой системы в зависимости от концентрации и температуры 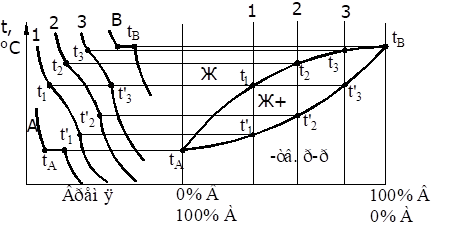 Рис. 4.5. Диаграмма состояния Диаграммы состояния показывают устойчивые состояния, т.е. состояния, которые при данных условиях обладают минимумом свободной энергии, и поэтому ее также называют диаграммой равновесия, так как она показывает, какие при данных условиях существуют равновесные фазы. Температуры, соответствующие фазовым превращениям, называют критическими точками. Некоторые критические точки имеют названия, например, точки отвечающие началу кристаллизации называют точками ликвидус, а концу кристаллизации – точками солидус. 1 тип: Сначала получают термические кривые. Полученные точки переносят на диаграмму, соединив точки начала кристаллизации сплавов и точки конца кристаллизации, получают диаграмму состояния. Проведем анализ диаграммы состояния. 1. Количество компонентов: К = 2 (компоненты А и В); 2. Число фаз: f = 3 (кристаллы компонента А, кристаллы компонента В, жидкая фаза). 3. Основные линии диаграммы: 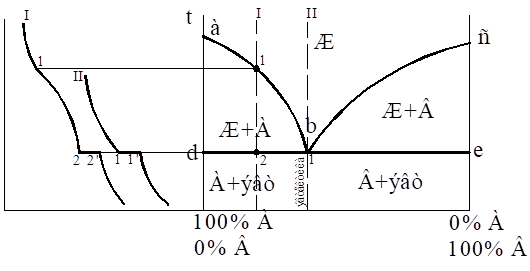 Рис.5.1. Диаграмма состояния и кривые охлаждения сплавов, образующих механические смеси из чистых компонентов • линия ликвидус abc, состоит из двух ветвей, сходящихся в одной точке; • линия солидус dbe, параллельна оси концентраций; 4. Типовые сплавы системы: а) чистые компоненты, которые кристаллизуются при постоянной температуре; б) эвтектический сплав – сплав, в котором происходит одновременная кристаллизация компонентов при постоянной и самой низкой для данной системы сплавов, температуре (сплав II). Кривая охлаждения этого сплава аналогична кривым охлаждения чистых металлов. Эвтектика – мелкодисперсная механическая смесь разнородных кристаллов, кристаллизующихся одновременно при постоянной, самой низкой для рассматриваемой системы, температуре. 2 тип: Оба компонента неограниченно растворимы в жидком и твёрдом состояниях и не образуют химических соединений. Диаграмма состояния и кривые охлаждения сплавов системы представлены на рис. 5.3. 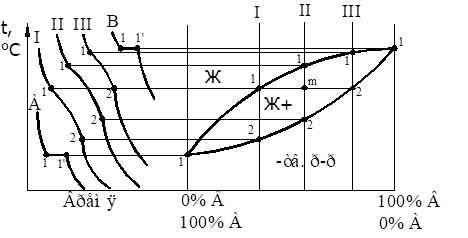 Рис. 5.3. Диаграмма состояния и кривые охлаждения сплавов, с неограниченной растворимостью в твёрдом состоянии Проведем анализ полученной диаграммы. 1. Количество компонентов: К = 2 (компоненты А и В). 2. Число фаз: f = 2 (жидкая фаза Ж, кристаллы твердого раствора α) 3. Основные линии диаграммы: • 1-1-1-1-1 – линия ликвидус, выше этой линии сплавы находятся в жидком состоянии; • 1-2-2-2-1 – линия солидус, ниже этой линии сплавы находятся в твердом состоянии. 4. Характерные сплавы системы: Чистые компоненты А и В, которые кристаллизуются при постоянной температуре. Остальные сплавы кристаллизуются аналогично сплаву I. 6. Ликвация сплавов. Виды. Меры борьбы с ней. Ликвация -- химическая и структурная неоднородность сплава в различных частях отливки. Ликвация может быть дендритной и зональной. Дендритная, или внутрикристаллическая, ликвация является следствием избирательного затвердевания сплава и недостатка времени для выравнивания химического состава кристаллов путем диффузии в процессе затвердевания. Дендритная ликвация, особенно в случае появления в структуре эвтектической составляющей, затрудняет последующую обработку давлением, так как снижается пластичность сплавов и, кроме того, ухудшает конечные механические свойства сплавов из-за неоднородности структуры. Дендритная ликвация тем заметнее, чем больше скорость затвердевания сплава в форме. Соответственно, ее предупреждению способствует уменьшение скорости затвердевания, например, путем подогрева форм со слитками и дальнейшим постепенным снижением температуры. Однако такой способ неэкономичен, так как требует значительного дополнительного расхода энергии, к тому же в ряде случаев он способствует развитию зональной ликвации. Поэтому, как правило, дендритная ликвация устраняется диффузионным отжигом отливок при высоких температурах и длительных выдержках. Зональная ликвация происходит в процессе затвердевания сплава при охлаждении вследствие расслоения сплава еще в жидком состоянии из-за различной плотности его компонентов образующиеся первичные кристаллы твердого раствора, если в его основе был более тяжелы металл (например, свинец), могут скапливаться внизу жидкой фазы и химический состав нижней части затвердевшего слитка может значительно отличаться от его верхнего слоя. Чтобы предупредить ликвацию по плотности, сплавы, склонные к ней, необходимо при затвердевании либо перемешивать, либо быстро охлаждать. Зональную ликвацию в уже затвердевшем слитке можно устранить лишь путем его повторного расплавления. 7.Диаграммы состояний сплавов III и IV типов 3 тип: Оба компонента неограниченно растворимы в жидком состоянии, ограниченно в твёрдом и не образуют химических соединений. В сплавах такого типа возможно существование: жидкой фазы, твёрдого раствора компонента В в А, который называется α-раствор, и твёрдого раствора компонента А в В, который обозначается β. В зависимости от того, какая реакция протекает в условиях существования трёх фаз, могут быть два вида диаграмм: диаграмма с эвтектикой (рис. 5.5) и диаграмма с перитектикой (рис. 5.6). Диаграмма с эвтектикой В этой системе не образуются фазы, представляющие собой чистые компоненты. Из жидкости могут выделяться только твёрдые растворы α или β. Следовательно, около вертикалей а и b, соответствующих чистым компонентам, находятся области существования твёрдых растворов α или β. Предельная растворимость компонента В в А определяется линией df, а предельная растворимость А в В – линией сg. 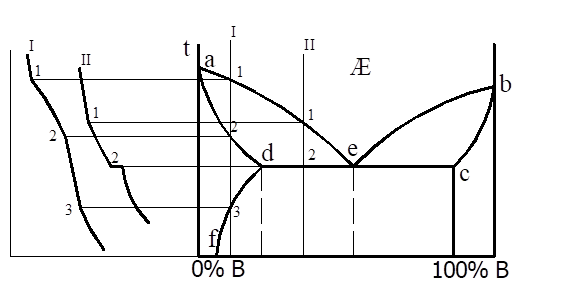 Рис. 5.5. Диаграмма с эвтектикой Сплавы, находящиеся между этими двумя линиями находятся за пределами растворимости и являются двухфазными, состоящими из α + β. Линия аеb является линией ликвидус, линия авсb – линией солидус. Диаграмма с перитектикой 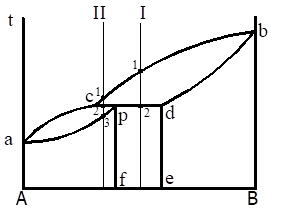 Рис. 5.6. Диаграмма с перитектикой При эвтектическом превращении жидкость кристаллизуется с образованием двух твёрдых фаз. Возможен и другой вариант, когда жидкость реагирует с ранее выпавшими кристаллами и образует новый вид кристаллов:  Такая реакция называется перитектической. 4 тип: Диаграмма состояния сложная, состоит из нескольких простых диаграмм. Число компонентов и количество диаграмм зависит от того, сколько химических соединений образуют основные компоненты системы.  Рис. 5.7. Диаграмма состояния сплавов, компоненты которых образуют химические соединения Число фаз и вид простых диаграмм определяются характером взаимодействия между компонентами. Эвт1 (кр. А + кр. AnBm); Эвт2 (кр. B + кр. AnBm). |
