Технические характеристики анодной печи
Процесс «Контимелт» используется в сочетании с Не�прерывным способом литья анодов и позволяет увеличить производительность по сравнению с обычными стационар�ными печами на 30% и в 1.8-2.6 раза повысить тепловой КПД агрегата.
Наряду с рассмотренными процессами, в укрупненно- лабораторном и п/промышленном масштабе испытаны близкие к режимам непрерывной технологии процессы вакуумной дистилляции , струйного рафинирова�ния.
Применение аналогичных процессов на отечественных предприятиях в условиях дефицита и непостоянства соста�ва сырья, отсутствия надежной технологии непрерывного конвертирования медных штейнов представляется преж�девременным. Увеличение производства анодной меди в этих условиях экономически целесообразно осуществлять на основе совершенствования существующих агрегатов периодического действия, при необходимости используя дополнительные единичные мощности.
Лекция 22. Электрохимические процессы при электролизе меди и поведение примесей
Вопрос. 1. Электродные процессы.
В основе электролитического рафинирования меди ле�жит процесс, при котором происходит растворение загряз�ненной (анодной) меди и осаждение чистой меди на катоде, а имеющиеся в анодной меди примеси распределяются меж�ду раствором и шламом. Данная электрохимическая систе�ма может быть представлена следующим образом:
+ Сuс примесями | СиSO4, Н2SO4, Н2O, ПАВ, Сu+| Сu -.
где ПАВ - поверхностно-активное вещество.
Рассмотрим сначала систему, в которую входят катод и анод из чистой меди и электролит, представляющий собой водный раствор сульфата меди и серной кислоты, гипоте�тически исключив вероятность образования ионов Сu+
+ Сu | СuSO4, Н2SO4, Н2O | Сu -.
Компоненты раствора дают при электролитической дис�социации следующие ионы:
СuSO4 ↔Сu2++ SO42-; (5.27)
Н2O ↔Н+ + ОН- (5.28)
Н2SO4 ↔Н+ + НSO4- ↔2Н+ + SO42- (5.29)
Тогда на электродах рассматриваемой системы возмож�ны электрохимические реакции:
на катоде: разряд ионов меди (II) с образованием металлической меди Сu2+ + 2е = Сu и разряд ионов гидроксония 2Н3O+ + 2е = Н2 + 2Н2O.
-на аноде: растворение меди Сu - 2е = Сu2+, разряд ионов гидроксила 2OН + +2е = Н2O + 1/2 O2 и разряд ионов SO42-.
Из всех возможных процессов желательными при элек�тролитическом получении меди являются процессы обра�зования металлической меди и ее растворение. Разряд ос- гальных ионов не только нарушает ход процесса, но и уве�личивает расход электроэнергии на электролиз.
При условии, что плотность тока близка к нулю, когда отсутствует любой вид электрохимической поляризации (концентрационная, химическая и др.), потенциал, при ко�тором начинается разряд какого-либо иона, зависит толь�ко от его природы и концентрации и от температуры элек�тролита в соответствии с уравнением Нернста:
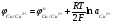 (5.30) (5.30)
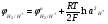 (5.31) (5.31)
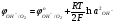 (5.32) (5.32)
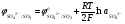 (5.33) (5.33)
Эти уравнения позволяют определить, в каком диапазо�не концентраций сульфата меди при заданной температуре можно вести процесс так, чтобы на электродах протекали только необходимые реакции. Так, совместный разряд ионов меди и гидроксония будет возможен, когда потенци�алы разряда медных и водородных ионов станут равными, т.е.
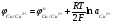 = =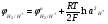 (5.34) (5.34)
Стандартные потенциалы водорода 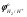 и меди и меди 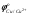 равны соответственно 0.000 и 0.344 В. Поскольку равны соответственно 0.000 и 0.344 В. Поскольку
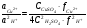 (5.35) (5.35)
где 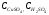 - концентрации сульфата меди и серной кислоты; - концентрации сульфата меди и серной кислоты; 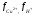 коэффициенты активности ионов Сu2+ и Н+, нижний предел концентрации сульфата меди равен коэффициенты активности ионов Сu2+ и Н+, нижний предел концентрации сульфата меди равен
 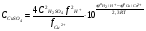 (5.36) (5.36)
Обычно при электролитическом получении меди кон�центрация серной кислоты составляет 1...2 моль/дм3; тогда нижний предел концентрации сульфата меди, согласно урав�нению (5.36) для 313 К очень мал: 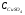 = 10-10 моль/дм3. Поэтому при плотностях тока, близких к нулю, при любых концентрациях сульфата меди на катоде будет протекать только разряд ионов меди. = 10-10 моль/дм3. Поэтому при плотностях тока, близких к нулю, при любых концентрациях сульфата меди на катоде будет протекать только разряд ионов меди.
Аналогично разряд ионов ОН совместно с анодным растворением меди возможен при условиях
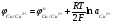 = =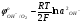 (5.37) (5.37)
Откуда
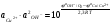 (5.38) (5.38)
При 523 К 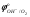 = 0,3976 В; в нейтральном растворе ( = 0,3976 В; в нейтральном растворе (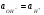 = =
=10-7моль/дм3) активность ионов меди, при которой начнется ее совместный разряд с ионами гидроксила, равна 1016 моль/дм3, т.е. во много раз превосходит растворимость сульфата меди в воде. Поскольку увеличе�ние активности ионов Н+ ведет к уменьшению активности ионов ОН- , в кислой среде верхний предел концентрации сульфата меди сместится в сторону еще больших значений. С другой стороны, растворимость сульфата меди в при�сутствии серной кислоты будет меньше, чем в воде, и тем меньше, чем больше концентрация серной кислоты.
Таким образом, при плотностях тока, близких к нулю (обратимые условия), на аноде из двух возможных процес�сов - растворения меди и разряда ионов гидроксила - все�гда (т.е. при любых концентрациях СuSO4) произойдет ра�створение меди. То же самое справедливо и для ионов SO42-, так как потенциал разряда их значительно более положи�телен, чем ионов ОН- (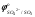
1-9 В).
Введение серной кислоты в раствор сужает (даже при обратимом процессе) пределы рабочих концентраций суль�фата меди. Верхний предел понижается за счет уменьшения растворимости сульфата меди, а нижний возрастает из-за опасности разряда ионов водорода на катоде. В практике электролиза применяют значительные плотности тока, т.е. работают в условиях необратимого процесса, связанного с возникновением электродной поляризации, которая допол�нительно ограничивает интервал рабочих концентраций сульфата меди. При конечных плотностях тока концентра�ции ионов меди у поверхности электродов будут иные, чем в объеме раствора.
Если ничто не препятствует процессам разряда ионов меди на катоде и растворению медного анода, то через определенное время, зависящее от концентрации сульфата
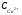
Рис. 1. Влияние плотности тока I на
изменение концентрации ионов Сu2+ в
межэлектродном пространстве
меди и силы тока, у катода концентрация меди достигнет достаточно малых значений, и на катоде станет возможен разряд ионов водорода. В этом случае у анода раствор будет перенасыщен сульфатом меди, и начнется его крис�таллизация.
Однако, как только у катода снижается концентрация ионов меди, начинается их диффузия к катоду из объема электролита. Обратные явления будут наблюдаться у ано�да. Следует отметить, что массоперенос в растворе элект�ролита осуществляется также миграцией (к противопо�ложно заряженному электроду) и конвекцией (перемеши�ванием). Скорость диффузии не зависит от плотности тока, но при ее увеличении возрастает скорость электрохими�ческих реакций и тем самым скорость изменения концент�рации ионов Сu2+ у электродов. Поэтому в конечном счете концентрация ионов меди у поверхности катода и анода зависит как от плотности тока, так и от скорости диффу�зии. Чем больше плотность тока, тем значительнее будет изменяться концентрация сульфата меди у электродов (рис.1).
Вопрос 2. Поведение примесей на аноде и катоде
По величине стандартного потенциала и характеру по�ведения примеси, содержащиеся в аноде, обычно делят на четыре основные группы (табл. 5.1):
-никель, железо, цинк, марганец, свинец, олово, ко�бальт и другие металлы, у которых стандартный потенци�ал более отрицателен, чем 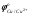 ; ;
мышьяк, сурьма, висмут - металлы, потенциал кото�рых близок к 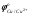 ; ;
золото, серебро, платиноиды, селен, теллур, у кото�рых потенциал положительнее, чем ; 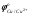 ; ;
химические и интерметаллические соединения меди, серебра и ряда других металлов (Сu2O, СuS, Сu2Sе, Сu2Те, Аs2Sе, Аs2Те, МеO∙Cu2O и им подобные), переходящие в основном в шлам.
В соответствии с общепринятыми представлениями о механизме электрохимического растворения анода в ра�створ в первую очередь переходят металлы, потенциал ра�створения которых более отрицателен, чем потенциал меди. Эти примеси накапливаются в электролите. Если по каким-либо причинам (например, неравномерное растворение анода) они и попадают в шлам, то затем химически растворя�ются в электролите с образованием сернокислых соедине�ний. Так как электроотрицательных примесей весьма не�много, первый слой анода быстро обедняется ими и на поверхности останутся в основном медь, электроположи�тельные металлы и нерастворимые примеси. Затем раство�ряется медь, будучи наиболее отрицательным из оставших�ся элементов. Таким образом, обнажается следующий слой анода, благодаря чему происходит непрерывное растворе�ние как меди, так и электроотрицательных примесей. При этом электроположительные примеси и электрохимически малоактивные вещества формируют отдельные нерастворенные островки, которые время от времени, теряя сцепле�ние с основой, осыпаются.
Однако необходимо отметить, что такой механизм ра�створения медных анодов иногда не согласуется с резуль�татами анализа их вещественного состава, в соответствии с которым большинство примесей присутствует в нем в виде твердых растворов в меди, и самостоятельной фазы, как правило, не образуют.
Железо при растворении медного анода переходит в раствор в виде ионов Fе2+, которые в процессе электролиза частично окисляются до Fе3+ в результате взаимодействия с кислородом воздуха, присутствующим в электролите
2FеSО4+0.5О2+Н2SО4 = Fе2(SO4)3+Н2O, (5.44)
что способствует растворению металлической меди как на аноде, так и на катоде и тем самым снижает катодный выход по току:
Сu + Fе2(SO4)3 = СuSO4 + 2FeSO4 (5.45)
На катоде возможна также реакция
Fе3+ - е = Fе2+, (5.46)
дополнительно снижающая выход меди по току.
Расчетные значения коэффициентов диффузии ионов Fе3+ и Сu2+, установленные применительно к условиям рафинировочного процесса с использованием метода вра�щающегося электрода, достаточно близки (соответственно 0,53∙10-9 и 1,4∙10-9 м2/с и поэтому концентрация ионов Fе3+ в электролите в значительной степени оказывает вли�яние на выход меди по току. Например, в электролите (со�став, г/дм3: Н2SO4 150, Сu 50) выход по току уменьшается на 1,0-1,5% при увеличении концентрации железа на 1 г/дм3; при электролизе разбавленных медьсодержащих растворов аналогичные потери тока составляют около 0,3 % на каж�дый 1 мг/ дм3 железа. Поэтому железо является крайне нежелательной примесью.
Совместный разряд ионов меди и железа в обычных условиях электролиза и концентрациях последнего невоз�можен. Частичный переход железа в катодный осадок обусловлен механическим включением его сернокислых солей и малорастворимых соединений. Известно, что у поверхности катода электролит подщелачивается и железо здесь находится в виде коллоидной взвеси гидроксида, кото�рая иногда, действуя подобно поверхностно-активной до�бавке, способствует образованию плотных мелкокристал�лических осадков меди. Осадки меди, полученные из раство�ров, содержащих ионы группы железа, отличаются эластич�ностью и высокодисперсной плотной структурой.
Никель из анода переходит в раствор и осложня�ет ведение процесса. Электрохимически он не осаждается на катоде, однако повышение концентрации никеля сверх 20 г/дм3 ухудшает качество катодного осадка, снижает технико-экономические показатели процесса. Высокая концентрация в растворе сульфата никеля уменьшает ра�створимость в нем сульфата меди, приводит к солевой пас�сивации анодов, повышает электросопротивление элект�ролита и увеличивает его вязкость, что способствует обра�зованию на катоде шишек и дендритов и вызывает ряд других отрицательных явлений. В особо чистом электролите (0.25 М СuSO4 и 0.1 М Н2SO4) уже при концентрации сульфата никеля 10-10 М увеличивается перенапряжение осаждения меди, а на кристаллах осадка появляются ямки травления. Влияние никеля на внешний вид медных като�дов сводится к тому, что в присутствии его небольших количеств (менее 14 г/дм3) выравнивается рельеф осадка и развивается его тонкая структура. При введении в элект�ролит никеля в количествах более 30 г/дм3 снижается ка�чество катодной поверхности: увеличивается амплитуда крупных неровностей и уменьшается шаг их следования.
При электролитическом рафинировании рядовых ано�дов в шлам переходит не более 10% никеля. Накап�ливание его в электролите не только усложняет техноло�гию рафинирования, увеличивая расход электроэнергии в среднем на 20% на каждые 10 г/дм3 никеля, но и увеличива�ет концентрацию сурьмы в электролите за счет образова�ния комплексных соединений. Примесь никеля в электро�лите снижает качество катодной меди, поскольку уменьша�ет долю миграции ионов меди к катоду в суммарной вели�чине массопереноса, уменьшает предельный ток разряда ионов меди и смещает зону образования переходных осад�ков в область более низких плотностей тока с соответству�ющим уменьшением зоны компактных осадков.
При исследовании влияния состава электролита и анода на растворение меди найдено, что в шламе не пассивирую�щихся образцов, наряду с медной основой, имеется метал�лическое серебро и отсутствует Cu2O.В шламе пассивиру�ющихся анодов, кроме этого, обнаружены соединения NiO, NiS, Сu2S, Си2O, Sb2O3, АsСuSе, СuС12∙2Н2O, АgС1, а также СuSO4 и NiSO4 с различной степенью гидратации. При этом максимальный ток в предпассивном состоянии при устано�вившейся скорости растворения уменьшается с увеличени�ем концентрации примесей, влияние которых убывает в ряду: Аs → Ni → РЬ.
С повышением концентрации кислорода в анодах боль�шая часть никеля переходит в шлам, где он присутствует в виде «слюдки» ЗСu2O∙4NiO∙Sb2O5, медно-никелевого арсената NiO ∙СuО ∙Аs2O3, а также NiO, NiSO4 и некоторых дру�гих соединений. При исследовании рафинирования кислородсодержащей анодной меди с концентрацией никеля 0,1-3,0% показано, что выход шлама и концентрация в нем меди увеличиваются при увеличении концентрации никеля. При растворении таких анодов на их поверх�ности образуются труднорастворимые пленки, обогащенные благородными металлами. Удерживаясь на поверхно�сти анодов, они вызывают неравномерное растворение или пассивацию последних; отслаиваясь и сползая с анодов, они могут быть причиной коротких замыканий.
Рис. 5.4. Зоны образования компактных осадков меди (заштрихованы)
в никельсодержащем электролите (концентрация Ni: 1-0.0; 2- 0.34)
В кислородсодержащей меди никель при концентрации 0.25-0.30% присутствует в виде твердого раствора. При медленном охлаждении анодов по границам зерен фазы Сu+Сu2O выделяется эвтектоидная фаза с концентрацией никеля 0,1% и кислорода 0,1%. В результате термообработ�ки таких анодов в аргоне (отжиг при 1273 К и 10-часовая выдержка при 733 К) фаза Си2O исчезает, а растворимость анодов увеличивалась до такой степени, что запассивировать их в обычных условиях электролиза не представля�ется возможным. При повышенной концентрации кис- лорода и никеля (более 0.3% и 0.6%, соответственно) увели�чивается количество эвтектоидной фазы и появляется от�дельная фаза N10, нерастворимая в электролите и полнос�тью переходящая в шлам. При дальнейшем увеличении концентрации кислорода никель в сплаве присутствует в основном в виде оксида, а электролиз сплава сопровож�дается значительным увеличением количества шлама. В этом случае никелевой слюдки в аноде не обнаруживается. Анализом электрохимических реакций анодного ра�створения сплава Сu-Ni-O и исследованием кинетики анод�ных процессов, выполненных на промышленных образ�цах никельсодержащей меди, установлено, что с увеличе�нием концентрации кислорода в анодной меди, содержа�щей никель как основную примесь, увеличивается степень перехода никеля в шлам, которая может составить 30% и более.
Таким образом, склонность медного анода к пассивации и количество шлама на его поверхности увеличиваются с увеличением концентрации в нем и никеля, и кислорода.
На основании этих данных предложен механизм пере�хода никеля из анода в шлам за счет интеркристалличе�ской коррозии зерен меди на межфазной границе и выкра�шивания частиц с повышенным содержанием никеля. Ко�личество никеля в шламе прямо зависит от концентрации никеля и кислорода в аноде. Поэтому глубина раскис�ления меди при огневом рафинировании оказывает значи�тельное влияние на технико-экономические показатели элек�трохимического рафинирования меди, что, прежде всего, связано с отрицательным влиянием примеси кислорода в анодном металле, особенно в присутствии никеля, мышья�ка и сурьмы.
Олово переходит в раствор в виде ионов Sn2+, а затем окисляется до Sn4+, что также приводит к дополнительно�му расходу электрического тока. Образующийся сульфат SnSO4 легко гидролизуется с образованием основных ма�лорастворимых солей, переходящих в состав шлама.
Свинец, переходя в раствор, образует малорастворимую соль РbSO4, выпадающую в осадок. При изучении поведе�ния свинца в условиях растворения медного анода в зави�симости от концентрации примесей и кислорода в аноде и серной кислоты в электролите установлено, что он образу�ет на аноде гранулы при его концентрациях в аноде < 0,5%. При более высоких концентрациях возникает ячеистая сетевидная структура медной матрицы. Зависимости потен�циала анода от времени имеют прерывистый, ступенчатый характер, определяющийся периодическим самопроизволь�ным отделением шлама от поверхности анода в течение электролиза. Образуется слипающийся шлам, который имеет темно-коричневый цвет и состоит в основном из суль�фата свинца и медного порошка; соотношение этих компо�нентов в шламе возрастает в пределах 50-80% с увеличени�ем содержания свинца в аноде. Характерно, что РbSO4 от�лагается вокруг нерастворенного металлического свинца. При электролизе анода, содержащего Аs, Рb и О, образу�ется шлам, в основном состоящий из РbSO4 и Си3Аs со следами Аs2O3, РbО и нерастворенного свинца.
Накопление примесей первой группы в электролите, особенно при плотностях тока выше 220 А/м2 и недоста�точной циркуляции электролита, создает условия для со�вместного их разряда с медью и загрязнения катодного осадка этими металлами. Увеличение концентрации при�месей (Fе2+, Fе3+, Мn2+, Ni2+, Со2+ в форме соответствую�щих сульфатов) в сульфатном электролите (Сu2+ 40 г/дм3, Н2SO4 150 г/дм3) повышает плотность и вязкость электро�лита и понижает его электропроводность, а следовательно увеличивает энергозатраты, понижает величину предельно допустимого тока и коэффициент массопереноса. Примеси влияют также на электрокристаллизацию меди на катоде: методом дифракции рентгеновских лучей и сканирующей электронной микроскопии показано, что наличие приме�сей стимулирует развитие пирамидальной и планарной структуры катодного осадка.
Цинк, даже при высоких концентрациях в электролите, не оказывает заметного влияния на электроосаждение меди, поскольку имеет, по сравнению с последней, значительно более отрицательный потенциал и из растворов простых солей совместно с медью разряжаться не может.
Увеличение концентрации сульфатов никеля, железа и цинка в электролите уменьшает его электропроводность. Кроме того, эти сульфаты, участвуя в переносе тока, созда�ют неблагоприятные условия для разряда ионов меди: ионы примесей накапливаются в прикатодном слое, чем умень�шают ее концентрацию у катода и затрудняют доставку в него ионов меди. Загрязнение катодного осадка примесями первой груп�пы, сульфаты которых растворимы в электролите (цинк, железо, никель), связано с окклюзией - захватом электро�лита растущим осадком, что подтверждается взаимосвя�зью концентраций этих примесей в катодах и в растворе. Действенным приемом очистки катодов от таких примесей является промывка катодов, наиболее эффективная при использовании ультразвука, обеспечивающего удаление примесей из микропор, по размеру сопоставимых с длиной волны ультразвука.
При выявлении причин загрязнения катодного осадка меди даже малорастворимыми в электролите примесями следует учитывать отмеченное выше различие состава раствора в диффузионном слое у поверхности катода (рас�четная толщина слоя - около 0,15 мм) и в объеме электро�лита; диффузия катионов в этот слой приводит к превыше�нию в нем предела растворимости солей с последующей кристаллизацией: сульфатов (свинца), арсенатов и антимонатов (цинка) и др.
Наибольшую опасность загрязнения катодного металла вызывают примеси мышьяка, сурьмы и висмута, потенци�ал разряда которых близок к стандартному равновесному потенциалу меди. Накопление этих примесей в электроли�те увеличивает вероятность попадания их в катодный оса�док. Даже небольшое содержание этих металлов в катод�ном осадке существенно снижает его электропроводность. Присутствие же висмута резко ухудшает механические свой�ства меди.
Для уменьшения вероятности совместного разряда с медью этих примесей применяют следующие приемы:
-регенерацию электролита, в процессе которой ра�створы подвергают очистке и часть растворов выводят из технологического цикла, во избежание превышения допус�тимой концентрации примесей;
-увеличение концентрации серной кислоты в электро�лите, вызывающее заметное понижение концентрации в нем ионов Sb3+ и Вi+;
-добавление в состав электролита ионов хлора, умень�шающих концентрацию ионов Аs3+;
-увеличение скорости циркуляции электролита, пре�дотвращающее уменьшение концентрации ионов меди в прикатодном слое.
В наиболее распространенных промышленных услови�ях электролитического рафинирования меди (35 г/дм3 Сu, 180 г/дм3 Н2SO4, 333 К и 230 А/м2 ) как металлический, так и окисленный мышьяк, содержащийся в аноде, растворя�ется в электролите в форме Аs3+ и далее окисляется кисло�родом воздуха до Аs5+. При высоком содержании мышьяка в аноде происходит обогащение электролита медью и обед�нение кислотой. Благодаря большому сродству мышьяка к кислороду, находящемуся в аноде, происходит усиленное зашламление последнего. Сурьма обладает меньшим, чем мышьяк, сродством к кислороду, поэтому в меньшей степе�ни влияет на зашламление анода и почти полностью пере�ходит в раствор.
Влияние висмута и кислорода на растворение медного анода и образование шлама было изучено в лабораторных условиях. Анод был выплавлен из электролитической меди с добавками металлического висмута и Си2O в каче�стве примесей (концентрация, %: Вi 0.4-4.2; О 0,0145-0,282). В аноде висмут находился в виде отдельных включений по границам зерен меди или в самих зернах. Электролиз (со�став электролита, г/дм3: Сu 40, Н2SO4 180, клей 1) проводи�ли при температуре 323 К. Шлам, образующийся в процессе электролиза, в основном концентрировался на дне ячей�ки (порошкообразная медь, упавшая с анода), хотя не�большое количество его обнаружено и на аноде (порош�кообразные медь и В12(SO4)3, содержащие Вi2O3). Раство�ренный в электролите висмут осаждался из насыщенного раствора в виде сульфата за счет взаимодействия ионов Вi3+ и SO42-. Увеличение плотности тока, концентрации кислорода и ионов Вi3+ в электролите ускоряло процесс образования Вi2(SO4)3 и соответственно приводило к пас�сивации анода. Сопутствующие висмуту примеси - Sb и Аs - образовали соединения Сu3Аs, Sb2O3, ВiАs04 и SbАsO4.
Мышьяк, сурьма и висмут при растворении анода час�тично переходят в раствор, а частично - в шлам. Распреде�ление между раствором и шламом чаще всего составляет: мышьяка 7:3, сурьмы - 4:6, висмута - 2:8. Таким образом, эти три элемента существуют как в форме твердых частиц, так и в виде растворенных соединений. Твердые частицы оксидов и основных солей, получающихся при гидролизе, могут образовать хорошо сформированные кристаллы, оседающие на дно ванны. Иногда они присутствуют в виде мелкодисперсных частиц, размеры которых близки к кол�лоидным; в растворе они находятся в форме взвесей и со�здают плавучие шламы. Время пребывания частиц шлама во взвешенном состоянии зависит от размера и природы частиц, от плотности электролита, скорости его циркуляции и ряда других факторов.
Вопрос 3. Плавучие шламы. Плавучие шламы, являющиеся продуктом вторичных процессов (образования малорастворимых соединений), значительно ухудшают качество катодного осадка, посколь�ку они легко ассимилируются растущим осадком и обыч�но являются центрами образования дендритов и шишек. Присутствие металлической меди в плавучем шла�ме связано с образованием гидрофобных микрочастиц ме�таллической меди в результате диспропорционирования соединений меди (I). Процесс включения частиц шлама в катодный осадок состоит из следующих стадий: подхода частиц к катодной поверхности, закрепления частицы на этой поверхности, зарастания частицы. Электрорафиниро�вание меди в присутствии плавучего шлама сопровождает�ся увеличением безвозвратных потерь благородных метал�лов. Частицы шлама проводят электрический ток и поэтому, при попадании их на поверхность катода, медь на�растает и по их поверхности, а это увеличивает шерохова�тость осадка. Такой осадок всегда богаче благородными металлами и примесями, чем ровный осадок; например, концентрация золота в шишках более чем в 300 раз превы�шает таковую в рядовом катоде.
Формирование плавучих шламов связывают не только с труднорастворимыми соединениями сурьмы и мышьяка, но и с пассивацией анодов; с увеличением вязкости элект�ролита при его охлаждении или повышении в нем концен�трации сульфатной группы; с повышением содержания тиомочевины; с попаданием смазочных масел в электро�лит, вызывающих флотацию частиц тонкодисперсного шлама. Устранение этих причин и является средством борь�бы с возникновением плавучих шламов.
Примеси третьей группы, не растворяющиеся анодно (более электроположительные, чем медь, металлы: Аu, Аg, Sе, Те, Рt и платиноиды) переходят в шлам. В случае недо�статка халькогенов, золото и серебро, находящиеся в ано�де в виде твердых растворов, выделяются в элементном виде. При избытке халькогенов, в основном селена, проис�ходит выделение элементных халькогенов, а также происхо�дит увеличение доли диселенидов, образование селенида свинца, вторичного селенида меди. Эти компоненты вместе с другими нерастворимыми соединениями и составляют ос�нову шлама. Установлено, что в них большая часть золота входит в медную матрицу, образуя твердый раствор на основе меди. Более 95% серебра также входит в медную матрицу, остальная его часть в основном ассоциирована с СuSе. В процессе электролиза они освобождаются из мед�ной матрицы и образуют самостоятельную фазу: на поверх�ности селенида начинается рост сфероидальных золотых частиц размером менее 1 мкм.
Оксидные матричные фазы могут содержать более 22% Аs. В процессе электролиза серебро растворяется, но боль�шая часть растворенного серебра затем быстро удаляется из раствора, образуя труднорастворимые осадки. В анод�ных шламах обнаружены сложные комплексы, содержащие около 12% Аи (ориентировочная формула Аu(Аg,Сu)6Sе5). Серебро также реагирует с выделившимися из анода час�тицами Си2(Sе,Те), образуя АgСuSе и Аg2Sе. Реакции проте�кают достаточно быстро; около 50% серебра реагирует за первые 5 ч. По отношению Аg/(Sе+Те) в медных анодах мож�но судить о содержании селенидов в анодном шламе.
Поведение серебра при электролизе меди было изучено на шести промышленных образцах медных анодов (состав, %: Сu 98,8-99,4; Аg 0,019-0,14; Рb 0,003-0,13; Ni 0,06-0,31, примеси Вi, Sb, Аs, Sе и Те). Переменные параметры: темпе�ратура 333, 338 и 343 К, плотность тока 280, 350 и 420 А/м2. Состав электролита, г/дм3: Сu 42±2; Н2SO4 160±5, добавки (в г на 1 т Сu): тиомочевина 60, клей 100; скорость подачи электролита 30 дм3/час. Электролизер (вместимость 15,5 дм3) был снабжен разделительной диафрагмой и устройством для периодического удаления образующихся шламов. По�казано, что при анодном растворении меди определенное количество серебра находится в растворе в коллоидной форме при концентрации, значительно превышающей рав�новесную, причем на анодное поведение серебра оказыва�ют влияние примеси, содержащиеся в исходных анодах (Sе, Аs). Рассчитана энергия активации исследуемого процесса, равная для различных образцов анодов 50-116 кДж/моль. Отдельные металлы платиновой группы при электрорафинировании меди ведут себя по-разному. Всего 1-5% платины и палладия переходят из анодов в электролит, остальное - в шлам; родий, рутений и осмий растворяются в электролите в виде комплексных ионов, частично разря�жающихся на катоде; иридий хорошо растворяется в элек�тролите в составе стабильных комплексных ионов, кото�рые на катоде не разряжаются. При типичных условиях промышленного электролиза (состав электролита, г/дм3: Н2SO4 140-190, Сu 40-45, температура 328-333 К) извлече�ние в электролит составило, %: Iг> >(80) > Ru (64,5) > Os (56) > Рt (2) > Рd (0). Извлечение в шлам, %: Рt (94) = Рd(94) > Rh (44) > Os (31) >Ru (25) > Iг (17). Плотность тока в пределах 200-400 А/м2 не влияет на эти порядки расположения ме�таллов. Применение реверсивного тока повышает извлече�ние в электролит платины, палладия и родия (до 10-15%) и их концентрацию в катодной меди (до 3,5%), но не влияет на иридий и рутений из-за стабильности их комплексных ионов. В ходе электролитического обезмеживания отрабо�танного электролита все металлы платиновой группы про�являют тенденцию к переходу в катодную медь.
При изучении влияния селена и кислорода на поведение медных анодов при электролизе в исходном аноде обнару�жены сфероидальные и эллипсоидальные частицы Сu2Sе, покрытые пленкой из смеси Сu2Sе и Си2O. При электроли�зе частицы Си2Sе не растворяются, а образуют шламовую корку на аноде. Корка не образуется при плотностях тока <2 А/дм2 и появляется при плотностях тока свыше 3 А/дм2, причем при электролизе происходит удаление меди из корки с образованием при соответствующих анодных потенциалах фаз определенных составов: Сu2Sе (100 мВ), Сu3Sе2 (440 мВ) и СuSе (740 мВ). При повышенных темпе�ратурах из пленки Сu2Sе-Сu2O выделяется самостоятель�ная фаза Си2O. Шламовые корки, образующиеся на аноде при повышенных температурах, прочно связаны с основой и приводят к пассивации медного анода, а следовательно, и к ухудшению технологических параметров процесса.
Благородные металлы частично попадают в катодный осадок (например, содержание золота достигает 0.1-1 г/т). Это в основном результат механического захвата шлама развитой поверхностью катода и поэтому переход благо родных металлов в катоды увеличивается с повышением плотности тока, уменьшением расстояния между электро�дами и чрезмерным увеличением скорости циркуляции элек�тролита. В промышленных условиях неоднократно отме�чалась прямая зависимость заработки серебра в катодный осадок от содержания шламовых взвесей в электролите.
Явление механического захвата растущим медным (или никелевым) катодным осадком твердых частиц - алмазно�го порошка АСМ крупностью (5-20)-106 м - использовано в технологии упрочнения инструмента для обработки сверх�твердых материалов. Композиционное покрытие осажда�лось на горизонтально расположенный катод из бронзы БРОФ 6.5-0.15 площадью25∙10-6 м2. Электроосаждение про�водилось из электролита никелирования Уоотса и кислого электролита меднения. Бронзовые образцы предваритель�но покрывались никелем или медью в течение 10 мин. Элек�троосаждение проводилось без перемешивания после од�нократного взмучивания и оседания алмазного порошка на катод. После снятия поляризационной кривой незак�репленный алмазный порошок смывался с катода и с помо�щью микроскопа ОРИМ-1 определялась поверхностная концентрация порошка в покрытии. Разработанная на ос�новании проведенных исследований технология позволяет получить монослойные и многослойные покрытия с требу�емой поверхностной концентрацией алмазного порошка в пределах от 5 до 60%.
Небольшое количество серебра в виде Аg2SO4 (до 10-3 г/дм3) переходит в раствор. На модельных анодах, содержащих 0,3-1,0% Аg, изучено влияние ряда парамет�ров электролиза на содержание серебра в катодной меди (температура, концентрация серебра в исходных анодах, скорость циркуляции электролита и др.). Наибольший эф�фект на исследуемый процесс оказывает температура 1 для минимизации концентрации серебра в катодном осадке тем�пература электролита должна быть не выше 318 К. В этом случае катодная медь содержит 0,3∙10-3Аg. В то же время изменение скорости циркуляции электролита от 3,0 до 9,0 дм3/час практически не оказывало влияния на катодное соосаждение серебра.
Неметаллические примеси (Сu2O, Си2Sе, СuS, Сu2Те, NiO, ZnО, SnО и др.) также в основном переходят в шлам. В процессе рафинирования селениды и теллуриды меди превращаются в селениды и теллуриды благородных ме�таллов: АuТе2, АgТе, Аg2Sе, СuАgSе. Оксид меди Си2O, находясь уже в составе шлама, частично растворяется в электролите, тем самым обогащая его медью и увеличивая расход серной кислоты, а частично распадается с образо�ванием более устойчивого при низких температурах окси�да СuО. В обоих случаях вследствие диспропорционирования соединений меди (I) образуется порошкообразная ме�таллическая медь, переходящая в шлам, в т.ч. - взвешен�ный в электролите.
Катодная медь чистотой 99,999% была получена из чер�новой меди электролизом с применением диафрагмы, уменьшающей механический захват частиц шлама расту�щим осадком. В диафрагму с воздухопроницаемостью 0,5-6,0 см3/(с∙см2), окружающую катод, подавали электролит, содержащий сульфат меди и серную кислоту, а также вяжущее вещество из расчета 5-20 г на 1 т электролитической меди. Электролиз вели при температуре 303-323 К и плот�ности тока на катоде 50-150 А/дм2.
Электролит непрерыв�но выводили из электролизера и фильтровали для удале�ния твердых примесей, а затем возвращали внутрь диаф�рагмы.
Вопрос 4. Образование медеэлектролитного шлама
В зависимости от состава анода и условий ведения про�цесса на его поверхности образуется шлам с различными физико-химическими свойствами. Так, повышение темпе�ратуры способствует образованию рыхлого слоя шлама, а понижение температуры приводит к получению плотной, вязкой, трудно отделяемой пленки. Увеличение содержа�ния серебра в анодной меди вызывает измельчение и, сле�довательно, уплотнение анодного шлама. Свинец и мышь�як, содержащиеся в анодной меди, способствуют образова�нию более тяжелых и быстро оседающих шламов, в кото�рых количество легко взмучиваемого селенида серебра уменьшается, а серебра, связанного в двойной и тройной селенид меди, а также свинца и мышьяка - увеличивается. Дисперсность, химический состав и количество образую�щегося шлама зависят также от применяемых ПАВ. Сред�ний размер частиц шлама 35-50 мкм. Осевший на аноде шлам создает дополнительное сопро�тивление току, замедляет диффузию и этим увеличивает анодный потенциал. Сопротивление шлама в зависимости от продолжительности растворения анодов и регулярно�сти их чистки составляет от 0,1 до 21,4% от общего сопро�тивления ванны. Анодная пленка шлама значительно уплотняется, когда в анодах повышено содержание свинца (0,24-0,5%), который переходит при ионизации анодного металла в труднорастворимый сульфат, накапливается на поверхности электрода, блокирует ее и увеличивает реаль�ную плотность тока. В этом случае дальнейшее окисление свинца до оксида (IV) приводит к пассивации анода и даже делает возможным выделение на нем кислорода.
Иной состав и природа шлама, оседаю�щего на дно ванны.
В анодных шламах рафинирования меди наблюдается наличие значительного количества сферических частиц, имеющих неоднородный состав, которые фор�мируются в период огневого рафинирования меди. Объек�том исследования был шлам (состав, %: Сu 23.7, S 14.4, Sе 4,2, Те 0,48, Аg 0,96, Sb 2,2) рафинирования анодов, содер�жащих около 0,5% примесей (Аs, Sb, Вi, О, S, Sе, Те, Zn, Рb, Ni, Fе, Аg, Аu). Поверхность анодов в некоторых местах покрыта шламовыми частицами, плотно внедренными в медную матрицу, в т. ч. и сферической формы. Их состав, %: 54,3 Сu, 2,5 Аg, 37,2 Sе, 1,43 Те, 3,29 S, 1,17 О. В анодном шламе сферические частицы сохраняются и содержат в за�висимости от места анализа, %: Сu 3,8-31,7, Аg 3,75-13,76, Sе 0,31-19,6, Те 0,96-1,99, S 1,4-27,8, О 47,5-52,7 и др. Напри�мер, в сферических частицах в меди на поверхности анодов содержится 2,54% Аg, в шламе – 10,2%. Сфериче�ские частицы шлама являются «наследниками» образую�щихся частиц при огневом рафинировании меди. Состав и структуру шламов многократно изучали с применением микроскопиче�ских, рентгеноструктурных исследований и химическим ана�лизом. Образование сфероидальных частиц шлама в про�цессе огневого рафинирования черновой меди связано с существованием областей несмешиваемости расплавов на диаграммах состояния «медь-примеси». Эти частицы ха�рактеризуются гетерогенным химическим составом: примеси О, S, Sе и Fе концентрируются во внешней оболочке частиц, поскольку они образуют интерметаллические со�единения с медью, температура затвердевания которых выше температуры плавления меди, и оболочка затверде�вает раньше, чем ядро частицы. В процессе электролити�ческого рафинирования меди примеси в значительной сте�пени окисляются. Ядра некоторых частиц, содержащих смесь Сu-Аg-0, растворяются в ходе электролитического рафинирования, и частицы шлама остаются полыми. Ядра частиц, содержащих смесь Рb-S-О, при рафинировании не растворяются.
В лабораторных условиях процесс образования анодно�го шлама при электролитическом рафинировании меди изу�чен с регистрацией результатов с применением лазерного облучения и видеокамеры. Осыпание шлама с анода и его движение в электролите фиксировали в зависимости от потенциала анода, силы тока и времени для анодов с раз�личным содержанием примесей. Показано, что при высо�ком содержании серебра и плотности тока, а также низкой температуре электролита пассивация анода наступает быс�трее. В связи с этим рост потенциала и его колебания про�исходили более интенсивно при осыпании шлама. При низком содержании серебра в аноде даже при комнатной температуре пассивации не обнаружено до 40 ч. ведения процесса. Рекомендовано не применять плотность тока более 100-150 мА/см2 в отсутствие интенсивной принуди�тельной циркуляции электролита.
В результате исследования электрорафинирования меди и сплавов системы «медь-кислород» и шламообразования на аноде даны рекомендации по снижению потерь меди со шламом. Опыты проводили в ячейке с 1 анодом и 2 катода�ми с рабочей поверхностью 96 и 120 см2, соответственно (межэлектродное расстояние 2 см; содержание в электро�лите, г/дм3: Сu 35, Н2SO4 180; объем электролита 1,8 дм3; скорость циркуляции 0,9 дм3/час; температура 333 К; плот�ность тока 235 А/м2; длительность опыта - до 4 суток). Перед опытом электролит продували азотом в течение 15 час при 353 К для удаления растворенного кислорода. Показано, что чем чище электролит и компактнее структу�ра анода, тем равномернее происходит растворение анода и тем меньше меди осыпается в шлам. Добавки костного клея в электролит приводят к блокировке растворяющихся дендритов и увеличению количества шлама. Аналогично влияет и обескислороживание электролита, т. к. в отсут�ствие кислорода содержащийся в аноде оксид меди (I) ра�створяется только электрохимически.
Установлено, что примеси в медных анодах находятся как в твердом растворе металли�ческой медной матрицы, так и в отдельных включениях на границах зерен меди. В процессе рафинирования все при�меси претерпевают химические и морфологические изме�нения, что существенно влияет на пассивирование анодов, качество катодов, очистку электролита и извлечение промпродуктов из анодных шламов.
Минералогическими исследованиями поведения приме�сей в процессе рафинирования меди с анодами и анодными шламами на всех стадиях процесса выяснены трансформа�ции, происходящие с ними в результате химических про�цессов, проходящие на границе фаз «анод-электролит». Об�щее содержание примесей в медных анодах, включая кис�лород, как правило, составляет менее 1%. Исследование матриц анодов с помощью электронного микроскопа по�казало наличие ряда элементов в твердом растворе: Ni, Аg, Рb, Аs, Sb, Вi Использование вторичной ионной масс-спектрометрии и микропротонного индуктированного рентгеноизлучения позволило определить наличие золота в твер�дом растворе медной матрицы. Проведен анализ включе�ний различных фаз в аноде: Сu2O, встречающейся в аноде в наибольшем объеме; Сu2(Sе,Те) и др. В анодных шламах изучали селенидную фазу, серебросодержащие фазы, а так�же фазы, содержащие Рb, Ni, Те, Аu и другие.
Анодные шламы после рафинирования меди в основном |
 Скачать 14.69 Mb.
Скачать 14.69 Mb.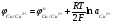 (5.30)
(5.30)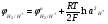 (5.31)
(5.31)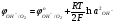 (5.32)
(5.32)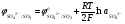 (5.33)
(5.33)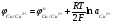 =
=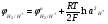 (5.34)
(5.34)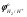 и меди
и меди 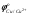 равны соответственно 0.000 и 0.344 В. Поскольку
равны соответственно 0.000 и 0.344 В. Поскольку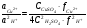 (5.35)
(5.35)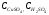 - концентрации сульфата меди и серной кислоты;
- концентрации сульфата меди и серной кислоты; 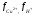 коэффициенты активности ионов Сu2+ и Н+, нижний предел концентрации сульфата меди равен
коэффициенты активности ионов Сu2+ и Н+, нижний предел концентрации сульфата меди равен
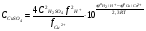 (5.36)
(5.36)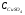 = 10-10 моль/дм3. Поэтому при плотностях тока, близких к нулю, при любых концентрациях сульфата меди на катоде будет протекать только разряд ионов меди.
= 10-10 моль/дм3. Поэтому при плотностях тока, близких к нулю, при любых концентрациях сульфата меди на катоде будет протекать только разряд ионов меди.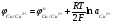 =
=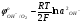 (5.37)
(5.37)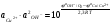 (5.38)
(5.38)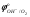 = 0,3976 В; в нейтральном растворе (
= 0,3976 В; в нейтральном растворе (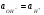 =
=
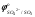
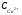
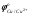 ;
;