тест по химии высокой сложности. тест. Методическая разработка по химии Композиция тестовых заданий на уроках химии
 Скачать 0.6 Mb. Скачать 0.6 Mb.
|
|
Глава 3. Композиция тестовых заданий по химии для 9 и 11 классов. В данной главе представлены проверочные тесты по химии для 9 и 11 классов средних общеобразовательных школ. Тесты даются в нескольких вариантах- 10 тестов для 9 класса по темам: Теория электролитической диссоциации. Реакции ионного обмена. Гидролиз солей. Подгруппа кислорода. Скорость химических реакций. Химическое равновесие. Азот и его соединения. Для 11 класса – 3 теста по следующим темам: 1) Амины. 2) Аминокислоты. Белки. Виды изомерии. .Последовательность материала дана в соответствии с действующей программой по учебнику химии для 9, 11 классов Г. Е. Рудзитиса, Ф. Г. Фельдмана и. Однако учителя, работающие по другим учебным пособиям, сделав необходимые корректировки, также могут использовать данные тесты, что и делается сейчаса при пе6реходе на программу и учебники О.С.Габриэляна. Предлагаемые тесты составлялись в соответствии с федеральными образовательными требованиями к уровню подготовки учащихся общеобразовательных школ. В тесты включались задания, которые позволяют выявить навыки практического использования химических знаний, владения основными понятиями школьного курса химии. Разработанные тесты могут использоваться учащимися для обобщения, закрепления и проверки своих знаний. Они могут применяться как для тематического, так и для текущего контроля, в ходе подготовки к контрольным работам и экзаменам. У каждого из предложенных тестов имеются цели тестирования. В целях указаны основные вопросы учебного материала, усвоение которых должно быть проверено с помощью разработанного теста. В соответствии с целями тестирования мы выработали определённую содержательную структуру теста. В структуре отразили дидактический уровень тестовых заданий. Все тесты содержат базовые задания, которые при нормальном уровне преподавания должны выполнятся основной массой учащихся. С помощью этих заданий проверяют усвоение тех знаний и умений, которые необходимы для успешного продолжения обучения на следующей образовательной ступени. Наряду с базовыми заданиями некоторые тесты содержат задания повышенного уровня сложности, ориентированные на учащихся отличного знания материала. К каждому из разработанных тестов составлен план, в котором приводится перечень контролируемых элементов знаний с указанием номеров заданий, к которым они относятся. При использовании приведённых здесь тестов эти планы позволяют определить, какие именно знания усвоены недостаточно или хорошо в зависимости от результатов выполнения соответствующих заданий. Каждое задание содержит инструкцию, позволяющую тестируемому ясно понимать, что от него требуется. Инструкция у одних тестов включена в текст заданий, у других вынесена в отдельную строку и относится ко всему тесту. При разработке тестов были использованы тестовые задания различных форм: задания закрытой формы с различным количеством правильных ответов; задания на установление соответствия; задания открытой формы. Для удобства пользования ко всем тестам приведены ответы. Тесты по темам «Теория электролитической диссоциации», «Гидролиз солей», «Подгруппа кислорода» (8 класс) и «Виды изомерии» (10 класс) были проведены на практике, поэтому к данным тестам прилагаются ещё обработка и интерпретация результатов тестирования. 3.1 Теория электролитической диссоциации. Реакции ионного обмена. Цели тестирования: проверить знания учащихся о сущности электролитической диссоциации, умения составлять уравнения диссоциации кислот, щелочей, солей; полные и сокращенные ионные уравнения; применять понятия электролиты и не электролиты, сильные и слабые электролиты. План теста:
Инструкция для учащихся: На выполнение теста отводится 20 минут. Задания рекомендуется выполнять по порядку, не пропуская ни одного, даже самого легкого. Если задание не удаётся выполнить сразу, перейдите к следующему. Если останется время, вернитесь к пропущенным заданиям. К каждому заданию (за исключением третьего) дано несколько ответов, из которых только один верный. Выберите верный, по Вашему мнению, ответ и занесите его в лист ответов. Вариант I 1. ЭЛЕКТРОЛИТОМ ЯВЛЯЕТСЯ: а) раствор гидроксида калия б) раствор глюкозы в) вода (дист.) г) раствор сахарозы д) спиртовой раствор 2. К СИЛЬНЫМ ЭЛЕКТРОЛИТАМ ОТНОСИТСЯ: а) H3PO4 в) H2S б) H2CO3 г) NaOH 3  . НАПИШИТЕ ДИССОЦИАЦИЮ СЛЕДУЮЩЕГО ВЕЩЕСТВА: . НАПИШИТЕ ДИССОЦИАЦИЮ СЛЕДУЮЩЕГО ВЕЩЕСТВА:  Ca(OH)2 Ca(OH)2 4.В УРАВНЕНИИ РЕАКЦИИ ОКСИДА АЛЮМИНИЯ С СЕРНОЙ КИСЛОТОЙ СУММА КОЭФФИЦИЕНТОВ ПЕРЕД ФОРМУЛАМИ СИЛЬНЫХ ЭЛЕКТРОЛИТОВ РАВНА: а) 3 в) 5 б)4 г) 6 5.1 МОЛЬ ФОСФАТА НАТРИЯ РАСТВОРЯЮТ В ВОДЕ. СКОЛЬКО МОЛЕЙ ИОНОВ НАТРИЯ ОБРАЗУЕТСЯ ПРИ ПОЛНОЙ ДИССОЦИАЦИИ СОЛИ: а) 1 б) 2 в) 3 6. ИСХОДЯ ИЗ ДАННЫХ О РАСТВОРИМОСТИ ВЕЩЕСТВ ОПРЕДЕЛИТЕ, В КАКОМ СЛУЧАЕ ОСАДКА НЕ ОБРАЗУЕТСЯ: 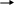 а) AgNO3 +NaCl а) AgNO3 +NaCl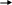 б) CuCl2 + NaОH б) CuCl2 + NaОH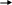 в) MnSO4 + NaJ в) MnSO4 + NaJ7  . ДЛЯ УРАВНЕНИЯ FeCl2 + H2S … СОКРАЩЕННОЕ ИОННОЕ УРАВНЕНИЕ ЗАПИСЫВАЕТСЯ В ВИДЕ: . ДЛЯ УРАВНЕНИЯ FeCl2 + H2S … СОКРАЩЕННОЕ ИОННОЕ УРАВНЕНИЕ ЗАПИСЫВАЕТСЯ В ВИДЕ: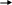 а) Fe2+ +S2- FeS а) Fe2+ +S2- FeS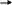 б) Fe2+ +H2S Fe2+ + S2- + 2H+ б) Fe2+ +H2S Fe2+ + S2- + 2H+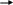  в) Fe2+ +H2S FeS +2H+ в) Fe2+ +H2S FeS +2H+8  . СОКРАЩЁННОМУ ИОННОМУ УРАВНЕНИЮ H+ + OH- H2O МОЖЕТ СООТВЕТСТВОВАТЬ СЛЕДУЮЩАЯ РЕАКЦИЯ В МОЛЕКУЛЯРНОМ ВИДЕ: . СОКРАЩЁННОМУ ИОННОМУ УРАВНЕНИЮ H+ + OH- H2O МОЖЕТ СООТВЕТСТВОВАТЬ СЛЕДУЮЩАЯ РЕАКЦИЯ В МОЛЕКУЛЯРНОМ ВИДЕ: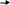 а) NaOH + HNO2 NaNO2 +H2O а) NaOH + HNO2 NaNO2 +H2O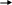 б) Cu(OH)2 + H2SO4 CuSO4 + 2H2O б) Cu(OH)2 + H2SO4 CuSO4 + 2H2O в) Ba(OH)2 + 2HNO3 Ba(NO3)2 +2H2O в) Ba(OH)2 + 2HNO3 Ba(NO3)2 +2H2OВариант II 1. ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ НЕ ПОДВЕРГАЮТСЯ: а) соединения с ковалентными неполярными связями б) соединения с ковалентными полярными связями в) соединения с ионными связями 2. К СИЛЬНЫМ ЭЛЕКТРОЛИТАМ ОТНОСЯТСЯ: а) Fe(OH)3 в) H2SO4 б) H2SiO3 г) Mg(OH)2 3  . НАПИШИТЕ ДИССОЦИАЦИЮ СЛЕДУЮЩЕГО ВЕЩЕСТВА: . НАПИШИТЕ ДИССОЦИАЦИЮ СЛЕДУЮЩЕГО ВЕЩЕСТВА:B 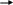 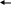 a(OH)2 a(OH)24. В УРАВНЕНИИ РЕАКЦИИ АЛЮМИНИЯ С СОЛЯНОЙ КИСЛОТОЙ СУММА КОЭФФИЦИЕНТОВ ПЕРЕД ФОРМУЛАМИ НЕЭЛЕКТРОЛИТОВ РАВНА: а) 3 в) 5 б) 4 г) 6 5. 1 МОЛЬ СУЛЬФАТА АЛЮМИНИЯ РАСТВОРЯЮТ В ВОДЕ. СКОЛЬКО МОЛЕЙ ИОНОВ АЛЮМИНИЯ ОБРАЗУЕТСЯ ПРИ ПОЛНОЙ ДИССОЦИАЦИИ СОЛИ: а) 1 б) 2 в) 3 6. КАКАЯ РЕАКЦИЯ ОБМЕНА ИДЁТ С ВЫДЕЛЕНИЕМ ГАЗА:  а) CaCl2 +Na2CO3 а) CaCl2 +Na2CO3 б) MgCO3 +HNO3 б) MgCO3 +HNO3 в) K2CO3 + H2SiO3 в) K2CO3 + H2SiO37  . ДЛЯ УРАВНЕНИЯ CuSO4 +NaOH … СОКРАЩЕННОЕ ИОННОЕ УРАВНЕНИЕ ЗАПИСЫВАЕТСЯ В ВИДЕ: . ДЛЯ УРАВНЕНИЯ CuSO4 +NaOH … СОКРАЩЕННОЕ ИОННОЕ УРАВНЕНИЕ ЗАПИСЫВАЕТСЯ В ВИДЕ: а) Cu2+ +2OH- Cu(OH)2 а) Cu2+ +2OH- Cu(OH)2 б) CuSO4 + 2OH- Cu(OH)2 +SO4 2- б) CuSO4 + 2OH- Cu(OH)2 +SO4 2- в) SO4 2- +2Na + Na2SO4 в) SO4 2- +2Na + Na2SO48  . СОКРАЩЁННОМУ ИОННОМУ УРАВНЕНИЮ Pb2+ +S2- PbS МОЖЕТ СООТВЕТСТВОВАТЬ СЛЕДУЮЩАЯ РЕАКЦИЯ В МОЛЕКУЛЯРНОМ ВИДЕ: . СОКРАЩЁННОМУ ИОННОМУ УРАВНЕНИЮ Pb2+ +S2- PbS МОЖЕТ СООТВЕТСТВОВАТЬ СЛЕДУЮЩАЯ РЕАКЦИЯ В МОЛЕКУЛЯРНОМ ВИДЕ: а) PbCl2 + Na2S PbS + 2NaCl а) PbCl2 + Na2S PbS + 2NaCl б) Pb(NO3)2 +Na2S PbS + 2NaNO3 б) Pb(NO3)2 +Na2S PbS + 2NaNO3 в) Pb(NO3)2 + H2S PbS + 2HNO3 в) Pb(NO3)2 + H2S PbS + 2HNO3Ответ. Ответы учащиеся заносят в специальный лист ответов, который выглядит следующим образом.  Лист ответов Ф. И. О.:
Вариант: В графу ответы учащиеся записывают номер (букву) верного, по их мнению, ответа. Ответы теста Вариант I Вариант II 1-а 1-а 2-г 2-в 3 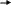   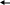 -Ca(OH)2 Ca OH+ +OH- 3-Ba(OH)2 BaOH+ +OH- -Ca(OH)2 Ca OH+ +OH- 3-Ba(OH)2 BaOH+ +OH-  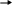 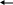 CaOH+ Ca2+ +OH- BaOH+ Ba2+ + OH- CaOH+ Ca2+ +OH- BaOH+ Ba2+ + OH-4-б 4-в 5-в 5-б 6-в 6-б 7-в 7-а 8-в 8-б Оценка: Данный тест был апробирован. При проверке результатов тестирования использовали дихотомическую оценку, т. е. за правильное выполнение задания учащийся получал единицу, а за неправильное - ноль. Таким образом, максимальное количество баллов, которое мог набрать ученик - это 8, при этом он получал оценку пять. Если испытуемый набирал 7 баллов - оценка четыре, 6 баллов (шесть правильных ответов)- три, и менее шести - два. Обработка результатов тестирования
Интерпретация результатов тестирования. Из полученной матрицы видно, что задание №4 явилось сложным для данного класса, т.к. с ним справилась только половина класса. Задание №3 оказалось более простым, его не выполнили только три ученика. Двое учащихся Васияров и Волчков не допустили ни одной ошибки. Шесть учашихся не справились с тестом. Общая оценка класса за тест - удовлетворительно. Основные ошибки, которые допустили испытуемые при выполнении теста, заключаются в том, что они, например, в задании №4 забывали суммировать единицу, если перед формулой вещества не стоит коэффициент. При выполнении заданий №6, 7, 8 расписывали слабые электролиты на ионы, забывали о том, что Н2CO3 слабая кислота и распадается на CO2 и H2O. |

 № задания
№ задания