тест по химии высокой сложности. тест. Методическая разработка по химии Композиция тестовых заданий на уроках химии
 Скачать 0.6 Mb. Скачать 0.6 Mb.
|
|
3. 2 Гидролиз солей. Цели тестирования: проверить знания учащихся о гидролизе солей, условиях протекания данного процесса, умение записывать уравнения реакции гидролиза, определять реакцию среды у предложенных солей. План теста:
Инструкция для учащихся  На выполнение теста отводится 20 минут. Задания рекомендуется выполнять по порядку, не пропуская ни одного, даже самого легкого. Если задание не удаётся выполнить сразу, перейдите к следующему. Если останется время, вернитесь к пропущенным заданиям. К каждому заданию дано несколько ответов, из которых только один верный. Выберите верный, по Вашему мнению, ответ и занесите его в лист ответов. На выполнение теста отводится 20 минут. Задания рекомендуется выполнять по порядку, не пропуская ни одного, даже самого легкого. Если задание не удаётся выполнить сразу, перейдите к следующему. Если останется время, вернитесь к пропущенным заданиям. К каждому заданию дано несколько ответов, из которых только один верный. Выберите верный, по Вашему мнению, ответ и занесите его в лист ответов.1  . КИСЛАЯ СРЕДА РАСТВОРА: . КИСЛАЯ СРЕДА РАСТВОРА:ЩЕЛОЧНАЯ [H+]=[OH-] [H+]>[OH-] [H+]<[OH-] 2. ГИДРОЛИЗ СОЛЕЙ УСИЛИВАЕТСЯ: при понижении температуры при уменьшении концентрации соли п   ри понижении давления ри понижении давления3. ЩЕЛОЧНОЙ РАСТВОР ПОЛУЧАЕТСЯ ПРИ РАСТВОРЕНИИ В КИСЛЫЙ ВОДЕ: (1) Na2SO3 (3) AlCl3  (2) Na2SO4 (4) ZnCO3 (2) Na2SO4 (4) ZnCO34  . КИСЛЫЙ РАСТВОР ПОЛУЧАЕТСЯ ПРИ РАСТВОРЕНИИ В . КИСЛЫЙ РАСТВОР ПОЛУЧАЕТСЯ ПРИ РАСТВОРЕНИИ В НЕЙТРАЛЬНЫЙ ВОДЕ: (1) CaSO3 (3) CrCl3 (2) NaNO3 (4) Ba(NO3)2 5  .ИЗ ПРИВЕДЕННЫХ НИЖЕ СОЛЕЙ ПО КАТИОНУ ГИДРОЛИЗУЕТСЯ: .ИЗ ПРИВЕДЕННЫХ НИЖЕ СОЛЕЙ ПО КАТИОНУ ГИДРОЛИЗУЕТСЯ:АНИОНУ (1) KNO3 (3)CaSO4 (2) ZnCl2 (4) Na2SO3 6  .ИЗ ПРИВЕДЕНННЫХ НИЖЕ СОЛЕЙ .ИЗ ПРИВЕДЕНННЫХ НИЖЕ СОЛЕЙ ГИДРОЛИЗУ НЕ ПОДВЕРГАЮТСЯ ГИДРОЛИЗУЕТСЯ ОДНОВРЕМЕННО ПОКАТИОНУ И АНИОНУ (1) Al2(SO4)3 (3) CH3COONH4 (2) Ca(NO3)2 (4) Zn(NO3)2 7  . ГИДРОЛИЗ Al2S3 ПРОТЕКАЕТ: . ГИДРОЛИЗ Al2S3 ПРОТЕКАЕТ:Na2CO3 обратимо н  еобратимо еобратимо8. ПРИ РАСТВОРЕНИИ В ВОДЕ СОЛИ FeCl3 ИНДИКАТОР CaCO3  МЕТИЛОВЫЙ ОРАНЖЕВЫЙ ПРИОБРЕТАЕТ ЦВЕТ: МЕТИЛОВЫЙ ОРАНЖЕВЫЙ ПРИОБРЕТАЕТ ЦВЕТ:ЛАКМУС (1) красный (3) розовый (2) синий (4) фиолетовый Ответы теста:
Оценка: Тест по теме «Гидролиз солей» был апробирован. При проверке результатов тестирования мы использовали дихотомическую оценку, т. е. за правильное выполнение задания учащийся получал единицу, а за неправильное- ноль. Таким образом, максимальное количество баллов, которое мог набрать ученик - это 8, при этом он получал оценку пять. Если испытуемый набирал 7 баллов - оценка четыре, 6 баллов (шесть правильных ответов)- три, и менее шести- два. Обработка результатов тестирования
Интерпретация результатов тестирования. Из данной матрицы видно, что большее число правильных ответов было дано на задание №1, т. е. это задание оказалось лёгким для данной группы испытуемых. Наиболее трудным заданием для группы оказалось последнее. С ним не справилось 7 учащихся. Без ошибок выполнили тест три ученика: Кузьмин Н., Николаев Б., Субботин А. Неудовлетворительную оценку получили три учащихся. Общая оценка класса за тест- хорошо. Ошибки, допущенные учащимися при выполнении теста: не все знают изменение окраски индикаторов при определённой реакции среды; путают анион и катион; не правильно составляют уравнение гидролиза. 3.3 Подгруппа кислорода Цель тестирования: определить уровень усвоения знаний учащимися по теме « Подгруппа кислорода». План теста
Вариант I Обведите номер правильного ответа. 1. ЭЛЕМЕНТЫ VI А ГРУППЫ ОБРАЗУЮТ ОКСИДЫ, КОТОРЫЕ ИМЕЮТ амфотерный характер кислотный характер основной характер 2. ОКИСЛИТЕЛЬНЫЕ СВОЙСТВА В РЯДУ O- S- Se- Te- Pb возрастают убывают убывают, а затем возрастают 3. ВАЛЕНТНОСТЬ И СТЕПЕНЬ ОКИСЛЕНИЯ КИСЛОРОДА В МОЛЕКУЛЕ О2 СОСТАВЛЯЮТ 0, 0 II, -2 II, 0 4. СИЛА КИСЛОТ В РЯДУ H2SO3- H2SeO3- H2TeO3 увеличивается уменьшается остаётся неизменной РАЗБАВЛЕННАЯ СЕРНАЯ КИСЛОТА НЕ РЕАГИРУЕТ С: оксидом кальция фосфатом натрия ртутью гидроксидом натрия цинком 6. Установите соответствие между цифрами и буквами: (1) ромбическая сера А: плохо растворяется в органических (2) моноклинная сера растворителях (3) пластическая сера Б: хорошо проводит электрический ток В: кристаллическая решётка состоит из длинных цепей Г: кристаллическое вещество желтого цвета Д: кристаллическая решетка состоит из восьмичленных колец Обведите номер правильного ответа. 7. МАССА ОТКРЫТОГО СОСУДА С ОЧЕНЬ РАЗБАВЛЕННЫМ РАСТВОРОМ СЕРНОЙ КИСЛОТЫ СО ВРЕМЕНЕМ: не изменяется увеличивается уменьшается 8. ПРИ ВЗАИМОДЕЙСТВИИ КОНЦЕНТРИРОВАННОЙ СЕРНОЙ КИСЛОТЫ С УГЛЕМ БУДУТ ПОЛУЧЕНЫ: CO2; SO2 и H2O CO2; H2 и S CO и H2S 9.СУММА КОЭФФИЦИЕНТОВ РЕАКЦИИ, ОПИСАННОЙ В ВОПРОСЕ 8, РАВНА: (1) 9 (3) 7 (2) 8 (4) 6 10. НАПИШИТЕ МОЛЕКУЛЯРНОЕ И ИОННЫЕ УРАВНЕНИЯ ВЗАИМОДЕЙСТВИЯ РАСТВОРА СЕРНОЙ КИСЛОТЫ И ГИДРОКСИДА НАТРИЯ. Вариант II Обведите номер правильного ответа. 1. ЭЛЕКТРОННАЯ КОНФИГУРАЦИЯ АТОМОВ ЭЛЕМЕНТОВ VI A ГРУППЫ МОЖЕТ БЫТЬ ПРЕДСТАВЛЕНА В ВИДЕ ОБЩЕЙ ФОРМУЛЫ : ns2 (n-1) d4 ns1 (n-1) d5 ns2 np4 2. ПЕРЕМЕННАЯ ВАЛЕНТНОСТЬ СЕРЫ МОЖЕТ БЫТЬ ОБЪЯСНЕНА: наличием 6 электронов на последнем энергетическом уровне более низким значением электроотрицательности по сравнению с кислородом распариванием электронов за счет возбуждения атомов 3. СТЕПЕНЬ ОКИСЛЕНИЯ СЕРЫ В СОЕДИНЕНИИ Na2SO3: +2 (2) +4 (3) +6 4. В РЯДУ H2S- H2SO3- H2SO4 КИСЛОТНЫЕ СВОЙСТВА: увеличиваются уменьшаются остаются неизменными 5. РАЗБАВЛЕННАЯ СЕРНАЯ КИСЛОТА НЕ РЕАГИРУЕТ С: железом гидроксидом лития оксидом магния оксидом азота (IV) хлоридом меди (II) 6. Установите соответствие между цифрами и буквами. (1) кислород А: образуется в процессе фотосинтеза (2) озон Б: газ с резким запахом В: обесцвечивает красители Г: образуется при разложении перманганата калия Д: в больших концентрациях убивает живые организмы Обведите номер правильного ответа. 7. МАССА ОТКРЫТОГО СОСУДА С КОНЦЕНТРИРОВАННОЙ СЕРНОЙ КИСЛОТОЙ СО ВРЕМЕНЕМ: не изменяется увеличивается уменьшается 8. ПРИ ВЗАИМОДЕЙСТВИИ ИЗБЫТКА КОНЦЕНТРИРОВАННОЙ СЕРНОЙ КИСЛОТЫ С МЕДЬЮ, ПРИ НАГРЕВАНИИ, БУДУТ ПОЛУЧЕНЫ: CuSO4 и H2 CuO и H2S CuSO4; H2O и SO2 9. СУММА КОЭФФИЦИЕНТОВ РЕАКЦИИ, ОПИСАННОЙ В ВОПРОСЕ 8, РАВНА: (1) 10 (3) 6 (2) 7 (4) 4 10. НАПИШИТЕ МОЛЕКУЛЯРНОЕ И ИОННЫЕ УРАВНЕНИЯ ВЗАИМОДЕЙСТВИЯ РАСТВОРА СЕРНОЙ КИСЛОТЫ И НИТРАТА СВИНЦА. Ответы теста: Вариант I Вариант II 1- 2 1- 3 2- 2 2- 3 3- 3 3- 2 4- 2 4- 1 5- 3 5- 4 6- 1Г; 2Д; 3В 6- 1А, Г; 2Б, В, Д 7- 1 7- 2 8- 1 8- 3 9- 2 9- 2 10- 10- H    2SO4+2NaOH Na2SO4+2H2O H2SO4+Pb(NO3)2 PbSO4 +2HNO3 2SO4+2NaOH Na2SO4+2H2O H2SO4+Pb(NO3)2 PbSO4 +2HNO32 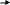 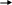 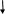 H++SO42-+ 2Na++2OH- 2Na++SO42_+2H2O 2H++SO42-+Pb2++2NO3- PbSO4 +2H++2NO3- H++SO42-+ 2Na++2OH- 2Na++SO42_+2H2O 2H++SO42-+Pb2++2NO3- PbSO4 +2H++2NO3- 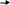 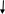 2H++2OH- 2H2O Pb2++SO42- PbSO4 2H++2OH- 2H2O Pb2++SO42- PbSO4Оценка: При проверке полученных результатов тестирования мы использовали дихотомическую оценку. Один балл получает учащийся за правильно выполненное задание и ноль- баллов, если задание выполнено неверно. Ученик, набравший 10- 9 индивидуальных баллов, получает оценку «отлично», 8 баллов- «хорошо», 7 баллов- «удовлетворительно», 6 и менее баллов- «неудовлетворительно». Обработка результатов тестирования:
Интерпретация результатов тестирования. Из матрицы, полученной при обработке результатов тестирования, видно, что с четвертым и седьмым заданиями удачно справились все испытуемые. Но с точки зрения традиционного тестирования, данные задания являются неудачными, так как они никого не выделяют. Возможно, данные задания будут работать активнее в другом классе. При выполнении теста у учащихся возникли затруднения с вопросами на химические свойства серной кислоты и окислительно-восстановительные реакции. Пять учащихся правильно ответили на все 10 заданий теста, два ученика получили неудовлетворительную оценку. Общая оценка класса за тест- хорошо. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 Тестовые задания
Тестовые задания № задания
№ задания