тест по химии высокой сложности. тест. Методическая разработка по химии Композиция тестовых заданий на уроках химии
 Скачать 0.6 Mb. Скачать 0.6 Mb.
|
|
3.4 Скорость химических реакций и её зависимость от условий протекания. Цель тестирования: проверить знания учащихся об основных условиях протекания химических реакций и управлении скоростью реакций, умения объяснять влияние различных условий на скорость химических реакций и решать задачи на данную тему. План теста
Вариант I Отметьте номер правильного ответа: 1. РАЗМЕРНОСТЬ ВЕЛИЧИНЫ СКОРОСТИ ХИМИЧЕСКОЙ РЕАКЦИИ: моль/л моль/л.с* м3/с 2. СКОРОСТЬ РЕАКЦИИ 2A+B=C, ИДУЩЕЙ В ОДНУ СТАДИЮ, ВЫРА-ЖАЕТСЯ ФОРМУЛОЙ: (1) v=k [B] (3) v=k[A]2[B] * (2) v=k[A][B] (4) v=k[A]2 3. В КАКОЙ РЕАКЦИИ КАТАЛИЗАТОР ПОВЛИЯЕТ НА УВЕЛИЧЕНИЕ ВЫХОДА ПРОДУКТА С: 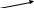 C C 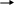 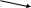 (1) A+B C+D (3) A+B * (1) A+B C+D (3) A+B *D 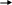 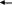 (2) A+B C+D (4) ни в какой (2) A+B C+D (4) ни в какой 4. ВО СКОЛЬКО РАЗ УВЕЛИЧИТСЯ СКОРОСТЬ РЕАКЦИИ ПРИ УВЕЛИЧЕНИИ ТЕМПЕРАТУРЫ ОТ 1000С ДО 1700С , ЕСЛИ ТЕМПЕРАТУРНЫЙ КОЭФФИЦИЕНТ РАВЕН 3 ? в 210 раз (2) в 729 раз (3) в 2187 раз * 5. РАСТВОРЕНИЕ ЦИНКА В СОЛЯНОЙ КИСЛОТЕ БУДЕТ ЗАМЕДЛЯТЬСЯ ПРИ: увеличении концентрации кислоты раздроблении цинка разбавлении кислоты * повышении температуры 6. С НАИБОЛЬШЕЙ СКОРОСТЬЮ ПРИ КОМНАТНОЙ ТЕМПЕРАТУРЕ ПРОТЕКАЕТ РЕАКЦИЯ: цинка с разбавленной серной кислотой магния с соляной кислотой железа с кислородом карбоната натрия (раствор) с соляной кислотой* СКОРОСТЬ ПРОТЕКАНИЯ РЕАКЦИИ ПРИ НАГРЕВАНИИ УВЕЛИЧИТСЯ: только для эндотермических реакций только для экзотермических реакций только для необратимых реакций практически для любой реакции * Дополните: ХИМИЧЕСКАЯ РЕАКЦИЯ ПРОТЕКАЕТ В РАСТВОРЕ СОГЛАСНО УРАВНЕНИЮ A+B=C , ИСХОДНАЯ КОНЦЕНТРАЦИЯ А=0,8 МОЛЬ/Л, А ЧЕРЕЗ 20 МИНУТ КОНЦЕНТРАЦИЯ А СНИЗИЛАСЬ ДО 0,78 МОЛЬ/Л. СРЕДНЯЯ СКОРОСТЬ РЕАКЦИИ_________(1,66.10-5 моль/л с) Вариант II Отметьте номер правильного ответа. 1. КОНСТАНТА СКОРОСТИ ХИМИЧЕСКОЙ РЕАКЦИИ- ЭТО… скорость данного процесса в начальный момент времени скорость данной реакции при концентрации реагентов, равных 1 моль/л * 2. СКОРОСТЬ РЕАКЦИИ А+2В=С, ИДУЩЕЙ В ОДНУ СТАДИЮ, ВЫРАЖАЕТСЯ ФОРМУЛОЙ: (1) v=k[A] (3) v=k[A][B] (2) v=k[B]2 (4) v=k[A][B]2 * 3. В КАКОМ СЛУЧАЕ ИМЕЕТ МЕСТО КАТАЛИТИЧЕСКАЯ РЕАКЦИЯ: интенсивность реакции горения угля возрастает после его измельчения скорость реакции горения фосфора повышается при внесении его в атмосферу чистого кислорода скорость реакции разложения пероксида водорода увеличивается при внесении в него оксида марганца (IV) * 4. ВО СКОЛЬКО РАЗ УВЕЛИЧИВАЕТСЯ СКОРОСТЬ РЕАКЦИИ ПРИ УВЕЛИЧЕНИИ ТЕМПЕРАТУРЫ ОТ 1500С ДО 2000С, ЕСЛИ ТЕМПЕРАТУРНЫЙ КОЭФФИЦИЕНТ РАВЕН 3 ? в 150 раз в 243 раза * в 729 раз 5. С НАИМЕНЬШЕЙ СКОРОСТЬЮ ПРИ КОМНАТНОЙ ТЕМПЕРАТУРЕ ПРОТЕКАЕТ РЕАКЦИЯ МЕЖДУ: NaCl (1%-й раствор) и AgNO3(1%-й раствор) NaCl (1%-й раствор) и AgNO3(5%-й раствор) Fe и CuSO4 (1%- й раствор) * NaCl (5%-й раствор) и AgNO3(5%-й раствор) 6. С НАИБОЛЬШЕЙ СКОРОСТЬЮ ПРИ КОМНАТНОЙ ТЕМПЕРАТУРЕ ПРОТЕКАЕТ РЕАКЦИЯ: O2 с H2 Fe с H2SO4 (раствор) FeSO4 (раствор) с NaOH (раствор) * 7. ПРАВИЛО ВАНТ- ГОФФА СПРАВЕДЛИВО ДЛЯ: экзотермической реакции эндотермической реакции любых реакций * Дополните: 8.ХИМИЧЕСКАЯ РЕАКЦИЯ ПРОТЕКАЕТ В РАСТВОРЕ СОГЛАСНО УРАВНЕНИЮ А+В=2С. ИСХОДНАЯ КОНЦЕНТРАЦИЯ А=0,22 МОЛЬ/Л, А ЧЕРЕЗ 10 СЕКУНД КОНЦЕНТРАЦИЯ А СНИЗИЛАСЬ ДО 0,215 МОЛЬ/Л. СРЕДНЯЯ СКОРОСТЬ РЕАКЦИИ _______(5.10-4 моль/л с) 3.5 Химическое равновесие. Условия его смещения. Цель тестирования: установить уровень усвоения знаний учащихся по теме «Химическое равновесие». План теста № 1
План теста № 2
Тест 1 Занесите букву правильного ответа в лист ответов. 1   . СПОСОБ, СМЕЩАЮЩИЙ РАВНОВЕСИЕ ГОМОГЕННОЙ РЕАКЦИИ: . СПОСОБ, СМЕЩАЮЩИЙ РАВНОВЕСИЕ ГОМОГЕННОЙ РЕАКЦИИ: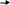 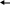 CO+Cl2 CCl2O ВПРАВО - ЭТО: CO+Cl2 CCl2O ВПРАВО - ЭТО:  PCl3+Cl2 PCl5 ВЛЕВО PCl3+Cl2 PCl5 ВЛЕВОа ) увеличение концентрации продукта б) увеличение концентрации хлора в) уменьшение концентрации хлора 2 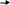   . СПОСОБ, СМЕЩАЮЩИЙ РАВНОВЕСИЕ РЕАКЦИИ FeO(T)+CO Fe(T)+ CO2 ВПРАВО - ЭТО: . СПОСОБ, СМЕЩАЮЩИЙ РАВНОВЕСИЕ РЕАКЦИИ FeO(T)+CO Fe(T)+ CO2 ВПРАВО - ЭТО:2   CO C(T)+CO2 CO C(T)+CO2 а ) увеличение концентрации угарного газа б) увеличение концентрации углекислого газа  в) уменьшение концентрации твердого продукта в) уменьшение концентрации твердого продукта 3. ПРИ ПОВЫШЕНИИ ДАВЛЕНИЯ РАВНОВЕСИЕ В ГОМОГЕННОЙ ПОНИЖЕНИИ Р    ЕАКЦИИ 4HCl+O2 2Cl2+2H2O СМЕСТИТСЯ ЕАКЦИИ 4HCl+O2 2Cl2+2H2O СМЕСТИТСЯ   2H2S+ 3O2 2SO2+2H2O 2H2S+ 3O2 2SO2+2H2Oа) вправо б) влево в) не сместится 4    . ПРИ ПОНИЖЕНИИ ДАВЛЕНИЯ РАВНОВЕСИЕ В РЕАКЦИИ CO2+H2 CO+H2O(ж) СМЕСТИТСЯ ВЛЕВО: . ПРИ ПОНИЖЕНИИ ДАВЛЕНИЯ РАВНОВЕСИЕ В РЕАКЦИИ CO2+H2 CO+H2O(ж) СМЕСТИТСЯ ВЛЕВО:S   O3(т)+NO SO2+NO2 O3(т)+NO SO2+NO2а) да б) нет  в) не знаю в) не знаю5    . РАВНОВЕСИЕ В РЕАКЦИИ 2SO2+O2 2SO3+Q СМЕСТИТСЯ ПРИ . РАВНОВЕСИЕ В РЕАКЦИИ 2SO2+O2 2SO3+Q СМЕСТИТСЯ ПРИ   ПОВЫШЕНИЯ H2+S H2S+Q ПОВЫШЕНИЯ H2+S H2S+Q ПОНИЖЕНИИ ТЕМПЕРАТУРЫ: а) влево б) вправо в) не сместится 6    . ПРИ ПОВЫШЕНИИ ТЕМПЕРАТУРЫ РАВНОВЕСИЕ РЕАКЦИИ N2+O2 2NO-Q СМЕСТИТСЯ ВЛЕВО: . ПРИ ПОВЫШЕНИИ ТЕМПЕРАТУРЫ РАВНОВЕСИЕ РЕАКЦИИ N2+O2 2NO-Q СМЕСТИТСЯ ВЛЕВО:2   CO+O2 2CO2+Q CO+O2 2CO2+Qа) да б) нет   в) не знаю в) не знаю7  . РАВНОВЕСИЕ РЕАКЦИИ Fe3O4+4CO 3Fe+4CO2-43,7 кДж . РАВНОВЕСИЕ РЕАКЦИИ Fe3O4+4CO 3Fe+4CO2-43,7 кДж    CaCO3 CaO+CO2-46 кДж CaCO3 CaO+CO2-46 кДж СМЕЩАЕТСЯ ВЛЕВО ВПРАВО а) при понижении температуры б) при повышении температуры в) при повышении давления 8    . ПРИ ОДНОВРЕМЕННОМ ПОНИЖЕНИИ ТЕМПЕРАТУРЫ И ПОВЫШЕНИИ ДАВЛЕНИЯ СМЕЩЕНИЕ РАВНОВЕСИЯ В ГОМОГЕННОЙ РЕАКЦИИ N2+3H2 2NH3+Q БУДЕТ ОДНОНАПРАВЛЕННЫМ: . ПРИ ОДНОВРЕМЕННОМ ПОНИЖЕНИИ ТЕМПЕРАТУРЫ И ПОВЫШЕНИИ ДАВЛЕНИЯ СМЕЩЕНИЕ РАВНОВЕСИЯ В ГОМОГЕННОЙ РЕАКЦИИ N2+3H2 2NH3+Q БУДЕТ ОДНОНАПРАВЛЕННЫМ:  3O2 2O3-Q 3O2 2O3-Qа) да б) нет в) не знаю 9  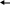  . РАВНОВЕСИЕ В РЕАКЦИИ H2S H2+S-Q СМЕСТИТСЯ ПРИ НАГРЕВАНИИ . РАВНОВЕСИЕ В РЕАКЦИИ H2S H2+S-Q СМЕСТИТСЯ ПРИ НАГРЕВАНИИОХЛАЖДЕНИИ а) вправо б) влево  в) не сместится в) не сместится10.ПРИ ОДНОВРЕМЕННОМ ПОВЫШЕНИИ ДАВЛЕНИЯ И ПОВЫШЕНИЯ ПОНИЖЕНИИ ТЕМПЕРАТУРЫ РАВНОВЕСИЕ В РЕАКЦИИ C 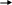 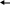  (T)+2N2O CO2+2N2+Q СМЕСТИТСЯ: (T)+2N2O CO2+2N2+Q СМЕСТИТСЯ: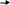  3Fe(T)+2CO Fe3C(T)+CO2+Q 3Fe(T)+2CO Fe3C(T)+CO2+Qа) вправо б) влево в) не сместится Ответы теста:
Тест № 2 Обведите номер правильного ответа. 1. ХИМИЧЕСКОЕ РАВНОВЕСИЕ- ЭТО СОСТОЯНИЕ СИСТЕМЫ, ПРИ КОТОРОМ: количество моль газообразных веществ, вступивших в реакцию, равно количеству моль газообразных продуктов реакции скорость прямой реакции равна скорости обратной реакции * масса веществ, вступивших в реакцию, равна массе продуктов реакции 2. ХИМИЧЕСКОЕ РАВНОВЕСИЕ В СИСТЕМЕ 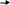  2CO(Г) CO2(Г)+C(T)+173 кДж СМЕЩАЕТСЯ В СТОРОНУ ПРОДУКТОВ РЕАКЦИИ ПРИ: 2CO(Г) CO2(Г)+C(T)+173 кДж СМЕЩАЕТСЯ В СТОРОНУ ПРОДУКТОВ РЕАКЦИИ ПРИ:(1) повышении давления * (2) повышении температуры (3) понижении давления использовании катализатора 3. РЕАКЦИЯ, В КОТОРОЙ ИЗМЕНЕНИЕ ДАВЛЕНИЯ НЕ ВЫЗОВЕТ СМЕЩЕНИЯ РАВНОВЕСИЯ- ЭТО: 2  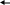 HBr(Г) H2(Г)+Br2(Г) * HBr(Г) H2(Г)+Br2(Г) *2 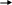  NF3(Г)+3H2(Г) 6НF(Г)+N2(Г) NF3(Г)+3H2(Г) 6НF(Г)+N2(Г) 2  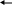 N2(Г)+O2(Г) 2N2O(Г) N2(Г)+O2(Г) 2N2O(Г)4 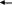 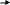 . РАВНОВЕСИЕ РЕАКЦИИ CaO(T)+CO2(Г) CaCO3(T)+Q СМЕСТИТСЯ ВЛЕВО ПРИ: . РАВНОВЕСИЕ РЕАКЦИИ CaO(T)+CO2(Г) CaCO3(T)+Q СМЕСТИТСЯ ВЛЕВО ПРИ:понижении давления * увеличении концентрации CO2 понижении температуры дополнительном введении CaCO3 5 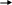  . ПРИ ПОНИЖЕНИИ ТЕМПЕРАТУРЫ РАВНОВЕСИЕ В РЕАКЦИИ 2SO3 2SO2+O2-Q СМЕСТИТСЯ: . ПРИ ПОНИЖЕНИИ ТЕМПЕРАТУРЫ РАВНОВЕСИЕ В РЕАКЦИИ 2SO3 2SO2+O2-Q СМЕСТИТСЯ:вправо (2) влево * (3) не сместится 6 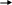  . РАВНОВЕСИЕ РЕАКЦИИ 2NO2(Г)+Cl2(Г) 2(NO)Cl(Г)+Q СМЕСТИТСЯ ВПРАВО ПРИ: . РАВНОВЕСИЕ РЕАКЦИИ 2NO2(Г)+Cl2(Г) 2(NO)Cl(Г)+Q СМЕСТИТСЯ ВПРАВО ПРИ:повышении температуры повышении давления * уменьшении концентрации NO увеличении концентрации (NO)Cl 7.РЕАКЦИЯ, В КОТОРОЙ ПОВЫШЕНИЕ ДАВЛЕНИЯ И ПОВЫШЕНИЕ ТЕМПЕРАТУРЫ ВЫЗОВУТ СМЕЩЕНИЕ РАВНОВЕСИЯ В ОДНУ СТОРОНУ: 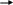  (1) CaO (T)+CO2(Г) CaCO3(Т)+Q (1) CaO (T)+CO2(Г) CaCO3(Т)+Q 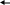 (2) 2ZnS(Т)+3O2(Г) 2ZnO(Т)+2SO2(Г)+Q (2) 2ZnS(Т)+3O2(Г) 2ZnO(Т)+2SO2(Г)+Q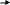  (3) N2(Г)+O2(Г) 2NO(Г)-Q (3) N2(Г)+O2(Г) 2NO(Г)-Q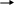  (4) J2(Г)+5CO2(Г) J2O5(Т)+5CO(Г)-Q * (4) J2(Г)+5CO2(Г) J2O5(Т)+5CO(Г)-Q *8   . СПОСОБ, СМЕЩАЮЩИЙ РАВНОВЕСИЕ ГОМОГЕННОЙ РЕАКЦИИ 2SO2+ O2 2SO3 ВПРАВО- ЭТО: . СПОСОБ, СМЕЩАЮЩИЙ РАВНОВЕСИЕ ГОМОГЕННОЙ РЕАКЦИИ 2SO2+ O2 2SO3 ВПРАВО- ЭТО:уменьшение концентрации продукта * уменьшение концентрации кислорода увеличение концентрации продукта 9. РЕАКЦИЯ, В КОТОРОЙ ПОВЫШЕНИЕ ДАВЛЕНИЯ СМЕЩАЕТ РАВНОВЕСИЕ ВПРАВО- ЭТО:   (1) CO2(Г)+2SO2(Г) CS2(Г)+3O2(Г) (1) CO2(Г)+2SO2(Г) CS2(Г)+3O2(Г)  (2) 2NO(Г) N2(Г)+O2(Г) (2) 2NO(Г) N2(Г)+O2(Г)  (3) 4FeS2(Т)+11O2(Г) 2Fe2O3(Т)+8SO2(Г) * (3) 4FeS2(Т)+11O2(Г) 2Fe2O3(Т)+8SO2(Г) *1   0. ПРИ УВЕЛИЧЕНИИ КОНЦЕНТРАЦИИ КИСЛОРОДА В 5 РАЗ СКОРОСТЬ РЕАКЦИИ N2(Г)+O2(Г) 2NO(Г) УВЕЛИЧИТСЯ 0. ПРИ УВЕЛИЧЕНИИ КОНЦЕНТРАЦИИ КИСЛОРОДА В 5 РАЗ СКОРОСТЬ РЕАКЦИИ N2(Г)+O2(Г) 2NO(Г) УВЕЛИЧИТСЯ(1) в 5 раз * (3) в 25 раз (2) в 10 раз (4) в 125 раз |

 Тестовые задания
Тестовые задания