Методические разработки
 Скачать 2.11 Mb. Скачать 2.11 Mb.
|
|
ЗАБОЛЕВАНИЯ ПЕЧЕНИ Острая печеночная недостаточность — патологическое состояние, которое развивается вследствие действия разнообразных этиологических факто- ров, основой патогенеза которого является воспаление и гепатоцеллюлярный некроз с дальнейшим нарушением или потерей основных функций печени. ОПечН является одним из наиболее тяжелых осложнений терапевтических, инфекционных, хирургических заболеваний и острых отравлений, как часть синдрома полиорганной недостаточности при любом критическом состоянии, а также следствием обострения течения хронического заболевания печени. Показатель выживаемости детей до 14 лет при ОПечН составляет 35 %, лиц старше 15 лет — 22 %, старше 45 лет — 5 %. Классификация печеночной недостаточности в зависимости от сроков развития симптоматики:
Независимо от причины основные проявления печеночной недостаточности одинаковы, так как нарушаются одна или несколько основных функций печени:
ОПечН развивается при поражении 75—80 % паренхимы. Виды острой печеночной недостаточности:
Э т и о л о г и я. У взрослых основными причинами ОпечН являются: вирусные гепатиты, циррозы печени любой этиологии, обострение хронических инфекционных заболеваний печени, синдром полиорганной недостаточности вследствие системного воспалительного ответа при всех критических состоя- ниях. У новорожденных и детей грудного возраста развитие ОпечН возможно по причине незрелости глюкуронилтрансферазы, фетального гепатита, наследственных метаболических нарушений, врожденных аномалий развития печени и желчевыводящих путей, сепсиса. У детей старшего возраста ОПечН обусловлена, главным образом, вирусными гепатитами, инфекциями и осложнениями заболеваний других органов и систем, отравлениями. Основные этиологические факторы ОПечН:
- • наследственные заболевания: болезнь Вильсона—Коновалова, синдромы Жильбера, Криглера—Найяра, Бадда—Киари (болезнь Рокитанского), Да-бина—Джонсона, недостаточность с^-антитрипсина, муковисцидоз;
Патогенез. В основе патогенеза печеночно-клеточной формы ОПечН лежит поражение структуры гепатоцитов, поэтому основными патогенетическими механизмами, которые обуславливают разнообразие клинических проявлений, являются нарушения процессов белкового обмена, что приводит к дисбалансу между различными аминокислотами и постепенному повышению уровня эндогенных токсинов в крови. Накопление аммиака в крови является одним из факторов развития алкалоза и энцефалопатии у пациентов с ОПечН. Токсический эффект аммиака вызван его прямым действием на мембраны нейронов и влиянием на глутаматэргическую систему, что предопределяет образование ошибочных нейромедиаторов. Развитие метаболического алкалоза сопровождается гипокалиемией и гипонатриемией. Печень играет важную роль в развитии синдрома системного воспалительного ответа (SIRS), так как синтезирует белки острой фазы (белки стресса): а]-антитрипсин, фибриноген, гаптоглобин, а2-макроглобулин, СЗ-компонент системы комплемента, церуло-плазмин. В печени синтезируются практически все плазменные факторы свертывания крови, за исключением фактора Виллебрандта и фактора VIII, поэтому недостаточность факторов свертывания является причиной развития геморрагических диатезов при недостаточности функции печени. Среди показа- телсй гемостаза наиболее чувствительными маркерами являются протромби-новое время, протромбиновой индекс, АЧТВ. Наиболее частой причиной недостаточности витамина К является внутри- и внепеченочный холестаз, а также нарушения нормальной микрофлоры кишечника, обусловленные антибактериальной терапией и хроническими заболеваниями пищеварительной системы. Кишечный дисбиоз уменьшает детоксикацию токсических метаболитов, которые образуются в процессе пищеварения, ухудшает местный иммунитет — все это увеличивает нагрузку на печень. Гипопротеинемия приводит к понижению онкотического давления, повышению давления в портальной системе, что ускоряет образование отеков и развитие асцита. При возникновении интерс-тициального отека легочной ткани увеличивается шунтирование венозной крови через легкие, в результате чего усиливается гипоксия во всех внутренних органах и системах организма, в том числе — в печени. Кроме этого, нарушаются функции мембран нефроцитов, эритроцитов, тромбоцитов, что влияет на развитие системных поражений и проявляется развитием синдрома полиорганной недостаточности. При ОПечН наблюдают развитие серьезных нарушений в Т-системе иммунитета в виде дефицита общего количества Т-лимфоцитов, дисбаланса имму-норегуляторных субпопуляций, нарушения функционального состояния макрофагов, что повышает риск вторичных инфекций. При ОПечН выделяют несколько синдромов поражения печени: мезенхимально-воспалительный синдром свидетельствует об активности воспалительного процесса с появлением в крови иммунных комплексов и антител к субклеточным структурам и белкам сыворотки крови. Холестатический синдром свидетельствует о нарушении желчевыдели-телыгой функции печени и может развиться как на уровне гепатоцитов, так pi на уровне внутри- и внепеченочных желчных протоков. Синдром печеночно-клеточной недостаточности (гепатодепрессивный синдром) характеризуется преобладанием нарушений функции печеночных кислот с нарушением структуры гепатоцитов, что может носить обратимый характер. Патогенетические механизмы цитолитического синдрома: активация лизо-сомальных гидролаз и деструкция органелл гепатоцитов, зернистая дистрофия клеток, переход б гидролитическую дистрофию с дальнейшим некрозом клеток. Синдром цитолиза обусловлен усилением проявлений печеночно-клеточной недостаточности. Клинические проявления. ОПечН проявляется остро. Характерными синдромами являются: диспепсические нарушения (тошнота, рвота), повышение температуры тела, нарушения функций ЦНС, наличие «печеночного» запаха, нарастание проявлений геморрагического синдрома (петехии, носовые и/или маточные кровотечения), иктеричность и зуд кожи, иктеричность склер, «печеночные» ладони. В начальных стадиях возможно увеличение размеров печени, при циррозе печени — уменьшение. ОПечН у взрослых преимущественно завершается развитием цирроза печени или молниеносного гепатита.  Б 60 % случаев цирроз печени алкогольного генеза является неблагоприятным прогностическим фактором относительно последствий печеночной недостаточности. Выделяют основные этиологические факторы цирроза печени: алкогольный цирроз, портальный (Лаеннека), билиарный, постнекротический, метаболический. При циррозе печени происходят необратимые изменения: повреждаются ретикулиновые волокна и разрастается соединительная ткань (очаги фиброза). Б 60 % случаев цирроз печени алкогольного генеза является неблагоприятным прогностическим фактором относительно последствий печеночной недостаточности. Выделяют основные этиологические факторы цирроза печени: алкогольный цирроз, портальный (Лаеннека), билиарный, постнекротический, метаболический. При циррозе печени происходят необратимые изменения: повреждаются ретикулиновые волокна и разрастается соединительная ткань (очаги фиброза).Молниеносный гепатит вирусной этиологии проявляется быстрым течением ОПечН, развивается в течение 8 недель после появления первых симптомов заболевания у пациентов с ранее интактной печенью. Симптомы печеночной недостаточности появляются в течение нескольких суток. У детей молниеносный гепатит может дополнительно провоцироваться вирусами Эпштейна— Барра, цитомегаловирусом, вирусом герпеса. Хронические заболевания органов пищеварительной системы и других внутренних органов, возраст пациента (особенно преклонный) предопределяют развитие и финал течения ОПечН. Особенно тяжелое течение и высокая летальность при печеночной недостаточности наблюдают у пациентов, инфицированных ВИЧ, и наркоманов. Клинические проявления ОПечН (Neil Kaplowitz, 1996):
Печеночная энцефалопатия завершается печеночной комой. Причиной ее развития является токсическое действие аммиака, жирных кислот, меркаптанов и других ложные нейромедиаторов. Для продромальной стадии характерна эйфория, которая сменяется депрессией, замедлением речи, нарушениями сна. Нарастают признаки депрессии, сонливости, появляется тремор. Факторы, которые усиливают энцефалопатию, обусловлены печеночной недостаточностью: желудочно-кишечное кровотечение, алкалоз, гипокали-емия, недостаточность функции почек, скомпрометированная ЦНС (атеросклероз, алкоголизм, наркомания, перенесенный ранее инсульт, психические заболевания). Основными клиническими проявлениями гепатаргии являются преимущественно психические и неврологические нарушения, «печеночный» запах, прогрессирующая желтуха, асцит.   Стадии энцефалопатии (Удо Штайнигер и соавт., 1996): Стадии энцефалопатии (Удо Штайнигер и соавт., 1996):
Основные принципы лечения энцефалопатии заключаются в проведении консервативных (детоксикация, энтеросорбция, обеспечение нормальных реологических свойств крови) и специальных инвазивных (плазмаферез, аминокислотный диализ) методов. Отек мозга чаще развивается у пациентов с печеночной энцефалопатией III—IV стадии. Механизмы развития:
Печеночная кома — это клинико-метаболическией синдром, который возникает в терминальной стадии острой или хронической печеночной недостаточности. При ОПечН кома развивается в случае, если количество токсинов, которые образуются в результате обмена веществ и при распаде паренхимы печени, превышает обезвреживающие возможности печени. Механизм нарушения сознания неизвестен. Считают, что имеет значение торможение окислительных процессов или влияние токсинов на рецепторы мозга, а также нарушение передачи нервных импульсов на регуляцию внутричерепного давления. Этот круг замыкает развитие синдрома SIRS, по причине которого возникают цитокино-вый и протеолитический «взрыв» и усиление образования релаксирующего фактора NO (оксида азота). Типы печеночной комы:
Как правило, в развитии обоих типов ком важное значение имеет влияние как экзогенных, так и эндогенных факторов. Клинически печеночная кома проявляется преимущественно психическими и неврологическими нарушениями. Возможно молниеносное, острое и по-дострое развитие коматозного состояния. Оценку степени поражения ЦНС проводят по шкале ком Глазго. Сознание отсутствует; отмечают ригидность затылочных мышц и конечностей, патологические рефлексы (Бабинского, Гордона, др.)- возможно появление генерализованных клонических судорог. Появляется патологическое дыхание по типу Куссмауля или Чейна—Стокса, «печеночный» запах изо рта, обусловленный повышенным содержанием в организме метилмеркаптана. Нарушения гемодинамики клинически проявляются артериальной гипотензисй, нарушениями сердечного ритма, микроциркуляторными расстройствами. Проявления почечной недостаточности на фоне ОПечН:
Количество мочи менее 40 мл/ч свидетельствует о развитии олигоанурии, менее 20 мл/ч — анурии. В стадиях олиг- и анурии относительная плотность мочи составляет 1003—1010. В этих случаях избегают назначения нефротокси-ческих лекарственных средств, снижения ОЦК, чрезмерного применения мочегонных средств и быстрого удаления асцитической жидкости. Дыхательная недостаточность на фоне ОПечН проявляется нарушениями сознания, метеоризмом, асцитом, ограничением экскурсий грудной клетки вследствие гепатомегалии; болевой синдром приводит к развитию гипоксемии, ателектазов легких, пневмонии. Вышеуказанные факторы и возникновение диспепсических явлений (тошноты и рвоты) увеличивают риск аспирации желудочного содержимого. Печень теряет способность инактивировать различные гуморальные факторы, которые регулируют проницаемость сосудистой стенки и эндотелия, поэтому нарушаются вентиляционно-перфузионные соотношения в легких, усиливается перегрузка организма пациента жидкостью, понижается сократительная способность миокарда. Сердечно-сосудистые нарушения на фоне ОПечН связаны с уменьшением системного сосудистого сопротивления (гиперпродукция NO) и компенсаторным повышением сердечного выброса. Гипоксия, интоксикация, нарушения кислотно-основного состояния, электролитный дисбаланс служат причиной развития аритмий. Артериальная гипотензия коррелирует с прогрессиро-ванием ОПечН. Нарушения кислотно-основного состояния и водно-электролитного баланса. При ОПечН может развиваться респираторный алкалоз центрального генеза, метаболический алкалоз на фоне выраженных диспепсических проявлений (тошноты, рвоты), гипокалиемии. Метаболический ацидоз возникает за счет гипоксии клеток и накопления лактата. Лактат-ацидоз является неблагоприятным прогностическим признаком. Отмечают разнообразные электро- литные нарушения: гипонатриемию, гипокалиемию, гшюкальциемию, гипо-магниемию. Коагулопатии и кровотечения. Нарушения гомеостатической функции печени приводят к появлению кровотечений, а при молниеносных формах ОПечН могут стать причиной смерти. Нарушение синтеза факторов свертывания крови, антитромбина III, протеинов С и S, тромбоцитопения служат причиной развития ДВС-синдрома. Желудочно-кишечные кровотечения, которые возникают на фоне ОПечН, усиливают коагулопатию. Для замещения факторов свертывания крови применяют инфузию свежезамороженной плазмы крови (10—20 мл/кг). Гемостатическая терапия заключается в назначении 12,5 % дицинона (этамзилата, 5 мг/кг), 1 % раствора викасола (1 мл). При тромбоци-топении (количество тромбоцитов < 50 х Ю3) показано переливание тромбо-цитарной массы (5—10 мл/кг). Н2-блокаторы (гистамин) при ОПечН назначают осторожно по причине отрицательного влияния на ЦНС и нарушения метаболизма лекарственных средств в печени. Сепсис, как вторичное осложнение ОПечН, является проявлением системной воспалительной реакции вследствие нарушения белоксинтетической функции и синтеза острофазных белков, медиаторов воспаления, что приводит к нарушению микроциркуляции, усилению гипоксии, нарушениям в системе иммунного ответа Т-лимфоцитов и макрофагов. Это провоцирует диссемина-цию условно патогенных микроорганизмов из кишечника. При первичном развитии сепсиса возникает синдром полиорганной недостаточности. В этом случае ОПечН является осложнением и одним из проявлений септического процесса. Лечение септического состояния должно быть комплексным, включать санацию первичного и вторичного очагов инфекции. Антибактериальную терапию проводят с учетом определения чувствительности выделенного возбудителя. Панкреатит при ОПечН является реактивным прявлением за счет нарушения микроциркуляции в спланхнических сосудах, запуска протеолитических ферментов и «протонного взрыва», нарушения водно-электролитного баланса. Панкреатит диагностируют по увеличению активности а-амилазы в крови на 25% я диастазы мочи; при проведении УЗИ обнаруживают преимущественно геморрагические формы, у детей — отечные. В схему интенсивной терапии включают ингибиторы протеолиза (гордокс — 10 000 ЕД/кг; трасилол, конт-рикал — 1000 ЕД/кг), ингибиторы протонной помпы (омепразол, гистак, ло-сек, гастрозол — 10—20 мг), ферментную терапию (креон, панкреатин, мезим-форте), сандостатин (применяют осторожно при кровотечении и декомпенсации ДВС-синдрома). Портальная гипертензия — осложнение печеночной недостаточности, которое проявляется кровотечениями из варикозно расширенных вен пищевода или кардиального отдела желудка. В физиологических условиях давление крови в воротной вене составляет 7—10 мм рт. ст. за счет низкого давления в печеночных синусоидах. О развитии портальной гипертензии свидетельствует повышение давления в портальной системе более 21 мм. рт. ст. Рост сосудистого сопротивления, как причина портальной гипертензии, определяется мор- фологически на трех уровнях: пресинусоидальном, синусоидальном и постсинусоидальном. В результате роста давления в системе портальной вены мобилизуется портальная система коллатеральных сосудов, что проявляется расширением вен пищевода, нижней части прямой кишки, пупочной вены, спле-номегалией, симптомом «головы медузы» и асцитом. Оперативные вмешательства при синдроме портальной гипертензии проводят по жизненным показаниям в случае массивного кровотечения и возможного рецидива в ближайшее время после его остановки. В плановом порядке оперативное вмешательство выполняют при уменьшении активности патологического процесса и относительной компенсации функционального состояния печени. В случае консервативного лечения портальной гипертензии применяют препараты, которые снижают портальное давление (пролонгированные нитраты в обычных возрастных дозах). В последние годы дискутируется вопрос относительно целесообразности использования вазопрессина — эндогенного пептида, который прямо влияет на мезэнтериальные сосуды, уменьшает спланхнический отток крови, что способствует уменьшению давления в портальной вене. Асцит и печеночный гидроторакс. Печеночный гидроторакс развивается вследствие проникновения асцитической жидкости в плевральную полость через диафрагму. Диагностируют по клиническим признакам: непродуктивному кашлю, одышке, боли тупого и ноющего характера в грудной клетке с локализацией в месте скопления асцитической жидкости, ограничению экскурсий грудной клетки; при рентгенологическом исследовании органов грудной полости и УЗИ определяют смещение органов средостения, наличие транссудата. Асцитическая жидкость при отсутствии бактериального обсеменения является транссудатом плазмы крови (содержит альбумины, катионы, анионы, эквивалентные содержимому в крови). В патогенезе развития асцита ведущими факторами являются: уменьшение синтеза альбуминов, как следствие уменьшения коллоидно-осмотического давления, обструкция кровотока на уровне печеночных синусоидов, что повышает гидростатическое давление в капиллярах и венулах. Это увеличивает ультрафильтрацию крови в интерстиции печени, а нарушение оттока лимфы содействует ее выходу в брюшную полость, что усугубляет явления асцита. Лечение заключается в ограничении употребления жидкости и гипонатриевых растворов. Плевральная пункция показана при объеме плеврального выпота более 100 мл (определяют при помощи рентгенологического исследования органов грудной полости и УЗИ). Назначают сочетание петлевых и дистальных мочегонных средств (фуросемид — 1—3 мг/кг/сут, верошпирон — 5—6 мг/кг/ сут, гипохлортиазид — 1—2 мг/кг/сут). Эффективность терапии определяют по увеличению диуреза на 300—500 мл и уменьшению массы тела на 300—500 г. При неэффективности мочегонной терапии показан лапароцентез, осложнением которого может стать артериальная гипотензия при быстрой эвакуации асцитической жидкости более 1—2 л у взрослых. Спонтанный бактериальный перитонит. Нарушение перфузии стенок кишечника, повышение проницаемости спланхнических сосудов, развитие сие- темного воспалительного ответа провоцируют транслокацию микроорганизмов в брюшную полость или асцитическую жидкость. Варианты бактериального перитонита: • в асцитической жидкости культура микроорганизмов не выделяется, но определяется повышенное количество полиморфноядерных лейкоцитов; • культура микроорганизмов высевается при отсутствии лейкоцитоза. Клинические проявления бактериального перитонита характеризуются нарастанием признаков декомпенсации цирроза печени, лихорадкой, энцефалопатией и умеренным болевым синдромом в брюшной полости. Антибактериальную терапию бактериального перитонита проводят при количестве лейкоцитов в перитонеальной жидкости около 250/мм3. Чаще при бактериальном перитоните выделяют грамотрицательную микрофлору. Используют цефалоспорины III—IV поколений. Лабораторная диагностика ОПечН заключается в определении показателей функции печени (АсАТ, АлАТ, ГлДГ, щелочной фосфатазы, холестерина, аммиака, билирубина, глюкозы в крови), почек (креатинина), кислотно-основного состояния, водно-электролитного баланса, данных иммунологического исследования, коагулограммы, количества тромбоцитов, длительности кровотечения. Проводят общеклиническое исследование крови и мочи, УЗИ и эндоскопическое исследование, ЭКГ, ЭЭГ, биопсию печени, бактериологическое исследование транссудата. Лечение. При ОПечН и печеночной коме необходимо проведение мероприятий по поддержанию и нормализации основных жизненно важных функций организма с учетом значительной способности печеночной ткани к регенерации. Больных с ОПечН госпитализируют в ОИТ, а при инфекционных заболеваниях — в инфекционное отделение. При отравлениях и токсических поражениях печени желательна госпитализация в центры экстракорпоральной детоксикации. Необходимо учитывать этиологию и стадию заболевания, что невозможно без правильно собранного анамнеза. Основные направления терапии: детокси-кация организма, уменьшение интенсивности цитолитического синдрома, стимуляция репаративных процессов в клетках, уменьшение риска осложнений. Общие принципы лечения:
10. Уменьшение интоксикации и гипераммониемии: гепастерил А (1,7 мл/кг/ч, противопоказан при почечной недостаточности), 5% раствор глюкозы с раствором глютаминовой кислоты (1 мл на год жизни 1 раз в сутки). И. Уменьшение образования аммиака, токсических соединений, очищение кишечника от азотсодержащих продуктов: промывание желудка, сифонная клизма, лактулоза (нормазе, 0,5 г/кг до достижения слабительного эффекта); для угнетения роста патогенной кишечной микрофлоры — антибиотики (нео-мицин, аминогликозиды, метронидазол), которые можно назначать одновременно с лактулозой.
Для коррекции геморрагического синдрома и кровотечения применяют: свежезамороженную плазму (10—20 мл/кг), дицинон (этамзилат, 5 мг/кг), ви-касол (1 % раствор 0,5—1 мл), аминокапроновую кислоту (5 % раствор 100— 400 мл).
 20. Симптоматическая терапия осложнений ОПечН, коррекция электролитного обмена и кислотно-основного состояния. 20. Симптоматическая терапия осложнений ОПечН, коррекция электролитного обмена и кислотно-основного состояния.При неэффективности консервативной терапии или в составе комплексной терапии применяют методы активной детоксикации, выбор которых зависит от степени тяжести состояния и возраста больного, данных лабораторно-инструментальных исследований: плазмаферез, плазмосорбция, гемодиализ, лимфосорбция, перитонеальный диализ. Большинство авторов считают нецелесообразным применение кортикостероидов при ОПечН, поскольку они усиливают катаболизм белков, вследствие чего возрастает азотемия и увеличивается риск развития инфекционно-токсических осложнений. Трансплантация печени на современном этапе является перспективным методом лечения печеночной недостаточности и всегда связана с правовыми, этическими и организационными вопросами. Профилактика ОПечН заключается в пропаганде здорового образа жизни, своевременной вакцинации против гепатитов В и С, диспансерном наблюдении пациентов с хроническими заболеваниями пищеварительной и ге-патобилиарной систем, а также с другой соматической патологией. Врачебная тактика при олигурии Олигурия (диурез менее 400 мл/сут) — грозный признак, летальность при острой почечной недостаточности с олигурией достигает 90% [I]. В данной главе рассматриваются простые способы контроля за олигурией (для того чтобы оценить её характер и значение для организма), базирующиеся на инвазивном мониторинге показателей гемодинамики пациента. ВВЕДЕНИЕ Патогенетически (с учётом анатомо-функциональных факторов) традиционно различают З типа олигурии: преренальную, ренальную и постренальную (рис. 34-1). ПРЕРЕНААЬНАЯ ОЛИГУРИЯ Основная причина, приводящая к олигурии подобного рода, состоит в снижении почечного кровотока, что может быть результатом слабого сердечного выброса либо неадекватного кровообращения в почках (гипоперфузия). Олигурия этого типа возникает на фоне общих клинических расстройств — гиповолемии, вазодилатации, острой сердечной недостаточности. 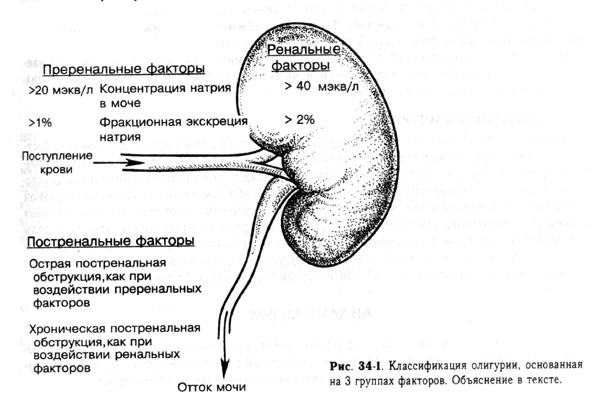 Рис. 34-1. Классификация олигурии, основанная на 3 группах факторов. РЕНАЛЬНАЯ ОЛИГУРИЯ , Ренальная олигурия характеризуется паренхиматозной почечной недостаточностью и может возникнуть вследствие поражения паренхимы почки различными повреждающими факторами. Однако в большинстве случаев острую почечную недостаточность с олигурией вызывают два заболевания: острый некроз канальцев и острый интерстициальный нефрит. Острый гломерулонефрит нечасто встречается у больных, находящихся в отделениях интенсивной терапии. Острый некроз канальцев (ОНК). Малоизученное заболевание, которое вызывается самыми разнообразными причинами, в том числе ишемией, сепсисом, хирургическими вмешательствами, лекарственными средствами, ядами растительного и животного происхождения, пигментами (например, миоглобином) и др. Острый интерстициальный нефрит (ОИН) обусловлен, по-видимому, реакцией гиперчувствительности, развивающейся в почках вследствие воздействия лекарственных средств (известно по меньшей мере 40 таких препаратов, причём наиболее часто ОИН вызывают пенициллины и нестероидные противовоспалительные средства) [5]. Клинические проявления ОНК и ОИН похожи. Несмотря на то что ОИН сопровождается лихорадкой, кожными высыпаниями и суставными болями [б], в 40% случаев высыпания могут быстро исчезать, а лихорадка отсутствовать [5]. Общепринятая точка зрения. Острая почечная недостаточность с олигуриеи (ОПНО) у больных, находящихся в отделениях интенсивной терапии, обычно указывает на системные поражения организма (сепсис, полиорганная недостаточность, токсическое действие лекарственных средств, красителей и др.). Связь ОПНО с системными поражениями подтверждает, что почечная недостаточность служит лишь составной частью большого клинического синдрома, поэтому появление ОПНО становится основанием для поиска ведущей патологии. В настоящее время в происхождении ОПНО всё более значимую роль придают различным лекарственным средствам, особенно антибиотикам группы аминогликозидов. Согласно данным последних лет, 1 из каждых 4 случаев применения аминогликозидов сопровождается развитием острой почечной недостаточности [З]. Если эти сведения соответствует действительности, то препараты группы аминогликозидов можно считать наиболее распространённой причиной острой почечной недостаточности у больных, находящихся в отделениях интенсивной терапии. ПОСТРЕНААЬНАЯ ОЛИГУРИЯ Данный тип патологии обусловлен нарушением оттока мочи из почек. К развитию пост-ренальной олигурии может привести препятствие оттоку мочи как в собирательных трубочках и протоках, так и на любом уровне мочевыводящих путей (одностороннее либо двустороннее). Группа постренальных факторов включает в себя, в частности, обструкцию разной выраженности и локализации, например на уровне сосочковых протоков (некроз почечных сосочков), мочеточника (забрюшинные опухоли), внутреннего отверстия мочеиспускательного канала (стриктуры, конкремент, патология предстательной железы) и др. Обструктив-ные процессы остаются обычной причиной олигурии, но они представляют ещё большую опасность при экстраординарных обстоятельствах (например, у больных с одной почкой). АНАЛИЗ МОЧИ С помощью анализа мочи можно дифференцировать преренальные и ренальные заболевания [7]. Параллельные болезни включают в себя острый гломерулонефрит и острую постренальную обструкцию, а ренальные — хроническую постренальную обструкцию. СОДЕРЖАНИЕ НАТРИЯ В МОЧЕ Снижение почечного кровотока сопровождается увеличением реабсорбции натрия и уменьшением его экскреции с мочой. Наоборот, при острой почечной недостаточности происходит снижение реабсорбции данного электролита и его выделение с мочой увеличивается. Следовательно, определяя концентрацию натрия в моче, можно простым способом отличить преренальный тип олигурии от ренального. Содержание натрия в моче менее 20 мэкв/л при олигурии обычно указывает на преренальную патологию. Однако концентрация данного электролита в моче выше 40 мэкв/л не всегда свидетельствует в пользу острой почечной недостаточности. Уровень натрия в моче, превышающий 40 мэкв/л, можно выявить и при преренальных расстройствах, и на фоне действия салуретиков. У пожилых больных почти всегда бывает потеря натрия, поэтому у них также наблюдается несоразмерно большое количество данного электролита в моче при сниженном почечном кровотоке. Таким образом, на основании измерения только одного показателя — содержания натрия в моче — нельзя установить причины острой почечной недостаточности, если концентрация натрия около 40 мэкв/л [З]. ФРАКЦИОННАЯ ЭКСКРЕЦИЯ (ЭКСКРЕТИРУЕМАЯ ФРАКЦИЯ) НАТРИЯ (ФЭNA) Для характеристики выведения натрия почками используют ряд показателей, в том числе ФЭNA, отражающую часть электролита, проходящую через клубочковый фильтр и экскретируемую с мочой [5]. ФЭNA вычисляют, сравнивая почечный клиренс натрия с клиренсом креатинина: ФЭNA — один из наиболее информативных показателей, используемых для идентификации почечной недостаточности. Однако значения ФЭNA <1% выявляют и при острой почечной недостаточности, вызванной рентгеноконтрастными веществами или сопровождающейся миоглобинурией [5]. Основной вопрос здесь заключается в возможности диагностики ОНК при ФЭNA < 1 %. Другими словами, если при олигурии значение ФЭNA ниже 1 %, то почечные цнальцы функционируют вполне нормально, что опровергает диагноз ОНК. В настоящее время определение ФЭNA остаётся наилучшим лабораторным тестом, используемым в отделениях интенсивной терапии для дифференциации преренальноё олигурии с ОПНО [5, б]. МИКРОСКОПИЧЕСКОЕ ИССЛЕДОВАНИЕ ОСАДКА МОЧИ Микроскопическое исследование осадка мочи следует проводить при любом подозрении на острую почечную недостаточность. В случае наличия преренальных факторов осадок мочи содержит неспецифические элементы — гиалиновые или зернистые цилиндры. При ОНК осадок мочи изобилует эпителиальными клетками и эпителиальными цилиндрами вместе с грубыми зернистыми цилиндрами. При ОИН осадок мочи может содержать лейкоциты и лейкоцитарные цилиндры. Эритроциты и эритроцитарные цилиндры характерны для острого гломерулонефрита, но могут встречаться и при других патологических процессах, приводящих к острой почечной недостаточности. СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА ДВУХ ТЕСТОВ: ОПРЕДЕЛЕНИЯ ФЭNA И МИКРОСКОПИЧЕСКОГО ИССЛЕДОВАНИЯ ОСАДКА МОЧИ При наличии эпителиальных клеток и цилиндров в осадке мочи или других высокоспецифичных показателей его микроскопическое исследование становится настоящим “золотым стандартом” диагностики ОНК. Вместе с тем определение ФЭNA более важно для оценки почечной реабсорбции. Например, в осадке мочи выявлены эпителиальные цилиндры, но значение ФЭNA< 1 %. На основании микроскопического исследования осадка мочи устанавливают диагноз ОНК, но канальцы функционируют нормально, поскольку они не утратили способности реабсорбировать натрий. Очевидно, что определение ФЭNA информативнее для оценки функционального состояния почек. ПОЭТАПНЫЙ ПОДХОД К ОЛИГУРИИ При первых симптомах олигурии или анурии необходимо убедиться в нормальном функционировании катетера, введённого в мочевой пузырь. Это особенно важно при выделения мочи менее 100 мл/сут (анурия*), так как почечные нарушения обычно не вызывают анурии. Подход к олигурии можно условно разделить на 3 этапа, что отражено на рис. 34-2. Подход требует использования инвазивных методов контроля за показателями гемодинамики (необходима катетеризация лёгочной артерии). I ЭТАП: ОПРЕДЕЛЕНИЕ ГЕМОДИНАМИЧЕСКОГО СТАТУСА Первоначальная задача состоит в нормализации гемодинамических показателей, определяющих кровоток в почках, которую проводят следующим образом. Наполнение желудочков кровью. Адекватность наполнения желудочков кровью оценивается с помощью измерения центрального венозного давления (ЦВД) или давления заклинивания в лёгочных капиллярах (ДЗЛК). Существенным считают снижение обоих показателей на 4 мм рт.ст. и более [8]. Если мониторинг данных параметров ранее не производили, то объём циркулирующей крови можно считать адекватным при ЦВД = 10-12 мм рт.ст., ДЗЛК = 15-20 мм рт.ст. Если давление наполнения желудочков неадекватно, следует проводить инфузионную терапию до тех пор, пока ДЗЛК не достигнет 15 мм рт.ст. В случае сохранения олигурии необходимо измерить сердечный выброс. Сердечный выброс. Значение сердечного выброса определяют только после нормализации наполнения желудочков. Если сердечный выброс невелик, необходимо немедленно определить причину этого (инфаркт миокарда, тампонада сердца и др.). Лекарственные средства для нормализации сердечного выброса выбирают, исходя из уровня АД. При нормальном АД рекомендуется внутривенное введение бета1-адреномиметика добутамина [10-20 мкг/(кгмин)], обладающего выраженной кардиотонической активностью. * Отечественные авторы об олигурии говорят тогда, когда суточный объём мочи колеблется от 50 до 400-500 мл, а об олигоанурии — если он меньше 50 мл. Однако объём мочи сам по себе не является важным диагностическим признаком. — Прим. ред. 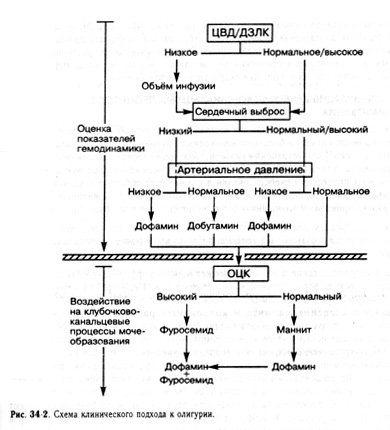 Рис. 34-2. Схема клинического подхода к олигурии. Если АД низкое, то более целесообразно назначить дофамин [5-15 мкг/(кг.мин)]. Когда сердечный выброс в норме или увеличен, а у пациента имеются признаки артериальной гипотензии (например, при сепсисе), следует немедленно начать лечение, направленное на повышение периферического сосудистого сопротивления без изменения уровня почечного кровотока. В данном случае предпочтение отдают дофамину [(5-15 мкг/(кг.мин)] из-за его способности расширять почечные сосуды (в результате стимуляции дофаминовых рецепторов гладких мышц) и тем самым усиливать перфузию почек. Необходимо подчеркнуть, что нельзя назначать более активные сосудосуживающие средства, такие, как мезатон (неосинефрин) и др. II ЭТАП: ПОЛУЧЕНИЕ МОЧИ ДЛЯ ПРОВЕДЕНИЯ ДИАГНОСТИЧЕСКИХ ТЕСТОВ В случае олигурии при нормальной гемодинамике берут пробы крови и мочи для исследования, в частности для определения ФЭNA оставшуюся порцию мочи следует сохранить для микроскопического исследования мочевого осадка (при необходимости). Мочу для анализа необходимо получить до назначения диуретиков. Это позволит избежать диагностически ошибок, обусловленных повышенным содержанием натрия в моче после приёма препаратов. Уже во время проведения диагностических тестов следует начать лечебные мероприятия, направленные, в частности, на повышение скорости образования мочи. Ill ЭТАП: СТИМУЛЯЦИЯ КЛУБОЧКОВО-КАНАЛЬЦЕВЫХ ПРОЦЕССОВ МОЧЕОБРАЗОВАНИЯ Олигурия при нормальной гемодинамике заставляет подумать об острой почечной недостаточности. В данной ситуации больному необходимо внутривенно ввести малые дозы дофамина [1 мкг/(кг-мин)] для устранения вазоконстрикции, сопровождающей острую почечную недостаточность, а также назначить (внутривенно) фуросемид, способствующий активизации канальцевых процессов мочеобразования и снижающий обратное давление (которое уменьшает эффективное фильтрационное давление в клубочках). К сожалению, такая лечебная тактика не приводит к улучшению функции почек даже при повышении диуреза. Клинические исследования свидетельствует о том, что даже при увеличении объёма мочи на фоне действия дофамина и фуросемида больным все равно проводили интенсивную терапию после возникновения олигурии (в период до 48 ч) (2, 9-11]. Задержка в коррекции данного состояния может помочь дифференцировать олигурическую и неолигурическую формы почечной недостаточности. Несмотря на невозможность улучшения функции почек в последнем случае, повышение диуреза упрощает ведение больных. Внутривенное введение маниита и коллоидных растворов. Внутривенная инфузия гипертонического раствора маннита (маннитола) на ранних сроках острой почечной недостаточности (после появления её первых симптомов) повышает скорость клубочковой фильтрации [9]. Диуретический эффект, обусловленный введением 50-100 мл 25% раствора препарата, возникает приблизительно в течение 2 ч. Также эффективно применение коллоидных растворов [10], на основании чего можно заключить, что снижение вязкости крови важно для поддержания почечного кровотока [10]. Несмотря на отсутствие сведении о механизмах, лежащих в основе подобной активности, проведённые исследования позволяют предположить, что для улучшения перфузии почек у больных в раннем периоде острой почечной недостаточности следует поддерживать объём плазмы на как можно более высоком уровне. Фуросемид. Сведения об эффективности фуросемида (внутривенное введение) при острой почечной недостаточности весьма противоречивы. Препарат в больших дозах вызывает вазоконстрикцию и снижает сердечный выброс [11]. Данные ряда наблюдений оправдывают (да и то с большой натяжкой) его использование для усиления почечного кровотока, хотя у некоторых пациентов при этом увеличивается диурез [1-3]. Для предотвращения возможных нарушений кровообращения перед внутривенным введением фуросемида необходимо нормализовать сердечный выброс и объём циркулирующей крови. Оптимальную дозу фуросемида при внутривенном введении установить достаточно трудно, но не рекомендуется применять препарат в дозах, превышающих 600 мг [12]. Наиболее приемлемо медленное введение фуросемида в начальной дозе 100 мг. При этом диуретический эффект обычно возникает в течение 1 ч. Дофамин. Препарат при внутривенном введении в малых дозах [1-2 мкг/(кгмин)] может избирательно стимулировать дофаминовые рецепторы гладких мышц сосудов, обеспечивающих кровообращение в почках [13]. Аналогичное введение препарата в условиях стойкой олигурии усиливает диурез [13]. Комбинированное применение дофамина с фуросемидом повышает эффективность последнего [14]. После возникновения диуретического эффекта, обусловленного внутривенным введением дофамина на ранних этапах острой почечной недостаточности, инфузию препарата следует продолжить ещё в течение 24-72 ч с постепенным уменьшением его дозы [II]. СТОЙКАЯ ОЛИГУРИЯ Стойкая олигурия или азотемия, возникающая у больных, находящихся в отделениях интенсивной терапии, в ходе проведения различных терапевтических мероприятий, свидетельствует об олигурической форме острой почечной недостаточности. Лекарственные средства, вызывающие эту патологию или способствующие её проявлению, приведены в табл. 34-1. НЕФРОТОКСИЧЕСКИЕ ЛЕКАРСТВЕННЫЕ СРЕДСТВА Аминогликозиды вообще не следует назначать, располагая альтернативным антибиотиком другой группы. Иными словами, аминогликозиды не следует использовать до развития резистентности у микроорганизмов ко всем прочим группам антибиотиков, а также если у больного нет нейтропении и инфекции, вызванной Pseudomonas aeruginosa. Аминогликозиды можно с успехом заменить азтреонамом, не обладающим нефротоксическими свойствами. Амфотерицин В не имеет подходящих альтернативных препаратов, поэтому лечение им следует прекратить, а через 24 ч повторно начать вводить антибиотик в половинной дозе (см. Приложение). И пентамидин, и триметоприм + сульфаметоксазол способны вызывать почечную недостаточность у больных СПИДом, причём иногда препараты приходится менять друг на друга при возникновении нефротоксического эффекта.Таблица 34-1 Лекарственные препараты, применение которых следует прервать при развитии острой почечной недостаточности Нефротоксические препараты Аминогликозиды Амфотерицин В Пентамидин Альтернативные препараты Азтреонам (?) Нет (уменьшить дозу наполовину) Триметоприм + сульфаметоксазол (?) Аллергический интерстициальный нефрит Все пенициллины Цефалотин Фуросемид Тиазидные диуретики Циметидин Нестероидные противовоспалит. ср-ва Эритромицин, ванкомицин Ванкомицин Буфенокс Буфенокс Сукралфат, антациды Парацетамол ОСТРЫЙ ИНТЕРСТИЦИАЛЬНЫЙ НЕФРИТ Острый интерстициальный нефрит лекарственного происхождения трудно распознать клинически из-за отсутствия специфических признаков, а сопутствующие сыпь и эозинофилия исчезают сравнительно быстро [4,5]. Кроме того, у трети подобных больных наблюдается классическая триада: лихорадка, сыпь, эозинофилия [4]. Необходимо прекратить введение всех препаратов, способных вызвать поражение почек. Возглавляют список лекарственных средств с нефротоксическими свойствами пенициллины и нестероидные противовоспалительные препараты. Фуросемид является типичным нефротоксическим веществом, поэтому его следует заменить на буфенокс (буметанид) в соотношении 1:40 (к фуросемиду); например, если больной получал 40 мг фуросемида, то доза буфенокса должна составлять 1 мг. Циметидин не проявляет выраженной нефротоксичности, тем не менее следует отдавать предпочтение сукралфату или антацидным средствам. ВЫВЕДЕНИЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ ПОЧКАМИ Наиболее часто используемые у больных, находящихся в отделениях интенсивной терапии, лекарственные средства, которые экскретируются почками, приведены в табл. 34-2. Магнийсодержащие антацидные средства следует отменить или заменить другими антацидами. Из-за изменения клиренса креатинина необходимо (по возможности) прекратить введение дигоксина При почечной недостаточности натрия нитропруссид следует вводить не более 3 сут, что обусловлено опасностью развития токсических эффектов из-за накопления цианидов и тиоцианатов (см. главу 20). При применении аминогликозидов в условиях острой почечной недостаточности необходимо скорректировать их дозы. Методика определения доз аминогликозидов, используемых при острой почечной недостаточности, дана в табл. 34-2. Коррекцию суточной дозы проводят либо изменением частоты введения препарата (3 раза в сутки через 8 ч), либо уменьшением разовой дозы с сохранением интервала между введениями. Оба метода одинаково эффективны и не имеют преимуществ друг перед другом. Таблица 34-2. Рекомендации по проведению медикаментозного лечения при острой почечной недостаточности Лекарственные средства Рекомендации Магнийсодержащие антацидные средства Дигоксин Натрия нитропруссид Новокаинамид Аминогликозиды Заменить на антациды, содержащие алюминия гидроокись, или сукралфат Снизить дозу на 25% или заменить на верапамил. Заменить на добутамин, оказывающий выраженное кардиотоническое действие Можно внутривенно вводить в дозе не более 3 мкг/(кг.мин) в течение 72 ч, но можно заменить на арфонад для снижения повышенного АД и амринон для увеличения сократительной способности миокарда. Использовать в половинной дозе Рекомендуемая доза 3-5 мг/(кг.сут) + контроль за содержанием креатинина в плазме крови Рекомендуемый интервал 8 ч + контроль уровня креатинина РАБДОМИОЛИЗ Острый некроз скелетных мышц, сопровождающийся миоглобинурийной почечной недостачностью, обычно способен к самоограничению, если функция почечных канальцев поддерживается с помощью интенсивной инфузионной терапии. Одним из признаков возможного некроза скелетной мускулатуры считается ежедневное возрастание содержания креатинина и значений других биохимических показателей в сыворотке крови, приведённых в Табл. 34-3. За сутки уровень креатинина повышается не более чем на 10 мг/л, а мочевина крови — на 300 мг/л [12]. На рабдомиолиз указывают изменения показателей, представленных в табл. 34-3. Кроме того, хорошим диагностическим тестом является определение активности креатинфосфокиназы в сыворотке крови, поскольку нормальная активгость фермента позволяет полностью исключить рабдомиолиз. Однако поставить точный дагноз, основываясь только на данных о повышенной активности креатинфосфокиназы, весьма затруднительно, и лишь при резком увеличении этой активности можно более или менее определённо думать о рабдомиолизе. В случае тяжёлого рабдомиолиза в кровь выделяется большое количество миоглобина и креатинина, что вызывает повышение активности ряда ишечных ферментов, в том числе креатинфосфокиназы. Установить источник их происхождения (сердечная мышца или скелетная мускулатура) можно, определяя активность альдолазы сыворотки крови. Как известно, альдолаза* — фермент, локализованный в поперечно-полосатых мышцах; повышенная активность альдолазы позволяет считать её источником скелетные мышцы. Немедленно после установления диагноза следует начать интенсивную инфузионную терапию, чтобы избежать неблагоприятного исхода. Традиционное лечение острой почечной недостаточности с олигурией включает, в частности, коррекцию нарушений водно-электролитного баланса. Многие методы такой коррекции изложены в следующих главах. Таблица 34-3 Признаки усиленного катаболизма или некроза скелетных мышц при острой почечной недостаточности Биохимические показатели сыворотки крови Ежедневное увеличение Конечная концентрация Азот мочевины крови Креатинин Калий Мочевая кислота Фосфор > 300 мг/л > 10 мг/л > 1 мэкв/л > 150 мг/л > 100 мг/л (Из: Schrier RW. Acute renal failure. Kidney Int 1979; 15:205-216.) * У людей имеется 3 типа альдолаз (групповое название ферментов, участвующих в механизме анаэробного расщепления углеводов): мышечный, печёночный и мозговой. В тексте подразумевают альдолазы мышечного типа. — Прим. ред. |
