Методические разработки
 Скачать 2.11 Mb. Скачать 2.11 Mb.
|
|
6.2.2. Обмен углеводов Печень играет важную роль в обмене глюкозы. Она обеспечивает депонирование глюкозы при повышении ее концентрации в крови воротной вены после приема пищи, а также в системном кровотоке. Кроме того, печень обеспечивает поддержание нормальной концентрации глюкозы в крови при голодании. В этом заключается глюкостатическая функция печени. Скорость поглощения глюкозы из крови или высвобождения в кровь пропорциональна степени гипер- или гипогликемии. При этом ведущим механизмом регуляции нормальной концентрации глюкозы в крови является обратимый двусторонний процесс: гликогенез (образование гликогена из поступающих в печень из кишок моносахаридов) и гликогенолиз (образование глюкозы крови из депо гликогена в печени). В течение суток синтезируется и расщепляется приблизительно 65 — 70 % гликогена, что свидетельствует о значительной динамичности его состояния. Первым этапом синтеза гликогена является образование глюкозо-6-фосфата. Глюкоза, из которой синтезируется глю-козо-6-фосфат, поступает в печень, как и в клетку головного мозга, по градиенту концентрации. Инсулин непосредственно на этот процесс влияния не оказывает. Глюкоза как моносахарид свободно диффундирует через мембрану печеночных клеток, поэтому она не может служить резервуаром углеводов в печени. Поскольку фосфатные эфиры глюкозы не так легко проникают через мембраны, фосфори-лирование создает «ловушку», изолируя  реакции в пределах внутриклеточного сектора. Однако фосфаты Сахаров не могут накапливаться в больших количествах в печени, поскольку из-за осмоса увеличение запасов подобных растворимых соединений будет сопровождаться накоплением больших количеств воды. Создание в печени запаса недиффундирующей глюкозы без сопутствующего осмотического набухания органа объясняется способностью печени превращать избыток углеводов в нерастворимый полимер с большой молекулярной массой — гликоген. Инсулин непосредственного влияния на проникновение глюкозы в клетку не оказывает, но дальнейшее превращение глюкозы в глюкозо-6-фосфат уже является ферментативным процессом: его катализирует глюкокиназа. Исходно она обладает более низким сродством к глюкозе по сравнению с аналогичными ферментами в других органах и тканях. Но активность глюкокиназы индуцирует инсулин, секретируемый в ответ на повышение концентрации глюкозы в циркулирующей крови. Таким образом, во время голодания вследствие сниженной секреции инсулина в печеночной клетке, несмотря на свободное поступление через мембрану клетки глюкозы, ее дальнейшее превращение замедлено. Но после приема пищи, повышения концентрации глюкозы и увеличения секреции инсулина печеночная клетка интенсивно превращает глюкозу в гликоген. Содержание гликогена в печени составляет 2 —8 % (в среднем 5 %) массы этого органа, или 100—125 г. Печень не единственное депо гликогена в организме. Его содержат и другие ткани. Количество гликогена в скелетных мышцах, находящихся в состоянии покоя и получающих достаточное количество питательных веществ, достигает 1 % их общей массы. Поскольку общая масса мышц в организме человека велика, суммарные запасы гликогена в мышцах примерно в пять раз больше, чем в печени, однако его невозможно использовать для ликвидации гипогликемии из-за отсутствия необходимых для этого ферментов. Гликоген в мышцах используется для энергетических потребностей клетки. Депо гликогена в печени, наоборот, служит быстромобилизуемым источником глюкозы как для крови, питающей ; другие ткани, так и для нужд самой печени. В течение первых 12 — 24 ч после приема пищи потребности организма в углеводах в основном удовлетворяются за счет распада гликогена в печени. При исчерпании запасов гликогена (голодание в течение примерно 24 ч) глюкоза i синтезируется в печени из углеводных и неуглеводных исходных продуктов (глю-конеогенез). Набор ферментов, необходимых для этого процесса, содержат печень, почки и слизистая кишок. Среди них печень играет главную роль. После длительного голодания замедленная реакция гли-когенолиза в печени на действие эндокринных факторов приводит к усиленному синтезу ферментов глюконеогенеза. Исходными субстратами для глюконеогенеза в печени могут быть пируват и его предшественники (аминокислота аланин, жирные кислоты), оксалоацетат и его предшественники (аминокислоты аспартат, глу-тамат), лактат, образующийся в других органах и тканях и попадающий в печень с током крови. Суммарные реакции образования глюкозы в ходе глюконеогенеза выглядят так: - 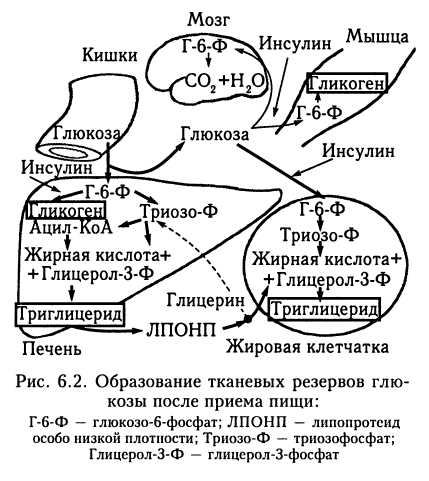 Примером роли печени в глюконеоге-незе с участием лактата является взаимосвязь печени и скелетных мышц в цикле Кори. Во время напряженной работы скелетных мышц лактат образуется в таком избытке, что митохондрии мышц не справляются с окислением пирувата и НАД х х Н, анаэробный гликолиз преобладает над аэробным катаболизмом. Лактат диффундирует в кровоток и достигает других органов, в частности печени и сердца. Сердечная мышца содержит большое количество митохондрий, поэтому она способна окислять не только пируват, образующий- ся в результате протекающего в ней самой гликолиза, но и лактат, поступивший извне. В печени лактат не окисляется, а используется для получения глюкозы при глюко- неогенезе. Образующаяся при этом глюкоза поступает в кровоток, а оттуда — в работающие мышцы, завершая цикл Кори. Существует предположение, что одной из возможных причин внезапной смерти новорожденного является недостаток ферментов глюконеогенеза. Этим может объясняться неспособность организма ребенка поддерживать нормальный уровень гликемии в промежутках между кормлениями и возможность внезапного летального исхода. Указанные механизмы помогают поддерживать постоянство уровня глюкозы в крови и стабильность обеспечения глюкозой такого чувствительного к гипо- и гипергликемии органа, как головной мозг. Этому же способствуют и особенности усвоения глюкозы другими органами и тканями. Так, быстрой нормализации гликемии после увеличения концентрации глюкозы в крови способствует поступление глюкозы в жировую клетчатку и в клетки мышц. В противоположность ее поступлению в печень и головной мозг этот процесс активизируется инсулином. Эти явления не наблюдаются при относительной или абсолютной недостаточности инсулина в условиях сахарного диабета. Кроме этого, фермент гексокиназа, содержащийся в клетках жировой ткани и мышц, который, как и глюкокиназа, стимулирует превращение внутриклеточной глюкозы в глюкозо-6-фосфат, имеет более высокое сродство к глюкозе, что обеспечивает в указанных клетках участие глюкозы в реакциях обмена веществ при более низких концентрациях, чем в печени. Избыток глюкозы печень превращает не только в гликоген, но и в триглицериды жировой ткани, участвуя в создании тканевых энергетических резервов (рис. 6.2). Из глюкозы синтезируются входящие в состав триглицеридов жирные кислоты (синтез глицеринового компонента триглицеридов из глюкозы осуществляется непосредственно в жировой ткани). Образовавшиеся в печени триглицериды в дальнейшем транспортируются в составе липопротеидов особо низкой плотности в жировую клетчатку, где они подвергаются гидролизу, катализируемому липопротеинлипазой. Высвобождающиеся жирные кислоты (печеночного происхождения) конденсируются с глицерол-3-фосфатом, образующимся из глюкозы, которая поступает в жировую ткань под действием инсулина, и накапливающиеся триглицериды составляют тканевой резерв, в котором сохраняется значительно больше энергии, чем в запасе гликогена. При парентеральном питании и введении избыточного количества растворов глюкозы возможно возникновение жировой дистрофии печени. Печень также играет главную роль в превращении галактозы и фруктозы в глюкозу. При нарушении ее функции способность организма использовать галактозу и глюкозу уменьшается. На этом основана ранее широко используемая функциональная проба печени с нагрузкой галактозой и фруктозой. 6.2.3. Обмен липидов Липиды — это соединения, отличительными особенностями которых являются наличие в их молекуле остатков жирных кислот и слабая растворимость в воде. Жирные кислоты содержат длинную неразветвленную цепь углеродных атомов (обычно 16, 18 или 20) и различное число двойных связей (от 0 до 4), а на одном из концов углеродного скелета — карбоксильную группу. Соответствующая формула наиболее распространенной насыщенной жирной кислоты — пальмитиновой — составляет 16:0; ненасыщенной кислоты с одной двойной связью — олеиновой — 18 : 1; полиненасыщенных жирных кислот 18 : 2 (линолевая), 18 : 3 (ли-ноленовая), 20 : 4 (арахидоновая). При этом организм человека способен синтезировать насыщенные и мононенасыщенные жирные кислоты. Полиненасыщенные жирные кислоты являются незаменимыми: они должны поступать с пищей. Значение полиненасыщенных жирных кислот обусловлено их ролью в организме. Во-первых, они являются предшественниками простагландинов, выполняющих различные регуляторные функции. Во-вторых, они поддерживают жидкое состояние липидов клеточных мембран. В-третьих, полиненасыщенные жирные кислоты предотвращают отложение холестерина и других липидов в стенках кровеносных сосудов. Молекулы жирной кислоты содержат большое количество звеньев ((СН2)„), этим объясняется то, что жирные кислоты являются наиболее эффективным энергетическим субстратом организма. Энергия, запасаемая в ходе биологических окислительных процессов, в основном связана с переносом электронов от атомов водорода по дыхательной цепи и фосфорилиро-ванием АДФ до АТФ. Поскольку жирные кислоты построены преимущественно из углерода и водорода, их окисление сопровождается большим выходом энергии, чем, например, углеводов: в состав последних входят и атомы кислорода. Так, при окислении 1 г жиров образуется 9 ккал (37,67 кДж) энергии, 1 г углеводов или белков — по 4 ккал (16,74 кДж). Более половины основной энергетической потребности многих тканей удовлетворяется за счет жиров, особенно в период голодания. Жирные кислоты редко встречаются в свободном виде. Обычно они входят в состав различных соединений — ацилгли-церидов, фосфоглицеридов, стероидов, жирорастворимых витаминов A, D, Е и К. Среди них особое место занимают три-ацилглицериды. В молекуле глицерина содержатся три гидроксильные группы, которые могут быть этерифицированы жирными кислотами с образованием соответственно моно-, ди- или триацилгли-церидов. Триацилглицериды обычно называют жирами. Их содержание в составе липидов, поступающих с пищей, у человека достигает более 90 %. Процесс метаболизма липидов пищи в просвете и стенке пищеварительного канала состоит из нескольких основных этапов: 1. Секреция поджелудочной железой гидролитических ферментов, содержащих липазы и буферные системы, разрывающие в жирах сложноэфирные связи. 2. Поступление в просвет ПК в составе желчи желчных кислот, эмульгирующих жиры и продукты их распада. 3. Гидролиз липидов под влиянием секрета поджелудочной железы и желчи до моноглицеридов и свободных жирных кислот. Моноглицериды располагаются между молекулами солей желчных кислот, образуя смешанные мицеллы. 4. Захват слизистой кишок мицелл с последующим превращением в стенке кишок. При этом жирные кислоты и моноглицериды вступают друг с другом в энергозависимые реакции реэтерификации с образованием триацилглицеридов, характерных именно для данного организма. 5. Транспорт липидов к печени как по системе воротной вены, так и по системе печеночной артерии. По системе воротной вены в печень поступает лишь незначительная часть липидов. К ним относятся соли желчных кислот и жирные кислоты с короткой цепью. Последние переносятся к печени в виде комплексов с альбумином плазмы. Достигая печени, они подвергаются катаболизму в ходе реакций окисления и не играют большой роли в обмене веществ, за исключением детей, в питании которых преобладают жиры молока. Соли желчных кислот, наоборот, захватываются печенью для дальнейшего использования. Они поступают в общий пул из нескольких граммов желчных кислот во внутриклеточном пространстве, в желчных протоках и в концен- трированном виде — в желчном пузыре. Таким образом, совершается энтеросистем-ная рециркуляция желчных кислот. При этом лишь незначительная часть желчных кислот экскретируется с калом. Основная часть липидов транспортируется к печени по системе печеночной артерии. Ресинтезированный триацилглице-рид и холестерин поступают из кишок в лимфатические сосуды, затем через грудной лимфатический проток попадают в кровь. Липиды к печени переносятся преимущественно в виде хиломикронов, хотя пул транспортных форм липидов разнообразен. После приема жирной пищи в крови содержится большое количество хиломикронов, вследствие чего плазма мутнеет и делается похожей на молоко. Это вызывает появление в крови так называемого просветляющего фактора. В его состав входит липаза липопротеидов, расщепляющая триглицериды хиломикронов и липопротеидов. Расщепляющий фактор образуется под влиянием гепарина, содержащегося в печени, легких, мышцах и других органах. На этом основаны рекомендации добавлять небольшие дозы гепарина в растворы жировых эмульсий при проведении парентерального питания. Еще одним источником липидов, поступающих в печень, являются свободные жирные кислоты, освобождаемые из жировой ткани и поступающие к печени с кровью в виде комплексов с альбумином. Хотя в самой печени запасы жиров незначительны (они составляют менее 1 % общей массы органа), она занимает ключевую позицию в процессах мобилизации, переработки и биосинтеза жиров. Окисление жирных кислот в печени осуществляется в митохондриях. Процессы связаны с заключительными реакциями катаболизма в системе переноса электронов и цикла лимонной кислоты. При этом окисление жирных кислот состоит из трех основных этапов (рис. 6.3). 1. Активация жирных кислот путем энергозависимой реакции образования тиоэфиров ацил-КоА. 2. р-Окисление — замкнутый цикл реакций последовательного отщепления атомов водорода от алкильной цепи и двухуглеродных остатков в виде молекул ацетил-КоА. 3. Окисление в цикле лимонной кислоты образующихся молекул ацетил-КоА до СО2 и дополнительного количества водорода, используемого затем при окислительном фосфорилировании. Печень играет также ключевую роль в процессах липогенеза — в синтезе жирных кислот в организме. За исключением полиненасыщенных, все другие жирные кислоты, необходимые либо как структурные липиды для построения мембран, либо для создания тканевых депо, синтезируется в организме человека. Любое вещество, конечным продуктом обмена которого является ацетил-КоА, может быть использовано в липогенезе. Но наиболее значимым предшественником являются углеводы (см. «Обмен углеводов»). Во всех случаях, когда потребление углеводов превышает энергетические потребности организма, их избыток превращается в жиры. Печень также принимает активное участие в обмене холестерина в организме человека. В отличие от триацилглицеридов, играющих роль энергетического резерва, холестерин является компонентом клеточных мембран, предшественником солей желчных кислот, стероидных гормонов, витамина D, а при патологии — узловым патогенетическим звеном развития атеросклероза. Часть холестерина поступает в организм с пищей. Небольшое количество 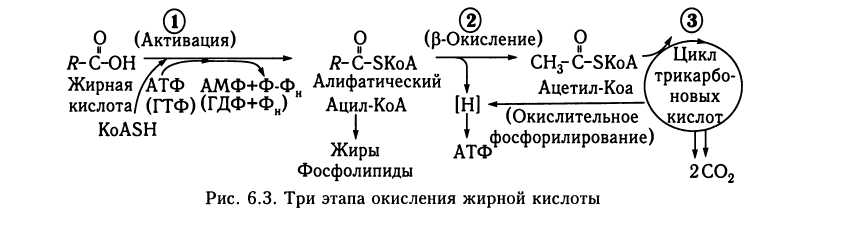 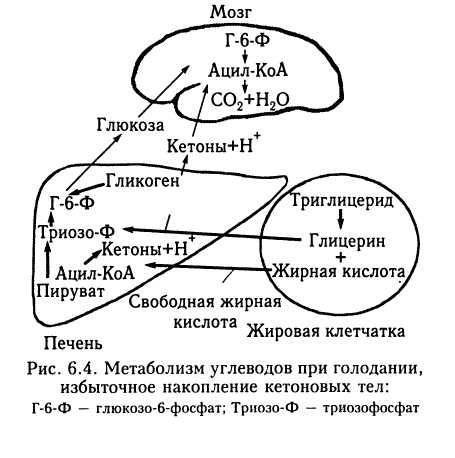 вещества образуют мицеллы с солями желчных кислот и за счет этого проникают в клетки слизистой кишок, в составе хиломикронов попадают в системный кровоток. При этом количество всасывающегося в кишках холестерина ограничено до 0,5 г/сут. Холестерин хиломикронов задерживается в печени, где подвергается метаболизму с образованием производных холестерина в мембранах печеночных клеток и желчных кислот. При этом синтез желчных кислот является важным механизмом элиминации холестерина из организма. Это обусловлено тем, что образование желчных кислот регулируется по принципу обратной связи. При уменьшении количества желчных кислот, всасывающихся в просвете кишок в процессах эн-теросистемной рециркуляции, например, за счет их связи в просвете кишки, в печени увеличивается синтез желчных кислот. За счет этого возможно уменьшение концентрации холестерина в кровотоке. Кроме поступления холестерина с пищей клетки печени и слизистой оболочки кишки могут синтезировать его из ацетил-КоА. Выведение холестерина в составе желчных кислот может вести к его патологическому накоплению в желчных протоках в составе желчных камней. Печень является местом синтеза кетоновых тел (ацетоуксусная кислота, р-оксимас-ляная кислота и ацетон). В норме их содержание в плазме не превышает 10 мг/л, но значительно возрастает при декомпенсации сахарного диабета. При этом происходят противоположные описанным при характеристике обмена углеводов процессы превращения триглицеридов жировой клетчатки (рис. 6.4). В условиях голодания, когда экзогенная глюкоза отсутствует, эндогенные триглицериды жировой клетчатки претерпевают обратное превращение путем липолиза в свободные жирные кислоты и глицерин. Эти соединения транспортируются в печень, где глицерин включается в реакции глюконеогенеза. Синтезируемая при этом глюкоза может поступать в кровоток в то время, когда концентрация глюкозы в плазме имела бы тенденцию к снижению, если бы процесс глюконеогенеза не функционировал. Кроме того, свободные жирные кислоты, поступающие из жировой ткани, могут использоваться большинством органов и тканей (за исключением головного мозга) как источник энергии. При превращении свободных жирных кислот в печени образуется ацетил-КоА. Путем ферментативного превращения двух молей ацетил-КоА в печени образуется ацетоуксусная кислота, которая в дальнейшем может быть восстановлена до р-оксимасляной кислоты или декарбо-ксилирована с образованием ацетона. 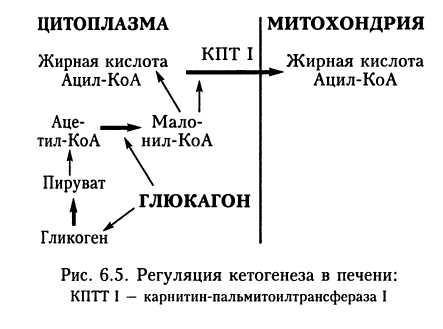 Таким образом, взаимосвязь биохимических процессов в печени и жировой ткани способствует поддержанию нормальной концентрации глюкозы в крови при голодании. Благодаря этому, а также за счет поступления и утилизации свободных жирных кислот обеспечивается энергоснабжение органов и тканей в случае отсутствия поступления экзогенной глюкозы. Биохимическим эквивалентом голодания может быть накопление в кровотоке кетоновых тел. При декомпенсации сахарного диабета повышение их концентрации обусловлено не только относительным или абсолютным недостатком инсулина и энергетическим голоданием органов и тканей, поскольку степень накопления кетоновых тел в данном случае зачастую гораздо больше, чем при отсутствии поступления пищи в связи с голоданием или нарушением функции пищеварительного канала, но и накоплением контринсулярных гормонов стресса чаще всего вследствие развития сопутствующего заболевания (прежде всего, воспалительных процессов, тром-боэмболических осложнений, инфаркта миокарда). Одним из таких контринсулярных гормонов является глюкагон (рис. 6.5). Кетоновые тела образуются в митохондриях печени. При этом количество соединений жирных кислот, поступающих в митохондрии печени, зависит от активности фермента карнитин-пальмитоилтрансфе-разы, локализованного на внешней стороне мембраны митохондрии. Обычно активность этого фермента снижена за счет повышенной концентрации в цитоплазме соединения малонил-КоА, являющегося первым промежуточным продуктом синтеза жирных кислот, уровень которого регулируется циркулирующим в крови глюкаго-ном. При накоплении последнего происходит нарушение образования малонил-КоА как вследствие блокирования гликолиза, так и из-за снижения активности малонил-КоА карбоксилазы. В результате увеличивается активность фермента карнитин-пальмитоилтрансферазы. Следствием этих процесов является поступление в митохондрии большого количества жирных кислот с последующим усилением активности кетогенеза. При этом в основном образуются ацетоуксусная кислота и р-гид-роксибутират. Печень также принимает активное участие в биосинтезе фосфолипидов и липо-протеидов. В норме печень содержит небольшие запасы жиров. В отдельных случаях возможно патологическое отложение жиров в органе. Это может быть обусловлено или нарушением их метаболизма при нормальном поступлении жиров в печень, или избыточным поступлением жиров на фоне нормальных процессов метаболизма в печеночной клетке. Типичными, причинами жировой инфильтрации печени являются: 1. Воздействие на печень токсикантов, в частности этанола, хлороформа, четырех-хлористого углерода. 2. Инфекционное поражение печени. 3. Поражение печени злокачественным процессом. 4. Избыточное поступление жиров в печень из тканевых депо при голодании, сахарном диабете. 5. Избыточное поступление углеводов в организм при парентеральном питании. 6. Пища, содержащая недостаточное количество белка. 6.2.4. Билирубин и его циркуляция 80 % всей массы билирубина образуется в результате разрушения эритроцитов в системе мононуклеарных фагоцитов, преимущественно селезенки. Высвобождаемый гемоглобин расщепляется до глобина, поступающего в общий фонд белков, и гема, превращающегося в билирубин после потери железа, которое затем используется повторно. К числу других источников билирубина относятся: распад незрелых эритроцитов в тканях костного мозга, а также близких к гемоглобину по составу и свойствам миоглобина и цитохромов. Образовавшийся в результате распада эритроцитов билирубин называют свободным неконъюгированным билирубином (это билирубин, которому еще не придана водорастворимость в результате конъюгации с глюкуронатом в печени). Он связывается с альбумином плазмы. Вследствие этого билирубин не может проникать ни через почечные клубочки в мочу, ни через биомембраны мозга. Но при низком содержании альбумина в плазме, вытеснении из билирубина связи с альбумином (в том числе и под действием лекарственных соединений), а также при нарушении (незрелости — у новорожденных) механизмов конъюгации в печени в плазме увеличивается фракция свободного неконъюгированного билирубина, который растворим в липидах, проникает через гематоэнцефа-лический барьер и вызывает токсическое повреждение ткани мозга. В печени происходит перенос билирубина от альбумина плазмы через свобод-нопроницаемую мембрану сосудистых синусов в гепатоциты. Этот процесс осуществляется с помощью транспортных белков. Перенос билирубина происходит быстро вследствие наличия в цитозоле связывающих белков, а также благодаря его быстрому последующему метаболизму в гепа-тоците в реакции глюкуронидизации и выделению в желчь. В гепатоците происходит активный транспорт поступившего билирубина в гладкий эндоплазматический ретикулум и конъюгация его с глюкуроновой кислотой в ходе процесса, катализируемого уридин-дифосфат-глюкуронилтрансферазой. При печеночно-клеточной желтухе активность этого фермента поддерживается на достаточном уровне, а при холестазе — увеличивается. Однако у новорожденных активность фермента снижена. Дефицит функции конъюгирующих ферментов является основой таких семейных негемолитических гипербилирубинемий, как синдромы Жильбера и Криглера —Найяра. Билирубин-моноглюкуронид поступает к обращенной в сторону желчных канальцев поверхности гепатоцита, где после присоединения второго остатка глюкуро-ната образуется диглюкуронид билирубина, который активно секретируется в желчные канальцы. Последующий транспорт зависит от нормального оттока желчи, а также от состояния транспортных белков. Экскреция билирубина в канальцы происходит с помощью семейства АТФ-зави-симых мультиспецифичных для органических анионов транспортных белков. Желчные кислоты переносятся в желчь также с помощью другого транспортного белка. Наличие разных механизмов транспорта билирубина и желчных кислот обуславливает клиническую картину синдрома Дубина —Джонсона, при котором нарушается экскреция конъюгированного билирубина, но сохраняется нормальная экскреция желчных кислот. При поражениях печени и повышении давления в желчевыводящих путях наиболее высока вероятность нарушения именно процессов секреции билирубина в желчные протоки, требующих затраты энергии. Поэтому повышение концентрации конъюгированного билирубина в плазме является наиболее ранним проявлением нарушения его экскреции. При печеночной желтухе, как правило, в плазме повышено содержание обеих фракций билирубина, но преобладает конъюгированный, который растворим в воде, менее прочно, чем свободный, связывается с белками и может экскретироваться с мочой. Конъюгированный билирубин поступает в кишки с желчью. Диглюкуронид билирубина водорастворим (полярная молекула), поэтому в тонкой кишке не всасывается. В толстой кишке конъюгированный билирубин подвергается гидролизу р-глюкуронидазами бактерий до соединений, обозначаемых собирательным термином стеркобилиноген (или уробилиноген кала). При бактериальном холангите часть диглюкуронида билирубина гидролизуется уже в желчных путях с последующей преципитацией билирубина. Этот процесс может играть важную роль в образовании билирубиновых желчных камней. Небольшая часть стеркобилиногена всасывается, попадает в систему портального кровообращения и преимущественно вновь экскретируется с желчью; очень небольшая его фракция экскретируется с мочой в виде уробилиногена, который, в свою очередь, может быть окислен до уробилина. Уробилин (оген) в отличие от билирубина часто обнаруживается в моче здоровых лиц, особенно в тех случаях, когда экскретируется концентрированная моча. У здорового человека экскреция уробилиногена с мочой настолько изменчива, что клинически значимо только обнаружение очень высокой концентрации уробилиногена в моче во время острых приступов гемолиза. Неабсорбированный стеркобилиноген окисляется до стеркобилина — пигмента, придающего калу коричневую окраску. Поэтому малоокрашенные фекалии рассматриваются как признак закупорки желчных протоков. Билирубин, уробилин и стер-кобилин (желчные пигменты) — окрашены. Уробилиноген и стеркобилиноген — бесцветны. Конъюгированный и неконъюгирован-ный билирубин иногда обозначают соответственно терминами «прямой» и «непрямой билирубин». 6.2.5. Влияние анестезии на метаболические функции печени Стресс, оперативное вмешательство сопровождаются повышением концентрации гормонов стресса (катехоламины, глюка-гон, кортизол) и одновременным снижением анаболических гормонов (инсулин, тестостерон). В результате катаболизм доминирует над анаболизмом. Это проявляется увеличением интенсивности распада белков, образования мочевины, снижением синтеза белков, повышением концентрации глюкозы. Последнее обусловлено активацией гликогенолиза и глюконеоге-неза. Энергетическую ценность образующейся в результате глюконеогенеза глю ■ козы иллюстрируют следующие реакции: 2 Лактат + 6 АТФ ► Глюкоза; Глюкоза ► 2 Лактат + 2 АТФ. Метаболизм жиров под влиянием оперативного вмешательства изменяется в меньшей степени. Степень этих отклонений зависит от эффективности анестезии: при использовании регионарных методов анестезии, предотвращающих поступление ноцицептивной информации в централь- ■ ную нервную систему, она меньше. [ Непосредственному влиянию средств для ■ наркоза на метаболизм в печени посвяще- ны лишь единичные исследования. Так, оказалось, что фторотан нарушает потреб- ление кислорода в цикле синтеза мочеви- - ны, глюконеогенез, усвоение лактата, содер- i жащегося в плазме. При использовании - этого анестетика может повыситься концен- ■ трация молочной кислоты в крови. В экс- > периментальных исследованиях на куль- - турах клеток также выявлено, что фторо- ■ тан и энфлуран могут угнетать синтез бел- - ков в печеночной клетке. |
