Методические разработки
 Скачать 2.11 Mb. Скачать 2.11 Mb.
|
|
6.3. ЖЕЛЧЕОБРАЗОВАНИЕ И ЖЕЛЧЕОТДЕЛЕНИЕ 6.3.1. Состав и функция желчи. Желчные кислоты Желчь является одновременно и экскреторным, и секреторным продуктом печени. Экскреторный характер желчи подтверждается тем, что в ее состав входят вещества, которые в силу своей баластно-сти и даже токсичности подлежат удалению из организма. Характеристика желчи как секрета обусловлена тем, что она содержит вещества, участвующие в ряде физиологических процессов в кишках, которые способствуют расщеплению и всасыванию пищевых соединений. Ежесуточно в печени образуется приблизительно 10 мл желчи на 1 кг массы тела, в среднем у взрослого — около 600 мл. В желчевыводящих путях происходит активная реабсорбция электролитов (Na+, СГ, НСО3) и изоосмотическая пассивная реабсорбция воды. В результате образуется пузырная желчь, в 10 раз более концентрированная, чем печеночная, содержащая в качестве преобладающего катиона натрий, а в качестве доминирующих анионов — соли желчных кислот. Таким образом, желчный пузырь выполняет не только резерву арную функцию, высвобождая после приема пищи необходимую для пищеварения желчь, но и защитную. Высокая ос-молярность желчи предотвращает размножение в ней микроорганизмов из просвета кишки. Нарушение концентрирования желчи, дренирование желчных протоков, формирование билиодигестивных анастомозов может создавать условия для инфицирования желчи и развития ангиохолита. На оценке осмолярности желчи основан метод идентификации протоковой желчи при исследовании больного с подозрением на бил парный сепсис. Согласно данным Украинского центра интенсивной терапии сепсиса, в структуре так называемых «лихорадок неясного происхождения» частота встречаемости билиарно го сепсиса составляет 23,4 %. Дифференциальная диагностика и реализация этио-тропного обоснования выбора антибиотиков в таких случаях требует получения желчи, выделения из нее возбудителя и оценки его чувствительности к антибиотикам. При этом для разграничения желчи из общего протока, желчного пузыря и внутрипеченочных протоков обычно используется метод Лопеса, в соответствии с которым вид желчи устанавливается на основе внешних признаков. Но такой подход в клинике часто не позволяет четко разграничить источник желчи. Поэтому с целью дифференциальной диагностики более обосновано разграничение вида желчи регистрацией ее осмолярности: осмо-лярность более 410 моем/л характерна для общего желчного протока (порция «А»), 360 — 400 моем/л — для желчного пузыря (порция «В»), 290 — 360 мосм/л — для внутрипеченочных ходов (порция «С»). Желчь состоит из желчных кислот, холестерина, фосфолипидов, билирубина, белков, минеральных ионов, воды (табл. 6.2). Из приведенных в таблице данных следует, что основным компонентом желчи являются желчные кислоты. В организме человека происходит образование четырех желчных кислот. Две из них называются первичными — это холевая и хенодезоксихолевая кислоты. Они синтезируются в печени из холестерина. При этом расходуется около 40 % холестерина, содержащегося в организме. Первичные желчные кислоты с желчью поступают в кишки, где при участии бактерий превращаются во вторичные — дез  оксихолевую и литохолевую. Часть вторичных желчных кислот подвергается всасыванию в кишках и повторно выделяется печенью. Таким образом, желчь содержит смесь первичных и вторичных желчных кислот. Они представлены натриевыми солями и конъюгированы с аминокислотами глицином и таурином. Конъюгация является важным механизмом, предотвращающим образование в желчных протоках осадка желчных кислот, а в просвете кишки — преждевременную абсорбцию желчных кислот в проксимальном отделе тонкой кишки и таким образом удерживающим желчные кислоты в просвете кишки в концентрациях, достаточных для осуществления переваривания и абсорбции жиров. Это обусловлено тем, что соли конъюгированных жирных кислот выпадают в осадок лишь при рН = 4,3 — 5,0, тогда как неконъюгированных — при рН = = 6,5 — 7,0. В то же время рН печеночной желчи в норме колеблется в пределах 7,3 — 7,7, пузырной — 6 — 7. В физиологических условиях в желчи и в просвете кишки рН = 4,3 — 5,0, в пределах которого происходит выпадение в осадок конъюгированных желчных кислот, не наблюдается. Если же в тонкой кишке происходит анормальная пролиферация бактериальной флоры, то может вести к деконъю-гации желчных кислот. Вследствие этого они быстро всасываются, что может привести к недостаточной для абсорбции жиров внутрипросветной концентрации желчных кислот и стеаторее. В норме большая часть желчных кислот не синтезируется вновь, а реабсорбирует-ся из кишок и доставляется в печень. При этом возможны два пути рециркуляции желчных кислот: 1. Портальный путь — вещества, абсорбированные из кишок, попадают в воротную вену и транспортируются в печень. Таким образом реабсорби-руется 98 % всосавшихся в кишках желчных кислот. 2. Экстрапортальный путь — всосавшиеся в кишках вещества по лимфатическим путям поступают в лимфатический проток, а затем — в верхнюю полую вену и разносятся током крови по всему организму. Из общего кровотока желчные кислоты захватываются печенью. В крови желчные кислоты связывают- 9 ся с альбумином. При однократном про- l хождении через печень извлекается око- ъ ло 90 — 95 % желчных кислот. Благодаря \ такой эффективности захвата гепатоцита- г ми уровень желчных кислот в перифери- г ческой крови крайне низок. Почечный ъ клиренс желчных кислот очень мал, по- ъ этому почти все желчные кислоты, попавшие в общий кровоток, возвращаются в печень. Низкий почечный клиренс желчных кислот почками отражает общую закономерность: чем более интенсивная связь вещества с белком, тем менее вероятен почечный клиренс соединения и тем необходимее участие печени в освобождении крови от такого химического вещества. В просвете кишки под влиянием желчных кислот происходит эмульгирование поступивших с питанием жиров. Желчные кислоты обволакивают жировые капли и, будучи поверхностно-активными веществами, уменьшают их поверхностное натяжение, способствуя тем самым расщеплению капелек на меньшие частицы, а также стабилизируют жировую эмульсию. Поскольку желчные кислоты растворимы в воде, они, соединяясь с липидами, повышают растворимость последних. Наконец, желчные кислоты активируют липазу поджелудочной железы. Липаза является белком и растворяется в воде, а так как жиры в воде не растворяются, то действие липазы на жиры происходит главным образом на их поверхности, т. е. на границе раздела фаз вода —жир. Таким образом, активируя липазу и создавая условия для ее нормального функционирования, желчные кислоты способствуют перевариванию и абсорбции жиров пищи и жирорастворимых витаминов. Уменьшение поступления желчи в двенадцатиперстную кишку вследствие патологического процесса на каком-либо участке от гепатоцита до фа-терова соска называют холестазом. Его клинико-физиологические и патохимичес-кие последствия приведены на рис. 6.6. 6.3.2. Функциональная анатомия желчевыводящих путей Начальным элементом желчных путей является желчный каналец, контактирующий с гепатоцитом (рис. 6.7). Желчные канальцы впадают в дуктулы, называемые иногда холангиолами, или каналами Геринга. Дуктулы располагаются в основном в портальных зонах и впадают в междоль-ковые желчные протоки, которые первыми из желчных путей сопровождаются 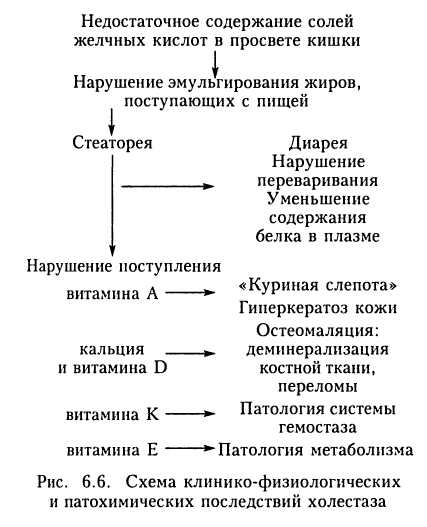 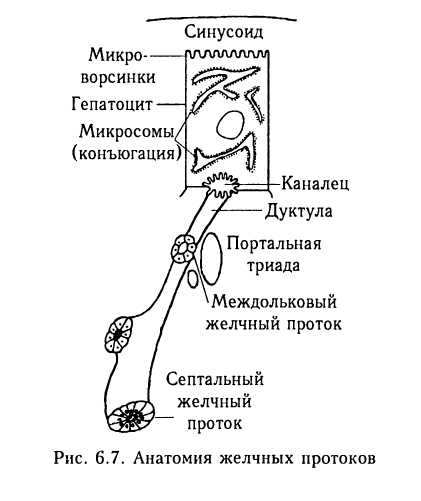 веточками печеночной артерии и воротной вены и обнаруживаются в составе портальных триад. Междольковые протоки, сливаясь, формируют септальные протоки, которые, в свою очередь, образуют два главных печеночных протока, выходящих из правой и левой долей в области ворот печени. Гепатоцит представляет собой полярную секретирующую эпителиальную клетку. В его структуре выделяют базолатераль-ную и апикальную мембраны. Базолате-ральная мембрана обращена к синусоидам, поэтому ее иногда называют также синусоидальной, апикальная — в сторону желчного канальца, вследствие этого она еще называется канальцевой мембраной. Образование желчи включает захват гепатоцитом желчных кислот и других органических и неорганических ионов, транспорт их через базолатеральную (синусоидальную) мембрану, синтез ряда соединений в гепатоците, транспорт синтезированных и захваченных веществ через цитоплазму и секрецию в желчный каналец. Процесс переноса соединений через апикальную мембрану сопровождается осмотической фильтрацией воды, содержащейся в гепатоците и парацеллюлярном пространстве. В образовании желчи участвуют такие структурно-функциональные образования гепатоцита:
5. Промежуточные филаменты, образующие сеть между внутриклеточными структурами. Разрыв промежуточных филамен-тов приводит к нарушению внутриклеточных транспортных процессов и облитерации просвета канальцев. Функции вышеназванных структурно-функциональных образований являются энергозависимыми процессами. Выделение таких образований важно, поскольку их поражения — главные звенья формирования внутрипеченочного холестаза (в отличие от внепеченочного холестаза при внутрипеченочном отсутствует обструкция магистральных желчных протоков). Так, повреждение базолатеральной и канальцевой мембран гепатоцита, внутриклеточных органелл развивается при холестатическом варианте вирусного и алкогольного гепатита. Некоторые лекарственные соединения, например аминазин, сульфаниламиды, нарушают активность микрофиламентов, что также обуславливает возникновение внутрипеченочного холестаза. Контакт гепатоцитов, отделяющий просвет канальцев от кровеносной системы печени, называют плотным контактом, целостность которого обеспечивается специализированными белками. Через плотные контакты между гепатоцитами по осмотическому градиенту могут перемещаться вода и электролиты, но крупные молекулы не проникают. Разрыв плотных контактов сопровождается попаданием в канальцы растворенных крупных молекул, а это приводит к потере осмотического градиента и развитию холестаза. При этом также может наблюдаться регургитация канальцевой желчи в синусоиды. 6.3.3. Желчеобразование С точки зрения механизмов формирования выделяют три фракции желчи, две из которых связаны с функцией гепатоцита.
В отдельных случаях нарушается выделение желчи и билирубина с желчью, но сохраняется выделение других фракций желчи. У таких пациентов желчь становится бесцветной (белая желчь) и напоминает слизистую желчь. 6.3.4. Желчный пузырь и его моторика. Влияние анестезии на нарушение моторики у больных в критическом состоянии Сокращение желчного пузыря находится под холинергическим и гуморальным контролем. Раздражение блуждающего нерва вызывает расслабление сфинктера Одди и сокращение желчного пузыря. Гуморальная регуляция деятельности желчного пузыря связана с холецистокинином, выделяющимся в ответ на поступление в двенадцатиперстную кишку жира с пищей. Он вызывает сокращение желчного пузыря, усиливает секрецию жидкости и разведение желчи. Отсутствие поступления пищи в пищеварительный канал у больных в критическом состоянии, а также получающих полное парентеральное питание сопровождается холестазом, а в отдельных случаях может даже приводить к образованию желчных камней. Лекарственные вещества, которые оказывают влияние на вегетативную нервную систему, могут воздействовать и на моторику желчного пузыря. Так, атропин уменьшает его сократительную способность. К препаратам, вызывающим спазм сфинктера Одди, относятся наркотические анал-гетики. Особенно это характерно для морфина и меперидина. При этом влияние опиатов на сфинктер Одди потенцируется галотаном и энфлураном. Точное значение повышения давления в желчевыво-дящих путях неясно. Имеющиеся данные позволяют сделать вывод, что это клинически малозначимо. Спазм желчевыводя-щих путей, возникающий под влиянием наркотических аналгетиков, купируется полным антагонистом опиатных рецепторов налоксоном, частично эффективны глюкагон, нитроглицерин, атропин. Эти данные свидетельствуют, что механизм спазма сфинктера Одди лишь отчасти обусловлен влиянием препаратов на нервную систему. Предполагается также вклад гистаминолибераторного эффекта наркотических аналгетиков. Этим может объясняться то, что спазм сфинктера особенно характерен после применения морфина и меперидина, гистаминолибераторные свойства которых выражены больше, чем у других опиоидов. 6.4. РОЛЬ ПЕЧЕНИ В ГЕМ0П0ЭЗЕ 6.4.1. Роль печени в эритропоэзе С 9-й по 24-ю неделю внутриутробного развития гемопоэтическая активность плода связана преимущественно с печенью. Печеночный период кроветворения является вторым в последовательной смене кроветворных органов плода, сменяя желточный (первые очаги кроветворения появляются на 19-й день развития эмбриона в так называемых кровяных островках, расположенных в стенке желточного мешка). После дифференциации костной ткани и костного мозга печеночный период сменяется костномозговым (медуллярным) кроветворением. С этого момента гемопоэти-ческие клетки полностью исчезают из печени. Но при нарушении функции костного мозга или при миелопролифератив-ных заболеваниях активность гемопоэти-ческих клеток в печени может восстанавливаться. Роль печени в гемопоэзе также связана с ее участием в обмене витамина В12 и фолиевой кислоты. Давно замечено, что одним из эффективных антианемических средств является сырая печень и препараты, полученные из нее. Были проведены эксперименты по выявлению антианемического фактора, изучению его строения и механизма действия. Результатом стало выделение витамина В12. Печень является основным депо витамина Bj2 в организме, куда витамин поступает с пищей животного происхождения (печень, почки, сердце, мышцы и другие органы). Из печени витамин В12 попадает в костный мозг, где используется в процессах кроветворения. Фолиевая кислота необходима для нормального протекания процессов образования эритроцитов и лейкоцитов. Печень накапливает активную форму расщепленной фолиевой кислоты в организме — тет-рагидрофолат, участвующий в различных биохимических процессах. Заболевание печени часто сопровождается анемией, чье развитие обусловлено следующими причинами: 1. Нарушается необходимый для нормального гемопоэза обмен веществ. 2. Эритроциты распадаются в большем, чем обычно, количестве. Это происходит вследствие часто сопутствующего патологии печени гиперспленизма, а также уменьшения длительности жизни эритроцита, поскольку состав и функции клеточной мембраны нарушаются в результате отклонений от нормы обменных процессов. 3. Развивается кровопотеря в связи с портальной гипертензией на фоне цирроза печени. Это может также обуславливаться сопутствующими язвами желудка и двенадцатиперстной кишки (особенно при алкоголизме). Анемию усугубляют тромбоцитопения и нарушение свертывания крови. Тяжелому поражению печени часто сопутствует лейкоцитоз. Он обусловлен нарушением функции системы мононуклеар-ных фагоцитов и проникновением микроорганизмов из просвета кишки в системный кровоток. В отдельных случаях этот же механизм является причиной лейкопении. При патологии печени могут развиваться тромбоцитопения и тромбоцитопатия. Механизмы их следующие. 1. Часто сопутствующий гиперспленизм. 2. Нарушение клеточной мембраны тромбоцитов в связи с патологией обмена веществ, развитием ДВС-синдрома. Это ведет к нарушению агрегации тромбоцитов. 3. Нарушение образования тромбоцитов в костном мозгу вследствие нарушения обмена веществ. 4. У некоторых пациентов с вирусными гепатитами причиной тромбоцитопе-нии может быть выработка антитромбо-цитарных антител. 6.4.2. Роль печени в обмене порфиринов Гем является составной частью гемоглобина. Он синтезируется в большинстве тканей организма. В костном мозгу происходит его включение в состав гемоглобина. В других клетках гем используется при синтезе компонентов цепи переноса электронов — цитохромов и родственных им соединений. Промежуточными соединениями процесса образования гема являются порфирины (рис. 6.8). Синтез непосредственного предшественника гема -протопорфирина наиболее активно протекает в печени и в эритроцитах. Группу метаболических заболеваний, при которых имеются дефекты ферментов биосинтеза гема, характеризующихся избыточным накоплением и экскрецией порфиринов и их предшественников, называют порфириями. Клинические их проявления разнообразны и могут варьировать от достаточно ярких до стертых. При этом главными клиническими проявлениями являются неврологические (психоз, вегетативная дисфункция, периферическая нейропатия, боль в животе) и кожные на 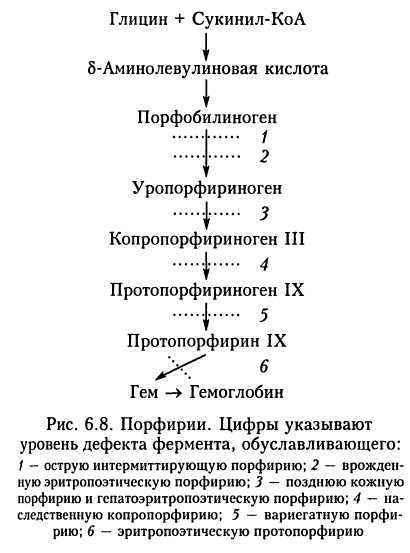  рушения (чаще всего фотосенсибилизация). Нейропсихические отклонения главным образом характерны для порфирий, в основе которых лежат дефекты ферментов, участвующих в начальных этапах метаболической цепочки синтеза гема. Дефекты ферментов и накопление субстратов на последующих этапах преимущественно ведут к кожным проявлениям. Различные дефекты синтеза гема лежат в основе выделения типов порфирий (табл. 6.3). А с учетом того, что синтез протопорфирина наиболее активно протекает в печени и эритроцитах, порфирий делят на печеночные и эритропоэтические. При этом для острых печеночных порфирий (острая перемежающаяся порфирия, наследственная копропорфирия и вариегатная порфирия) характерны обострения с нейропсихичес-кой симптоматикой, рвотой, абдоминальными коликами и периферической нейропа-тией. Важным моментом является то, что обострение возникает под воздействием лекарств, индуцирующих ферменты печени, включая препараты для наркоза — барбитураты, кетамин, пентазоцин, галотан. Факторами, вызывающими обострение печеночных порфирий, также могут быть алкоголь, пероральные контрацептивы, беременность, предменструальный период. Подобно гемофилии, печеночную порфи-рию называют «королевской болезнью», так как она передавалась по наследству в королевских домах Ганновера и Пруссии, а также в семье Стюартов (помешательство короля Англии Георга III связывали с этим заболеванием). Поздняя кожная порфирия, а также эритропоэтические порфирий обычно не сопровождаются острыми неврологическими расстройствами. Препараты для наркоза на них влияния не оказывают. Основным клиническим проявлением этих видов порфирий являются поражения кожи, чаще всего фотосенсибилизация. |
