|
|
Методические разработки
6.1.2. Регуляция кровообращения в печени
6.1.2.1. Внутренняя регуляция
Ауторегуляция. Кровоснабжение печени относительно стабильно. Это обеспечивается ауторегуляцией кровотока, а также реципрокностью взаимосвязи кровотока по печеночной артерии и воротной вене. При этом ауторегуляция кровотока (изменение сопротивления сосуда в зависимости от колебаний системного артериального давления) преимущественно характерна для печеночной артерии и в меньшей степени — для воротной вены, это обусловлено тем, что в воротной вене величина давления невелика: основной перепад давлений произошел до поступления крови в v. portae — на уровне сосудистых бассейнов кишок, желудка, поджелудочной железы.
Особенностью ауторегуляции кровотока по печеночной артерии является то, что она преимущественно выражена при функционально активном состоянии органа — после приема пищи, малохарактерна натощак, в том числе и при плановых оперативных вмешательствах, при подготовке к которым для предотвращения аспирации желудочного содержимого пациенту запрещается принимать пищу.
Изменение тонуса печеночной артерии позволяет компенсировать колебания не только системного артериального давления, но и давления на уровне печеночной вены. Так, увеличение венозного давления при сердечной недостаточности сопровождается констрикцией печеночных артериол и уменьшением интенсивности кровотока в них (это не характерно для воротной вены).
Стабильность кровоснабжения печени обеспечивается не только ауторегуляцией кровотока по печеночной артерии, но и ре-ципрокной взаимосвязью кровотока по печеночной артерии и v. portae — при увеличении кровотока в одной системе уменьшается кровоток в другой и наоборот. Но
предел компенсации составляет примерно 20 %. Поэтому при полном прекращении кровоснабжения печени по одному из сосудистых бассейнов полного компенсаторного увеличения доставки кислорода по другой сосудистой системе не происходит и может развиться некроз печени.
Поскольку предел компенсаторного колебания кровотока при нарушении кровообращения по одному из сосудов, обеспечивающих доставку кислорода к печени, составляет 20 %, то выполняемая в отдельных случаях портальной гипертензии окклюзия печеночной артерии для обеспечения реартериализации не эффективна, пока не будут дополнительно наложены анастомозы с диафрагмальными артериями.
Особенностью воротной вены является то, что она связана многочисленными ана-i стомозами с полыми венами (портокаваль-ные анастомозы). Это анастомозы с венами пищевода и венами желудка, прямой кишки, околопупочными венами и венами передней брюшной стенки, а также анастомозы между корнями вен портальной системы (верхней и нижней брыжеечных, селезеночной и др.) и венами забрюшин-ного пространства (почечными, надпочечными, венами яичка или яичника).
Анастомозы играют важную роль в развитии коллатерального кровообращения при нарушениях оттока в системе воротной вены при портальной гипертензии. Последняя может возникать на различных участках портальной вены и циркуляции крови в печени. Принципиально важно дифференцировать гипертензию в связи с препятствием до синусоидов, а также на их уровне и после них. Пресинусоидаль-ный тип портальной гипертензии может быть обусловлен обструкцией ствола v. portae, а также поражением разветвлений вены в печени (врожденный печеночный фиброз, саркоидоз, миелопролиферативные заболевания, гепатопортальный склероз при идиопатической портальной гипертензии, отравлении некоторыми химическими соединениями (винилхлорид, мышьяк). У таких больных в связи с портальной гипер-тензией и компенсаторным увеличением кровотока по портокавальным анастомозам течение заболевания осложняется желудочно-кишечными кровотечениями, но функция печеночной клетки обычно сохраняется. Поэтому в подобных случаях отсутствуют такие типичные проявления поражения печени, как желтуха, асцит и др. В противоположность этому при портальной гипертензии в связи с локализацией процесса на уровне и после синусоидов (цирроз любой этиологии, флебосклеротические процессы при алкогольном гепатите, синдром Бадда — Киарри( Синдром Бадда —Киарри характеризуется нарушением оттока крови из печени вследствие тромбоза печеночных вен. Клинические проявления зависят от обширности тромбоза, степени вовлечения нижней полой вены, темпов развития синдрома. Последнее определяет скорость вовлечения коллатерального кровотока. При быстром развитии синдрома возникает гепатомега-лия, боль, сердечно-сосудистая недостаточность. В случаях более медленного развития синдрома наблюдаются гепатомегалия, асцит, признаки пор-токавального анастомозирования, симптомы поражения гепатоцита)) имеет место нарушение функции печеночной клетки. Поэтому прогноз такой группы больных хуже, а возникающее желудочно-кишечное кровотечение вследствие портальной гипертензии существенно усугубляет состояние пациента. Синдром Бадда —Киарри характеризуется нарушением оттока крови из печени вследствие тромбоза печеночных вен. Клинические проявления зависят от обширности тромбоза, степени вовлечения нижней полой вены, темпов развития синдрома. Последнее определяет скорость вовлечения коллатерального кровотока. При быстром развитии синдрома возникает гепатомега-лия, боль, сердечно-сосудистая недостаточность. В случаях более медленного развития синдрома наблюдаются гепатомегалия, асцит, признаки пор-токавального анастомозирования, симптомы поражения гепатоцита)) имеет место нарушение функции печеночной клетки. Поэтому прогноз такой группы больных хуже, а возникающее желудочно-кишечное кровотечение вследствие портальной гипертензии существенно усугубляет состояние пациента.
При патологии печени кровь может течь в обход этого органа как по большим естественным портокавальным коллатералям, так и по портопеченочным венозным анастомозам внутри самой печени.
Шунтирование крови, оттекающей от кишечника, при портальной гипертензии является одним из механизмов возникающей при заболевании печени энцефалопатии (портосистемная энцефалопатия). Источником интоксикации при портокаваль-ной энцефалопатии является содержимое кишок, в том числе токсины, вырабатываемые кишечными бактериями. Это служит обоснованием применения у таких больных перорального приема антибиотиков и очищения кишок слабительными, способствующими подавлению микрофлоры кишок.
Метаболическая регуляция. Основными факторами метаболической регуляции печеночного кровотока являются: парциальное напряжение кислорода и углекислого газа в крови, осмолярность крови. Так, системная артериальная гипоксемия с понижением парциального напряжения кислорода в артериальной крови до 30 мм рт. ст. и менее повышает сопротивление печеночных артерий практически в два раза и уменьшает печеночный кровоток. Но на тонус печеночных артерий системная ги-пероксия существенного влияния не оказывает. Уменьшение напряжения кислорода в воротной вене, наблюдаемое после принятия пищи, также ведет к увеличению кровотока по печеночной артерии. Повышает кровоток не только по печеночной артерии, но и по v. portae наблюдающееся после приема пищи умеренное увеличение осмолярности крови.
Повышение системного напряжения углекислого газа в крови и сопутствующий этому ацидоз приводят к интенсификации кровотока как по печеночной артерии, так и в системе портальной вены. Уменьшение же системного напряжения углекислого газа при гипокапнии оказывает противоположное воздействие.
6.1.2.2. Внешняя регуляция
Нервная регуляция. Кровоток в печени контролируется главным образом симпатической нервной системой (СНС). Повышение ее активности приводит к уменьшению кровотока в печени. Вследствие этого при шоке и других состояниях, сопровождающихся повышением тонуса СНС, кровь сосудов печени является резервом увеличения объема циркулирующей крови.
Парасимпатическая нервная система на объем кровотока в печени оказывает опосредованное влияние: от ее активности зависит тонус пресинусоидальных сфинктеров и, как следствие, распределение кровотока в печени.
Гуморальная регуляция. Среди факторов гуморальной регуляции кровотока в печени наибольшее значение имеют ка-техоламины. В печеночной артерии представлены как а-, так и р-адренорецепто-ры. При выбросе адреналина в кровоток тонус артерий печени сперва повышается (активация а-адренорецепторов), затем уменьшается (активация р-адренорецеп-торов). В v. portae представлены только а-адренорецепторы, поэтому при выбросе адреналина в кровоток тонус воротной вены повышается.
Допамин при физиологических состояниях на кровоток в печени существенного влияния не оказывает. В таких случаях циркуляция в органе преимущественно будет зависеть от адреналина, норадрена-лина и активности симпатической нервной системы.
6.1.3. Влияние анестезии на кровоток в печени
Нарушение функции печени после наркоза чаще всего обусловлено непосредственным воздействием на гепатоциты, а не на кровоток в органе. А среди факторов интраоперационного воздействия при спектре используемых в настоящее время препаратов для наркоза наибольшее влияние на кровоток оказывает искусственная вентиляция легких (ИВЛ) и само оперативное вмешательство. Так, операционная агрессия при операциях на верхнем отделе брюшной полости в ряде случаев сопровождается уменьшением кровотока в печени на 60 %. Если ИВЛ проводится в режиме гипервентиляции, то развивающаяся при этом гипокапния также уменьшает кровоток в печени. Дополнительным фактором снижения печеночного кровотока может быть применение положительного давления в конце выдоха, поскольку при этом увеличивается давление в венах печени.
Уменьшение кровотока в печени при использовании средств для наркоза или под влиянием методов анестезии чаще всего опосредованно и обусловлено гипотензи-ей. Например, такой эффект могут вызывать эпидуральная и спинномозговая анестезия. Уменьшение кровотока также может быть вызвано накоплением СО2 и наблюдающимся при этом повышением активности симпатической нервной системы. Непосредственное угнетающее воздействие на печеночный кровоток выявлено у фторотана, энфлурана, нейролептанал-гетиков. Но уменьшение кровотока под влиянием средств для наркоза не означает, что в гепатоците действительно развивается анаэробный метаболизм: анестетики одновременно вызывают снижение интенсивности метаболизма и потребности в кислороде.
6.2. МЕТАБОЛИЧЕСКИЕ ФУНКЦИИ ПЕЧЕНИ
6.2.1. Обмен белков
Печень играет ключевую роль в белковом обмене организма, функционируя как аминостат: несмотря на суточные колебания в поступлении аминокислот и полипептидов в печень из кишок, поглощение и высвобождение в кровоток азотистых соединений периферическими тканями, уровень белков и свободных аминокислот в крови остается строго постоянным. Выполнению функции печени как аминоста-та способствует, с одной стороны, анатомическое расположение органа, с другой — биохимическая уникальность печени. Анатомическая составляющая обусловлена тем, что печень связана с кишками (посредством воротной вены) и с желчевыводя-щими путями. После потребления белковой пищи клетки печени принимают на себя «первый удар» потока аминокислот и других продуктов метаболизма, поступающих из кишок по воротной вене. Органическая связь печени с желчевыводящи-ми путями позволяет выводить некоторые вредные конечные продукты азотистого обмена (в частности желчные пигменты) непосредственно в пищеварительный канал.
Биохимическая уникальность печени обусловлена тем, что в ее клетке содержится полный набор ферментов, участвующих в обмене аминокислот, а также тем, что синтез и распад белков в печени происходит с большой скоростью. При этом скорость обновления белков в печени выше, чем в любом другом органе, кроме поджелудочной железы.
Главными реакциями превращения аминокислот в печени являются, во-первых, взаимопревращение аминокислот, распад углеродного скелета аминокислот с выде
и катализируется специфическим ферментом глутаматдегидрогеназой:
лением энергии и обеспечением глюконео-генеза реакциями трансаминирования и окислительного дезаминирования; во-вторых, обезвреживание аммиака и других конечных продуктов катаболизма, в том числе мочевины, мочевой кислоты, желчных кислот.
Аминокислоты поступают в обменный фонд печени из трех источников: 1. Экзогенные — по воротной вене из кишок. 2. Эндогенные — это продукты физиологического распада белков в органах и тканях человека. 3. Аминокислоты, образующиеся в процессе обмена веществ из углеводов и жирных кислот.

Реакциями превращения аминокислот являются трансаминирование и окислительное дезаминирование. В реакции трансаминирования аминогруппа (
NH2) одной аминокислоты переносится на а-ке-токислоту с образованием другой аминокислоты в соответствии со схемой:

Эти реакции могут протекать в любом направлении в зависимости от соотношения концентраций реагирующих компонентов и потребности в них. Если концентрация аминокислоты 2 снижена, а аминокислота 1 и кетокислота 2 представлены в изобилии, то реакция переноса аминогрупп при наличии фермента будет идти слева направо, приводя к синтезу аминокислоты 2. Реакция может идти и в противоположном направлении, если аминокислота 2 имеется в ткани печени в избытке. Ферменты этих реакций — аминотранс-феразы — при повреждении клеток печени (а также клеток других органов) поступают в кровь, что обуславливает диагностическое значение их определения в кровотоке.
Принцип реакции окислительного дезаминирования иной. В ходе этой реакции аминогруппа освобождается в виде аммиака (NH3), а углеродный скелет аминокислоты окисляется до а-кетоглутарата. Эта реакция требует участия в окислении нико-тинамидного кофермента (НАД или НАДФ)
Посредством такой реакции разнообразные аминокислоты, попадающие в печень, могут подвергаться катаболизму с образованием а-кетокислот, восстановленных ни-котинамидных коферментов, NH3. В дальнейшем кетокислоты могут включаться в цикл трикарбоновых кислот (цикл обмена лимонной кислоты, или цикл Кребса), а восстановленные никотинамидные ко-ферменты — служить источником энергии.
Образующийся в процессе метаболизма азотистых соединений аммиак является токсическим веществом. В печени происходит три процесса фиксации аммиака с образованием органических азотистых соединений: 1. Восстановительное амини-рование, обеспечивающее синтез глутама-та и других аминокислот при сохранении азота аммиака. 2. Образование амидов, в частности глутамина, способных выполнять функции временного резервуара и транспортной формы аммиака. 3. Образование карбамоилфосфата, который необходим при биосинтезе таких соединений, как пиримидиновые азотистые основания нуклеиновых кислот, или при синтезе мочевины — выводимого из организма конечного продукта азотистого обмена. Среди этих механизмов решающее значение имеет биосинтез мочевины. Процесс образования мочевины целиком протекает в печени в цикле мочевины Кребса. В сутки в печени образуется 20 — 30 г мочевины.
Поражение печени приводит к нарушению обмена аминокислот, что имеет как диагностическое, так и клинико-физиоло-гическое значение. Поскольку процессы синтеза поражаются одними из первых, то нарушение связывания
аммиака и увеличение его
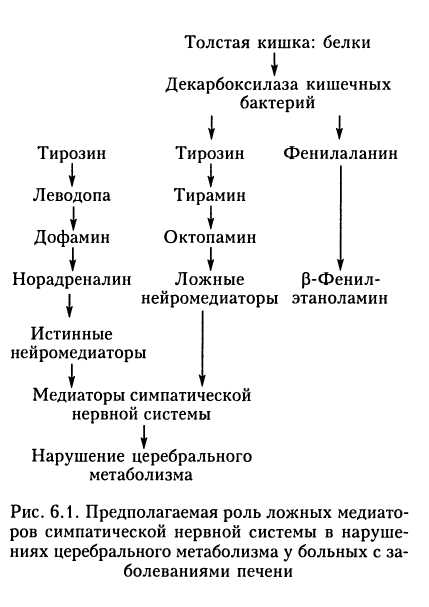 концентрации в крови является одним из ранних проявлений заболеваний. Биосинтез мочевины является более «устойчивым» биохимическим процессом. Так, согласно данным экспериментальных исследований, для клинически значимого подавления образования мочевины необходимо удалить по крайней мере 85 % ткани печени. Поэтому диагностически значимое уменьшение концентрации мочевины характерно для терминальных стадий недостаточности печеночной клетки. Фуль-минантная печеночная недостаточность редко сопровождается снижением концентрации мочевины в крови. Накопление аммиака в крови оказывает токсическое действие на органы, прежде всего на клетки ЦНС, и является одним из факторов возникновения энцефалопатии у пациентов с печеночной недостаточностью. Токсический эффект аммиака обусловлен прямым действием на мембраны нейронов, а также опосредованным нарушением функции нейронов в результате влияния на глутаматергическую систему. Это объясняется тем, что в головном мозгу цикл мочевины не функционирует, поэтому удаление из него аммиака происходит различными путями. В астроцитах под действием глутаматсинтетазы из глу-тамата и аммиака синтезируется глутамин. В условиях избытка аммиака запасы глу-тамата истощаются, а поскольку он является важным возбуждающим медиатором, то следствием уменьшения его содержания будет снижение активности головного мозга. Нарушение белкового обмена при недостаточности гепатоцита проявляется также уменьшением соотношения в крови различных аминокислот, в частности нарушается баланс между аминокислотами с разветвленной углеродной цепью (лейцин, изолейцин, валин) и ароматическими аминокислотами (тирозин, фенилаланин, триптофан). Обе группы аминокислот проходят через гематоэнцефалический барьер с помощью одного и того же транспортера. Относительное увеличение концентрации ароматических аминокислот ведет к их преимущественному проникновению через гематоэнцефалический барьер в головной мозг. Такие аминокислоты в большом количестве являются предшественниками «ложных медиаторов» (октопамина, р-фенилэтаноламина). Существует точка зрения, что именно они способствуют развитию печеночной комы (теория ложных медиаторов Джеймса). Кроме того, ароматическая аминокислота триптофан является предшественником серотонина — нейротрансмиттера, участвующего в регуляции уровня возбуждения коры головного мозга. Нарушение синтеза серотонина является одним из механизмов развития печеночной энцефалопатии. Этому же способствует и развивающееся при патологии печени нарушение ферментативных систем, отвечающих за обмен серотонина. Существует и иная трактовка гипотезы ложных медиаторов (рис. 6.1), согласно которой декарбоксилирование некоторых аминокислот в кишках приводит к образованию р-фенилэтиламина, тирамина и октопамина — ложных нейротрансмитте-ров. При патологии печени они могут замещать истинные нейротрансмиттеры. Тео рия ложных медиаторов лежит в основе разработки специальных аминокислотных препаратов для парентерального питания больных с печеночной недостаточностью, содержащих большое количество аминокислот с разветвленной углеродной цепью. Однако при всей теоретической привлекательности клиническая эффективность этих смесей окончательно не доказана. Из аминокислот в печени синтезируются многочисленные белки: альбумин, оц-анти-трипсин, а-фетопротеин, а 2-макроглобулин, церулоплазмин, компоненты системы комплемента (С3, C 6, Cj), трансферрин, фибриноген и другие факторы свертывания крови, факторы антикоагулянтной системы, С-реактивный протеин (табл. 6.1). Некоторые из них (фибриноген, гаптогло-бин, а гантитрипсин, С 3-компонент системы комплемента, церулоплазмин) являются белками острой фазы. Их концентрация увеличивается при синдроме системного воспалительного ответа у больных с нарушением белковосинтетической функции печени. Это следует учитывать при оценке функции печени по данным биохимических показателей. Сопоставляя изменение концентрации белков острой фазы с другими признаками воспалительного процесса, можно судить о динамике синдрома системного воспалительного ответа. Некоторые из бел-  ков, синтезируемых в печени, имеют особое клинико-физиологическое и диагностическое значение. Альбумин является основным белком плазмы крови, синтезируемым в печени. Другие плазменные белки — глобулины — синтезируются во всех органах, где есть клетки системы мононуклеарных фагоцитов (печень, костный мозг, легкие). На долю альбумина приходится 15 % общего синтеза белков печенью. Ежедневно образуется около 120 — 300 мг/кг этого белка. Скорость синтеза альбумина наиболее высока у новорожденных, с возрастом она уменьшается. Альбумин распределяется во внутрисо-судистый и интерстициальный водные секторы. При этом внутрисосудистый пул альбумина составляет около 40 %. Основное физиологическое значение альбумина заключается в том, что он является ведущим фактором, поддерживающим онкотическое давление крови. В нормальных условиях альбумин крови обеспечивает примерно 75 — 80 % плазменного онкотического давления. В норме концентрация альбумина в крови колеблется в пределах 40 — 50 г/л. Содержание белка зависит от функции печени, скорости метаболического разрушения альбумина и интенсивности поступления
альбумина из интерстициального сектора. Период полуэлиминации альбумина из организма составляет примерно 16 — 21 сут. Поэтому при отсутствии нарушения взаимопревращения альбумина его концентрация в крови является поздним признаком нарушения белковосинтетической функции печени.
В печени синтезируются почти все плазменные факторы свертывания (фибриноген, факторы II, V, VII, IX, X, XI, XII, XIII), за исключением фактора Виллебранда и фактора VIII. При этом факторы II, VII, IX, X являются витамин-К-зависимыми, т. е. содержат на одном конце несколько остатков глутаминовой кислоты, которые в последующем подвергаются превращению при участии карбоксилазы. Для функционирования карбоксилазы необходим витамин К. При отсутствии его поступления в организм витамин-К-зависимые факторы свертывания крови остаются структурно незавершенными и не могут выполнять свою функцию. Гипокоагуляционный эффект непрямых антикоагулянтов связан с нарушением образования в печени витамин-К-зависимых факторов свертывания. Наиболее частой причиной недостаточности витамина К является внутри- и внепеченочный холестаз, однако снижение его концентрации может быть также вызвано применением антибиотиков (нарушение микрофлоры кишок), хелаторов желчных кислот (например, холестирамина).
Причиной уменьшения концентрации фибриногена является недостаточность функции гепатоцита. Гипофибриногенемия обычно сопутствует выраженной печеночной недостаточности. Но на ранних этапах нарушения функции органа может наблюдаться нарушение функции фибриногена — дисфибриногенемия. При этом может выявляться фибриноген с низкой молекулярной массой, а также фибриноген, содержащий избыток сиаловых кислот. Дисфибриногенемия сопровождается нарушением полимеризации фибрин-мономеров.
Недостаточность функции печени является также основной причиной уменьшения остальных факторов свертывания крови. При этом, в отличие от альбумина, период полуэлиминации факторов свертывания крови небольшой. Поэтому нарушения гемостаза при нарушении бел-ковосинтетической функции печени проявляются рано. Минимальным периодом полуэлиминации обладает VII фактор свертывания крови (4 —6 ч). Поэтому среди показателей гемостаза часто наиболее чувствительным маркером является про-тромбиновое время и его производное — протромбиновый индекс.
Кроме факторов свертывания крови в печени синтезируются основные первичные антикоагулянты: антитромбин-Ш, протеины С и S. При этом синтез протеинов С и 5 зависит от достаточного содержания в организме витамина К. Нарушение белковосин-тетической функции печени может сопровождаться уменьшением концентрации в крови первичных антикоагулянтов. Это обуславливает возможность возникновения тромбозов. В клинике недостаточности функции печени обычно сопутствует геморрагический диатез в связи с отсутствием необходимого количества прокоагулянтов.
Печень также имеет непосредственное отношение к системе фибринолиза. В ге-патоцитах синтезируется плазминоген. Его концентрация уменьшается при тяжелом поражении печени. Это наряду с недостатком факторов свертывания является дополнительным фактором возникновения геморрагического диатеза при недостаточности функции печени.
|
|
|
 Скачать 2.11 Mb.
Скачать 2.11 Mb.