Для заочников. Методические указания и контрольные задания для студентов заочников инженернотехнических (нехимических)
 Скачать 417.39 Kb. Скачать 417.39 Kb.
|
|
Пример 3. Реакция горения этилового спирта выражается термохимическим уравнением С2Н5ОН(ж) + 3О2(г) = 2СО2(г) + ЗН2О(ж); ΔН-? Вычислите тепловой эффект реакции, если известно, что мольная(молярная) теплота парообразования С2Н5ОН(ж) равна +42,36 кДж и известны теплоты образования: С2Н5ОН(г); СО2(г); Н2О(ж) (см. табл. 5). Решение. Для определения ΔН реакции необходимо знать теплоту образования С2Н5ОН(ж). Последнюю находим из данных: С2Н5ОН (ж) = С5Н5ОН(г); ΔН = + 42,36 кДж. + 42,36 = — 235,31 —  ; ; = -235,31 – 42,36 = -277,67 кДж. = -235,31 – 42,36 = -277,67 кДж.Вычисляем ΔН реакции, применяя следствия из закона Гесса: 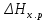 = 2 (- 393,51) + 3 (— 285,84) + 277,67 = - 1366,87 кДж = 2 (- 393,51) + 3 (— 285,84) + 277,67 = - 1366,87 кДжКонтрольные вопросы 81. Вычислите, какое количество теплоты выделится при восстановлении Fe2O3 металлическим алюминием, если было получено 335,1 г. Железа.Ответ:2543,1 кДж. 82. Газообразный этиловый спирт С5Н5ОН можно получить при взаимодействии этилена C2H4(г) и водяных паров. Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект. Ответ: -45,76 кДж. 83. вычислите тепловой эффект реакции восстановления оксида железа (׀׀) водородом, исходя из следующих термохимических уравнений: FeО(к) + СО(г) = Fe(к) + СО2(г); ΔН= -13,18 кДж. СО(г) + ½ О2(г) = СО2(г); ΔН= -283,0 кДж. Н2 (г) + ½ О2(г) = Н2О(г); ΔН = -241,83 кДж. Ответ: +27,99 кДж. 84. При взаимодействии газообразных сероводорода и диоксида углерода образуются пары воды и сероуглерод CS2(г). Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект. Ответ:+65,43 кДж. 85. Напишите термохимическое уравнение реакции между СО(г) и водородом, в результате которой образуются СН4 (г) и Н2О (г). Сколько теплоты выделится при этой реакции, если было получено 67,2 л метана в пересчете на нормальные условия? Ответ: 618,48 кДж. 86. Тепловой эффект какой реакции равен теплоте образования NО? Вычислите теплоту образования NО, исходя из следующих термохимических уравнений: 4 NH3(г) + 5О2(г) = 4 NО(г) + 6 Н2О(ж); ΔН = -1168,80 кДж. 4 NH3(г) + 3О2(г) = 2N2(г) + 6 Н2О(ж); ΔН = 1530,28 кДж. Ответ:+90,37 кДж. 87. Кристаллический хлорид аммония образуется при взаимодействии газообразных аммиака и хлорида водорода. Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект. Сколько теплоты выделится, если в реакции было израсходовано 10 л аммиака в пересчете на нормальные условия? Ответ:, 78,97 кДж. 88. Тепловой эффект какой реакции равен теплоте образования метана? Вычислите теплоту образования метана, исходя из следующих термохимических уравнений: Н2 (г) + ½ О2(г) = Н2О(ж): ΔН = - 285,84 кДж С(к) + О2(г) = СО2(г); ΔН = -393,51 кДж СН4(г) + 2О2 (г) = 2Н2О(ж) + СО2(г); ΔН = -890,31 кДж Ответ: -74,88 кДж. 89. Тепловой эффект какой реакции равен теплоте образования гидроксида кальция? Вычислите теплоту образования гидроксида кальция, исходя из следующих термохимических уравнений: Са (к) + ½О2 (г) = СаО (к); ΔН = -635,60 кДж Н2 (г) + ½О2 (г) = Н2О (ж); ΔН = -285,84 кДж СаО (к) + Н2О (ж) = Са(ОН)2(к); ΔН = -65,06 кДж Ответ: -986,50 кДж. 90. Тепловой эффект реакции сгорания жидкого бензола с образованием паров воды и диоксида углерода равен -3135,58 кДж. Составьте термохимическое уравнение этой реакции и вычислите теплоту образования С6Н6 (ж). Ответ: +49,03 кДж. 91. Вычислите, сколько теплоты выделится при сгорании 165 л (н.у.) ацетилена С2Н2, если продуктами сгорания являются диоксид углерода и пары воды? Ответ: 924,88 кДж. 92. При сгорании газообразного аммиака образуются пары воды и оксида азота NO (г). Напишите термохимическое уравнение этой реакции. Сколько теплоты выделится, если было получено 44,8 л NO в пересчете на нормальные условия? Ответ: 452,37 кДж. 93. Реакция горения метилового спирта выражается термохимическим уравнением: СН3ОН (ж) + 3/2О2 (г) = СО2(г) + 2Н2О (ж); ΔН - ? Вычислите тепловой эффект этой реакции, если известна мольная теплота парообразования СН3ОН (ж) равна +37,4 Ответ: -726,62 кДж. 94. При сгорании 11,5 г жидкого этилового спирта выделилось 308,71 кДж теплоты. Напишите термохимическое уравнение реакции, в результате которой образуются пары воды и углерода. Вычислите теплоту образования C2H5OH (ж). Ответ: -277,67 кДж/моль. 95. Реакция горения бензола выражается термохимическим уравнением: С6Н6(ж) + 73/2О2 (г) = 6СО2 (г) + ЗН2О (г); ΔН - ? Вычислите тепловой эффект этой реакции, если известно, что мольная теплота парообразования бензола равна +33,9 кДж. Ответ: -3135,58 кДж. 96. Вычислите тепловой эффект и напишите термохимическое уравнение реакции горения 1 моль этана С2Н6(г), в результате которой образуются пары воды и диоксид углерода. Сколько теплоты выделится при сгорании 1 м3 этана в пересчете на нормальные условия? Ответ: 63742,86 кДж. 97. Реакция горения аммиака выражается термохимическим уравнением: 4NН3(г) + 3О2(г) = 2N2(г) + 6Н2О(ж); ΔН = -1530,28 кДж Вычислите теплоту образования NH3 (г). Ответ: -46,19 кДж. 98. При взаимодействии 6,3г железа с серой выделилось 11,31 кДж теплоты. Вычислите теплоту образования сульфида железа FeS. Ответ: -100,26 кДж/моль. 99. При сгорании 1 л а ацетилена (н. у.) выделяется 56,053 кДж теплоты. Напишите термохимическое уравнение реакции, в результате которой образуются пары воды и диоксид углерода. Вычислите теплоту образования C2H2(г). Ответ: 226,75 кДж/моль 100. При получении эквивалентной массы гидроксида кальция из СаО(к) и Н2О (ж) выделяется 32,53 кДж теплоты. Напишите термохимическое уравнение этой реакции и вычислите теплоту образования оксида кальция. Ответ: -635,6 кДж. Химическое сродство При решении задач этого раздела см. табл. 5-7. Самопроизвольно могут протекать реакции, сопровождающиеся не только выделением, но и поглощением теплоты. Реакция, идущая при данной температуре с выделением теплоты, при другой температуре идет с поглощением теплоты. Здесь проявляется диалектический закон единства и борьбы противоположностей. С одной стороны, система стремиться к упорядочению (агрегации), к уменьшению Н; с другой стороны, система стремится к беспорядку (дезагрегации). Первая тенденция растет с понижением, а вторая – с повышением температуры. Тенденцию к беспорядку характеризует величина, которую называют энтропией. Энтропия S, так же как внутренняя энергия U, энтальпия H, объем V и др., является свойством вещества, пропорциональным его количеству. S, U, Н, V обладают аддитивными свойствами, т. Е. при соприкосновении системы суммируются. Энтропия отражает движение частиц вещества и является мерой неупорядоченности систем . Она возрастает с увеличением движения частиц: при нагревании, испарении, плавлении, расширении газа, при ослаблении или разрыве связей между атомами и т. П. Процессы, связанные с упорядоченностью системы: конденсация, кристаллизация, сжатие, упрочнение связей, полимеризация и т. П. — ведут к уменьшению энтропии. Энтропия является функцией состояния, т. Е. ее изменение (ΔS) зависит только от начального (S1) и конечного (S2) состояния и не зависит от пути процесса: 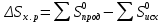 ΔS=S2—S1.Если S2> S1 то ΔS>0. Если S2< S1 то ΔS<0. Так как энтропия растет с повышением температуры, то можно считать, что мера беспорядка ≈ TΔS. Энтропия выражается в Дж/(моль · К). Таким образом, движущая сила процесса складывается из двух сил: стремления к упорядочению (Н)и стремления к беспорядку (TS).При p=const и Т=const общую движущую силу процесса, которую обозначают ΔG, можно найти из соотношения ΔG = (Н2 – Н1) — (ТS2-ТS1); ΔG = ΔН –TΔS. Величина G называется изобарно-изотермическим потенциалом или энергией Гиббса. Итак, мерой химического сродства является убыль энергии Гиббса, или ΔG, которая зависит от природы вещества, его количества и от температуры. Энергия Гиббса является функцией состояния, поэтому 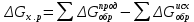 Самопроизвольно протекающие процессы идут в сторону уменьшения потенциала и, в частности, в сторону уменьшения ΔG. Если ΔG <0, процесс принципиально осуществим, если ΔG >0— процесс самопроизвольно проходить не может. Чем меньше ΔG,тем сильнее Стремление к протеканию данного процесса и тем дальше он от состояния равновесия, при котором ΔG—0 и ΔH = TΔS. Из соотношения ΔG =ΔH—TΔSвидно, что самопроизвольно могут протекать и процессы, для которых ΔН >0 (эндотермические). Это возможно, когда ΔS>0,но |ТΔS|>| ΔН |, и тогда ΔG<0.С другой стороны, экзотермические реакции (ΔН <0) самопроизвольно не протекают, если при ΔS<0 окажется, что ΔG >0. Таблица 6. Стандартная энергия Гиббса образования  некоторых некоторыхвеществ
Пример 1. В каком состоянии энтропия 1 моль вещества больше: в кристаллическом или в парообразном при той же температуре? Решение.Энтропия есть мера неупорядоченности состояния вещества. В кристалле частицы (атомы, ионы) расположены, упорядочено и могут находиться лишь в определенных точках пространства, а для газа таких ограничений нет. Объем 1 моль газа гораздо больше, чем объем 1 моль кристаллического вещества, и возможность хаотичного движения молекул газа больше. А так как энтропию можно рассматривать как количественную меру хаотичности атомно-молекулярной структуры вещества, то энтропия 1моль паров вещества больше энтропии 1 мол его кристаллов при одинаковой температуре. Пример 2. Прямая или обратная реакция будет протекать при стандартных условиях в системе СН4 (г) + СО2 (г) 2СО (г) + 2Н2 (г) Решение.Для ответа на вопрос следует вычислить  прямой реакции. Значения прямой реакции. Значения  соответствующих веществ приведены в табл. 6. Зная, что ΔG есть функция состояния и что ΔG для простых веществ, находящихся в устойчивых при стандартных условиях агрегатных состояниях, равны нулю, находим соответствующих веществ приведены в табл. 6. Зная, что ΔG есть функция состояния и что ΔG для простых веществ, находящихся в устойчивых при стандартных условиях агрегатных состояниях, равны нулю, находим  процесса: процесса: = 2(-137,27) + 2(0) — (-50,79 — 394,38) = + 170,63 кДж. = 2(-137,27) + 2(0) — (-50,79 — 394,38) = + 170,63 кДж.То, что  >0, указывает на невозможность самопроизвольного протекания прямой реакции при Т =298 К и равенстве давлений взятых газов 1,013• 105 Па. (760 мм РТ. Ст. = 1 атм). >0, указывает на невозможность самопроизвольного протекания прямой реакции при Т =298 К и равенстве давлений взятых газов 1,013• 105 Па. (760 мм РТ. Ст. = 1 атм).Таблица 7. Стандартные абсолютные энтропии  некоторых веществ некоторых веществ
|

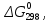 кДж/моль
кДж/моль Дж/(моль∙К)
Дж/(моль∙К)