Для заочников. Методические указания и контрольные задания для студентов заочников инженернотехнических (нехимических)
 Скачать 417.39 Kb. Скачать 417.39 Kb.
|
|
Б. Для инженеров-энергетиков 1. Химия конструкционных и электротехнических материалов Металлы и сплавы; физико-химический анализ. Магний, бериллий; свойства, соединения, применение в технике. Алюминий, свойства, соединения, применение в технике. Переходные металлы, их свойства, соединения, применение в энергетике, электротехнике и радиотехнике. Кремний, германий, олово, свинец, их свойства и применение. Химия полупроводниковых материалов. Химия материалов волоконной оптики. Методы получения материалов высокой чистоты. 2. Полимерные материалы в энергетической технике Методы получения полимерных материалов. Зависимость свойств полимеров от их строения. Полимерные конструкционные материалы. Органические полупроводники. 3. Электрохимические процессы в энергетике и электронике Химические источники тока. Электрохимические генераторы. Электрохимические преобразователи (хемотроны). Электрохимическая анодная обработка металлов и сплавов. Получение и свойства гальванопокрытий. Гальванопластика. 4. Химия воды и топлива Строение молекул и свойства воды. Природные воды. Основные методы отчистки воды. Состав и свойства органического топлива. Теплота сгорания и теплопроводная способность топлива. Твердое топливо и продукты его переработки. Жидкое и газообразное топливо. Области применения топлива. 5. Химия и охрана окружающей среды Технический прогресс и экологические проблемы. Роль химии в решении экологических проблем. Продукты горения топлива и защита воздушного бассейна от загрязнений. Методы малоотходной технологии. Водородная энергетика. Получение и использование водорода. Охрана водного бассейна. Характеристика сточных вод. Методы отчистки сточных вод. Методы замкнутого водооборота. В. Для инженеров-строителей Химия воды Строение молекул воды. Внутреннее строение и свойства воды в жидком состоянии. Структура кристаллов и свойства льда. Различные формы связанной воды. Химически связанная вода. Термическая диссоциация гидроксидов. Аквасоединения. Гидрогели. Процессы гидратации и дегидратации гидрогелей. Тиксотропные явления в строительной технике. Сорбция водяных паров. Адсорбированная вода. Хемосорбция воды. Капиллярная конденсация. Адсорбция. Гидрофильность и гидрофобность. Диаграммы состояния двойных систем типа вода — соль. Кристаллизация воды и водных растворов в различных условиях. Химические свойства воды. Взаимодействие воды с элементарными веществами и химическими соединениями. Процессы гидратации и гидролиза. Щелочноземельные металлы и алюминий Магний, свойства и соединения. Природные соединения магния. Оксид и гидроксид магния; огнеупоры. Магнезиальное вяжущее вещество. Карбонат и гидрокарбонат магния. Кальций. Природные соединения кальция; известняки, мергели, разновидности природного сульфата кальция. Оксид и гидроксид кальция, свойства, получение и применение. Сульфат, карбонат и гидрокарбонат, силикаты кальция. Карбид кальция. Жесткость природных вод. Происхождение жесткости воды; единицы измерения жесткости. Карбонатная и некарбонатная жесткость. Методы умягчения воды. Другие процессы обработки воды. Методы умягчения воды. Другие процессы обработки воды; методы ионного обмена. Алюминий, свойства и соединения. Природные соединения алюминия. Получение алюминия. Применение алюминия и его сплавов в строительстве. Коррозия алюминиевых сплавов и методы защиты от нее. Оксид и гидроксид алюминия. 3.Переходные металлы Хром. Свойства соединений хрома (III) и хрома (VI). Природные соединения хрома. Применение хрома и его соединений. Марганец. Свойства соединений марганца. Применение марганца и его соединений. Железо, свойства и соединения. Железные руды. Чугун и сталь, специальные стали. Применение соединений железа. Никель, медь; свойства и соединения. Применение никеля, меди, их сплавов и соединений. Цинк, свойства и соединения. Применение цинка и его соединений. Элементы группы углерода Углерод. Аллотропные формы углерода. Углерод в природе. Виды топлива. Природный газ. Монооксид углерода, свойства, получение и применение. Диоксид углерода, свойства и применение. Угольная кислота и карбонаты. Кремний. Полупроводниковые свойства кремния. Диоксид кремния, его полиморфные видоизменения. Кремниевые кислоты. Силикаты, их гидролиз и гидратация. Взаимодействие диоксида кремния с оксидом кальция; силикаты и гидросиликаты кальция; алюминосиликаты. Стекло и стекломатериалы. Ситаллы. Фторосиликаты и их применение. Германий, олово, свинец. 5. Неорганические вяжущие вещества Физико-химические свойства вяжущих веществ. Воздушные и гидравлические вяжущие вещества. Значение степени дисперсности. Гипсовые вяжущие вещества. Ступенчатая дегидратация двухводного сульфата кальция. Полуводный сульфат кальция. Физико-химическая природа процессов схватывания и твердения. Портландцемент, ого получение и процессы, происходящие при его обжиге. Состав цементного клинкера и взаимодействие его с водой. Процессы схватывания и твердения. Основные составляющие цементного камня. Коррозия бетона и методы борьбы с ней. Взаимодействие составных частей цементного камня с водой. Сульфатная, угольно-кислотная, магнезиальная коррозия. Методы защиты бетона от коррозии. Технико-экономическое значение борьбы с коррозией бетона. 6. Органические полимеры Получение полимеров. Реакция полимеризации. Полиэтилен, полипропилен, поливинилхлорид, полистирол. Реакции поликонденсации. Фенолформальдегидные смолы, карбамидоформальдегидные смолы, эпоксидные смолы, фурановые смолы. Кремнийорганические полимеры. Битумы и дегти. Физико-химические свойства полимеров. Особенности внутреннего строения полимеров. Пластические массы и полимербетоны, заполненные полимеры, наполнители, добавки к бетонам. Полимерные покрытия и клеи. Способы переработки пластических масс и получения элементов строительных конструкций. Стойкость и старение различных полимерных материалов в условиях длительной эксплуатации. Физиологическая активность полимерных материалов. ЛИТЕРАТУРА Основная Лучинский Г.П. Курс химии.- М.: Высшая школа, 1985. Курс общей химии/ Под ред. Н.В. Коровина.- М.: Высшая школа, 1981. Дополнительная Глинка Н. Л. Общая химия.- Л.: Химия, 1977- 1983. Введение в общую химию/ Под ред. Г.П. Лучинского,- М.: Высшая школа, 1980. Фролов В. В. Химия. М.: Высшая школа, 1979. Харин А. Н., Катаева Н. А., Харина Л. Т. Курс химии.- М.: Высшая школа, 1983. Курс химии. Ч. 2, специальная для строительных вузов/Под ред. В. А. Киреева. М.: Высшая школа, 1974. Ливант Г.Е. и Райцин Г.А. Практикум по общей химии.- М.: Высшая школа, 1978. Павлов Н.Н. Теоретические основы общей химии.- М.: Высшая школа, 1978. Васильева 3. Г., Грановская А. А., Таперова А. А. Лабораторные работы по общей и неорганической химии. М.: Химия, 1979. Глинка Н. Л. Задачи и упражнения по общей химии. Л.: Химия, 1985. Гольбрайх З.Е. Сборник задач и упражнений по общей химии.- М.: Высшая школа, 1984. КОНТРОЛЬНЫЕ ЗАДАНИЯ Каждый студент выполняет вариант контрольных заданий, обозначенный двумя последними цифрами номера студенческого билета (шифра). Например, номер студенческого билета 86594, две последние цифры 94, им соответствует вариант контрольного задания 94. КОНТРОЛЬНОЕ ЗАДАНИЕ 1 Моль. Эквиваленты и эквивалентные массы простых и сложных веществ. Закон эквивалентов С 1 января 1963 г. в СССР введена Международная система единиц измерения (СИ), состоящая из шести основных единиц: метр (м) – длина, килограмм (кг) – масса, секунда (с) – время, ампер (А) – сила тока, кельвин (К) – термодинамическая температура, кандела (кд) – сила света. XIV Генеральная конференция по мерам и весам (1971) утвердила единицу количества вещества моль (моль) в качестве седьмой основной единицы Международной системы моль (моль)- единицу количества вещества. Моль равен количеству вещества системы, содержащей столько же структурных элементов, сколько содержится атомов в углероде-12 массой 0,012 кг. При применении моля структурные элементы должны быть специфицированы и могут быть атомами, молекулами, ионами, электронами и другими частицами или специфицированными группами частиц. Моль вещества соответствует постоянной Авогадро NА = (6,022045± 0,000031) • 1023 моль-1 структурных элементов. При применении понятия «моль» следует указывать, какие структурные элементы имеются в виду, например моль атомов Н, моль молекул Н2, моль протонов, моль электронов и т. п. Так, заряд моля электронов равен 6,022•1023 е и отвечает количеству электричества, равному 1 фарадею (F). Масса моля атомов или масса моля молекул (мольная или молярная масса), выраженная вграммах (г/моль), есть грамм-атом данного элемента или соответственно грамм-молекула данного вещества в прежнем понимании. Пример I. Выразите в молях: а) 6,02*1021 молекул СО2; б) 1,20•1024 атомов кислорода; в) 2,00•1023 молекул воды, чему равна мольная (молярная) масса указанных веществ? Решение. Моль — это количество вещества, в котором содержится число частиц любого определенного сорта, равное постоянной Авогадро (6,02*1023). Отсюда а) 6,02•1021 , т.е. 0,01 моль; б) 1,20•1024 , т.е. 2 моль; в) 2,00-•1023, т.е. 1/3 моль. Масса моля вещества выражается в кг/моль или г/моль. Мольная (молярная) масса вещества в граммах численно равна его относительной молекулярной (атомной) массе, выраженной в атомных единицах массы (а. е. м.). Так как молекулярные массы СО2 и Н2О и атомная масса кислорода соответственно равны 44, 18 и 16 а. е. м., то их мольные (молярные) массы равны: а) 44 г/моль, б) 18 г/моль, в) 16 г/моль. Пример 2. Определите эквивалент (Э) и эквивалентную массу тэазота, серы и хлора в соединениях NH3, H2S и НСl. Решение. Масса вещества и количество вещества — понятия не идентичные. Масса выражается в килограммах (граммах), а количество вещества — в молях. Эквивалент элемента (Э) — это такое количество вещества, которое соединяется с 1 моль атомов водорода или замещает то же количество атомов водорода в химических реакциях. Масса 1 эквивалента элемента называется его эквивалентной массой (тэ). Таким образом, эквиваленты выражаются в молях, а эквивалентные массы — в г/моль. В данных соединениях с 1 моль атомов водорода соединяется 1/3 моль азота, 1/2 моль серы и 1 моль хлора. Отсюда Э(N) = 1/3 моль, Э(S)=1/2 моль, Э(Cl)=l моль. Исходя из мольных масс этих элементов, определяем их эквивалентные массы: mЭ(N)= 1/3 • 14 = 4,67 r/моль; mЭ(S) = 1/2 • 32 = 16 г/моль; mЭ(Cl) = 1 • 35,45 = 35,45 г/моль. Пример 3. На восстановление 7,09 г оксида двухвалентного металла требуется 2,24 л водорода (н. у.*). Вычислите эквивалентную массу оксида и эквивалентную массу металла. Чему равна атомная масса металла? Решение. Согласно закону эквивалентов массы (объемы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объемам): 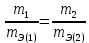 (1) (1)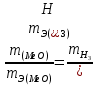 (2) (2)Если одно из веществ находится в газообразном состоянии, то, как правило, его количество измеряется в объемных единицах (см3, л, м3). Объем, занимаемый при данных условиях мольной или эквивалентной массой газообразного вещества, называется мольным или соответственно эквивалентным объемом этого вещества. Мольный объем любого газа при н. у. равен 22,4 л. Отсюда эквивалентный объем водорода (  ), молекула которого состоит из двух атомов, т. е. содержит два моля атомов водорода, равен 22,4:2 = 11,2 л. В формуле (2) отношение ), молекула которого состоит из двух атомов, т. е. содержит два моля атомов водорода, равен 22,4:2 = 11,2 л. В формуле (2) отношение 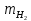 /mЭ(2) заменяем равным ему отношением /mЭ(2) заменяем равным ему отношением 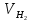 / / , где , где 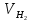 — объем водорода, — объем водорода,  – эквивалентный объем водорода – эквивалентный объем водорода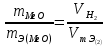 (3) (3)Из (3) находим эквивалентную массу оксида металла 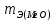 : :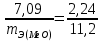 ; ; 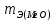 = = Согласно закону эквивалентов 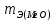 = = 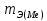 + +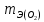 отсюда отсюда  5,45 – 8=27,45 г/моль. Мольная масса металла определяется из соотношения mЭ=А/В, где mэ – эквивалентная масса, А – мольная масса металла, В – стехиометрическая валентность элемента; А= mЭ В = 27,45•2=54,9 г/моль. Так как атомная масса в а. е. м. численно равна мольной массе, выраженной в г/моль, то искомая атомная, масса металла 54,9 а. е. м. 5,45 – 8=27,45 г/моль. Мольная масса металла определяется из соотношения mЭ=А/В, где mэ – эквивалентная масса, А – мольная масса металла, В – стехиометрическая валентность элемента; А= mЭ В = 27,45•2=54,9 г/моль. Так как атомная масса в а. е. м. численно равна мольной массе, выраженной в г/моль, то искомая атомная, масса металла 54,9 а. е. м.Пример 4. Сколько металла, эквивалентная масса которого 12,16 г/моль, взаимодействует с 310 см3 кислорода (н. у.). Решение. Так как мольная масса O2 (32 г/моль) при н. у. занимает объем 22,4 л, то объем эквивалентной массы кислорода (8 г/моль) будет 22,4:4 = 5,6 л = 5600 см3. По закону эквивалентов 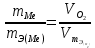 или или  откуда  = 12,16•310/5600 = 0,673 г. = 12,16•310/5600 = 0,673 г.Пример 5. Вычислите эквиваленты и эквивалентные массы Н2SO4 и Al(ОН)3 в реакциях, выраженных уравнениями H2SO4 + КОН = KHSO4 + Н2O (1) H2SО4 + Mg = MgSO4 + Н2 (2) Аl(ОН)3 + HCl = Al(ОН)2Cl + Н2O (3) Al(ОН)3 + 3HNO3 = Al(NO3)3 + 3H2O (4) Решение. Эквивалент (эквивалентная масса) сложного вещества, как и эквивалент (эквивалентная масса) элемента, может иметь различные значения и зависит от того, в какую реакцию обмена вступает это вещество. Эквивалентная масса кислоты (или основания) равна мольной массе (М), деленной на число атомов водорода, замещенных в данной реакции на металл (на число вступающих в реакцию гидроксильных групп). Следовательно, эквивалентная масса H2SO4 в реакции (1) 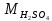 = 98 г/моль, а в реакции (2) = 98 г/моль, а в реакции (2) 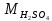 /2=49 г/моль. Эквивалентная масса Аl(ОН)3 в реакции (3) /2=49 г/моль. Эквивалентная масса Аl(ОН)3 в реакции (3) 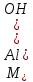 /3=78 г/моль, а в реакции (4) /3=78 г/моль, а в реакции (4) 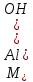 /3=26 г/моль. /3=26 г/моль.Задачу можно решить и другим способом. Так как H2SO4 взаимодействует с одной эквивалентной массой КОН и двумя эквивалентными массами магния, то ее эквивалентная масса равна в реакции (1) М/1г/моль и в реакции (2) М/2г/моль. Аl(ОН)3 взаимодействует с одной эквивалентной массой НСl и тремя эквивалентными массами HNO3, поэтому его эквивалентная масса в реакции (3) равна М/1 г/моль, в реакции (4) М/3 г/моль. Эквиваленты H2SO4 в уравнениях (1) и (2) соответственно равны 1 моль и 1/2 моль; эквиваленты Аl(ОН)3 в уравнениях (3) и в (4) соответственно равны 1 моль и 1/3 моль. Пример 6. Из 3,85 г нитрата металла получено 1,60 г его гид-роксида. Вычислите эквивалентную массу металла ( 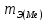 ). ).Решение. При решении задачи следует иметь в виду: а) эквивалент (эквивалентная масса) гидроксида равен сумме эквивалентов (эквивалентных масс) металла и гидроксильной группы; б) эквивалент (эквивалентная масса) соли равен сумме эквивалентов (эквивалентных масс) металла и кислотного остатка. Вообще эквивалент (эквивалентная масса) химического соединения равен сумме эквивалентов (эквивалентных масс) составляющих его частей. Учитывая сказанное, подставляем соответствующие данные в уравнение (1) примера 3: 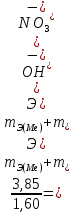 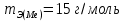 |
