Для заочников. Методические указания и контрольные задания для студентов заочников инженернотехнических (нехимических)
 Скачать 417.39 Kb. Скачать 417.39 Kb.
|
|
Рис 2. Энергетическая схема образования молекулярных орбиталей из атомных для гомоядерных молекул второго периода Следует отметить, что при образовании молекул В2, С2, N2 энергия связывающей δ2рх-орбитали больше энергии связывающих π2ру- и π2рz- орбиталей, тогда как в молекулах О2 и F2, наоборот, энергия связывающих π2ру- и π2рz- орбиталей больше энергии связывающей δ2рх-орбитали. Это нужно учитывать при изображении энергетических схем (рис 2) соответствующих молекул. Порядок связи в молекуле определяется разностью между числом связывающих и разрыхляющих орбиталей, деленной на два. Порядок связи может быть равен нулю (молекула не существует), целому или дробному положительному числу. Подобно электронным формулам, показывающим распределение электронов в атоме по атомным орбиталям, в методе МО составляются формулы молекул, отражающие их электронную конфигурацию. По аналогии с атомными s-, p-, d-,f- орбиталями молекулярные орбитали обозначаются греческими буквами δ, π, σ, φ. Так, электронная конфигурация молекул О2 описывается следующим образом: О2[KK  )2 ( )2 (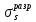 )2 ( )2 (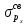 )2 ( )2 (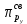 )2 )2 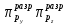 ] ]Буквами КК показано, что четыре 1s- электрона (два связывающих и два разрыхляющих) практически не оказывают влияния на химическую связь. Контрольные вопросы 61. Какую химическую связь называют ковалентной? Чем можно, объяснить направленность ковалентной связи? Как метод валентных связей (ВС) объясняет строение молекулы воды? 62. Какаю ковалентную связь называют полярной? Что служит количественной мерой полярности ковалентной связи? Исходя из значений электроотрицательности атомов соответствующих элементов определите, какая из связей: HI, ICl, BrF – наиболее полярна. 63. Какой способ образования ковалентной связи называется донорно-акцепторным? Какие химические связи имеются в ионах NH4+ и BF4–? Укажите донор и акцептор. 64. Как метод валентных связей (ВС) объясняет линейное строение молекулы ВеСl2 и тетраэдрическое СН4? 65. Какую ковалентную связь называют σ -связью и какая π -связью? Разберите на примере строения молекулы азота. 66. Сколько неспаренных электронов имеет атом хлора в нормальном и возбужденном состояниях? Распределите эти электроны по квантовым ячейкам. Чему равна валентность хлора, обусловленная неспаренными электронами? 67. Распределите электроны атома серы по квантовым ячейкам. Сколько неспаренных электронов имеют ее атомы в нормальном и возбужденном состояниях? Чему равна валентность серы, обусловленная неспаренными электронами? 68. Что называется электрическим моментом диполя? Какая из молекул НСl, HBr, HI имеет наибольший момент диполя? Почему? 69. Какие кристаллические структуры называются ионными, атомными, молекулярными и металлическими? Кристаллы каких веществ: алмаз, хлорид натрия, диоксид углерода, цинк — имеют указанные структуры? 70. Как метод валентных связей (ВС) объясняет угловое строение молекулы Н2S и линейное молекулы СО2? 71. Нарисуйте энергетическую схему образования молекулы Не2 и молекулярного иона Не2+ по методу молекулярных орбиталей. Как метод МО объясняет устойчивость иона Не2+ и невозможность существования молекулы Не2? 72. Какая химическая связь называется водородной? Между молекулами каких веществ она образуется? Почему Н2O и HF, имея меньшую молекулярную массу, плавятся и кипят при более высоких температурах, чем их аналоги? 73. Какая химическая связь называется ионной? Каков механизм ее образования? Какие свойства ионной связи отличают ее от ковалентной? Приведите два примера типичных ионных соединений. Напишите уравнения превращения соответствующих ионов в нейтральные атомы. 74. Что следует понимать под степенью окисления атома? Определите степень окисления атома углерода и его валентность, обусловленную числом неспаренных электронов, в соединениях СН4, СН3ОН, НСООН, СO2. 75. Какие силы молекулярного взаимодействия называются ори-ентационными, индукционными и дисперсионными? Когда возникают и какова природа этих сил? 76. Нарисуйте энергетическую схему образования молекулярного иона Н2- и молекулы Н2 по методу молекулярных орбиталей. Где энергия связи больше? Почему? 77. Какие электроны атома бора участвуют в образовании ковалентных связей? Как метод валентных связей (ВС) объясняет симметричную треугольную форму молекулы BF3? 78. Как метод молекулярных орбиталей объясняет парамагнитные свойства молекулы кислорода? Нарисуйте энергетическую схему образования молекулы O2 по методу молекулярных орбита-лей (МО). 79. Нарисуйте энергетическую схему образования молекулы F2 по методу МО. Сколько электронов находится на связывающих и paзрыхляющих орбиталях? 80. Нарисуйте энергетическую схему образования молекулы N2 по методу МО. Сколько электрона находится на связывающих и разрыхляющих орбиталях? Чему равен порядок связи в этой молекуле? Энергетика химических процессов (термохимические расчеты) Наука о взаимных превращениях различных видов энергии называется термодинамикой. Термодинамика устанавливает законы них превращений, а также направление самопроизвольного течения различных процессов в данных условиях. При химических реакциях происходят глубокие качественные изменения в системе, рвутся связи исходных веществах и возникают новые связи в конечных продуктах. Эти изменения сопровождаются поглощением или выделением энергии. В большинстве случаев этой энергией является теплота. Раздел термодинамики, изучающий тепловые эффекты химических реакции, называется термохимией. Реакции, которые сопровождаются выделением теплоты, называются экзотермическими, а те, которые сопровождаются поглощением теплоты, — эндотермическими. Теплоты реакций являются, таким образом, мерой изменения свойств системы, и знание их может иметь большое значение при определении условий протекания тех или иных реакций. При любом процессе соблюдается закон сохранения энергии как проявление более общего закона природы — закона сохранения материи. Теплота (Q), поглощенная системой, идет на изменение ее внутренней энергии Δ U и на совершение работы A : Q = Δ U + A. Внутренняя энергия системы U— это общий ее запас, включающий энергию поступательного и вращательного движения молекул, энергию внутримолекулярных колебаний атомов и атомных групп движения электронов, внутриядерную энергию и т. д. Внутренняя энергия — это полная энергия системы без потенциальной энергии, обусловленной положением системы в пространстве, и кинетической энергии системы как целого. Абсолютное значение внутренней энергии U вещества, известно, так как нельзя привести систему в состояние лишенного энергии. Внутренняя энергия как и любой вид энергии, является функцией состояния т.е. её изменение однозначно определяется её начальным и конечным состоянием системы и не зависит от пути перехода, по которому протекает процесс Δ U =U2 – U1, где Δ U — изменение внутренней энергии системы при переходе от начального состояния U1в конечное U2. Если U2>U1то Δ U >0. Если U2<U1, то Δ U <0 Теплота и работа функциями состояния не являются, ибо они служат формами передачи энергии с связаны с процессом, а не с состоянием системы. При химических реакциях А— это работа против внешнего давления, т. е. в первом приближении A = pΔV, где, ΔV – изменение объема системы (V2 – V1). Так как большинство химических реакций проходит при постоянном давлении, то изобарно- и изотермического процессов (p = const, Т =const) теплота QP = Δ U + pΔV, QP = (U2 – U1)+ р(V2 – V1) QP=(U2+pV2)-(U1+pV1). Сумму U +pV обозначим через Н, тогда QP = Н2 – Н1= Δ Н Величину Н называют энтальпией. Таким образом, теплота при p=const и T=const приобретает свойство функции состояния и не зависит от пути, по которому протекает процесс. Отсюда теплота реакции в изобарно-изотермическом процессе QBравна изменению энтальпии системы ΔН (если единственным видом работы является работа расширения): QP=ΔH Энтальпия, как и внутренняя энергия, является функцией состояния; ее изменение (ΔH) определяется только начальными и конечными состояниями системы и не зависит от пути перехода. Нетрудно видеть, что теплота реакции в изохорно-изотермическом процессе (V=const; T=const), при котором ΔV=0, равна изменению внутренней энергии системы: QV = ΔU Теплоты химических процессов, протекающих при p,T=const и V,Т = const, называют тепловыми эффектами. При экзотермических реакциях энтальпия системы уменьшается и Δ Н <0 (H2<Н1), а при эндотермических энтальпия системы увеличивается и Δ Н >0 (H2>H1). В дальнейшем тепловые эффекты всюду выражаются через ΔН. Термохимические расчеты основаны на законе Гесса (1840): тепловой эффект реакции зависит только от природы и физического состояния исходных веществ и конечных продуктов, но не зависит от пути перехода. Часто в термохимических расчетах применяют следствие из закона Гесса: тепловой эффект реакции ( 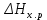 ) равен сумме теплот образования ΔНобр продуктов реакции за вычетом суммы теплот образования исходных веществ с учетом коэффициентов перед формулами этих веществ в уравнении реакции ) равен сумме теплот образования ΔНобр продуктов реакции за вычетом суммы теплот образования исходных веществ с учетом коэффициентов перед формулами этих веществ в уравнении реакции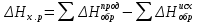 (1) (1)Пример 1. При взаимодействии кристаллов хлорида фосфора (V) с парами воды образуется жидкий РОCl3 и хлористый водород. Реакция сопровождается выделением 111,4 кДж теплоты. Напишите термохимическое уравнение этой реакции. Решение. Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также численное значение тепловых эффектов, называют термохимическими. В термохимических уравнениях, если это специально не оговорено, указываются значения тепловых эффектов при постоянном давлении QP, равные изменению энтальпии системы Δ Н. Значение Δ Н приводят обычно в правой части уравнения, отделяя его запятой или точкой с запятой. Приняты следующие сокращенные обозначение агрегатного состояния веществ: г- газообразное, ж- жидкое, к- кристаллическое. Эти символы опускаются, если агрегатное состояние веществ очевидно. Если в результате реакции выделяется теплота, то Δ Н <0. Учитывая сказанное, составляем термохимическое уравнение данной в примере реакции: PCl5 (к) + H2O (г) = РОCl3 (ж) + 2HCl (г); 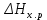 = - 111,4 кДж = - 111,4 кДжТаблица 5. Стандартные теплоты (энтальпии) образования 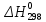 некоторых веществ
Пример 2. Реакция горения этана выражается термохимическим уравнением C2H6 (г) +3½ О2 = 2CO2(г) + 3 H2O(ж); 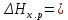 — 1559,87 кДж — 1559,87 кДжВычислите теплоту образования этана, если известны теплоты образования CO2(г) и H2O(ж). (табл. 5). Решение. Теплотой образования (энтальпией) данного соединения называют тепловой эффект реакции образования 1 моль этого соединения из простых веществ, взятых в их устойчивом состоянии при данных условиях. Обычно теплоты образования относят к стандартному состоянию, т. Е. 25о С (298 К) и 1.013• 105 Па, и обозначают через 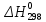 . Так как тепловой эффект с температурой изменяется незначительно, то и здесь и в дальнейшем индексы опускаются и тепловой эффект обозначается через ΔН. Следовательно, нужно вычислить тепловой эффект реакции, термохимическое уравнение которой имеет вид . Так как тепловой эффект с температурой изменяется незначительно, то и здесь и в дальнейшем индексы опускаются и тепловой эффект обозначается через ΔН. Следовательно, нужно вычислить тепловой эффект реакции, термохимическое уравнение которой имеет вид 2С(графит) + 3 H2(г) = C2H6 (г); ΔН-? исходя из следующих данных: а) C2H6 (г) + 3½ О2(г) = 2CO2(г) + 3H2O(ж); ΔН = -1559,87 кДж; б) С(графит) + О2(г) = CO2(г); ΔН = -393,51 кДж; в) H2(г) + ½ О2 = H2O(ж); ΔН = -285,84 кДж. На основании закона Гесса с термохимическими уравнениями можно оперировать так же, как и с алгебраическими. Для получения искомого результата следует уравнение (б) умножить на 2, уравнение (в) – на 3, а затем сумму этих уравнений вычесть из уравнения (а): C2H6 + 3½ О2 – 2C – 2О2 – 3H2 – 3/2О2 = 2CO2 + 3H2O – 2CO2 – 3H2O ΔН = -1559,87 – 2(-393,51) – 3(-285,84) = +84,67 кДж; ΔН = -1559,87 + 787,02 + 857,52; C2H6 = 2C + 3H2; ΔН = +84,67 кДж. Так как теплота образования равна теплоте разложения с обратным знаком, то  = - 84,67 кДж. К тому же результату придем, если для решения задачи применить вывод из закона Гесса: = - 84,67 кДж. К тому же результату придем, если для решения задачи применить вывод из закона Гесса: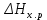 = 2 = 2 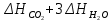 – –  – 3 – 3  Учитывая, что теплоты образования простых веществ условно приняты равными нулю  = 2 = 2 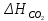 + + 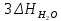 – – 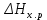  = 2(-393,51) + 3(-285,84) + 1559,87 = -84,67; = 2(-393,51) + 3(-285,84) + 1559,87 = -84,67; = -84,67 кДж. = -84,67 кДж. |
