Для заочников. Методические указания и контрольные задания для студентов заочников инженернотехнических (нехимических)
 Скачать 417.39 Kb. Скачать 417.39 Kb.
|
|
Пример 2. Раствор, содержащий 1,22 г бензойной кислоты С6Н5СООН в 100 г сероуглерода, кипит при 46,5290С. Температура кипения сероуглерода 46,3°С. Вычислите эбуллиоскопическую константу сероуглерода. Решение. Повышение температуры кипения Δt=46,529 – 46,3 = 0,2290. Мольная масса бензойной кислоты 122 г/моль, Из формулы (1) находим эбуллиоскопическую константу:  Пример 3. Раствор, содержащий 11,04 г глицерина в 800 г воды, кристаллизуется при -0,279°С. Вычислить мольную массу глицерина. Решение. Температура кристаллизации чистой воды 0°С, следовательно, понижение температуры кристаллизации 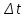 = 0 – ( -0,279) =0,279°. Масса глицерина m(г), - приходящаяся на 1000 г воды, = 0 – ( -0,279) =0,279°. Масса глицерина m(г), - приходящаяся на 1000 г воды, Подставляя в уравнение 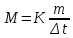 (2) (2)данные, вычисляем мольную массу глицерина:  = 92г/моль. = 92г/моль.Пример 4. Вычислите процентную концентрацию водного раствора мочевины (NH2)2CO, зная, что температура кристаллизации этого раствора равна —0,465°С. Решение. Температура кристаллизации чистой воды 0°С, следовательно, 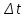 =0-(-0,465) =0,465°. Мольная масса мочевины 60 г/моль. Находим массу m(г) растворенного вещества, приходящуюся на 100 г воды, из формулы (2); =0-(-0,465) =0,465°. Мольная масса мочевины 60 г/моль. Находим массу m(г) растворенного вещества, приходящуюся на 100 г воды, из формулы (2); . .Общая масса раствора, содержащего 15 г мочевины, составляет 1000 + 15=1015 г. Процентное содержание мочевины в данном растворе находим из соотношения 1015 г раствора – 15 г вещества 1000 – х х = 1,48%. Контрольные вопросы 161. Раствор, содержащий 0,512 г неэлектролита в 100 г бензола, кристаллизуется при 5,296°С. Температура кристаллизации бензола 5,5°С Криоскопическая константа 5,10. Вычислите мольную массу растворенного вещества. Ответ: 128 г/моль. 162. Вычислите процентную концентрацию водного, раствора сахара С12Н22О11, зная, что температура кристаллизации раствора -0,93°С. Криоскопическая константа воды 1,86°. Ответ: 14,6%. 163. Вычислите температуру кристаллизации раствора мочевины (NH2)2CO, содержащего 5 г мочевины в 150 г воды. Криоскопическая константа воды 1,86 °. Ответ: –1,03°С. 164. Раствор, содержащий 3,04 г камфоры С10Н16О в 100 г бензола, кипит при 80,714°С. Температура кипения бензола 80,2°С. Вычислите эбуллиоскопическую константу бензола. Ответ: 2,57° 165. Вычислите процентную концентрацию водного раствора глицерина С3Н5(ОН)3, зная, что этот раствор кипит при 100,39°С. Эбуллиоскопическая константа воды 0,52°. Ответ: 6,45%. 166. Вычислите мольную массу неэлектролита, зная, что раствор, содержащий 2,25 г этого вещества в 250 г воды, кристаллизуется при - 0,279°С. Криоскопическая константа воды 1,86°. Ответ: 60 г/моль. 167. Вычислите температуру кипения 5%-ного раствора нафталина С10Н8 в бензоле. Температура кипения бензола 80,2°С. Эбуллиоскопическая константа его 2,57 °. Ответ: 81,25°С. 168. Раствор, содержащий 25,65 г некоторого неэлектролита в 300 г воды, кристаллизуется при -0,465°С. Вычислите мольную массу растворенного вещества. Криоскопическая константа воды 1,86 °. Ответ: 342 г/моль. 169. Вычислите криоскопическую константу уксусной кислоты, зная, что раствор, содержащий 4,25 г антрацена С14Н10 в 100 г уксусной кислоты, кристаллизуется при 15,718°С. Температура кристаллизации уксусной кислоты 16,65°С. Ответ: 3,9°. 170. При растворении 4,86 г серы в 60 г бензола температура кипения его повысилась на 0,81°. Сколько атомов содержит молекула серы в этом растворе. Эбуллиоскопическая константа бензола 2,57°. Ответ: 8. 171. Температура кристаллизации раствора, содержащего 66,3 г некоторого неэлектролита в 500 г воды, равна -0,558°С. Вычислите мольную массу растворенного вещества. Криоскопическая константа воды 1,86°. Ответ: 442 г/моль. 172. Какую массу анилина С6Н5NН2 следует растворить в 50 г этилового эфира, чтобы температура кипения раствора была выше температуры кипения этилового эфира на 0,53°. Эбуллиоскопическая константа этилового эфира 2,12°. Ответ: 1,16 г. 173. Вычислите температуру кристаллизации 2%-ного раствора этилового спирта C2H5OH, зная, что криоскопическая константа воды 1,86°. Ответ: — 0,82°С. 174. Сколько граммов мочевины (NH2) 2СО следует растворить в 75 г воды, чтобы температура кристаллизации понизилась на 0,465°С? Криоскопическая константа воды 1,86°. Ответ: 1,12 г. 175. Вычислите процентную концентрацию водного раствора глюкозы C6H1206, зная, что этот раствор кипит при 100,26°С. Эбуллиоскопическая константа воды 0,52°. Ответ: 8,25%. 176. Сколько граммов фенола С6Н5ОН следует растворить в 125 г бензола, чтобы температура кристаллизации раствора была ниже температуры кристаллизации бензола на 1,7°? Криоскопическая константа бензола 5,1°. Ответ: 3,91 г. 177. Сколько граммов мочевины (NH2)2CO следует растворить в 250 г воды, чтобы температура кипения повысилась на 0,26°? Эбуллиоскопическая константа воды 0,52°.Ответ: 7,5 г. 178. При растворении 2,3 г некоторого неэлектролита в 125 г воды температура кристаллизации понижается на 0,372°. Вычислите мольную массу растворенного вещества. Криоскопическая константа воды 1,86°. Ответ: 92 г/моль. 179. Вычислите температуру кипения 15%-ного водного раствора пропилового спирта С3Н7ОН. Эбуллиоскопическая константа воды 0,52°. Ответ: 101,52°С. 180. Вычислите процентную концентрацию водного раствора метанола СН3ОН, температура кристаллизации которого -2,79°С. Криоскопическая константа воды 1,86°. Ответ: 4,58%. Ионно-молекулярные (ионные) реакции обмена При решении задач этого раздела см. табл. 9, 12 приложения. Ионно-молекулярные, или просто ионные, уравнения реакций обмена отражают состояние электролита в растворе. В этих уравнениях сильные растворимые электролиты, поскольку они полностью диссоциированы, записывают в виде ионов, а слабые электролиты, малорастворимые и газообразные вещества записывают в молекулярной форме. В ионно-молекулярном уравнении одинаковые ионы из обеих его частей исключаются. При составлении ионно-молекулярных уравнений следует помнить, что сумма электрических зарядов в левой части уравнения должна быть равна сумме электрических зарядов в правой части уравнения. Пример 1. Написать ионно-молекулярные уравнения реакций взаимодействия между водными растворами следующих веществ: а) HCl и NaOH; б) Pb(NO3)2 и Na2S; в) NaClO и HNO3; г) K2CO3 и H2SO4; д) CH3COOH и NaOH. Решение. Запишем уравнения взаимодействия указанных веществ в молекулярном виде: а) HCl + NaOH = NaCl + H2O б) Pb(NO3)2 + Na2S = PbS + 2NaNO3 в) NaClO + HNO3 = NaNO3 + HClO г) K2CO3 + H2SO4 = K2SO4 + CO2 + H2O д) CH3COOH + NaOH = CH3COONa + H2O Отметим, что взаимодействие этих веществ возможно, ибо в результате происходит связывание ионов с образованием слабых электролитов (H2O, HClO), осадка (PbS), газа (CO2). В реакции (д) два слабых электролита, но так как реакции идут в сторону большего связывания ионов и вода – более слабый электролит, чем уксусная кислота, то равновесие реакции смещено в сторону образования воды. Исключив одинаковые ионы из обеих частей равенства а) Na+ и Cl; б) Na+ и NO3¯; в) Na+ и NO3¯; г) K+ и SO42-; д) Na+, получим ионно-молекулярные уравнения соответствующих реакций: а) H+ + OH¯ = H2O б) Pb2+ + S2- = PbS в) ClO¯ + H+ = HClO г) CO32- + 2H+ = CO2 + H2O д) CH3COOH + OH¯ = CH3COO¯ = H2O Пример 2. Составьте молекулярные уравнения реакций, которым соответствуют следующие ионно-молекулярные уравнения: а) SO32- + 2H = SO2 + H2O б) Pb2+ + CrO42- = PbCrO4 в) HCO3¯ + OH¯ = CO32- + H2O г) ZnOH+ + H+ = Zn2+ + H2O В левой части данных ионно-молекулярных уравнений указаны свободные ионы, которые образуются при диссоциации растворимых сильных электролитов, следовательно, при составлении молекулярных уравнений следует исходить из соответствующих растворимых сильных электролитов. Например: а) Na2SO3 + 2HCl = 2NaCl + SO2 + H2O б) Pb(NO3)2 + K2CrO4 = PbCrO4 + 2KNO3 в) KHCO3 + KOH = K2CO3 + H2O г) ZnOHCl + HCl = ZnCl2 + H2O Контрольные вопросы 181. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) NaHCO3 и NaOH; б) K2SiO3 и HCl; в) BaCl2 и Na2SO4. 182. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) K2S и HCl; б) FeSO4 и (NH4)2S; в) Cr(OH)3 и КОН. 183. Составьте по три молекулярных уравнения реакций, которые выражаются ионно-молекулярными уравнениями: а) Mg2+ + CO32- = MgCO3 б) Н+ + ОН¯ = Н2О 184. Какое из веществ: Al(OH)3; H2SO4; Ba(OH)2 – будет взаимодействовать с гидроксидом калия? Выразите эти реакции молекулярными и ионно-молекулярными уравнениями. 185. Составьте молекулярные и ионно-молекулярные уравнения реакции взаимодействия в растворах между: а) КНСО3 и Н2SO4; б) Zn(OH)2 и NaOH; в) CaCl2 и AgNO3. 186. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) CuSO4 и H2S; б) BaCO3 и HNO3; в) FeCl3 и KOH. 187. Составьте по три молекулярных уравнения реакций, которые выражаются ионно-молекулярными уравнениями: а) Cu2+ + S2- = CuS б) SiO32- + 2H+ = H2SiO3 188. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) Sn(OH)2 и HCl; б) BeSO4 и KOH; в) NH4Cl и Ba(OH)2. 189. Какое из веществ: KHCO3, CH3COOH, NiSO4, Na2S – взаимодействует с раствором серной кислоты? Запишите молекулярные и ионно-молекулярные уравнения этих реакций. 190. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) AgNO3 и K2CrO4; б) Pb(NO3)2 и KI; в) CuSO4 и Na2S. 191. Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями: а) CaCO3 + 2H+ = Ca2+ + H2O + CO2 б) Al(OH)3 + OH¯ = AlO2¯ + 2H2O в) PB2+ + 2I¯ = PbI2 192. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) Be(OH)2 и NaOH; б) Cu(OH)2 и HNO3; в) ZnOHNO3 и HNO3. 193. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) Na3PO4 и CaCl2; б) K2CO3 и BaCl2; в) Zn(OH)2 и KOH. 194. Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями: Fe(OH)3 + 3H+ = Fe3+ + 3H2O Cd2+ + 2OH¯ = Cd(OH)2 H+ + NO2¯ = HNO2 195. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) CdS и HCl; б) Cr(OH)3 и NaOH; в) Ba(OH)2 и CoCl2. 196. Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями: а) Zn2+ + H2S = ZnS + 2H+ б) НСО3¯ + Н+ = Н2О + СО2 в) Ag+ + Cl¯ = AgCl 197. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) Н2SO4 и Ba(OH)2; б) FeCl3 и NH4OH; в) CH3COONa и HCl. 198. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) FeCl3 и KOH; б) NiSO4 и (NH4)2S; в) MgCO3 и HNO3. 199. Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями: а) Be(OH)2 + 2OH¯ = BeO22- + 2H2O б) CH3COO¯ + H+ = CH3COOH в) Ba2+ + SO42- = BaSO4 200. Какое из веществ: NaCl, NiSO4, Be(OH)2, KHCO3 – взаимодействует с раствором гидроксида натрия. Запишите молекулярные и ионно-молекулярные уравнения этих реакций. Гидролиз солей Химическое обменное взаимодействие ионов растворенной соли с водой, приводящее к образованию слабодиссоциирующих продуктов (молекул слабых кислот или оснований, анионов кислых или катионов основных солей) и сопровождающиеся изменениям рН среды, называется гидролизом. Пример 1. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей: а) KCN; б) Na2CO3; в) ZnSO4. Определите реакцию среды растворов этих солей. Решение. а) Цианид калия KCN – соль слабой одноосновной кислоты (см. табл. 9) HCN и сильного основания КОН. При растворении в воде молекулы KCN полностью диссоциируют на катионы К+ и анионы CN-. Катионы К+ не могут связывать ионы ОН- воды, так как КОН – сильный электролит. Анионы же CN- связывают ионы Н+ воды, образуя молекулы слабого электролита HCN. Соль гидролизуется, как говорят, по аниону. Ионно-молекулярное уравнение гидролиза C  Nˉ + H2O HCN + OHˉ Nˉ + H2O HCN + OHˉИли в молекулярной форме K  CNˉ + H2O HCN + KOH CNˉ + H2O HCN + KOHВ результате гидролиза в растворе появляется некоторый избыток ионов ОНˉ, поэтому раствор имеет щелочную реакцию (рН >7). Б) Карбонат натрия Na2CO3 – соль слабой кислоты и сильного основания. В этом случае анионы соли СО32-, связывая водородные ионы воды, образуют анионы кислой соли НСО3ˉ, а не молекулы Н2СО3, так как ионы НСО3ˉ диссоциируют гораздо труднее, чем молекулы Н2СО3. В обычных условиях гидролиз идет по первой ступени. Соль гидролизуется по аниону. Ионно-молекулярное уравнение гидролиза С  О32- + Н2О НСО3ˉ + ОНˉ О32- + Н2О НСО3ˉ + ОНˉили в молекулярной форме N  a2CO3 + H2O NaHCO3 + NaOH a2CO3 + H2O NaHCO3 + NaOHВ растворе появляется избыток ионов ОНˉ, поэтому раствор Na2CO3 имеет щелочную реакцию (рН > 7). В) Сульфат цинка ZnSO4 – соль слабого многокислотного основания Zn(OH)2 и сильной кислоты H2SO4. В этом случае катионы Zn2+ связывают гидроксильные ионы воды, образуя катионы основной соли ZnOH+. Образование молекул Zn(OH)2 не происходит, так как ионы ZnOH+ диссоциируют гораздо труднее, чем молекулы Zn(OH)2. В обычных условиях гидролиз идет по первой ступени. Соль гидролизуется по катиону. Ионно-молекулярное уравнение гидролиза Z  n2+ + H2O ZnOH+ + H+ n2+ + H2O ZnOH+ + H+или в молекулярной форме 2  ZnSO4 + 2H2O (ZnOH)2SO4 + H2SO4 ZnSO4 + 2H2O (ZnOH)2SO4 + H2SO4В растворе появляется избыток ионов водорода, поэтому раствор ZnSO4 имеет кислую реакцию (рН < 7). |
