Для заочников. Методические указания и контрольные задания для студентов заочников инженернотехнических (нехимических)
 Скачать 417.39 Kb. Скачать 417.39 Kb.
|
|
Пример 2. Какие продукты образуются при смешивании растворов Al(NO3)3 и К2СО3? Составьте ионно-молекулярное и молекулярное уравнения реакции. Решение. Соль Al(NO3)3 гидролизуется по катиону, а К2СО3 – по аниону: A  l3+ + H2O AlOH2+ + H+ l3+ + H2O AlOH2+ + H+C  O32- + H2O HCO3ˉ + OHˉ O32- + H2O HCO3ˉ + OHˉЕсли растворы этих солей находятся в одном сосуде, то идет взаимное усиление гидролиза каждой из них, ибо ионы Н+ и ОНˉ образуют молекулу слабого электролита Н2О. при этом гидролитическое равновесие сдвигается вправо и гидролиз каждой из взятых солей идет до конца с образованием Al(OH)3 и CO2(H2CO3). Ионно-молекулярное уравнение: 2Al3+ + 3CO32- + 3H2O = 2Al(OH)3 + 3CO2 Молекулярное уравнение: 2Al(NO3)3 + 3K2CO3 + 3H2O = 2Al(OH)3 + 3CO2 + 6KNO3 Контрольные вопросы 201. Составьте ионно-молекулярное и молекулярное уравнения совместного гидролиза, происходящего при смешивании растворов К2S и CrCl3. Каждая из взятых солей гидролизуется необратимо до конца с образованием соответствующих основания и кислоты. 202. К раствору FeCl3 добавили следующие вещества: а) HCl; б) KOH; в) ZnCl2; г) Na2CO3. В каких случаях гидролиз хлорида железа (III) усилится? Почему? Составьте ионно-молекулярные уравнения гидролиза соответствующих солей. 203. Какие из солей Al2(SO4)3, K2S, Pb(NO3)2? KCl подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей. Какое значение рН (> 7 <) имеют растворы этих солей? 204. При смешивании растворов FeCl3 и Na2CO3 каждая из взятых солей гидролизуется необратимо до конца с образованием соответствующих основания и кислоты. Выразите этот совместный гидролиз ионно-молекулярным и молекулярным уравнениями. 205. К раствору Na2CO3 добавили следующие вещества: а) HCl; б) NaOH; в) Cu(NO3)2; г) K2S. В каких случаях гидролиз карбоната натрия усилится? Почему? Составьте ионно-молекулярные уравнения гидролиза соответствующих солей. 206. Какое значение рН (> 7 <) имеют растворы солей Na2S, AlCl3, NiSO4? Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей. 207. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей Pb(NO3)2, Na2CO3, Fe2(SO4)3. Какое значение рН (> 7 <) имеют растворы этих солей? 208. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей СН3СООК, ZnSO4, Al(NO3)3. Какое значение рН (> 7 <) имеют растворы этих солей? 209. Какое значение рН (> 7 <) имеют растворы солей Na3PO4, K2S, CuSO4? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей. 210. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей CuCl2, Cs2CO3, Cr(NO3)3/ Какое значение рН (> 7 <) имеют растворы этих солей? 211. Какие из солей RbCl, Cr2(SO4)3, Ni(NO3)2, Na2SO3 подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей. Какое значение рН (> 7 <) имеют растворы этих солей? 212. К раствору Al2(SO4)3 добавили следующие вещества: а) H2SO4; б) KOH; в) Na2SO3; г) ZnSO4. В каких случаях гидролиз сульфата алюминия усилится? Почему? Составьте ионно-молекулярные уравнения гидролиза соответствующих солей. 213. Какая из двух солей при равных условиях в большей степени подвергается гидролизу: Na2CO3 или Na2SO3; FeCl3 или FeCl2? Почему? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей. 214. При смешивании растворов Al2(SO4)3 и Na2CO3 каждая из взятых солей гидролизуется необратимо до конца с образованием соответствующих основания и кислоты. Составьте ионно-молекулярное и молекулярное уравнение происходящего совместного гидролиза. 215. Какие из солей NaBr, Na2S, K2CO3, CoCl2 подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей. Какое значение рН (> 7 <) имеют растворы этих солей? 216. Какая из двух солей при равных условиях в большей степени подвергается гидролизу: NaCN или NaClO; MgCl2 или ZnCl2? Почему? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей. 217. Составьте ионно-молекулярное и молекулярное уравнения гидролиза соли, раствор которой имеет: а) щелочную реакцию; б) кислую реакцию. 218. Какое значение рН (> 7 <) имеют растворы следующих солей: К3РО4, Pb(NO3)2, Na2S? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей. 219. Какие из солей подвергаются K2CO3, FeCl3, K2SO4, ZnCl2 гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей. Какое значение рН (> 7 <) имеют растворы этих солей? 220. При смешивании растворов Al2(SO4)3 и Na2S каждая из взятых солей гидролизуется необратимо до конца с образованием соответствующих основания и кислоты. Выразите этот совместный гидролиз ионно-молекулярным и молекулярным уравнениями. КОНТРОЛЬНОЕ ЗАДАНИЕ 2 Окислительно-восстановительные реакции Окислительно-восстановительными называются реакции, сопровождающиеся изменением степени окисления атомов, входящих в состав реагирующих веществ. Под степенью окисления (n) понимают тот условный заряд атома, который вычисляется исходя из предложения, что молекула состоит только из ионов. Иными словами: степень окисления – это тот условный заряд, который приобрел бы атом элемента, если предположить, что он принял или отдал то или иное число электронов. Окисление – восстановление – это единый, взаимосвязанный процесс. Окисление приводит к повышению степени окисления восстановителя, а восстановление – к ее понижению у окислителя. Повышение или понижение степени окисления атомов отражается в электронных уравнениях; окислитель принимает электроны, а восстановитель их отдает. При этом не имеет значения, переходят ли электроны от одного атома к другому полностью, и образуется ионные связи или электроны только оттягиваются к более электроотрицательному атому и возникает полярная связь. О способности того или иного вещества проявлять окислительные, восстановительные или двойственные (как окислительные, так и восстановительные) свойства можно судить по степени окисления атомов окислителя и восстановителя. Атом того или иного элемента в своей высшей степени окисления не может ее повысить (отдать электроны) и проявляет только окислительные свойства, а в своей низшей степени окисления не может ее понизить (принять электроны) и проявляет только восстановительные свойства. Атом же элемента, имеющий промежуточную степень окисления, может проявлять как окислительные, так и восстановительные свойства. Например: N5+ (HNO3) S6+ (H2SO4) проявляют только окислительные свойства; N  4+ (NO2) S4+ (SO2) 4+ (NO2) S4+ (SO2)N3+ (HNO2) N2+ (NO) S2+ (SO) проявляются окислительные и N1+ (N2O) восстановительные свойства; N0 (N2) S0 (S2;S8) N-1 (NН2ОН) S-1 (H2S2) N2- (N2Н4) N3- (NН3) S2- (H2S) проявляют только восстановительные свойства. При окислительно-восстановительных реакциях валентность атомов может и не меняется. Например, в окислительно-восстановительной реакции Н20 + Cl20 = 2H+Clˉ валентность атомов водорода и хлора до и после реакции равна единице. Изменилась их степень окисления. Валентность определяет число связей, образованных данным атомом, и поэтому знака не имеет. Степень же окисления имеет знак плюс или минус. Пример 1. Исходя из степени окисления (n) азота, серы и марганца в соединениях NH3, HNO2, H2S, H2SO3, H2SO4, MnO2, KMnO4, определите какие из них могут быть только восстановителями, только окислителями и какие проявляют как окислительные, так и восстановительные свойства. Решение. Степень окисления n (N) в указанных соединениях соответственно равна: -3 (низшая), +3 (промежуточная), +5 (высшая); n (S) соответственно равна; -2 (низшая); +4 (промежуточная); +6 (высшая0; n (Mn) соответственно равна; +4 (промежуточная); +7 (высшая). Отсюда: NH3, H2S – только восстановители; HNO3, H2SO4, KMnO4 – только окислители; HNO2, H2SO3, MnO2 – окислители и восстановители. Пример 2. Могут ли происходить окислительно-восстановительные реакции между следующими веществами: а) H2S и HI; б) H2S и H2SO3; в) H2SO3 и HClO4? Решение. а) Степень окисления в H2S n (S) = 2; в HI n(I) = -1. Так как и сера, и йод находятся в своей низшей степени окисления, то оба взятые вещества проявляют только восстановительные свойства и взаимодействовать друг с другом не могут; б) в H2S n(S) = -2 (низшая); в H2SO3 n (S) = +4 (промежуточная). Следовательно, взаимодействия этих веществ возможно, причем H2SO3 является окислителем; в) в H2SO3 n (S) = +4 (промежуточная); в HClO4 n(Cl) = +7 (высшая). Взятые вещества могут взаимодействовать. H2SO3 в этом случае будет проявлять восстановительные свойства. Пример 3. Составьте уравнения окислительно-восстановительной р еакции, идущей по схеме 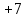 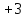 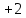 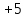 KMnO4 + H3PO3 + H2SO4 → MnSO4 + H3PO4 + K2SO4 + H2O Решение: Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют свою степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях: восстановитель 5 Р+3 – 2 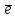 = P+5 процесс окисления = P+5 процесс окисленияокислитель 2 Mn+7 + 5 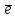 = Mn+2 процесс восстановления = Mn+2 процесс восстановленияОбщее число электронов, отданных восстановителем, должно быть равно числу электронов, которое присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов десять. Разделив это число на 5, получаем коэффициент 2 для окислителя и продуктов его восстановления, а при делении 10 на 2 получаем коэффициент 5 для восстановителя и продукта его окисления. Коэффициент перед веществами, атомы которых не имеют свою степень окисления, находят подбором. Уравнение реакции будет иметь вид 2KМnO4 + 5H3PO3 + 3H2SO4 = 2MnSO4 + 5H3PO4 + K2SO4 + 3H2O Пример 4. Составьте уравнение реакции взаимодействия цинка с концентрированной серной кислотой, учитывая максимальное восстановление последней. Решение. Цинк, как любой металл, проявляет только восстановительные свойства. В концентрированной серной кислоте окислительную функцию несет сера (+6). Максимальное восстановление серы означает, что она приобретает минимальную степень окисления. Минимальная степень окисления серы как р-элемента VIA группы равна -2. Цинк как металл IIB группы имеет постоянную степень окисления +2. Отражаем сказанное в электронных уравнениях: восстановитель 4 Zn0 – 2 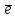 = Zn2+ процесс окисления = Zn2+ процесс окисленияокислитель 1 S6+ + 8 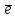 = S2- процесс восстановления = S2- процесс восстановленияСоставляем уравнение реакции: 4Zn + 5H2SO4 = 4ZnSO4 + H2S + 4H2O Перед H2SO4 стоит коэффициент 5, а не 1, ибо четыре молекулы H2SO4 идут на связывание четырех ионов Zn2+. Контрольные вопросы 221. Исходя из степени окисления хлора в соединениях HCl, HClO3, HClO4, определите, какое из них является только окислителем, только восстановителем и какое может проявлять как окислительные, так и восстановительных свойства. Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме KBr + KbrO3 + H2SO4 → Br2 + K2SO4 + H2O 222. Реакции выражаются схемами: Р + HIO3 + H2O → H3PO4 + HI H2S + Cl2 + H2O → H2SO4 + HCl Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое – восстановителем; какое вещество окисляется, какое – восстанавливается. 223. Составьте электронные уравнения и укажите, какой процесс – окисление или восстановление – происходит при следующих превращениях: As3- → As5+; N3+→ N3-; S2- → S0 На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме Na2SO3 + KМnO4 + H2O→ Na2SO4 + MnO2 + KOH 224. Исходя из степени окисления фосфора в соединениях РН3, Н3РО4, Н3РО3, определите, какое из них является только окислителем, только восстановителем и какое может проявлять как окислительные, так и восстановительные свойства. Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме PbS + HNO3 → S + Pb(NO3)2 + NO + H2O 225. См. условие задачи 222. Р + HNO3 + H2O → H3PO4 + NO KМnO4 + Na2SO3 + KOH → K2MnO4 + Na2SO4 + H2O 226. Составьте электронные уравнения и укажите, какой процесс – окисление или восстановление – происходит при следующих превращениях: Mn6+ → Mn2+; Cl5+ → Clˉ; N3- → N5+ На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме Cu2O + HNO3 → Cu(NO3)2 + NO + H2O 227. См. Условие задачи 222. HNO3 + Ca → NH4NO3 + Ca(NO3)2 + H2O K2S + KМnO4 + H2SO4 → S + K2SO4 + MnSO4 + H2O 228. Исходя из степени окисления хрома, йода и серы в соединениях K2Cr2O7, KI и H2SO3, определите, какое из них является только окислителем, только восстановителем и какое может проявлять как окислительные, так и восстановительные свойства. Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме NaCrO2 + PbO2 + NaOH → Na2CrO4 + Na2PbO2 + H2O 229. См. Условие задачи 222. H2S + Cl2 + H2O → H2SO4 + HCl K2Cr2O7 + H2S + H2SO4 → S + Cr2(SO4)3 + K2SO4 +H2O |
