Для заочников. Методические указания и контрольные задания для студентов заочников инженернотехнических (нехимических)
 Скачать 417.39 Kb. Скачать 417.39 Kb.
|
|
Пример 2. Напишите выражение для константы нестойкости комплекса [Fe(CN)6]-4. Решение. Если комплексная соль гексацианоферрат (II) калия, являясь сильным электролитом, в водном растворе необходимо диссоциирует на ионы внешней и внутренней сфер K4[Fe(CN)6] = 4К+ + [Fe(CN)6]4-, то комплексный ион диссоциирует обратимо и в незначительной степени на составляющие частицы: [  Fe(CN)6]4- Fe2+ + 6CN¯ Fe(CN)6]4- Fe2+ + 6CN¯Обратимый процесс характеризуется своей константой равновесия, которая в данном случае называется константой нестойкости (КН) комплекса: 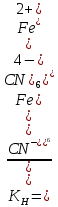 Чем меньше значение КН, тем более прочен данный комплекс. Контрольные вопросы 301. Определите, чему равны заряд комплексного иона, степень окисления и координационное число комплексообразователя в соединениях [Cu(NH3)4]SO4, K2[PtCl6], K[Ag(CN)2]. Напишите уравнения диссоциации этих соединений в водных растворах. 302. Составьте координационные формулы следующих комплексных соединений платины: PtCl4·6NH3, PtCl4·4NH3, PtCl4·2NH3. Координационное число платины (IV) равно шести. Напишите уравнение диссоциации этих соединений в водных растворах. Какое из соединений является комплексным неэлектролитом? 303. Составьте координационные формулы следующих комплексных соединений кобальта: CoCl3·6NH3, CoCl3·5NH3, CoCl3·4NH3. Координационное число кобальта (III) равно шести. Напишите уравнения диссоциации этих соединений в водных растворах. 304. Определите, чему равны заряд комплексного иона, степень окисления и координационное число сурьмы в соединениях Rb[SbBr6], K[SbCl6], Na[Sb(SO4)2]. Как диссоциируют эти соединения в водных растворах? 305. Составьте координационные формулы следующих комплексных соединений серебра: AgCl·2NH3, AgCN·KCN, AgNO2·NaNO2. Координационное число серебра равно двум. Напишите уравнения диссоциации этих соединений в водных растворах. 306. Определите, чему равны заряд комплексного иона, степень окисления и координационное число комплексообразователя в соединениях К4[Fe(CN)6], K4[TiCl8], K2[HgI4]. Как диссоциируют эти соединения в водных растворах? 307. Из сочетания частиц Со3+, NH3, NO2¯ и К+ можно составить семь координационных формул комплексных соединений кобальта, одна из которых [Co(NH3)6] (NO2)3. Составьте формулы других шести соединений и напишите уравнения их диссоциации в водных растворах. 308. Определите, чему равен заряд следующих комплексных ионов: [Cr(H2O)4Cl2], [HgBr4], [Fe(CN)6], если комплексообразователями являются Cr3+, Hg2+, Fe3+. Напишите формулы соединений, содержащих эти комплексные ионы. 309. Определите, чему равен заряд комплексных ионов [Cr(NH3)5NO3], [Pd(NH3)Cl3], [Ni(CN)4], если комплексообразователями являются Cr3+, Pd2+, Ni2+. Напишите формулы комплексных соединений, содержащих эти ионы. 310. Из сочетания частиц Cr3+, H2O, Cl¯, K+ можно оставить семь координационных формул комплексных соединений хрома, одна из которых [Cr(H2O)6]Cl3. Составьте формулы других шести соединений и напишите уравнения их диссоциации в водных растворах. 311. Составьте координационные формулы следующих комплексных соединений кобальта: 3NaNO2·Co(NO2)3, CoCl3·3NH3·2H2O, 2KNO2·NH3·Co(NO2)3. Координационное число кобальта (III) равно шести. Напишите уравнения диссоциации этих соединений в водных растворах. 312. Напишите выражения для констант нестойкости комплексных ионов [Ag(NH3)2]+, [Fe(CN)6]4-, [PtCl6]2-. Чему равны степень окисления и координационное число комплексообразователей в этих ионах? 313. Константы нестойкости комплексных ионов [Co(CN)4]2-, [Hg(CN)4]2-, [Cd(CN)4]2- соответственно равны 8·10-20, 4·10-41, 1,4·10-17. В каком растворе, содержащем эти ионы, при равной молярной концентрации ионов CN¯ больше? Напишите выражения для констант нестойкости указанных комплексных ионов. 314. напишите выражения для констант нестойкости следующих комплексных ионов: [Ag(CN)2]¯, [Ag(NH3)2]+, [Ag(SCN)2]¯. Зная, что они соответственно равны 1,0·10-21, 6,8·10-8, 2,0·10-11, укажите, в каком растворе, содержащем эти ионы, при равной молярной концентрации больше ионов Ag+. 315. При прибавлении раствора КСN к раствору [Zn(NH)3]4SO4 образуется растворимое комплексное соединение К2[Zn(CN)4]. Напишите молекулярное и ионно-молекулярное уравнение реакции. Константа нестойкости какого иона, [Zn(NH3)4]2+ или [Zn(CN)4]2-, больше? Почему? 316. Напишите уравнения диссоциации солей K3[Fe(CN)6] и NH4Fe(SO4)2 в водном растворе. К каждой из них прилили раствор щелочи. В каком случае выпадает осадок гидроксида железа (III)? Напишите молекулярное и ионно-молекулярное уравнения реакции. Какие комплексные соединения называются двойными солями? 317. Составьте координационные формулы следующих комплексных соединений платины (II), координационное число которой равно четырем: PtCl2·3NH3, PtCl2·NH3·KCl, PtCl2·2NH3. Напишите уравнения диссоциации этих соединений в водных растворах. Какое из соединений является комплексным неэлектролитом? 318. Хлорид серебра растворяется в растворах аммиака и тиосульфата натрия. Дайте этому объяснение и напишите молекулярные и ионно-молекулярные уравнения соответствующих реакций. 319. какие комплексные соединения называются двойными солями? Напишите уравнения диссоциации солей K4[Fe(CN)6] и (NH4)2Fe(SO4)2 в водном растворе. В каком случае выпадает осадок гидроксида железа (II), если к каждой из них прилить раствор щелочи? Напишите молекулярное и ионно-молекулярное уравнение реакции. 320. Константы нестойкости комплексных ионов [Co(NH3)6]3+, [Fe(CN)6]4-, [Fe(CN)6]3- соответственно равны 6,2·10-36б 1,0·10-37, 1,0·10-44. Какой из этих ионов является более прочным? Напишите выражения для констант нестойкости указанных комплексных ионов и формулы соединений, содержащих эти ионы. S – Элементы (…ns1-2) 321. Какую степень окисления может проявлять водород в своих соединениях? Приведите примеры реакций, в которых газообразный водород играет роль окислителя и в которых - восстановителя. 322. Напишите уравнения реакций натрия с водородом, кислородом, азотом и серой. Какую степень окисления приобретают атомы окислителя в каждой из этих реакций? 323. Напишите уравнения реакций с водой следующих соединений натрия: Na2O2, Na2S, NaH, Na3N. 324. Как получают металлический натрий? Составьте электронные уравнения процессов, происходящих на электродах при электролизе расплава NaOH. 325. Какие свойства может проявлять пероксид водорода в окислительно-восстановительных реакциях? Почему? На основании электронных уравнений напишите уравнения реакций Н2О2: а) с Ag2O; б) c KI. 326. Почему пероксид водорода способен диспропорционировать (самоокисляться - самовосстанавливаться)? Составьте электронные и молекулярные уравнения процесса разложения Н2О2. 327. Как можно получить гидрид и нитрид кальция? Напишите уравнения реакций этих соединений с водой. К окислительно-восстановительным реакциям составьте электронные уравнения. 328. Назовите три изотопа водорода. Укажите состав их ядер. Что такое тяжелая вода? Как она получается и каковы ее свойства? 329. Гидроксид, какого из s – элементов проявляет амфотерные свойства? Составьте молекулярные и ионно-молекулярные уравнения реакций этого гидроксида: а) с кислотой, б) со щелочью. 330. При пропускании диоксида углерода через известковую воду [раствор Са(ОН)2] образуется осадок, который при дальнейшем пропускании СО2 растворяется. Дайте объяснение этому явлению. Составьте уравнения реакций. 331. Составьте электронные и молекулярные уравнения реакций: а) бериллия с раствором щелочи; б) магния с концентрированной серной кислотой, учитывая, что окислитель приобретает низшую степень окисления. 332. При сплавлении оксид бериллия взаимодействует с диоксидом кремния и с оксидом натрия. Напишите уравнения соответствующих реакций. О каких свойствах ВеО говорят эти реакции? 333. Какие соединения магния и кальция применяются в качестве вяжущих строительных материалов? Чем обусловлены их вяжущие свойства? 334. Как можно получить карбид кальция? Что образуется при его взаимодействии с водой? Напишите уравнения соответствующих реакций. 335. Как можно получить гидроксиды щелочных металлов? Почему едкие щелочи необходимо хранить в хорошо закрытой посуде? Составьте уравнения реакций, происходящих при насыщении гидроксида натрия: а) хлором; б) оксидом серы SO3; в) сероводородом. 336. Чем можно объяснить большую восстановительную способность щелочных металлов. При сплавлении гидроксида натрия с металлическим натрием последний восстанавливает водород щелочи в гидрид – ион. Составьте электронные и молекулярные уравнения этой реакции. 337. Какое свойство кальция позволяет применять его в металлотермии для получения некоторых металлов из их соединений? Составьте электронные и молекулярные уравнения реакций кальция: а) с V2O5; б) c CaSO4. В каждой из этих реакций окислитель восстанавливается максимально, приобретая низшую степень окисления. 338. Какие соединения называют негашеной и гашеной известью? Составьте уравнения реакций их получения. Какое соединение образуется при прокаливании негашеной извести с углем? Что является окислителем и восстановителем в последней реакции? Составьте электронные и молекулярные уравнения. 339. Составьте электронные и молекулярные уравнения реакций: а) кальция с водой; б) магния с азотной кислотой, учитывая, что окислитель приобретает низшую степень окисления. 340. Составьте уравнения реакций, которые нужно провести для осуществления следующих превращений: Са → СаН2 → Са(ОН)2 → СаСО3 → Са(НСО3)2 Жесткость воды и методы ее устранения Жесткость воды выражается суммой миллиэквивалентов ионов Са2+ и Мg2+, содержащихся в 1 л воды (мэкв/л). Один миллиэквивалент жесткости отвечает содержанию 20,04 мг/л Са2+ или 12,16 мг/л Мg2+. Пример 1. Вычислите жесткость воды, зная, что в 500 л ее содержится 202,5 г Са(НСО3)2. Решение. В 1 л воды содержится 202,5 : 500 = 0,405 г Са(НСО3)2, что составляет 0,405 : 81 = 0,005 эквивалентных масс или 5 мэкв/л [81 г/моль – эквивалентная масса Са(НСО3)2]. Следовательно, жесткость воды 5 мэкв. Пример 2. Сколько граммов СаSO4 содержится в 1 м3 воды, если жесткость обусловленная присутствием этой соли, равна 4 мэкв? Решение. Мольная масса СаSO4 136,14 г/моль; эквивалентная масса равна 136,14 : 2 = 68,07 г/моль. В 1 м3 воды жесткостью 4 мэкв содержится 4 · 1000 = 4000 мэкв, или 4000 · 68,07 = 272280 мг = 272,280 г СаSO4. Пример 3. Какую массу соды надо добавить к 500 л воды, чтобы устранить ее жесткость, равную 5 мэкв? Решение. В 500 л воды содержится 500 · 5 = 2500 мэкв солей, обусловливающих жесткость воды. Для устранения жесткости следует прибавить 2500 · 53 = 132500 мг = 132,5 г соды (53 г/моль – эквивалентная масса Na2CO3). Пример 4. Вычислите карбонатную жесткость воды, зная, что на титрование 100 см3 этой воды, содержащей гидрокарбонат кальция, потребовалось 6,25 см3 0,08 н раствора HCl. Решение. Вычисляем нормальность раствора гидрокарбоната кальция. Обозначив число эквивалентов растворенного вещества в 1 л раствора, т.е. нормальность, через х, составляем пропорцию: 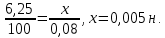 Таким образом, в 1 л исследуемой воды содержится 0,005 · 1000 = 5 мэкв гидрокарбоната кальция или 5 мэкв Са2+ - ионов. Карбонатная жесткость воды 5 мэкв. Приведенные примеры решают, применяя формулу Ж = m/ЭV, Где m – масса вещества, обусловливающего жесткость воды или применяемого для устранения жесткости воды, мг; Э – эквивалентная масса этого вещества; V – объем воды, л. Решение примера 1. Ж = m/ЭV = 202500/81 · 500 = 5 мэкв. 81 – эквивалентная масса Са(НСО3)2, равная половине его мольной массы. Решение примера 2. Из формулы Ж = m/ЭV, m = 4 · 68,07 · 1000 = 272280 мг = 272,280 г СаSO4/ Контрольные вопросы 341. Какую массу Na3PO4 надо прибавить к 500 л воды, чтобы устранить ее карбонатную жесткость, равную 5 мэкв? Ответ: 136,6 г. 342. Какие соли обуславливают жесткость природной воды? Какую жесткость называют карбонатной, некарбонатной? Как можно устранить карбонатную, некарбонатную жесткость? Напишите уравнения соответствующих реакций. Чему равна жесткость воды, в 100 л которой содержится 14,632 г гидрокарбоната магния? Ответ: 2 мэкв/л. 343. Вычислите карбонатную жесткость воды, зная, что для реакции с гидрокарбонатом кальция, содержащимся в 200 см3 воды, требуется 15 см3 0,08 н раствора HCl. Ответ: 6 мэкв/л. 344. в 1 л воды содержится ионов магния 36,47 мг и ионов кальция 50,1 мг. Чему равна жесткость этой воды? Ответ: 5,5 мэкв/л. 345. Какую массу карбоната натрия надо прибавить к 400 л воды, чтобы устранить жесткость, равную 3 мэкв. Ответ: 63,6 г. 346. Вода, содержащая только сульфат магния, имеет жесткость 7 мэкв. Какая масса сульфата магния содержится в 300 л этой воды? Ответ: 126,3 г. 347. Вычислите жесткость воды, зная, что в 600 л ее содержится 65,7 г гидрокарбоната магния и 61,2 сульфата калия. Ответ: 3,2 мэкв/л. 348. В 220 л содержится 11 г сульфата магния. Чему равна жесткость этой воды? Ответ: 0,83 мэкв/л. 349. Жесткость воды, в которой растворен только гидрокарбонат кальция, равна 4 мэкв. Какой объем 0,1 н раствора HCl потребуется для реакции с гидрокарбонатом кальция, содержащимся в 75 см3 этой воды? Ответ: 3 см3. 350. в 1 м3 воды содержится 140 г сульфата магния. Вычислите жесткость этой воды. Ответ: 2,33 мэкв/л. 351. Вода, содержащая только гидрокарбонат магния, имеет жесткость 3,5 мэкв. Какая масса гидрокарбоната магния содержится в 200 л воды? Ответ: 51,1 г. 352. к 1 м3 жесткой воды прибавили 132,5 г карбоната натрия. Насколько понизилась жесткость? Ответ: на 2 мэкв/л. 353. Чему равна жесткость воды, если для ее устранения к 50 л воды потребовалось прибавить 21,2 г карбоната натрия? Ответ: 8 мэкв/л. 354. Какая масса CaSO4 содержится в 200 л воды, если жесткость, обусловливаемая этой солью, равна 8 мэкв? Ответ: 108,9 г. 355. Вода, содержащая только гидрокарбонат кальция, имеет жесткость 9 мэкв. Какая масса гидрокарбоната кальция содержится в 500 л воды? Ответ: 364,5 г. 356. Какие ионы надо удалить из природной воды, чтобы сделать ее мягче? Введением, каких ионов можно умягчить воду? Составьте уравнения соответствующих реакций. Какую массу Са(ОН)2 надо прибавить к 2,5 л воды, чтобы устранить ее жесткость, равную 4,43 мэкв/л? Ответ: 0,406 г 357. Какую массу карбоната натрия надо прибавить к 0,1 м3 воды, чтобы устранить жесткость, равную 4 мэкв? Ответ: 21,2 г. 358. К 100 л жесткой воды прибавили 12,95 г гидроксида кальция. Насколько понизилась карбонатная жесткость? Ответ: на 3,5 мэкв/л. 359. Чему равна карбонатная жесткость воды, если в 1 л ее содержится 0,292 г гидрокарбоната магния и 0,2025 г гидрокарбоната кальция? Ответ: 6,5 мэкв/л. 360. Какую массу гидроксида кальция надо прибавить к 275 л воды, чтобы устранить ее карбонатную жесткость, равную 5,5 мэкв? Ответ: 56,06 г. |
