Для заочников. Методические указания и контрольные задания для студентов заочников инженернотехнических (нехимических)
 Скачать 417.39 Kb. Скачать 417.39 Kb.
|
|
Контрольные задания 121. Окисление серы и ее диоксида протекает по уравнениям: а) S (к) + О2 = SO2 (к); б) 2SO2 (г)+О2 =2SO3 (г). Как изменятся скорости этих реакций, если объемы каждой из систем увеличить четыре раза? 1  22. Напишите выражение для константы равновесия гомогенной системы N2 + 3H2 2NH3. Как изменится скорость прямой реакции образования аммиака, если увеличить концентрацию водорода в три раза? 22. Напишите выражение для константы равновесия гомогенной системы N2 + 3H2 2NH3. Как изменится скорость прямой реакции образования аммиака, если увеличить концентрацию водорода в три раза?123. Реакция идет по уравнению N2+О2 = 2NO. Концентрации исходных веществ до начала реакции были: [N2] = 0,049 моль/л; [О2] = 0,01 моль/л. Вычислите концентрацию этих веществ в момент, когда [NO] = 0,005моль/л. Ответ: [N2] = 0,0465 моль/л; [О2] = 0,0075 моль/л. 124. Реакция идет по уравнению N2+3H2=2NH3. Концентрации участвующих в ней веществ были: [N2] = 0,80 моль/л; [Н2]= 1,5 моль/л; [NH3]= 0,10 моль/л. Вычислите концентрацию водорода и аммиака, когда N2]= 0,5 моль/л. Ответ: [NH3]=0,70 моль/л; [Н2]= 0,60 моль/л. 125. Реакция идет по уравнению Н2 + I2 = 2НI. Константа скорости этой реакции при некоторой температуре равна 0,16. Исходные концентрации реагирующих веществ: [Н2]=0,04 моль/л; [I2] = 0,05 моль/л. Вычислите начальную скорость реакции и ее скорость, когда [H2]= 0,03 моль/л. Ответ: 3,2∙ 10-4; 1,92∙ 10-4. 126. Вычислите, во сколько раз уменьшится скорость реакции, протекающей в газовой фазе, если понизить температуру от 120 до 80°С. Температурный коэффициент скорости реакции 3. 127. Как изменится скорость реакции, протекающей в газовой фазе, при повышении температуры на 60°, если температурный коэффициент скорости данной реакции 2? 1  28. В гомогенной системе СО + Сl2 СОСl2 равновесные концентрации реагирующих веществ: [СО] = 0,2 моль/л; [Сl2] = 0,3 моль/л; [СОСl2] = 1,2 моль/л. Вычислите константу равновесия системы и исходные концентрации хлора и СО. Ответ: К = 20; [Сl2]исх = 1,5 моль/л; [СО]исх = 1,4 моль/л. 28. В гомогенной системе СО + Сl2 СОСl2 равновесные концентрации реагирующих веществ: [СО] = 0,2 моль/л; [Сl2] = 0,3 моль/л; [СОСl2] = 1,2 моль/л. Вычислите константу равновесия системы и исходные концентрации хлора и СО. Ответ: К = 20; [Сl2]исх = 1,5 моль/л; [СО]исх = 1,4 моль/л.1  29. В гомогенной системе А + 2В С равновесные концентрации реагирующих газов: [А] = 0,06 моль/л; [В] = 0,12 моль/л; [С] = 0,216 моль/л. Вычислите константу равновесия системы и исходные концентрации веществ А и В. Ответ: К = 2,5; [А]исх = 0,276 моль/л; [В]исх = 0,552 моль/л. 29. В гомогенной системе А + 2В С равновесные концентрации реагирующих газов: [А] = 0,06 моль/л; [В] = 0,12 моль/л; [С] = 0,216 моль/л. Вычислите константу равновесия системы и исходные концентрации веществ А и В. Ответ: К = 2,5; [А]исх = 0,276 моль/л; [В]исх = 0,552 моль/л.1  30. В гомогенной газовой системе А + В С + D равновесие установилось при концентрациях: [В] = 0,05 моль/л; [С] = 0,02 моль/л.Константа равновесия системы равна 0,04. Вычислите исходные концентрации веществ А и В. Ответ: [А]исх = 0,22 моль/л; [В]исх = 0,07 моль/л 30. В гомогенной газовой системе А + В С + D равновесие установилось при концентрациях: [В] = 0,05 моль/л; [С] = 0,02 моль/л.Константа равновесия системы равна 0,04. Вычислите исходные концентрации веществ А и В. Ответ: [А]исх = 0,22 моль/л; [В]исх = 0,07 моль/л131. Константа скорости реакции разложения N2O, протекавшей по уравнению 2N2O = 2 N2 + О2, равна 5∙10-4. Начальная концентрация N2O = 6,0 моль/л. Вычислите начальную скорость реакции и ее скорость, когда разложится 50 % N2O.Ответ: 1,8∙10-2; 4,5 ∙10-3. 1  32. Напишите выражение для константы равновесия гетерогенной системы СО2 + С 2СО. Как изменится скорость прямой реакции— образования СО, если концентрацию СО2 уменьшить в четыре раза? Как следует изменить давление, чтобы повысить выход СО? 32. Напишите выражение для константы равновесия гетерогенной системы СО2 + С 2СО. Как изменится скорость прямой реакции— образования СО, если концентрацию СО2 уменьшить в четыре раза? Как следует изменить давление, чтобы повысить выход СО?1  33. Напишите выражение для константы равновесия гетерогенной системы С + Н2О(г) СО + Н2. Как следует изменить концентрацию и давление, чтобы сместить равновесие в сторону обратной реакции - образования водных паров? 33. Напишите выражение для константы равновесия гетерогенной системы С + Н2О(г) СО + Н2. Как следует изменить концентрацию и давление, чтобы сместить равновесие в сторону обратной реакции - образования водных паров?134. Равновесие гомогенной системы 4  НСl(г) +О2 2Н2О (г) + 2Сl2(г) НСl(г) +О2 2Н2О (г) + 2Сl2(г)установилось при следующих концентрациях реагирующих веществ: [Н2О]=0,14 моль/л; [Сl2]=0,14 моль/л; [НСl]=0,20 моль/л; [02] =0,32 моль/л. Вычислите исходные концентрации хлороводорода и кислорода. Ответ: [НСl]исх=0,48 моль/л; [О2]исх=0,39 моль/л. 135. Вычислите константу равновесия для гомогенной системы С  О (г) + Н2О (г) СО2 (г) + Н2 (г) О (г) + Н2О (г) СО2 (г) + Н2 (г)если равновесные концентрации реагирующих веществ: [СО] =0,004 моль/л; [Н2О]=0,064 моль/л; [СО2]=0,016 моль/л; [Н2] =0,016 моль/л. Чему равны исходные концентрации воды и СО? Ответ: К = 1; [Н2О]исх=0,08 моль/л; [СО]исх=0,02 моль/л. 136. Константа равновесия гомогенной системы С  О (г) + Н2О (г) СО2+Н2 (г) при некоторой температуре равна 1. Вычислите равновесные концентрации всех реагирующих веществ, если исходные концентрации: [СО]=0,10 моль/л; [Н2О]=0,40 моль/л. Ответ: [СО2]р = [Н2]р=0,08 моль/л; [СО]р =0,02 моль/л; [Н2О]р =0,32 моль/л. О (г) + Н2О (г) СО2+Н2 (г) при некоторой температуре равна 1. Вычислите равновесные концентрации всех реагирующих веществ, если исходные концентрации: [СО]=0,10 моль/л; [Н2О]=0,40 моль/л. Ответ: [СО2]р = [Н2]р=0,08 моль/л; [СО]р =0,02 моль/л; [Н2О]р =0,32 моль/л.1  37. Константа равновесия гомогенной системы N2+3H2 2NH3 при некоторой температуре равна 0,1. Равновесные концентрации водорода и аммиака соответственно равны 0,2 и 0,08 моль/л. Вычислите равновесную и исходную концентрацию азота. Ответ: [N2]р = 8 моль/л; [N2]исх = 8,04 моль/л. 37. Константа равновесия гомогенной системы N2+3H2 2NH3 при некоторой температуре равна 0,1. Равновесные концентрации водорода и аммиака соответственно равны 0,2 и 0,08 моль/л. Вычислите равновесную и исходную концентрацию азота. Ответ: [N2]р = 8 моль/л; [N2]исх = 8,04 моль/л.138. При некоторой температуре равновесие гомогенной системы 2  NO + О2 2NO2 установилось при следующих концентрациях реагирующих веществ: [NO]р =0,2 моль/л; [О2]р =0,1 моль/л; [NO2]р =0,1 моль/л. Вычислите константу равновесия и исходную концентрацию NO и О2. Ответ: К = 2,5; [NO]исх =0,3 моль/л; [О2]исх =0,15 моль/л. NO + О2 2NO2 установилось при следующих концентрациях реагирующих веществ: [NO]р =0,2 моль/л; [О2]р =0,1 моль/л; [NO2]р =0,1 моль/л. Вычислите константу равновесия и исходную концентрацию NO и О2. Ответ: К = 2,5; [NO]исх =0,3 моль/л; [О2]исх =0,15 моль/л.139. Почему при изменении давления смещается равновесие системы N   2 + 3H2 2NH3 и не смещается равновесие системы N2+ О2 2NO? Ответ мотивируете на основании расчета скорости прямой и обратной реакции в этих системах. До и после изменения давления. Напишите выражения для констант равновесия каждой из данных систем. 2 + 3H2 2NH3 и не смещается равновесие системы N2+ О2 2NO? Ответ мотивируете на основании расчета скорости прямой и обратной реакции в этих системах. До и после изменения давления. Напишите выражения для констант равновесия каждой из данных систем.1  40. Исходные концентрации [NO]исх и [Сl2]исх в гомогенной системе 2NO +Cl2 2NOCl составляют соответственно 0,5 и 0,2 моль/л. Вычислите константу равновесия, если к моменту наступления равновесия прореагировало 20% NO. Ответ: 0,416. 40. Исходные концентрации [NO]исх и [Сl2]исх в гомогенной системе 2NO +Cl2 2NOCl составляют соответственно 0,5 и 0,2 моль/л. Вычислите константу равновесия, если к моменту наступления равновесия прореагировало 20% NO. Ответ: 0,416.Способы выражения концентрации раствора Концентрацией раствора называется количество растворенного вещества, содержащееся в определенной массе или известном объеме раствора или растворителя. Пример 1. Вычислите: а) процентную (С, %); б) молярную (См); в) нормальную (Сн); г) моляльную (Сm) концентрации раствора Н3РО4, полученного при растворении 18 г кислоты в 282 см3 воды, если плотность его 1,031 г/см3. Чему равен титр Т этого раствора? Решение:а) массовая процентная концентрация показывает число граммов (единиц массы) вещества, содержащееся в 100 г (единиц массы) раствора. Так как массу 282 см3 воды можно принять равной 282 г, то масса полученного раствора 18 + 282 = 300 г и, следовательно: 300— 18 100-С% 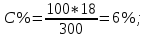 б ) мольно-объемная концентрация, или молярность, показывает число молей растворенного вещества, содержащихся в 1 л раствора. Масса 1 л раствора 1031 г. Массу кислоты в литре раствора находим из соотношения 300 - 18 1031 - х 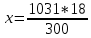 = 61,86 = 61,86Молярность раствора получим делением числа граммов Н3РО4 в 1л раствора на мольную, массу Н3PO4 (97,99 г/моль): Сm =61,86797,99 = 0,63 m; в) эквивалентная концентрация, или нормальность, показывает число эквивалентов растворенного вещества, содержащихся в 1 л раствора. Так как эквивалентная масса Н3PO4 = М/3=97,99/3 = 32,6 г/моль, то Сн = 61,86/32,66 = 1,89 н.; г) мольно-массовая концентрация, или моляльность, показывает число молей растворенного вещества, содержащихся в 1000 г растворителя. Массу Н3PO4 в 1000 г растворителя находим из соотношения 282— 18  = 68,83 = 68,831000-х Отсюда Сm=63,83/97,99 = 0,65 m. Титром раствора называется количество граммов растворенного вещества в 1 см3 (мл) раствора. Так как в 1 л раствора содержится 61,86 г кислоты, то Т= 61,86/1000 = 0,06186 г/см3. Зная нормальность раствор и эквивалентную массу mЭ растворенного вещества, титр легко найти по формуле Т= Си mэ/1000. Пример 2. На нейтрализацию 50 см3 раствора кислоты Израсходовано 25 см3 0,5 н. раствора щелочи. Чему равна нормальность кислоты? Решение. Так как вещества взаимодействуют между собой в эквивалентных соотношениях, то растворы равной нормальности реагируют в равных объемах. При разных нормальностях объемы растворов реагирующих веществ обратно пропорциональны их нормальностям, т. Е. V1/ V2 = Сн2/Сн1 или V1Cнl= V2Cн2 50Сн1= 25∙0,5, откуда Сн1 = 25∙0,5/50 = 0,25 н. Пример 3. К 1 л 10%-ного раствора КОН (пл. 1,092 г/см3) прибавили 0,5 л 5%-ного раствора КОН (пл. 1,045 г/см3). Объем смеси довели до 2 л. Вычислите молярную концентрацию полученного раствора. Решение. Масса одного литра 10%-ного раствора КОН 1092 г. В этом растворе содержится 1092∙10/100= 109,2 г КОН. Масса 0,5 л 5%-ного раствора 1045∙0,5=522,5 г. В этом растворе содержится 522,5∙5/100 = 26,125 г КОН. В общем объеме полученного раствора (2 л) масса КОН составляет 109,2 + 26,125=135,325 г. Отсюда молярность этого раствора См =135,325/2∙56,1 = 1,2 М, где 56,1 г/моль — мольная масса КОН. Пример 4. Какой объем 96%-ной кислоты, плотность которой 1,84 г/см3, потребуется для приготовления 3 л 0,4 н. раствора? Решение. Эквивалентная масса H2SO4 = M/2 = 98,08/2 = 49,04 г/моль. Для приготовления 3 л 0,4 в. раствора требуется 49,04∙0,4∙3 = 58,848 г H2SО4. Масса 1 см3 96%-ной кислоты 1.84 г. В этом растворе содержится 1,84∙96/100 = 1,766 г H2SO4. Следовательно, для приготовления 3 л 0,4 н. раствора надо взять 58,848 : 1,766 = 33,32 см3 этой кислоты. Контрольные вопросы 141. Вычислит молярную и эквивалентную концентрации 20%-ного раствора хлорида кальция, плотностью 1,178 г/см3. Ответ: 2,1 М; 4,2 н. 142. Чему равна нормальность 30%-ного раствора NaOH, плотностью 1,328 г/см3? К 1 л этого раствора прибавили 5 л воды. Вычислите процентную концентрацию полученного раствора. Ответ: 9,96н.; 6,3%. 143. К 3 л 10%-ного раствора HNO3, плотностью 1,054 г/м3, прибавили 5 л 2%-ного раствора той же кислоты плотностью 1,009 г/см3. Вычислите процентную и молярную концентрацию полученного раствора, объем которого равен 8 л. Ответ: 5,0%; 0,82 М. 144. Вычислите эквивалентную и моляльную концентрации 20,8%-ного раствора HNO3, плотность которого 1,12 г/см3. Сколько граммов кислоты содержится в 4 л этого раствора? Ответ: 3,70 н.; 4,17 м; 931,8 г. 145. Вычислите молярную, эквивалентную и моляльную концентрации 16%-ного раствора хлорида алюминия, плотностью1,149 г/см3. Ответ:1,38М; 4,14 н.; 1,43 м. 146. Сколько и какого вещества останется в избытке, если к 75 см3 0,3н раствора H2SO4 прибавить 125 см3 0,2 н раствора КОН? Ответ; 0,14 г КОН. 147. Для осаждения в виде AgCl всего серебра, содержащегося в100 см3 раствора Agn03, потребовалось 50 см3 0,2 н раствора НСl. Какая нормальность раствора AgNO3? Какая масса AgCl выпала в осадок? Ответ: 0,1 н.; 1,433 г. 148. Какой объем 20,01%-ного раствора НСl (пл.1,100г/ см3) требуется для приготовления 1 л 10,17%-ного раствора (пл.1,050г/ см3)? Ответ: 485,38 см3 . 149. Смешали 10 см3 10%-ного раствора НNО3 (пл. 1,056 г/ см3) и 100 см3 30%-ного раствора НNО3 (пл. 1,184г/ см3). Вычислите процентную концентрацию получившегося раствора. Ответ: 28,38%. 150. Какой объем 50%-ного раствора КОН (пл. 1,538 г/ см3) требуется для приготовления З л 6%-погораствора (пл. 1,048г/ см3)? Ответ: 245,5 см3 . 151. Какой объем 10%-ного раствора карбоната натрия (пл. 1,105см3 ) требуется для приготовления 5 л 2%-ного раствора (пл. 1,02 см3 ) Ответ:923,1 см3. 152. На нейтрализацию 31 см3 0,16 н. раствора щелочи требуется 217 см3 раствора H2SO4. Чему равны нормальность и титр раствора H2SO4. Ответ: 0,023н; 1,127∙10-3 г/ см3. 153. Какой объем 0,3 н. раствора кислоты требуется для нейтрализации раствора, содержащего 0,32 г NaOH в 40 см3? Ответ:26,6 см3 154. На нейтрализацию 1 л. Раствора, содержащего 1,4 г КОН, требуется 50 см3 раствора кислоты. Вычислите нормальность раствора кислоты. Ответ: 0,53 н. 155. Какая масса HNO3 содержалось в растворе, если на нейтрализацию его потребовалось 35 см3 0,4 н. раствора NaOH? Какой титр раствора NaOH? Ответ: 0,882 г, 0,016 г/см3. 156. Какую массу NaNO3 нужно растворить в 400 г воды, чтобы приготовить 20%-ный раствор? Ответ: 100 г. 157. Смешали 300 г 20%-ного раствора и 500 г 40%-ного раствора NaCl. Чему равна процентная концентрация полученного раствора? Ответ: 32,5%. 158. Смешали 247 г 62%-ного и 145 г 18%-ного раствора серной кислоты. Какова процентная концентрация полученного раствора. Ответ: 45,72%. 159. Из 700 г 60%-ной серной кислоты выпариванием удалили 200 г воды. Чему равна процентная концентрация оставшегося раствора? Ответ: 84%. 160. Из 10 кг 20%-ного раствора при охлаждении выделилось 400 г соли. Чему равна Процентная концентрация охлажденного раствора? Ответ: 16,7%. Свойства растворов Пример 1. Вычислите температуры кристаллизации и кипения 2%-ного водного раствора глюкозы С6Н12О6. Решение. По закону Рауля понижение температуры кристаллизации и повышение температуры кипения раствора (Δt) по сравнению с температурами кристаллизации и кипения растворителя выражается уравнением 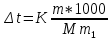 (1) (1)где К — криоскопическая или эбуллиоскопическая константы. Для воды они соответственно равны 1,86 и 0,520; mи М — соответственно масса растворенного вещества и его мольная масса; m1- масса растворителя. Понижение температуры кристаллизации 2%-ною раствора С6Н12О6 находим из формулы (1): 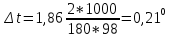 Вода кристаллизуется при 0°С, следовательно, температуры кристаллизации раствора 0- 0,21= -0.210 С. Из формулы (1) находим повышение температуры кипения 2%-ного paствора: 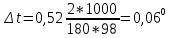 Вода кипит при 100°С, следовательно, температура кипения этого раствора 100+0,06= 100,06°С. |
