Для заочников. Методические указания и контрольные задания для студентов заочников инженернотехнических (нехимических)
 Скачать 417.39 Kb. Скачать 417.39 Kb.
|
|
31. Изотоп углерода-11 образуется при бомбардировке протонами ядер атомов азота-14. Составьте уравнение этой ядерной реакции и напишите его в сокращенной форме. 32. Напишите электронные формулы атомов элементов с порядковыми номерами 15 и 28.Чему равен максимальный спин р-электронов у атомов первого и d-электронов у атомов второго элемента? 33. Напишите электронные формулы атомов элементов с порядковыми номерами 21 и 23. Сколько свободных d-орбиталей в атомах этих элементов? 34. Сколько и какие значения может принимать магнитное квантовое число ml при орбитальном числе l= 0, 1, 2 и 3? Какие элементы в периодической системе называют s-, p-, d- и f- элементами? Приведите примеры. 35. Какие значения могут принимать квантовые числа n,l, тlи тs, характеризующие состояние электронов в атоме? Какие значения они принимают для внешних электронов атома магния? 36. Какие из электронных формул, отражающих строение невозбужденного атома некоторого элемента неверны: а) 1s22s22p53s1; б)1s22s22p6; в)1s22s22p63s23p63d4; г)1s22s22p63s23p64s2; д)1s22s22p63s23d2 ? Почему? Атомам каких элементов отвечают правильно составленные электронные формулы? 37. Напишите электронные формулы атомов элементов с порядковыми номерами 24 и 33, учитывая, что у первого происходит провал одного 4s-электрона на 3d-подуровень. Чему равен максимальный спин d-электронов у атомов первого и р -электронов у атомов второго элемента? 38. Квантовые числа для электронов внешнего энергетического уровня атомов некоторого элемента имеют следующие значения: n=4; l=0; тl=0; тs= ± 1/2/. Напишите электронную формулу атома этого элемента и определите, сколько свободных 3d-орбиталей он содержит. 39. В чем заключается принцип Паули? Может ли быть на каком-нибудь подуровне атома р7- или d12-электронов? Почему? Составьте электронную формулу атома элемента с порядковым номером 22 и укажите его валентные электроны. 40. Составьте электронные формулы атомов элементов с порядковыми номерами 32 и 42, учитывая, что у последнего происходит провал одного 5s-электрона на 4d-подуровень. К какому электронному семейству относится каждый из этих элементов? Периодическая система элементов Д. И. Менделеева Пример 1. Какую высшую и низшую степени окисления проявляют мышьяк, селен и бром? Составьте формулы соединений данных элементов, отвечающих этим степеням окисления. Решение. Высшую степень окисления элемента определяет номер группы периодической системы Д. И. Менделеева, в которой он находится. Низшая степень окисления определяется тем условным зарядом, который приобретает атом при присоединении того количества электронов, которое необходимо для образования устойчивой восьмиэлектронной оболочки (ns2np6). Данные элементы находятся соответственно в VA, VIA, VIIА- группах и имеют структуру внешнего энергетического уровня s2p3, s2p4 и s2p5 (табл. 3). Таблица 3. Степени окисления мышьяка, селена, брома
Пример 2. У какого из элементов четвертого периода — марганца или брома — сильнее выражены металлические свойства? Решение. Электронные формулы данных элементов 25Мn 1s2 2s2 2p6 3s2 3p6 3d5 4s2 35Br ls22s22p63s23p63d104s24p5 Марганец — d-элемент VIIB группы, а бром — р-элемент VILA, группы. На внешнем энергетическом уровне у атома марганца два электрона, а у атома брома — семь. Атомы типичных металлов характеризуются наличием небольшого числа электронов на внешнем энергетическом уровне, а, следовательно, тенденцией терять эти электроны. Они обладают только восстановительными свойствами и не образуют элементарных отрицательных ионов. Элементы, атомы которых на внешнем энергетическом уровне содержат более трех электронов, обладают определенным сродством к электрону, а, следовательно, приобретают отрицательную степень окисления и даже образуют элементарные отрицательные ионы. Таким образом, марганец, как и все металлы, обладает только восстановительными свойствами, тогда как для брома, проявляющего слабые восстановительные свойства, более свойственны окислительные функции. Общей закономерностью для всех групп, содержащих р- и d-элементы, является преобладание металлических свойств у d-элементов. Следовательно, металлические свойства у марганца сильнее выражены, чем у брома. Пример 3. Как зависят кислотно-основные свойства оксидов и гидроксидов от степени окисления атомов элементов, их образующих? Какие гидроксиды называются амфотерными (амфолитами)? Решение. Если данный элемент проявляет переменную степень окисления и образует несколько оксидов и гидроксидов, то с увеличением степени окисления свойства последних меняются от основных к амфотерным и кислотным. Это объясняется характером электролитической диссоциации (ионизации) гидроксидов ЭОН, которая в зависимости от сравнительной прочности и полярности связей Э---О и О---Н может протекать по двум типам: 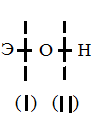 Э  ОН Э+ + ОН- ОН Э+ + ОН-Э  ОН ЭО- + Н+ ОН ЭО- + Н+Полярность связей, в свою очередь, определяется разностью электроотрицательностей компонентов, размерами и эффективными зарядами атомов. Диссоциация по кислотному типу (II) протекает, если ЕО-Н < EЭ-О (высокая степень окисления), а по основному типу, если ЕО-Н > EЭ-О (низкая степень окисления). Если прочности связей О-Н и Э-О близки или равны, диссоциация гидроксида может одновременно протекать и по (I), и по (II) типам. В этом случае речь идет об амфотерных электролитах (амфолитах): Э  n+ + nOH- Э(ОН)n = НnЭОn = nH+ + n+ + nOH- Э(ОН)n = НnЭОn = nH+ +  как основание как кислота Э – элемент, n – его положительная степень окисления. В кислой среде амфолит проявляет основной характер, а в щелочной среде – кислый характер: Ga(OH)3 + 3HCl = GaCl3 + 3H2O Ga(OH)3 + 3NaOH = Na3GaO3 + 3H2O Контрольные вопросы 41. Исходя из положения германия, цезия и технеция в периодической системе, составьте формулы мета-, ортогерманиевой кислот и оксида технеция, отвечающие их высшей степени окисления. Изобразите формулы этих соединений графически. 42. Что такое энергия ионизации? В каких единицах она выражается? Как изменяется восстановительная активность s- и р- элементов в группах периодической системы с увеличением порядкового номера? Почему? 43. Что такое электроотрицательность? Как изменяется электроотрицательность р-элементов в периоде; в группе периодической Системы с увеличением порядкового номера? Почему? 44. Исходя из положения германия, молибдена и рения в периодической системе составьте формулы водородного соединения германия, оксида молибдена и рениевой кислоты, отвечающих их высшей степени окисления. Изобразите графически формулы этих соединений. 45. Что такое сродство к электрону? В каких единицах оно выражается? Как изменяется окислительная активность неметаллов в периоде и группе периодической системы с увеличением порядкового номера? Ответ мотивируйте строением атома соответствующего элемента. 46. Составьте формулы оксидов и гидроксидов элементов третьего периода периодической системы, отвечающих их высшей степени окисления. Как изменяется кислотно-основный характер этих соединений при переходе от натрия к хлору? Напишите уравнение реакций, доказывающих амфотерность гидроксида алюминия. 47. Какой из элементов четвертого периода — ванадий или мышьяк обладает более выраженными металлическими свойствами? Какой из этих элементов образует газообразное соединение с водородом? Ответ мотивируйте, исходя из строения атомов данных элементов. 48. Марганец образует соединения, в которых он проявляет степень окисления +2, +3, +4, +6, +7. Составьте формулы его оксидов и гидроксидов, отвечающих этим степеням окисления. Напишите уравнения реакций, доказывающих амфотерность гидросида марганца (IV). 49. У какого элемента четвертого периода — хрома или селена — сильнее выражены металлические свойства? Какой из этих элементов образует газообразное соединение с водородом? Ответ мотивируйте строением атомов хрома и Селена. 50. Какую низшую степень окисления проявляют хлор, сера, азот и углерод? Почему? Составьте формулы соединений алюминия с данными элементами в этой их степени окисления. Как называются соответствующие соединения? 51. У какого из р-элементов пятой группы периодической системы — фосфора или сурьмы — сильнее выражены неметаллические свойства? Какой из водородных соединений данных элементов более сильный восстановитель? Ответ мотивируйте строением атома этих элементов. 52. Исходя из положения металла в периодической системе, дайте мотивированный ответ на вопрос: какой из двух гидроксидов более сильное основание: Ва(ОН)2 или Mg(OH)2; Са(ОН)2 или Fe(OH)2; Cd(OH)2 или Sr(OH)2? 53. Исходя из степени окисления атомов соответствующих элементов, дайте мотивированный ответ на вопрос: какой из двух гидроксидов является более сильным основанием: CuOH или Cu(OH)2; Fe(OH)2 или Fe(OH)3; Sn(OH)2 или Sn(OH)4? Напишите уравнения реакций, доказывающих амфотерность гидроксида олова(II). 54. Какую низшую степень окисления проявляют водород, фтор, сера и азот? Почему? Составьте формулы соединений кальция с данными элементами в этой их степени окисления. Как называются соответствующие соединения? 55. Какую низшую и высшую степени окисления проявляют кремний, мышьяк, селен и хлор? Почему? Составьте формулы соединений данных элементов, отвечающих этим степеням окисления. 56. . Хром образует соединения, в которых он проявляет степень окисления +2, +3, +6. Составьте формулы его оксидов и гидроксидов, отвечающих этим степеням окисления. Напишите уравнения реакций, доказывающих амфотерность гидросида хрома (III). 57. Атомные массы элементов в периодической системе непрерывно увеличиваются, тогда, как свойства простых тел изменяются периодически. Чем это можно объяснить? Дайте мотивированный ответ. 58. Какова современная формулировка - периодического закона? Объясните, почему в периодической системе элементов аргон, кобальт, теллур и торий помещены соответственно перед калием, никелем, иодом и протактинием, хотя и имеют большую атомную массу? 59. Какую низшую и высшую степени окисления проявляют углерод, фосфор, сера и иод? Почему? Составьте формулы соединений данных элементов, отвечающих этим степеням окисления. 60. Атомы, каких элементов четвертого периода периодической системы образуют оксид, отвечающий их высшей степени окисления Э2О5? Какой из них дает газообразное соединение с водородом? Составьте формулы кислот, отвечающих этим оксидам, и изобразите их графически? Химическая связь и строение молекул. Конденсированное состояние вещества Пример 1. Какую валентность, обусловленную неспаренными электронами (спинвалентность), может проявлять фосфор в нормальном и возбужденном (*) состояниях? Решение. Распределение электронов внешнего энергетического уровня фосфора ... 3s23p3 (учитывая правило Хунда — 3s2 3рх3ру3рzпо квантовым ячейкам имеет вид S ׀ p ׀ d 15Р 3s2 3рх3ру3рz Атомы фосфора имеют свободные d-орбитали, поэтому возможен переход одного Зs-электрона в Зd-состояние s ׀ p ׀ d 15Р 3s 3рх3ру3рz3dxy Отсюда валентность (спинвалентность) фосфора в нормальном состоянии равна трем, а в возбужденном — пяти. Пример 2. Что такое гибридизация валентных орбиталей? Какое Строение имеют молекулы типа АВn, если связь в них образуется за счет sp-, sp2-, sр3-гибридизации орбиталей атома А? Решение. Теория валентных связей (ВС) предполагает участие в образовании ковалентных связей не только «чистых» АО, но и «смешанных», так называемых гибридных АО. При гибридизации первоначальная форма и энергия орбиталей (электронных облаков) взаимно изменяются и образуются орбитали (облака) новой одинаковой формы и одинаковой энергии. Число гибридных орбиталей (q) равно числу исходных. Ответ на поставленный Вопрос отражен в табл. 4. Таблица 4. Гибридизация орбиталей ипространственная конфигурация молекул
Пример 3. Какой метод молекулярных орбиталей (МО) описывает строение двухатомных гомоядерных молекул элементов второго периода? Решение. Метод валентных связей (ВС) не может объяснить целый ряд свойств и строение некоторых молекул (парамагнетизм молекулы О2; большую прочность связей в молекулярных ионах 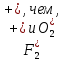 соответственно, в молекулах F2 и О2; наоборот, меньшую прочность связи в ионе соответственно, в молекулах F2 и О2; наоборот, меньшую прочность связи в ионе 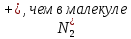 N2; Существование молекулярного иона N2; Существование молекулярного иона и неустойчивость молекулы Не2 и т. п. ). Более плодотворным оказался другой подход к объяснению ковалентной связи- метод молекулярных орбиталей (МО). в методе МО состояние молекулы описывается как совокупность электронных молекулярных орбиталей. Молекулярной орбитали, возникающей от сложения атомных орбиталей (АО), соответствует более низкая энергия, чем исходным орбиталям. Такая МО имеет повышенную электронную плотность в пространстве между рядами, способствует образованию химической связи и называется связывающей. Молекулярной орбитали, образовавшейся от вычитания атомных, соответствует более высокая энергия, чем атомным орбиталям. Электронная плотность в этом случае сконцентрирована за ядрами атомов, а между ними равна нулю. Подобные МО Энергетически менее выгодны, чем исходные АО, они приводят к ослаблению химической связи и называются разрыхляющими. Электроны, занимающие связывающие и разрыхляющие орбитали, называют, соответственно, связывающими (св) и разрыхляющими (разр) электронами. Заполнение молекулярных орбиталей происходит при соблюдении принципа Паули и правила Хунда по мере увеличения их энергии в такой последовательности: и неустойчивость молекулы Не2 и т. п. ). Более плодотворным оказался другой подход к объяснению ковалентной связи- метод молекулярных орбиталей (МО). в методе МО состояние молекулы описывается как совокупность электронных молекулярных орбиталей. Молекулярной орбитали, возникающей от сложения атомных орбиталей (АО), соответствует более низкая энергия, чем исходным орбиталям. Такая МО имеет повышенную электронную плотность в пространстве между рядами, способствует образованию химической связи и называется связывающей. Молекулярной орбитали, образовавшейся от вычитания атомных, соответствует более высокая энергия, чем атомным орбиталям. Электронная плотность в этом случае сконцентрирована за ядрами атомов, а между ними равна нулю. Подобные МО Энергетически менее выгодны, чем исходные АО, они приводят к ослаблению химической связи и называются разрыхляющими. Электроны, занимающие связывающие и разрыхляющие орбитали, называют, соответственно, связывающими (св) и разрыхляющими (разр) электронами. Заполнение молекулярных орбиталей происходит при соблюдении принципа Паули и правила Хунда по мере увеличения их энергии в такой последовательности: δcв1s < δразр1s < δсв2s < δразр2s < δразр1s < δcв2рх < δcв2ру = πcв2рz < πразр2 ру = = πразр2 рz < δразр2 рх На рис. 2 изображена энергетическая схема образования молекулярных орбиталей на атомных для двухатомных гомоядерных (одного и того же элемента) молекул элементов второго периода. Число связывающих и разрыхляющих электронов зависит от их числа в атомах исходных элементов. 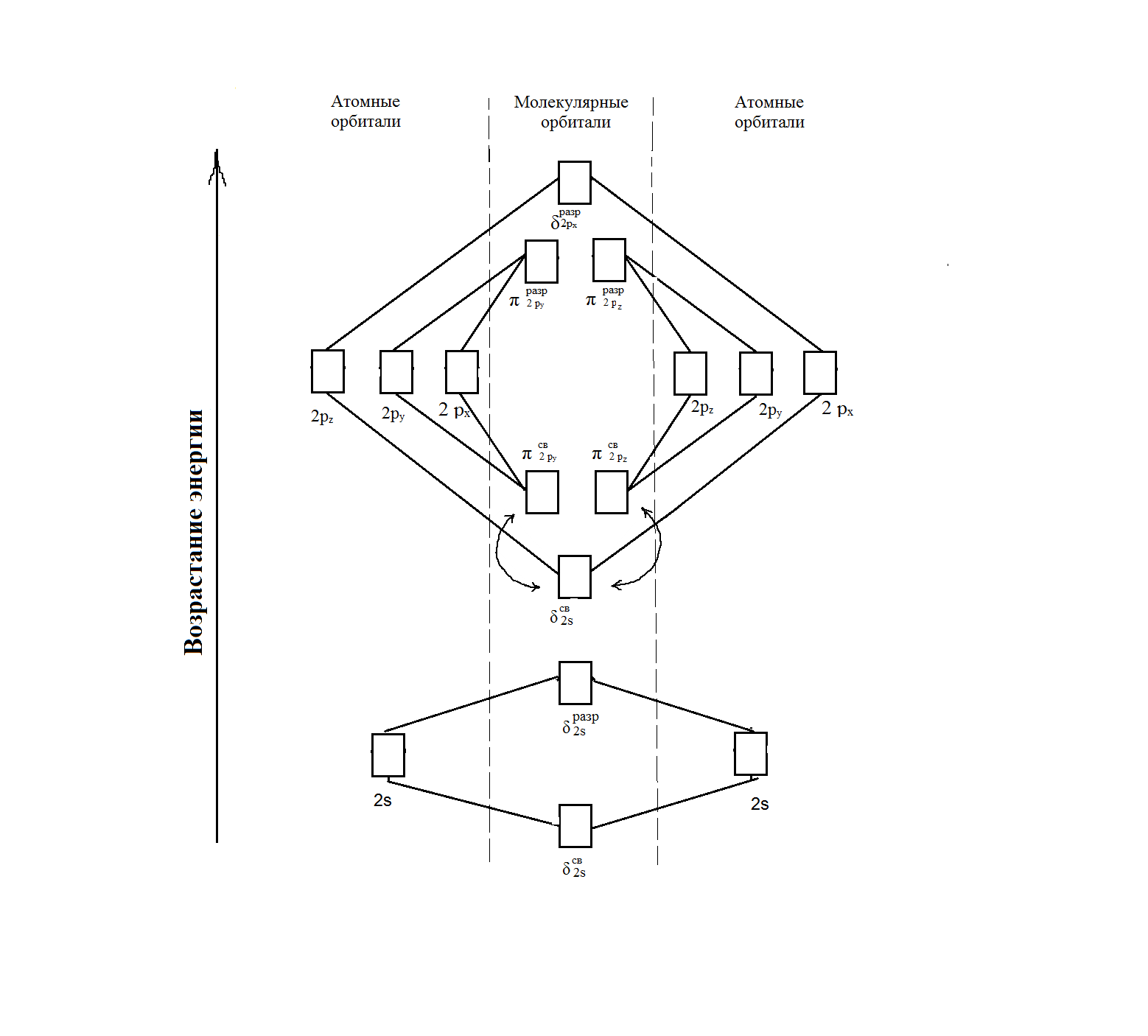 | ||||||||||||||||||||
