Методичка по органике. Методические указания по выполнению лабораторных работ по курсу Органическая химия
 Скачать 2.59 Mb. Скачать 2.59 Mb.
|
|
Опыт 3. Бромирование ароматических углеводородов. Реактивы и материалы: бензол; толуол; бром (раствор в четыреххлористом углероде). Специальное указание: опыт проводят в вытяжном шкафу! Для проведения опыта берут 2 сухие пробирки. В одну пробирку помещают 2 капли бензола, в другую – 2 капли толуола. В обе пробирки приливают по капле раствора брома и встряхивают в течение 1-2 мин. Признаком идущей реакции является выделение бромистого водорода, дымящего на воздухе, и обесцвечивание брома. В пробирке с бензолом реакция бромирования не обнаруживается. Толуол в этих условиях бромируется медленно, но вполне отчетливо. Содержимое обеих пробирок нагревают до кипения. Толуол при этом бромируется очень легко, а бензол не бромируется даже при кипячении. Химизм процесса:  толуол бромистый бензил Действие хлора и брома на ароматические соединения в условиях радикальной реакции (нагревание, освещение) приводит к замещению водорода в боковой цепи. Опыт 4. Получение бензолсульфокислоты. Реактивы и материалы: бензол; серная кислота (d = 1,84 г/см3). Оборудование: водяная баня. В пробирку помещают 3 капли бензола и 5 капель концентрированной серной кислоты. Содержимое пробирки нагревают в кипящей водяной бане при постоянном взбалтывании реакционной смеси. После получения однородного раствора выливают сульфомассу в пробирку с 10 каплями холодной воды. Если сульфирование закончено полностью, образуется прозрачный раствор, так как сульфокислоты растворимы в воде. Химизм процесса:  Легкость сульфирования при действии серной кислоты так же характерна для ароматических соединений, как способность к нитрованию. Реакция сульфирования, в отличие от реакций галогенирования и нитрования, обратима. Сульфирующими агентами являются S03 и бисульфониевый ион HSO3+, образующиеся в результате реакции молекул серной кислоты между собой: 2H2SO4 → SO3 + H3O+ + HSO4- Это сильные электрофильные реагенты с недостатком электронов у атома серы (смещение электронной плотности к кислороду). При взаимодействии с ароматическим ядром образуется промежуточный карбониевый бензол сульфокислота H-Ar+-SO3-, отщепляющий с одинаковыми скоростями SO3- или Н+. Чтобы полностью использовать серную кислоту, реакцию сульфирования ведут в избытке бензола при нагревании. Опыт 5. Получение трифенилметана. Реактивы и материалы: бензол; хлороформ; хлористый алюминий, безводный порошок. Специальное указание: опыт проводят в вытяжном шкафу! В сухую пробирку помещают немного хлорида алюминия, 4 капли бензола и 2 капли хлороформа. Содержимое пробирки слегка нагревают. Реакция идет очень энергично, выделяется дымящий на воздухе хлороводород. В результате реакции образуется густое окрашенное масло. Химизм процесса:  трифенилметан Хлорид алюминия образует с исходными, а иногда и с конечными продуктами реакции маслообразные комплексные соединения. Для выделения чистого конечного продукта комплекс разрушают соляной кислотой. Три фенильных ядра влияют на атом водорода при третичном углероде, поэтому этот атом водорода обладает особенно высокой реакционной способностью; легко окисляется, легко замещается на атом хлора или брома. Опыт 6. Возгонка нафталина. Реактивы и материалы: нафталин. Оборудование: микроскоп; предметное стекло; стеклянная палочка; фильтровальная бумага. В сухую пробирку помешают несколько кристаллов нафталина и укрепляют ее в штативе. Верхнюю половину пробирки обертывают влажной фильтровальной бумагой и начинают очень осторожно нагревать дно пробирки. В охлаждаемой части пробирки образуются кристаллы нафталина. Стеклянной палочкой переносят кристаллы на предметное стекло и рассматривают под микроскопом. Рекомендуется зарисовать форму кристаллов. Способность нафталина возгоняться используют в промышленности для его очистки. Опыт 7. Нитрование нафталина. Реактивы и материалы: нафталин; азотная кислота (d = 1,4 г/см3).Оборудование: водяная баня; стеклянная палочка. В пробирку помещают несколько кристаллов нафталина и приливают 5 капель азотной кислоты. Содержимое пробирки перемешивают стеклянной палочкой и нагревают в слабо кипящей водяной бане 1-2 мин. Горячий раствор выливают в пробирку с холодной водой. Нитронафталин опускается на дно в виде оранжевой маслянистой жидкости, затвердевающей при взбалтывании. Химизм процесса:  α-нитронафталин Нитрование нафталина идет значительно легче, чем в ряду бензола. Поэтому вместо нитрующей смеси можно применять концентрированную азотную кислоту. При нитровании нафталина получается α-нитронафталин. Более энергичное нитрование приводит к образованию 1,5-и 1,8-динитронафталинов. β-Нитронафталин получается диазотированием β-нафтиламина в азотнокислом растворе в присутствии оксида меди (I) Сu2O (обмен диазогруппы на NO2). Опыт 8. Сульфирование нафталина. Реактивы и материалы: нафталин; серная кислота (d= 1,84 г/см3). В сухую пробирку помешают несколько кристаллов нафталина, нагревают в пламени горелки до плавления и охлаждают. К затвердевшему нафталину приливают 5 капель концентрированной серной кислоты и осторожно нагревают смесь при постоянном взбалтывании до получения однородной массы. После этого дают содержимому пробирки остыть. К полученной сульфомассе добавляют 6 капель воды, слегка нагревают и охлаждают до 10-12°С – выделяются кристаллы (β-нафталинсульфокислоты). Химизм процесса:  Если на нафталин действовать серной кислотой при 80°С, получается почти исключительно α-нафталинсульфокислота. При 160°С получается β-нафталинсульфокислота. При промежуточных температурах получается равновесная смесь обоих изомеров: Сульфокислоты нафталина — важнейшие промежуточные соединения для получения более сложных производных ряда нафталина. Литература: 1. Аверина А.В., Снегирева А.Я. Лабораторный практикум по органической химии. М.: Высшая школа, 1980. – С. 34-40. Лабораторная работа №6 Галогенпроизводные углеводородов Цель: экспериментальное получение и изучение свойств галогенпроизводных углеводородов. Опыт 1. Получение бромистого этила. Реактивы и материалы: этиловый спирт; бромид калия (порошок); серная кислота (d = 1,84 г/см3). В пробирку с отводной трубкой помещают 3 капли спирта, 2 капли воды и 3 капли серной кислоты. Охладив разогревшуюся спирто-кислотную смесь, в нее помещают на конце микролопатки несколько кристаллов бромида калия. Пробирку укрепляют наклонно в лапке штатива и осторожно нагревают содержимое пробирки до кипения. Конец отводной трубки погружают в другую пробирку, содержащую 6-7 капель воды и охлаждаемую льдом. Нагревание ведут до исчезновения кристаллов бромида калия в реакционной пробирке. В приемнике образуется два слоя: нижний – бромистый этил, верхний – вода. С помощью пипетки удаляют верхний слой. Стеклянной палочкой вносят 1 каплю бромистого этила в пламя горелки. Пламя окрашивается по краям в зеленый цвет. Химизм процесса: С2Н5ОН + НО—SO3Н → С2Н5 – О – S03H + Н2О этилсерная кислота КВr + H2SO4 → НВr + KHSO4 гидросульфат калия С2Н5 – О – S03H + HBr → C2H5Br + H2SO4 бромистый этил Наиболее удобным способом получения галогеналкилов является замещение гидроксильной группы спиртов R—ОН на галоген. Получение галогенопроизводных из спиртов применяется в больших масштабах, так как спирты – легкодоступные и хорошо изученные соединения. В некоторых случаях при получении галогеналкилов вместо галогеноводородов применяют галогениды фосфора. Опыт 2. Получение хлористого этила. Реактивы и материалы: этиловый спирт; серная кислота (d = 1,84 г/см3). В пробирку насыпают мелкие кристаллы хлорида натрия (слой высотой 1 мм), затем добавляют 3 капли этилового спирта, 3 капли концентрированной серной кислоты и нагревают смесь в пламени горелки. Время от времени подносят отверстие пробирки к пламени горелки. Выделяющийся хлористый этил загорается, образуя характерное колечко, окрашенное в зеленый цвет. Химизм процесса: С2Н5ОН + НО—SO3Н → С2Н5 – О – SO3H + Н2О NaCl + H2SO4 → HCl + NaHSO4 С2Н5 – О – SO3H + HCl → C2H5Cl + H2SO4 Хлористый этил — газ, легко сгущается в жидкость с т. кип. 12,4°С. Опыт 3. Определение хлора действием металлического натрия на спиртовой раствор органического вещества (метод А. В. Степанова). Реактивы и материалы: хлороформ; этиловый спирт; металлический натрий; нитрат серебра, 0,1 н. раствор; азотная кислота, 0,1 н. раствор. В пробирку помещают 3 капли хлороформа, 3 капли этилового спирта и взбалтывают. Затем вводят в раствор кусочек металлического натрия величиной со спичечную головку. Смесь в пробирке начинает бурно кипеть, и для охлаждения пробирку погружают в холодную воду. Жидкость в пробирке мутнеет или из нее выпадает осадок плохо растворимого в спирте хлорида RC1. По окончании выделения пузырьков водорода проверяют, полностью ли растворился металлический натрий. Если натрий растворился, приливают к смеси 3-4 капли дистиллированной воды и добавляют разбавленную азотную кислоту до кислой реакции. Затем прибавляют 2-3 капли раствора нитрата серебра – выпадает белый творожистый осадок хлорида серебра. Химизм процесса: 2С2Н5ОН + 2Na → 2C2H5ONa + Н2 этилат натрия RC1 + 2H+ → R-H + HC1 углеводород R-Cl + C2H5ONa → R-O-C2H5 + NaCl простой эфир HC1 + C2H5ONa → C2H5OH + NaCl NaCl + AgNO3 → AgCl + NaNO3 Реакцию образования нерастворимых серебряных солей галогеноводородных кислот при действии азотнокислого серебра непосредственно нельзя использовать для определения галогена в органических соединениях, так как они не диссоциируют на ионы и в растворе нет ионов галогена. Необходимо сначала перевести галоген в неорганическое соединение – в данном случае хлорид натрия. При действии водорода в момент выделения происходит отщепление галогена. Опыт 4. Получение йодоформа из этилового спирта. Реактивы и материалы: этиловый спирт; едкий натр, 2 н. раствор; раствор йода в йодиде калия. Оборудование: микроскоп; предметное стекло. В пробирку помещают 1 каплю этилового спирта, 3 капли раствора йода в иодиде калия и 3 капли раствора едкого натра. Содержимое пробирки нагревают, не допуская закипания раствора, так как в кипящем растворе йодоформ расщепляется щелочью. Появляется беловатая муть, из которой постепенно при охлаждении образуются кристаллы йодоформа. Если муть растворяется, то добавляют еще 3-4 капли раствора йода к теплой реакционной смеси и тщательно перемешивают содержимое, пока не начнется выделение кристаллов. Д 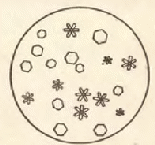 ве капли осадка переносят на предметное стекло и рассматривают их под микроскопом (рис. 5). Кристаллы йодоформа имеют вид шестиугольников или шестиконечных снежинок. Химизм процесса: ве капли осадка переносят на предметное стекло и рассматривают их под микроскопом (рис. 5). Кристаллы йодоформа имеют вид шестиугольников или шестиконечных снежинок. Химизм процесса:I2 + 2NaOH → NaOI + NaI + Н2O NaOI → NaI + [О] CH3CH2OH + [O] → CH3COH + H2O CH3COH + 3I2 → CI3COH + 3HI CI3COH + NaOH → CHI3 + HCOONa Йодоформ образует кристаллы желтого цвета с температурой плавления 119°С, обладает сильным, очень навязчивым запахом. Это прекрасный антисептик. Опыт 5. Получение бромбензола. Реактивы и материалы: бензол; бром; железо (опилки); натронная известь; едкий натр, 2 н. раствор. Оборудование: пробирка с плотно вставленной изогнутой отводной трубкой: стеклянная трубка-поглотитель; ватный тампон; водяная баня, термометр. Специальное указание: опыт проводят в вытяжном шкафу! В  сухую пробирку помещают немного железных опилок, 5 капель бензола и 2 капли брома. Отверстие пробирки сразу же закрывают пробкой с газоотводной трубкой, к которой прикреплена стеклянная трубка-поглотитель с натронной известью (рис.5). Рис. 5. сухую пробирку помещают немного железных опилок, 5 капель бензола и 2 капли брома. Отверстие пробирки сразу же закрывают пробкой с газоотводной трубкой, к которой прикреплена стеклянная трубка-поглотитель с натронной известью (рис.5). Рис. 5.Реакция начинается немедленно, смесь при этом почти не разогревается. После того как в реакционной пробирке прекратится выделение пузырьков НВr и исчезнут окрашенные пары брома, ее помещают в водяную баню и нагревают 2 мин при температуре 60-700С. Полученный бромбензол охлаждают и промывают от следов брома раствором едкого натра почти до обесцвечивания. Верхний водный слой отбирают при помощи пипетки. С бромбензолом проводят качественную реакцию на галоген. Химизм процесса: 2Fe + ЗВr2 →2FeBr3 FeBr3 С6Н6 + Вr2 → С6Н5Вr + НВr Опыт 6. Прочность галогена, стоящего в бензольном кольце. Реактивы и материалы: хлорбензол; нитрат серебра, 0,2 н. раствор. В пробирку помещают 1 каплю хлорбензола, 5 капель воды и нагревают до кипения. К горячему раствору приливают 1 каплю раствора нитрата серебра. Появление белого осадка или мути хлорида серебра не происходит. Это подтверждает прочность связи галогена с ядром. Атом галогена сопряжен с бензольным ядром, в результате которого уменьшается длины связи С-Hal и возрастает ее энергии. Сопряжение уменьшает полярность связи С-Hal и тем самым затрудняет условия для протекания реакций замещения. Подвижность галогена в ядре увеличивают электроноакцепторные заместители. Например, нитрогруппа в пара- или орто-положении к галогену. Опыт 7. Легкая подвижность галогена боковой цепи. Реактивы и материалы: хлористый бензил; нитрат серебра, 0,2 н. раствор. В пробирку помещают 1 каплю хлористого бензила, 5 капель воды, нагревают до кипения и прибавляют 1 каплю раствора нитрата серебра. Немедленно выпадает белый осадок хлорида серебра. Химизм процесса: С6Н5-СН2С1 + НОН → С6Н5-CH2OH + НС1 хлористый бензил бензиловый спирт НС1 + AgNO3 → AgCl + HNO3 Атом галогена у углеродного атома боковой цепи обладает большой подвижностью. Литература: 1. Аверина А.В., Снегирева А.Я. Лабораторный практикум по органической химии. М.: Высшая школа, 1980. – С. 34-40. Лабораторная работа №7. Определение состава органических соединений Цель: определение качественного элементного состава органических соединений. В состав органических веществ, кроме углерода, чаще всего входят еще водород, кислород и азот. Наряду с ними в молекулу органического вещества могут входить и другие элементы, например сера, галогены, фосфор и др. Для определения элементов, входящих в состав органических веществ, их необходимо предварительно перевести в неорганические соединения, для дальнейшего исследования которых применяют методы обычного качественного анализа. Например, специальными методами углерод переводят в диоксид углерода, водород – в воду, азот – в цианистый натрий, серу – в сульфид натрия и т. д. Рассмотрим определение углерода, водорода, азота, серы и галогенов. Для определения кислорода обычно не пользуются качественными реакциями. О его присутствии чаще всего судят по данным количественного анализа. Опыт 1. Определение углерода пробой на обугливание Реактивы и материалы: глюкоза кристаллическая (или сахар); казеин сухой; серная кислота, 0,1 н раствор. Оборудование: фильтровальная бумага; скальпель (или крышка тигля). Специальное указание: опыт проводят в вытяжном шкафу! Присутствие углерода во многих органических веществах можно обнаружить по обугливанию вещества при осторожном его прокаливании. 1. На кончик скальпеля (или крышку тигля) помещают несколько кристаллов глюкозы (или сахара) и осторожно нагревают в пламени горелки. Глюкоза расплавляется, темнеет и загорается. На скальпеле остается обуглившаяся масса черного цвета – углерод. Следовательно, глюкоза является органическим веществом. 2. На кончик скальпеля (или крышку тигля) помещают крупинку казеина и осторожно нагревают в пламени горелки. Казеин вспучивается, обугливается и загорается. Па кончике скальпеля остается обуглившаяся черная масса – углерод. Следовательно, белки являются органическими веществами. При сгорании натурального белка ощущается характерный запах жженых волос или перьев. 3. Иногда обугливание наблюдается также при действии на органические вещества (сахар, крахмал, клетчатку, спирты и т. д.) водоотнимающих веществ, например концентрированной серной кислоты. Особенно ясно обугливание проявляется при нагревании. Так, при над нагревании обугливающее действие оказывает даже разбавленная серная кислота. На кусочек фильтровальной бумаги (клетчатка) помещают каплю раствора серной кислоты. При высыхании на бумаге не остается следа. Осторожно подогревают бумагу над пламенем горелки. Участок фильтровальной бумаги, смоченной серной кислотой, обугливается раньше, чем чистая бумага. Следовательно, и клетчатка относится к органическим веществам. Проба на обугливание является только вспомогательным способом определения углерода в исследуемом веществе, так как она достоверна только при наличии обугливания. Если обугливания не происходит, то это не дает еще основания делать вывод об отсутствии в исследуемом веществе углерода, так как ряд веществ нельзя обугливать обычным путем. Некоторые органические вещества, например спирт и эфир, при нагревании испаряются раньше, чем успевают обуглиться; другие, например мочевина, фталевый ангидрид, возгоняются. Поэтому наиболее общим методом открытия углерода и одновременно с ним водорода является сжигание органического вещества в смеси с окислителем, в качестве которого применяют мелкий порошок оксида меди. |
