Методичка по органике. Методические указания по выполнению лабораторных работ по курсу Органическая химия
 Скачать 2.59 Mb. Скачать 2.59 Mb.
|
|
Опыт 2. Определение углерода и водорода сожжением вещества с оксидом меди (II) Реактивы и материалы: глюкоза (или глицерин, крахмал, сахар); оксид меди (порошок); баритовая вода, насыщенный водный раствор; сульфат меди (II) безводный. Оборудование: газоотводная трубка с пробкой; стеклянная палочка; микролопатка. В 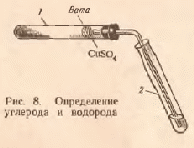 сухую пробирку 1(рис. 8) насыпают черный порошок оксида меди (слой высотой около 5 мм). Добавляют половину микролопатки глюкозы и тщательно перемешивают, встряхивая пробирку. В верхнюю часть пробирки помещают небольшой комочек ваты, на который насыпают немного белого порошка безводного сульфата меди (II). Пробирку закрывают пробкой с газоотводной трубкой. При этом конец трубки должен почти упираться в вату с CuSО4. сухую пробирку 1(рис. 8) насыпают черный порошок оксида меди (слой высотой около 5 мм). Добавляют половину микролопатки глюкозы и тщательно перемешивают, встряхивая пробирку. В верхнюю часть пробирки помещают небольшой комочек ваты, на который насыпают немного белого порошка безводного сульфата меди (II). Пробирку закрывают пробкой с газоотводной трубкой. При этом конец трубки должен почти упираться в вату с CuSО4. Нижний конец трубки опускают в пробирку 2, предварительно налив в нее 5-6 капель баритовой (или известковой) воды. Пробирку 1нагревают на пламени горелки. Через несколько секунд из газоотводной трубки начинают выходить пузырьки газа, и баритовая вода мутнеет вследствие выделения белого осадка углекислого бария. Пробирку 2удаляют. Продолжают нагревать пробирку 1, пока пары воды не достигнут белого порошка обезвоженного медного купороса, находящегося на ватной пробке, и не вызовут изменения его окраски вследствие образования кристаллогидрата CuSO4*5H2O . Химизм процесса: C6H12O6 + 12CuO → 6CO2 + 6H2O + 12Cu CO2 + Ba(OH)2 → BaCO3 + H2O CuSO4 + 5H2O → CuSO4*5H2O Метод основан на том, что при прокаливании органического вещества в смеси с окислителем (СuО) происходит окисление углерода органического вещества в диоксид углерода, а водорода – в воду. Оксид меди при этом восстанавливается до металлической меди. Выделение диоксида углерода доказывается появлением белого осадка углекислого бария. Воду в продуктах сжигания обнаруживают по образованию синих кристаллов медного купороса. Опыт 3. Определение азота сплавлением вещества с металлическим натрием Реактивы и материалы: мочевина кристаллическая; натрий металлический, сульфат железа (II) FeSО4, 0,1 н. раствор; хлорид железа (III) FeCl3, 0,1 н. раствор; соляная кислота, 2 н. раствор; этиловый спирт, 90%-ный. Оборудование: стекла предметные; пипетки. В сухую пробирку помещают 5-10 мг мочевины (несколько кристаллов) и вносят небольшой кусочек металлического натрия. Смесь осторожно нагревают в пламени микрогорелки до сплавления мочевины с натрием. При этом иногда наблюдается небольшая вспышка. После охлаждения пробирки со сплавом в нее добавляют 3 капли этилового спирта для устранения остатков металлического натрия, который реагирует со спиртом, но не так бурно, как с водой. При этом образуется алкоголят натрия и выделяется водород: 2С2Н5ОН + 2Na → 2С2Н5ОNa + H2 Затем в пробирку добавляют 5 капель дистиллированной воды и нагревают на пламени горелки для растворения образовавшегося цианистого натрия. С помощью пипетки переносят раствор цианистого натрия на предметное стекло, добавляют 1 каплю железного купороса и 1 каплю хлорида железа (III), которые в присутствии щелочи, образовавшейся при реакции алкоголята натрия с водой, дают грязно-зеленый осадок гидроксида железа (II) Fe(ОН)2 и желтый осадок гидроксида железа (III) Fe(ОН)3: С2Н5ОNa + НОН → С2Н5ОН + NaOH FeSO4 + 2NaOH → Fe(OH)2 + Na2SO4 FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl Если в растворе имеется избыток цианистого натрия, то образуется гексациано(II)феррат натрия Na4[Fe(CN)6]. Наносят пипеткой на фильтровальную бумагу (30*30 мм) одну каплю мутной жидкости. После того как капля впитается, на это же место наносят одну каплю соляной кислоты. Химизм процесса: Na + [С] + [N] → NaCN 2NaCN + FeSO4 → Fe(CN)2 + Na2SO4 Fe(CN)2 + 4NaCN → Na4[Fe(CN)6] гексацианоферрат(II)натрия Образовавшийся комплекс с солями железа (III) может дать синий осадок – берлинскую лазурь. Однако присутствующая в растворе щелочь связывает ионы Fe3+ в гидроксид железа (III). Поэтому берлинская лазурь может образоваться только после растворения гидроксида в кислоте: Fe(OH)3 + 3НС1 → FeCl3 + ЗH2O 3Na4[Fe(CN)6] + 4FeCl3 → Fe4[Fe(CN)6] + 12NaCl берлинская лазурь При проведении опыта необходимо обратить внимание на то, чтобы натрий плавился вместе с органическим веществом. Если натрий плавится отдельно от вещества, то даже при наличии в веществе азота цианистый натрий не образуется и опыт будет неудачным. Опыт 4. Определение серы сплавлением вещества с металлическим натрием Реактивы и материалы: металлический натрий; стрептоцид белый (или сульфаниловая кислота); этиловый спирт; уксуснокислый свинец, 0,1 н. раствор; нитропруссид натрия, 0,5 н. раствор. Оборудование: фильтровальная бумага. В сухую пробирку помещают испытуемое вещество, например белый стрептоцид или сульфаниловую кислоту (несколько крупинок 5-6 мг), и вносят небольшой кусочек металлического натрия. Держа пробирку вертикально, нагревают смесь докрасна, чтобы натрий плавился в смеси с веществом. Затем пробирку со сплавом охлаждают и добавляют в нее 3 капли этилового спирта для удаления остатка металлического натрия. После окончания выделения пузырьков газа (водорода) сплав растворяют при нагревании в 5 каплях дистиллированной воды. Складывают вместе два кусочка фильтровальной бумаги 30*30 мм и наносят с помощью пипетки по 2 капли темной жидкости на противоположные углы бумажки (рис.).  Верхняя фильтровальная бумажка служит фильтром, через который фильтруется раствор сернистого натрия от частичек угля, образовавшегося при обугливании вещества. На нижней фильтровальной бумажке появляются два бесцветных пятна. На одно из них наносят каплю раствора уксуснокислого свинца: мгновенно появляется коричневое окрашивание от образовавшегося сульфида свинца. На другое пятно наносят одну каплю свежеприготовленного раствора нитропруссида натрия Na2[Fe(CN)5(NO)], при этом тотчас появляется красно-фиолетовое окрашивание, постепенно изменяющее свой цвет. Эта цветная реакция на ион S2- обусловлена образованием комплексной соли состава Na4[Fe(CN)5(NO)S]. Химизм процесса: 2Na + [S] → Na2S Na2S + (CH3COO)2Pb → PbS + 2CH3COONa Na2S + Na2[Fe(CN)5NO] → Na4[Fe(CN)5(NO)S]. Опыт 5. Определение хлора по зеленой окраске пламени Реактивы и материалы: хлороформ (или дихлорэтан); медная проволока. Галогены проще всего открываются по Бейльштейну – прокаливанием органического вещества с оксидом меди в пламени горелки. Медную проволоку длиной 10 см с петлей на конце прокаливают на пламени горелки до исчезновения посторонней окраски пламени (признак отсутствия загрязнения медной петли). Остывшую петлю, покрывшуюся черным налетом оксида меди, опускают в пробирку с 1-2 каплями испытуемого вещества, например хлороформа, и вновь вносят в пламя горелки. Немедленно появляется характерная ярко-зеленая окраска пламени. При прокаливании кислород оксида меди окисляет углерод и водород органического вещества в диоксид углерода и воду, медь же образует с галогеном летучие соединения, которые и окрашивают пламя горелки в зеленый цвет. Появление зеленого окрашивания указывает на присутствие в органическом соединении галогена. Химизм процесса: 2СНС13 + 5СuО → CuCl2 + 4СuС1 + 2СO2 + Н2O Чтобы очистить проволоку, ее смачивают соляной кислотой и снова прокаливают. Для открытия галогенов органическое вещество разрушают. При этом галогены переходят в неорганические соли, которые могут быть обнаружены обычными ионными реакциями. Галогены можно отщепить и перевести в соли галогеноводородных кислот методом А. В. Степанова – действием металлического натрия на спиртовой раствор органического вещества. Этот метод будет рассмотрен нами в дальнейшем. Лабораторная работа №8 Спирты Цель: исследовать химические свойства одноатомных и многоатомных спиртов, осуществить качественные реакции на гидроксильные соединения. Опыт 1. Определение строения спиртов Реактивы и материалы: реактив Лукаса; пропанол; 2-пропанол, спирт; трет-бутанол. Берут 3 пробирки, нумеруют восковым карандашом и приливают в каждую по 2 капли спирта (в первую – пропанол, во вторую – 2-пропанол и в третью – трет-бутанол). Затем в пробирки приливают по 5 капель реактива Лукаса (хлористый цинк, растворенный в концентрированной соляной кислоте), взбалтывают содержимое пробирок и оставляют стоять 1 мин. В пробирке с пропанолом спиртом раствор остается прозрачным, раствор 2-пропанола слегка мутнеет, а в пробирке с трет-бутанолом образуется на дне маслянистая капля. При помощи пробы Лукаса можно установить, является ли данный спирт первичным, вторичным или третичным: первичный спирт отается прозрачным, вторичный – мутнеет, а третичный вступает в химическую реакцию с образованием галогеналкила. Сформулируйте вывод по работе. Опыт 2. Обнаружение присутствия воды в спирте и обезвоживание спирта. Реактивы и материалы: этанол (ректификат); сульфат меди безводный (порошок). В сухую пробирку помещают несколько кристаллов безводного сульфата меди и добавляют 3-4 капли этанола спирта. Смесь хорошо встряхивают и слегка нагревают. Белый порошок быстро окрашивается в голубой цвет. Спирты содержат примесь растворенной воды. В обычном спирте-ректификате содержится около 5% воды, которую нельзя удалить перегонкой, так как ректификат является азеотропной смесью. Безводный сульфат меди, связывая воду, переходит в синий кристаллогидрат CuSO4*5H2O. По изменению окраски судят о наличии воды в спирте и о ходе обезвоживания спирта. Сформулируйте вывод по работе. Опыт 3. Свойства изоамилового спирта Реактивы и материалы: изоамиловый спирт; раствор йода в KI, 0,1 н. В сухую пробирку помещают 2 капли изоамилового спирта и отмечают его запах. Изоамиловый спирт имеет специфический запах, он раздражает дыхательные пути (вызывает кашель). К 2 каплям изоамилового спирта добавляют 5 капель воды и взбалтывают. Образуется мутная жидкость – эмульсия, которая быстро расслаивается. В пробирку со смесью изоамилового спирта и воды добавляют каплю водного раствора йода в йодистом калии и взбалтывают. Йод растворяется в изоамиловом спирте лучше, чем в воде, поэтому при встряхивании переходит из водного в спиртовой слой, окрашивая его в желтый цвет. Сформулируйте вывод по работе. Опыт 4. Взаимодействие глицерина с гидроксидом меди (II) Реактивы и материалы: глицерин; сульфат меди, 0,2 н. раствор; едкий натр, 2 н раствор. Помещают в пробирку 2 капли раствора сульфата меди, 2 капли раствора едкого натра и перемешивают — образуется голубой студенистый осадок гидроксида меди (П). В пробирку добавляют 1 каплю глицерина и взбалтывают содержимое. Осадок растворяется и появляется темно-синее окрашивание вследствие образования глицерата меди. Химизм процесса: 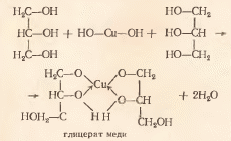 Глицерин – трехатомный спирт. Кислотность его больше, чем одноатомных спиртов: увеличение числа гидроксильных групп усиливает кислотный характер. Глицерин легко образует глицераты с гидроксидами тяжелых металлов. Однако способность его образовывать металлические производные (глицераты) с многовалентными металлами объясняется не столько его повышенной кислотностью, сколько тем, что при этом образуются внутрикомплексные соединения, обладающие особой устойчивостью. Соединения такого типа часто называют хелатными(от греческого «хела» - клешня). Опыт 5. Окисление этанола оксидом меди(II) Реактивы и материалы: этанол; фуксинсернистая кислота; спираль из медной проволоки, пинцет. В сухую пробирку помещают 2 капли этанола. Держа спираль из медной проволоки пинцетом, нагревают ее в пламени горелки до появления черного налета оксида меди (II). Далее горячую спираль опускают в пробирку с этанолом. Черная поверхность спирали немедленно становится золотистой вследствие восстановления оксида меди. При этом ощущается характерный запах этаналя (запах яблок). Подтверждением образования этаналя может служеть цветная реакция с фуксинсернистой кислотой. В пробирку помещают 3 капли раствора фуксинсернистой кислоты и пипеткой вносят 1 каплю полученного раствора. Появляется розово-фиолетовая окраска (цветная реакция на альдегид). Химизм процесса: С2Н5ОН + CuO = CH3COH + Cu + H2O Сформулируйте вывод по работе. Опыт 6. Окисление этанола хромовой смесью Реактивы и материалы: этанол; дихромат калия, 0,5 н. раствор; серная кислота, 2 н. раствор. Окисление спиртов в лабораторных условиях чаще всего осуществляется хромовой смесью. В пробирку помещают 2 капли этанола, добавляют 1 каплю раствора серной кислоты и 2 капли раствора двухромовокислого калия. Оранжевый раствор нагревают над пламенем горелки до начала изменения окраски на синевато-зеленую. Одновременно ощущается характерный запах этаналя. Химизм процесса: K2Cr2O7 + H2SO4 = H2Cr2O7+ K2SO4 H2Cr2O7 = 2CrO3 + H2O 2CrO3 = Cr2O3 + 3O С2Н5ОН + [O] = CH3COOH Cr2O3 + 3H2SO4 = Cr2(SO4)3 + 3H2O K2Cr2O7 + 3C2H5OH + 4H2SO4 = 3CH3COH + Cr2(SO4)3 + K2SO4 + 7H2O Сформулируйте вывод по работе. Опыт 7. Получение диэтилового эфира Реактивы и материалы: этанол, 96%-ный; серная кислота. В сухую пробирку вносят 2 капли этанола и 2 капли серной кислоты. Смесь осторожно нагревают над пламенем горелки до побурения раствора. К горячей смеси очень осторожно добавляют еще 2 капли этанола. Ощущается характерный запах диэтилового эфира. Химизм процесса: 1300C, H2SO4 C  2H5-OH + HO-C2H5 C2H5–O–C2H5 + H2O 2H5-OH + HO-C2H5 C2H5–O–C2H5 + H2OРеакция проходит в две стадии. Сначала спирт реагирует с серной кислотой, образуя кислый сложный эфир серной кислоты – этилсульфат, или этилсерную кислоту: CH3-CH2-OH + HO-SO3H = CH3–CH2–O–SO3H Если спирт берется в избытке, то образуется простой эфир: CH3–CH2–O–SO3H + HO–CH2–CH3 = CH3–CH2–O–CH2–CH3 + H2SO4 Если в реакцию вступает относительно много серной кислоты и мало спирта, то при дальнейшем нагревании (до 160оС) образуется олефин. Следовательно, в зависимости от темпрературы реакции и количественных соотношений спирта и серной кислоты возможны два случая дегидратации: а) с образованием этиленового углеводорода (внутримолекулярная дегидротация) и б) с образованием простого эфира (межмолекулярная дегидротация). Лабораторная работа №9 Фенолы Цель: исследовать химические свойства одноатомных и многоатомных фенолов, осуществить качественные реакции на гидроксильные соединения. Опыт 1. Растворение фенола в воде Реактивы и материалы: раствор фенола. Помещают в пробирку 2 капли раствора фенола, прибавляют 2 капли воды и взбалтывают. Образуется мутная жидкость — эмульсия фенола. Дают содержимому пробирки отстояться. После отстаивания эмульсия постепенно расслаивается: верхний слой — раствор фенола в воде, нижний — раствор воды в феноле. Фенол плохо растворим в холодной воде. Осторожно нагревают содержимое пробирки. Получается однородный раствор. При охлаждении вновь образуется мутная жидкость. При повышении температуры увеличивается растворимость как воды в феноле, так и фенола в воде, и при 68°С они смешиваются друг с другом в любых соотношениях. Примечание. Простейший фенол С6Н5ОН представляет собой бесцветное кристаллическое вещество с характерным запахом, плавящееся при 41°С. Температура плавления фенола сильно понижается от примеси небольших количеств воды (кристаллогидрат С6Н6ОН*Н20 плавится при 16°С). Фенол гигроскопичен, кристаллы его при стоянии на воздухе расплываются, образуя так называемый жидкий фенол. Сформулируйте вывод по работе. |
