Методичка по органике. Методические указания по выполнению лабораторных работ по курсу Органическая химия
 Скачать 2.59 Mb. Скачать 2.59 Mb.
|
|
Опыт 6. Кислотный гидролиз сахарозы Реактивы и материалы: сахароза, 1%-ный раствор; соляная кислота, 2 н. раствор; соляная кислота (d=l,19 г/см3); сульфат меди (II), 0,2 н. раствор; резорцин; лакмусовая бумага. В пробирку помещают 1 каплю раствора сахарозы, 1 каплю 2 н. соляной кислоты, 3 капли воды и осторожно нагревают над пламенем горелки 20—30 мин. Половину раствора отливают в другую пробирку и добавляют к ней 4—5 капель раствора щелочи (до щелочной реакции на лакмус) и 3—4 капли воды. Затем добавляют 1 каплю раствора сульфата меди и нагревают верхнюю часть синего раствора до кипения. Появляется оранжево-желтое окрашивание, доказывающее образование глюкозы. К оставшейся части гидролизованного раствора сахарозы (первая пробирка) прибавляют кристаллик резорцина, 2 капли концентрированной соляной кислоты и нагревают до кипения. Появляется красноватое окрашивание, указывающее на образование фруктозы (реакция Селиванова). Химизм процесса: 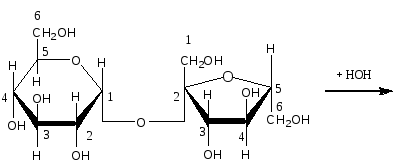 Остаток α – D- глюкозы остаток β – D- глюкозы 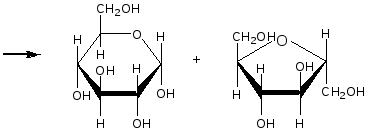 α – D- глюкоза β – D- глюкоза Молекула сахарозы легко расщепляется при гидролизе на молекулу глюкозы и молекулу фруктозы. Оба моносахарида входят в состав сахарозы в циклических формах. В создании связи между ними участвуют оба гликозидных гидроксида. В сахарозе остаток фруктозы находится в виде непрочного пятичленного кольца — фуранозы; такие сложные сахара очень легко гидролизуются. Опыт 7. Реакция крахмала с йодом Реактивы и материалы: крахмальный клейстер, 2%-ный раствор; йод, 0,1 н. водный раствор. В пробирку помещают 2 капли крахмального клейстера и 1 каплю раствора йода. Содержимое пробирки окрашивается в синий цвет. Полученную темно-синюю жидкость нагревают до кипения. Окраска при этом исчезает, но при охлаждении появляется вновь. Крахмал представляет собой смесь двух полисахаридов — амилозы (20%) и амилопектина (80%). Амилоза растворима в теплой воде и дает с йодом синее окрашивание. И амилоза, и амилопектин состоят из остатков глюкозы, связанных α-гликозидными связями, но они отличаются формой молекул. Амилоза представляет собой линейный полисахарид, построенный из нескольких тысяч остатков глюкозы, обладающий структурой винта или спирали. Внутри спирали остается свободный канал диаметром около 5 мкм, в который могут внедряться посторонние молекулы, образуя особого типа комплексы — так называемые соединения включения. Одним из них является соединение амилозы с йодом, имеющее синее окрашивание. Амилопектин в теплой воде нерастворим, набухает в Вей, образуя крахмальный клейстер. В состав амилопектина в отличие от амилозы входят разветвленные цепи глюкозных остатков. Амилопектин с йодом дает красновато-фиолетовое окрашивание. Лабораторная работа №15. Амины. Опыт 1. Определение строения аминов Реактивы и материалы: анилин; дифениламин; диметиланилин; нитрит натрия, 0,5 н. раствор; β-нафтол, щелочной раствор; соляная кислота; щелочь, 2 н. раствор. 1.В три пробирки вносят по капле или несколько кристаллов испытуемых аминов, 2 капли соляной кислоты и 3 капли раствора нитрита натрия. Взбалтывают содержимое и добавляют каплю щелочного раствора β-нафтола. Появление окраски доказывает, что в данной пробирке находится первичный амин. 2.Содержимое двух пробирок, в которых не появилась окраска, подщелачивают, добавляя по 4 капли раствора щелочи. Появление зеленой окраски служит доказательством того, что данный амин является третичным жирноароматическим амином, который в этих условиях дает пара-нитрозамин. Опыт 2. Свойства аминов жирного ряда Реактивы и материалы: метиламин (или диэтиламин), водный раствор; фенолфталеин, 1%-нын спиртовой раствор; хлороформ; едкий натр, концентрированный раствор; сульфат меди (II), 0,02 н. раствор; хлорид железа, 0,1 н. раствор; соляная кислота (d=l,19 г/см3); лакмусовая бумага красная. 1.Проверка водного раствора на индикаторы. К отверстию газоотводной трубки прибора для получения метиламина подносят влажную красную лакмусовую бумажку. Бумажка синеет. В пробирку помещают 2 капли водного раствора метиламина и добавляют 1 каплю раствора фенолфталеина. Появляется розовое окрашивание. Химизм процесса: Метиламин гидроокись метиламония ион метиламмония В водных растворах амины, подобно аммиаку, содержатся в виде гидроокисей замещенного аммония, которые в результате электролитической диссоциации образуют ион замещенного аммония и гидроксил. Поэтому водные растворы аминов имеют щелочную реакцию. 2.Изонитрильная реакция. В пробирку помещают 3 капли раствора метиламина, 1 каплю хлороформа, 1 каплю концентрированного раствора щелочи и нагревают смесь. Появляется характерный, очень неприятный запах изонитрила. Химизм процесса: 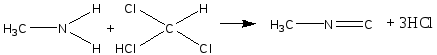 Эта реакция является специфической реакцией для открытия первичных аминов. Примечание. Так как изонитрил очень ядовит, после проведения опыта его разлагают. Пробирку с изонитрилом помещают в стакан с разбавленной серной или соляной кислотой. Изонитрил быстро гидролизуется с образованием соли амина и муравьиной кислоты: 3. Реакция с раствором сульфата меди. В пробирку помещают 2 капли раствора метиламина и добавляют 2 капли сульфата меди (II) —выпадает голубой осадок. К реакционной смеси добавляют по каплям избыток раствора амина. Осадок растворяется, раствор окрашива¬ется в интенсивный фиолетовый цвет. Из раствора солей меди (II) метиламин как довольно сильное основание осаждает гидроксид меди, а избыток амина образует с ионами меди комплексные соединения, легко растворимые в воде. 4.Реакция с раствором хлорида железа. В пробирку вводят 2—3 капли раствора метиламина и добавляют несколько капель раствора хлорида железа FeCl. Выпадает осадок гидроксида железа (III) Fe(OH)3: 5.Реакция газообразного метиламина с концентрированной соляной кислотой. К отверстию газоотводной трубки прибора для получения метиламина подносят стеклянную палочку, смоченную концентрированной соляной кислотой. Образуется белый осадок солянокислой соли метиламина: Амины как производные аммиака проявляют основные свойства и являются органическими основаниями. Опыт 3. Образование солей анилина и их разложение Реактивы и материалы: анилин; серная кислота, 2 н. раствор; соляная кислота (d=1,19 г/см3); едкий натр, 2 н. раствор; фенолфталеин, 1%-ный спиртной раствор, лакмусовая бумага красная. Оборудование: микроскоп; предметные стекла; стеклянная палочка 1.В пробирку помещаю 1 каплю анилина, 8 капель воды и встряхивают содержимое пробирки. Одну каплю эмульсии наносят на лакмусною бумажку. Цвет красного лакмуса не меняется, 2.Приготовленную эмульсию анилина делят па две части. К одной част добавляют по каплям раствор серной кислоты. Образуется осадок сернокислого анилина. Нагревают пробирку до растворения осадка и медленно охлаждают. Выпавшие игольчатые кристаллы переносят на предметное стекло и рассматривают их форму в микроскоп (рис. 1). Химизм процесса: 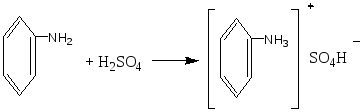 3. К другой части эмульсии анилина добавляют по каплям концентрированную соляную кислоту до получения однородного раствора. К прозрачному раствору солянокислого анилина добавляют 1—2 капли фенолфталеина и по каплям раствор щелочи. Жидкость мутнеет еще до появления малиновой окраски. Химизм процесса: 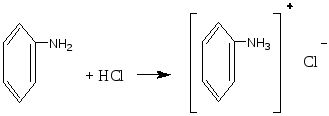 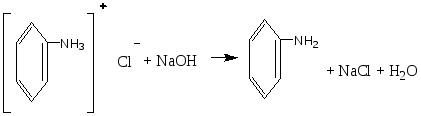 Основные свойства аминогруппы, связанной с ароматическим ядром, значительно ослаблены по сравнению с аминами жирного ряда. Водный раствор анилина не окрашивает лакмус в синий цвет. Анилин образует соли только с сильными минеральными кислотами. Водные растворы этих солей имеют кислую реакцию и их можно титровать щелочами.  Рисунок 1 – Кристаллы сернокислого анилина. Опыт 4. Цветные реакции анилина Реактивы и материалы: анилин; хлорная известь, насыщенный раствор; дихромат калия, 0,5 н. раствор; соляная кислота (d=1,19 г/см3), серная кислота, 2 н. раствор; лигнин (газетная бумага, лучинка). Оборудование: предметное стекло; стеклянная палочка. 1.Цветная реакция с лигнином. В пробирку помещают 1 каплю анилина, 5 капель воды и по каплям добавляют соляную кислоту до образования прозрачного раствора солянокислого анилина. Каплю этого раствора наносят на полоску газетной бумаги. Появляется желто-оранжевое окрашивание. Лучинка, опущенная в раствор солянокислого анилина, также окрашивается в желто-оранжевый цвет. Окрашивание обусловлено присутствием в бумаге и древесине лигнина. Если раствором соли анилина смочить полоску фильтровальной бумаги, окрашивания не произойдет, так как фильтровальная бумага представляет собой чистую клетчатку без примеси лигнина. 2.Цветная реакция с хлорной известью. Готовят раствор солянокислого анилина и каплю раствора наносят на предметное стекло. Добавляют каплю раствора хлорной извести. Появляется темно-зеленое окрашивание, переходящее в синее, а затем в черное. Эти реакции основаны на легкой окисляемости анилина. Конечным продуктом является «черный анилин» — краситель для хлопчатобумажных тканей, меха. Опыт 5. Бромирование анилина Реактивы и материалы: анилин (разбавленная анилиновая эмульсия); бромная вода, насыщенный раствор. В пробирку помещают 3 капли бромной воды и 1 каплю анилиновой воды. Выпадает белый осадок триброманилина: 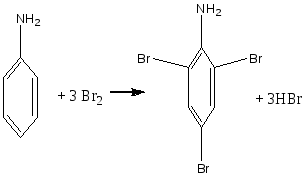 Являясь электронодонорным заместителем, аминогруппа повышает электронную плотность в ароматическом ядре, облегчая этим реакции электрофильного замещения. Вместо анилина можно использовать для этого опыта соли анилина. Они бромируются так же легко, как и сам анилин. Опыт 6. Цветная реакция дифениламина с азотной кислотой Реактивы и материалы: дифениламин; азотная кислота (d=1,4 г/см3); серная кислота (d=l,84 г/см3). Оборудование: предметное стекло; стеклянная палочка. На предметное стекло помещают 2—3 кристалла дифениламина и каплю серной кислоты. Стеклянной палочкой размешивают кристаллы до растворения, т. е. до образования сернокислой соли дифениламина. В пробирку помещают каплю азотной кислоты, доливают ее почти доверху водой и перемешивают. Одну каплю полученного разбавленного раствора азотной кислоты наносят на предметное стекло рядом с каплей сернокислого дифениламина. В месте соприкосновения появляется яркое синее окрашивание. Раствор дифениламина в концентрированной серной кислоте применяется в аналитической химии как чувствительный реактив на анион N03-. Примечание. Соли дифениламина гидролизуются избытком воды. Поэтому при проведении опыта следует добавить только одну каплю раствора азотной кислоты во избежание гидролиза. Лабораторная работа №16. Диазо- и азосоединения. Опыт 15. Диазотирование анилина Реактивы и материалы: анилин (свежеперегнанный); соляная кислота, 2 н. раствор; нитрит натрия 0,5 н. раствор; йодкрахмальная бумага. Оборудование: стеклянная палочка, лед. В пробирку помещают 1 каплю анилина, 5 капель соляной кислоты и кусочек льда. По одной капле, постоянно встряхивая содержимое пробирки, добавляют 5 капель раствора нитрита натрия. Одну каплю полученной реакционной смеси с помощью стеклянной палочки наносят на полоску йодкрахмальной бумаги. Если диазотирование анилина закончено, то на йодкрахмальной бумаге появляется голубое пятно, указывающее на наличие свободной азотистой кислоты в растворе. Пробу повторяют через минуту, не добавляя раствора нитрита. Если голубое пятно сохранилось, реакция диазотирования окончена. Если пятно исчезает, добавляют еще 2 капли раствора азотистокислого натрия и делают повторную пробу с йодкрахмальной бумагой. Пробирку с полученным раствором помещают в охлаждающую смесь и сохраняют для следующего опыта. Химизм процесса:  Последнее уравнение реакции соответствует определению конца диазотирования по йодкрахмальной бумажке. Установлено, что азотистая кислота не взаимодействует непосредственно, а превращается в результате быстрой равновесной реакции сначала в активную форму. При диазотировании в кислой среде активной формой является катион нитрозония  Медленной стадией, определяющей скорость процесса, является реакция этой активной формы с первичным амином. В нейтральном растворе или в растворе с небольшой кислотностью активной формой является триоксид азота. Амины диазотируются тем легче, чем выше их основность. Опыт 16. Диазотирование сульфаниловой кислоты Реактивы и материалы: сульфаниловая кислота; едкий натр, 1 н. раствор, нитрит натрия, 0,5 н. раствор; серная кислота (d=1,84 г/см3). В пробирку помещают на конце микролопатки сульфаниловую кислоту, 4 капли раствора едкого натра и слегка нагревают в пламени горелки. Затем приливают 6 капель раствора нитрита натрия. В другую пробирку помещают кусочек льда, осторожно приливают 2 капли серной кислоты и при помешивании вливают содержимое первой пробирки. Выделяется белый осадок диазобензолсульфокислоты. Немного влажной диазобензолсульфокислоты на стеклянной палочке вносят в пламя горелки. Происходит вспышка. Химизм процесса:   Диазотировать можно любое ароматическое соединение, содержащее первичную аминогруппу в ароматическом ядре. Диазосоединения в твердом состоянии разлагаются со взрывом. Диазотировать можно любое ароматическое соединение, содержащее первичную аминогруппу в ароматическом ядре. Диазосоединения в твердом состоянии разлагаются со взрывом.Опыт 17. Получение β-нафтолазобензола. Реактивы и материалы: р-нафтол; едкий натр, 2 н. раствор; раствор хлористого фенилдиазония (опыт 15). В пробирку помещают на кончике микролопатки р-нафтол, добавляют 3 капли раствора щелочи и встряхивают содержимое пробирки до растворения β-нафтола. В другую пробирку наливают 2 капли раствора хлористого фенилдиазония и приливают каплю щелочного раствора р-нафтола. Выпадает осадок оранжево-красного цвета. Это азокраситель β-нафтолазобензол. Химизм процесса:  Лабораторная работа №17 Аминокислоты. Цель: изучение химических свойств аминокислот. Опыт 1. Отношение аминокислот к индикаторам. Реактивы и материалы: аминоуксусная кислота, 0,2 н. раствор; метиловый оранжевый, раствор; метиловый красный, раствор; лакмус, раствор. В пробирку помещают 2 капли раствора аминруксусной кислоты и добавляют 1 каплю метилового оранжевого. Такой ж е опыт проделывают с метиловым красным и лакмусом. Окраска индикаторов не меняется. Аминокислоты обладают как кислотными, так и основными свойствами; кислотная группа - СООН и основная - NH2 взаимно нейтрализуются, следовательно, аминокислоты имеют структуру амфотерных, или биполярных, ионов (внутренние соли): H3N+-СН2-СОО-. Поэтому водные растворы одноосновных моноаминокислот нейтральны по отношению к индикаторам. Опыт 2. Образование медной соли аминоуксусной кислоты. Реактивы и материалы: аминоуксусная кислота, 0,2н. раствор; оксид меди (II) СuО, порошок; едкий натр, 2 н. раствор. В пробирку помещают немного порошка оксида меди (II) СuО, 4 капли раствора аминоуксусной кислоты и нагревают в пламени горелки, встряхивая содержимое пробирки. Пробирку ста вят на некоторое время в штатив, чтобы осел избыток черного порошка оксида меди. К отстоявшемуся синему раствору приливают 1 каплю раствора едкого натра. Раствор остается прозрачным. Для аминокислот характерно образование медных солей, окрашенных в синий цвет. а-Аминокислоты дают с медью окрашенные внутренние комплексные соли, очень устойчивые: С  вязь между атомами меди и азота координационная за счет свободной пары электронов азота аминогруппы. вязь между атомами меди и азота координационная за счет свободной пары электронов азота аминогруппы.Опыт 3. Действие муравьиного альдегида на аминокислоты. Реактивы и материалы: аминоуксусная кислота, 0,2 н. раствор; формальдегид, 40%-ный раствор; метиловый красный, раствор. Оборудование: пипетка с капиллярным отверстием. В пробирку помещают 3 капли раствора формальдегида и 1 каплю метилового красного. Из-за дисмутации муравьиного альдегида раствор окрашивается в красный цвет. При помощи пипетки с капиллярным отверстием приливают по каплям раствор щелочи до появления желтой окраски (нейтральная среда на метиловый красный). В отдельную пробирку помещают 3 капли аминоуксусной кислоты и приливают к ней содержимое первой пробирки. Тотчас же появляется красное окрашивание: блокированная муравьиным альдегидом аминогруппа не влияет на карбоксил, и раствор аминокислоты приобретает кислую реакцию.  монооксиметиламинокислота Опыт 4. Действие азотистой кислоты на аминокислоты Реактивы и материалы: нитрит натрия, 1 н. раствор свежеприготовленный); аминоуксусная кислота, 0,2 н. раствор; соляная кислота, 2 н. раствор. В пробирку помещают 2 капли раствора аминокислоты, 2 капли раствора нитрита натрия и 2 капли соляной кислоты. При встряхивании содержимого пробирки выделяются пузырьки газа. Химизм реакции: NaNO2 + HCl → HNO2 + NaCl  На этой реакции основано количественное определение аминогрупп в аминокислотах, а также в белках и продуктах их распада. Выделяющийся азот определяется объемным методом. |
