Методичка по органике. Методические указания по выполнению лабораторных работ по курсу Органическая химия
 Скачать 2.59 Mb. Скачать 2.59 Mb.
|
|
Опыт 2. Реакция фенола с хлоридом железа (III) Реактивы и материалы: фенол, насыщенный водный раствор; хлорид железа (III), 0,1 н. раствор. Помещают в пробирку 2 капли раствора фенола, добавляют 3 капли воды и 1 каплю раствора хлорида железа (III). Появляется интенсивное красно-фиолетовое окрашивание. Фенолы с хлоридом железа в водном растворе дают цветную реакцию вследствие образования окрашенного комплексного соединения С6Н5ОFеСl2 (или, точнее, окрашенного иона C6H5OFe2+). Эта реакция служит для качественного открытия фенолов. Сформулируйте вывод по работе. Опыт 3. Получение 2,4,6-трибромфенола Реактивы и материалы: фенол, водный раствор; бромная вода, насыщенный раствор. В пробирку вносят капли бромной воды и добавляют каплю водного раствора фенола. При этом бромная вода обесцвечивается и жидкость мутнеет вследствие образования белого осадка 2,4,6-трибромфенола. Химизм процесса:  Гидроксильная группа относится к числу наиболее сильных орто-пара-ориентантов. Реакции электрофильного замещения водорода в бензольном ядре для фенолов проходят значительно легче и в более мягких условиях, чем для бензола. Сформулируйте вывод по работе. Опыт 4. Сульфирование фенола Реактивы и материалы: фенол; серная кислота (d=l,84 г/см3),: водяная баня. В пробирку помещают несколько кристаллов фенола и добавляют 3 капли серной кислоты. Встряхивают содержимое пробирки: кристаллы фенола растворяются. Вносят каплю получившегося раствора в другую пробирку и добавляют 4—5 капель воды: фенол выделяется в виде мути. Реакционную смесь в первой пробирке нагревают на кипящей водяной бане в течение 2—3 мин, затем охлаждают содержимое пробирки и выливают в пробирку с 10 каплями холодной воды. Образуется однородный раствор, почти не имеющий характерного запаха фенола. Химизм процесса:  Сформулируйте вывод по работе. Опыт 5. Нитрование фенола Реактивы и материалы: фенол, азотная кислота (d=l,4 г/см3), газоотводная трубка. В пробирку помещают несколько кристалликов фенола, 2—3 капли воды и встряхивают до образования однородного раствора. В другую пробирку помещают 3 капли концентрированной азотной кислоты и 3 капли воды. Разбавленную азотную кислоту по каплям приливают к жидкому фенолу, все время энергично встряхивая и охлаждая реакционную пробирку, — реакция идет очень энергично. Реакционную смесь выливают в пробирку с несколькими каплями воды. Отверстие пробирки закрывают пробкой с газоотводной трубкой и отгоняют о-нитрофенол в чистую, сухую пробирку-приемник. Мутная капля жидкости в приемнике имеет характерный горько-миндальный запах о-нитрофенола. П-изомер остается в реакционной пробирке: 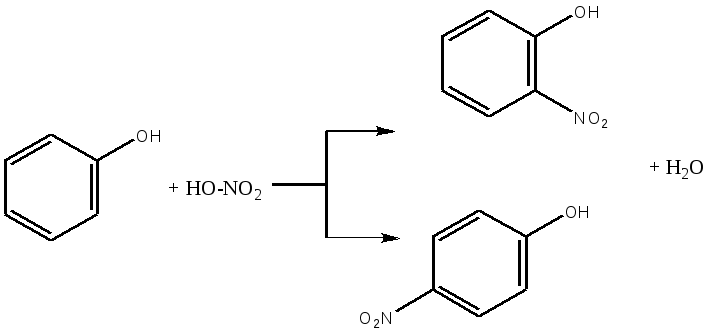 Гидроксильная группа — заместитель, активирующий содержащее ее ядро. Реакции замещения фенолов протекают значительно легче, чем у ароматических углеводородов. Фенол нитруется разбавленной азотной кислотой, тогда как при нитровании бензола нужна смесь концентрированных азотной и серной кислот. Сформулируйте вывод по работе. Опыт 6. Цветные реакции многоатомных фенолов с хлоридом железа Реактивы и материалы: 1%-ные растворы пирокатехина, резорцина, гидрохинона, пирогаллола; хлорид железа FeCl3, 0,1 н. раствор. В одну пробирку вносят 3 капли раствора пирокатехина, в другую — 3 капли раствора резорцина, в третью — гидрохинона и в четвертую — пирогаллола. В каждую из пробирок добавляют по 1 капле раствора хлорида железа. При этом в первой пробирке появляется зеленое окрашивание, во второй — фиолетовое, в треть ей — зеленое, моментально переходящее в желтое, и в четвертой — красное. Одновременно с образованием фенолятов хлорид железа действует на фенолы и как окислитель. Появление быстро изменяющейся зеленой окраски в пробирке с гидрохиноном указывает на то, что при окислении гидрохинона в хинон образуется промежуточное соединение одной молекулы гидрохинона с одной молекулой хинона, так называемый хингидрон. Заметить зеленую окраску можно только в первый момент попадания капли хлорида железа в раствор гидрохинона при рассматривании на белом фоне. Окраска становится заметнее при насыщенном растворе гидрохинона и более слабом растворе хлорида железа. Сформулируйте вывод по работе. Опыт 7. Цветные реакции многоатомных фенолов с хлоридом железа на фильтровальной бумаге Реактивы и материалы: 1%-ные растворы пирокатехина и пирогаллола, хлорид железа FeCl3, 0,1 н. раствор, фильтровальная бумага. На полоску фильтровальной бумаги (3х7 см) наносят по 1 капле раствора пирокатехина и пирогаллола. Когда капли расплывутся, в центр каждого пятна помещают по капле раствора хлорида железа (III) —продукты окисления распределяются в виде концентрических колец, т. Е. удается наблюдать распределительную хроматографию на бумаге. Полученную хроматограмму приложите к рабочему журналу Сформулируйте вывод по работе. Опыт 8. Цветные реакции нафтолов с хлорным железом Реактивы и материалы: α-нафтол; β-нафтол, этанол, хлорид железа FeCI3, 0,1 н. раствор. В пробирку помещают несколько кристаллов α-нафтола и добавляют 3 капли этанол (нафтолы плохо растворимы в воде). К спиртовому раствору α-нафтол добавляют 1 каплю хлорида железа (III) — появляется фиолетовое окрашивание. Такой же опыт повторяют с β-нафтолом, который дает сначала зеленоватое окрашивание, а затем выпадает осадок белого цвета. Лабораторная работа №10 Альдегиды Цель: исследовать химические свойства альдегидов и осуществить качественные реакции на карбонильные соединения. Опыт 1. Цветная реакция на альдегиды с фуксинсернистой кислотой Реактивы и материалы: формальдегид, 40%-ный водный раствор; этаналь; фуксинсернистая кислота. В две пробирки помещают по 2 капли раствора фуксинсернистой кислоты и добавляют в одну из них 2 капли раствора формальдегида, в другую – 2 капли этаналя. Раствор фуксинсернистой кислоты при добавлении раствора формальдегида постепенно окрашивается в фиолетовый цвет, при добавлении этаналя — в розово-фиолетовый цвет. Опыт 2. Самоокисление водных растворов формальдегида Реактивы и материалы: формальдегид, 40%-ный водный раствор, метиловый красный, раствор. В пробирку помещают 2—3 капли раствора формальдегида и добавляют 1 каплю индикатора метилового красного. Раствор принимает красную окраску, что указывает на кислую реакцию. Альдегиды очень легко окисляются. В водных растворах они могут окисляться до кислоты за счет кислорода другой молекулы альдегида, восстанавливая ее в спирт — происходит реакция окислительного восстановления (дисмутации): 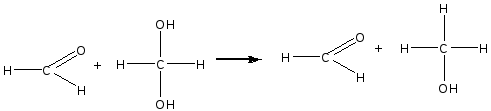 Сформулируйте вывод по работе. Опыт 3. Окисление альдегидов аммиачным раствором оксида серебра (реакция «серебряного зеркала») Реактивы и материалы: формальдегид, 40%-ный водный раствор; аммиак, 2 н. раствор; нитрат серебра, 0,2 н. раствор. В чистую пробирку вводят 2 капли раствора нитрата серебра и прибавляют каплю аммиака. Образующийся бурый осадок гидроксида серебра растворяют, добавляя избыток (1—2 капли) раствора аммиака. Затем прибавляют каплю раствора формальдегида и медленно подогревают содержимое пробирки над пламенем горелки. При осторожном нагревании содержимое пробирки буреет и на ее стенках может выделиться серебро в виде блестящего зеркального налета (комплексный ион металла восстанавливается до металлического серебра). Альдегид окисляется до кислоты, которая образует аммониевую соль. Химизм процесса: 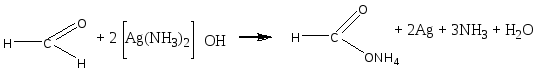 Сформулируйте вывод по работе. Сформулируйте вывод по работе.Опыт 4. Окисление альдегидов гидроксидом меди (II) Реактивы и материалы: формальдегид, 40%-ный водный раствор; сульфат меди CuSO4, 0,2 н. раствор; едкий натр, 2 н. раствор. В пробирку помещают 4 капли раствора едкого натра, разбавляют 4 каплями воды и добавляют 2 капли раствора сульфата меди (II). К выпавшему осадку гидроксида меди (II) прибавляют 1 каплю раствора формальдегида и взбалтывают содержимое пробирки. Нагревают над пламенем горелки до кипения только верхнюю часть раствора так, чтобы нижняя часть оставалась для контроля холодной. В нагретой части пробирки выделяется желтый осадок гидроксида меди (I) (СuОН), переходящий в красный оксид меди (I) (Сu2О), а иногда на стенках пробирки выделяется даже металлическая медь. Химизм процесса: CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4 2Cu(OH)2 + HCOH = HCOOH + Cu2O + 2H2O Повторите этот опыт, заменив раствор формальдегида раствором этаналя. Сформулируйте вывод по работе. Опыт 5. Реакция бензальдегида с гидросульфитом натрия Реактивы и оборудование: бензальдегид; гидросульфит натрия (насыщенный раствор; водяная баня. В пробирку помещают 3 капли бензойного альдегида, добавляют 5 капель насыщенного раствора гидросульфита натрия и энергично встряхивают смесь. Образуются кристаллы гидросульфитного соединения. Затем к смеси добавляют 6 капель воды и помещают пробирку в горячую водяную баню. Кристаллы быстр исчезают, в растворе появляются маслянистые капли ощущается характерный запах бензальдегида. Химизм процесса: 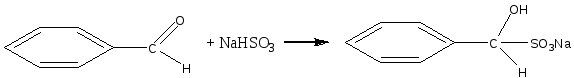 При нагревании в водном растворе гидросульфитное соединение легко разлагается на исходные вещества: 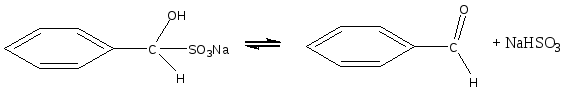 Сформулируйте вывод по работе. Опыт 6. Свойства ализарина. Реактивы и оборудование: ализарин; алюминиевые квасцы, насыщенный водный раствор; едкий нарт, 0,1 н. раствор; белая хлопчатобумажная ткань; фарфоровая чашка. В пробирку помещают 3-5 капель ализарина, добавляют 6 капель щелочи и тщательно взбалтывают. Получается раствор, окрашенный в фиолетовый цвет. 1.В пробирку помещают 2 капли раствора ализарина и добавляют 3 капли раствора квасцов. Образуется оранжево-красный осадок алюминиевого ализаринового лака. 2.Кусочек белой ткани простирывают с мылом и тщательно прополаскивают в воде. В фарфоровую чашечку наливают раствор квасцов, пропитывают им ткань и отжимают. В пробирку помещают 5 капель щелочного раствора ализарина, нагревают и в горячий раствор погружают кусочек «протравленной» ткани на 1—2 мин. Затем ткань, окрашенную в красный цвет, промывают водой. Ализарин, или 1,2-диоксиантрахинон, образует оранжевые игольчатые кристаллы с т. пл. 290°С. Он нерастворим в воде и растворим в обычных органических растворителях. Растворяется он также в водном растворе едкого натра, причем раствор имеет пурпурную окраску. Ализарин — протравной краситель. С алюминиевой протравой он дает ярко-красную окраску; с оловянной — фиолетово-красную; с железной — черно-фиолетовую. С ионами этих металлов ализарин образует хелатные соединения за счет групп С=О и группы ОН, находящейся в α-положении: 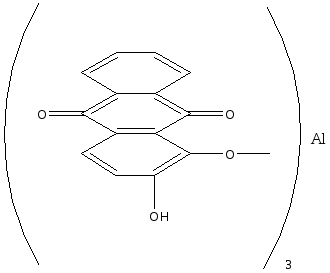 Лабораторная работа №11 Кетоны Цель: исследовать химические свойства кетонов и осуществить качественные реакции на карбонильные соединения. Опыт 1. Получение ацетона из уксуснокислого натрия Реактивы и оборудование: уксуснокислый натрий, обезвоженный; соляная кислота, концентрированная; газоотводная трубка с пробкой. В сухую пробирку помещают около 0,1 г обезвоженного уксуснокислого натрия CH3COONa (высота слоя должна быть около 3 мм). Закрывают пробирку пробкой с газоотводной трубкой, нижний конец которой опускают в пробирку с 6—8 каплями воды. Держа пробирку с уксуснокислым натрием в горизонтальном положении, нагревают ее в пламени горелки. Пары ацетона конденсируются в воде, находящейся во второй пробирке. Ощущается характерный запах ацетона. После остывания первой пробирки добавляют в нее каплю концентрированной соляной кислоты. Происходит сильное вспенивание вследствие выделения двуокиси углерода. Химизм процесса: 2  CH3COONa CH3 – C – CH3 + Na2CO3 CH3COONa CH3 – C – CH3 + Na2CO3|| O N  a2CO3 + 2HCl 2NaCl + CO2 + H2O a2CO3 + 2HCl 2NaCl + CO2 + H2OОпыт 2. Цветная реакция на ацетон с нитропруссидом натрия Реактивы и оборудование: ацетон, раствор; нитропруссид натрия, 0,5 н. раствор; уксусная кислота, 2 н. раствор; едкий натр, 2 н. раствор; предметное стекло. На предметное стекло наносят каплю раствора нитропруссида натрия, 2 капли воды и 1 каплю водного раствора ацетона. При добавлении капли раствора едкого натра смесь окрашивается в красный цвет, который от добавления 1 капли раствора уксусной кислоты принимает вишнево-красный оттенок. Опыт 3. Реакция ацетона с гидросульфитом натрия Реактивы и оборудование: ацетон; гидросульфит натрия, насыщенный раствор, соляная кислота, 2 н. раствор; микроскоп; предметное стекло; запаянный капилляр. На предметное стекло наносят 2 капли насыщенного раствора бисульфита натрия, добавляют 1 каплю ацетона и размешивают концом запаянного капилляра. Вскоре начинает выпадать кристаллический осадок гидросульфитного соединения ацетона. Предметное стекло переносят под микроскоп и рассматривают кристаллы. Кристаллы гидросульфитного соединения ацетона представляют собой неправильной формы четырехугольные таблички (рис. 2) 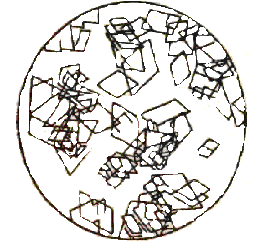 Рисунок 2 – Кристаллы гидросульфитного соединения ацетона Добавляют к осадку каплю раствора соляной кислоты — осадок гидросульфитного соединения ацетона растворяется: 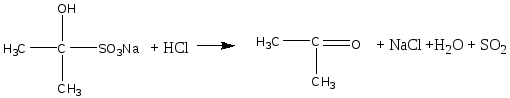 Реакцию широко используют для отделения карбонильных соединений от веществ, с которыми гидросульфит натрия не вступает в реакцию. Продукты присоединения гидросульфита натрия при обработке слабой щелочью или разбавленной кислотой (НСl, H2SO4) разлагаются, образуя исходные карбонильные соединения. Карбонильные соединения относятся к числу весьма реакционноспособных органических веществ. Их химические свойства связаны с особенностями электронного строения карбонильной группы. Связь между атомом углерода и атомом кислорода вследствие большой электроотрицательности кислорода по сравнению с углеродом сильно поляризована за счет смещения электронной плотности π-связи к кислороду: Опыт 4. Действие ацетона на пластмассы Реактивы и оборудование: ацетон; кинопленка (ацетилцеллюлоза). Оборудование: стеклянная палочка. Помещают в сухую пробирку 5—6 капель ацетона и при помешивании стеклянной палочкой растворяют в нем маленький кусочек целлулоида (кинопленки). Когда раствор станет вязким, смачивают в нем ватку и натирают гладкий кусочек дерева. После улетучивания ацетона на дереве остается пленка лака. Два кусочка очищенной кинопленки смачивают с концов ацетоном, через 1—2 мин накладывают концы пленки друг на друга и слегка сдавливают. После высыхания кусочки пленки прочно склеиваются. Опыт 5. Получение йодоформа из ацетона Реактивы и материалы: ацетон; раствор йода в йодиде калия; едкий натр, 2 н. раствор. Помещают в пробирку 3 капли раствора йода в йодистом калии и 5 капель раствора едкого натра. Раствор обесцвечивается. К обесцвеченному раствору иодноватистокислого натрия добавляют 1 каплю ацетона. Мгновенно без нагревания выпадает желтовато-белый осадок с характерным запахом йодоформа. Химизм процесса: 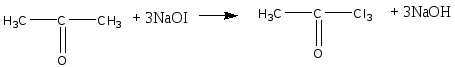 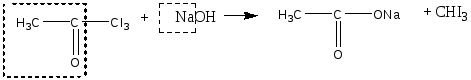 Реакция очень чувствительная и используется для открытия ацетона (йодоформная проба на ацетон). Реакция очень чувствительная и используется для открытия ацетона (йодоформная проба на ацетон).Лабораторная работа №12 Карбоновые кислоты Цель: исследовать химические свойства карбоновых кислот и осуществить качественные реакции на карбонильные соединения. |
