Методичка по органике. Методические указания по выполнению лабораторных работ по курсу Органическая химия
 Скачать 2.59 Mb. Скачать 2.59 Mb.
|
|
Опыт 1. Кислотные свойства карбоновых кислот. Реактивы и материалы: уксусная кислота, 0,1 н. раствор; магний (порошок или стружка); карбонат натрия; баритовая вода; метиловый оранжевый, раствор; лакмус синий, раствор; фенолфталеин, 1 %-ный спиртовой раствор. 1.В три пробирки помещают по 1 капле раствора уксусной кислоты. В первую пробирку добавляют 1 каплю метилового оранжевого, во вторую—1 каплю лакмуса и в третью— 1 каплю фенолфталеина. В пробирке с метиловым оранжевым появляется красное окрашивание, в пробирке с лакмусом — розовое. Фенолфталеин остается бесцветным. 2.В пробирку помещают 2 капли раствора уксусной кислоты и добавляют немного магния. К отверстию пробирки подносят горящую лучинку. При этом наблюдается вспышка, сопровождающаяся резким звуком, характерным для вспышки смеси водорода и воздуха. Химизм процесса: 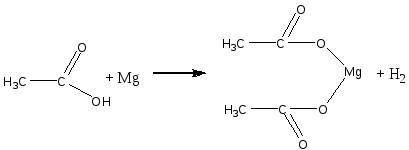 3. В пробирку наливают 2—3 капли раствора уксусной кислоты и добавляют несколько крупинок углекислого натрия. К отверстию пробирки подносят горящую лучинку. Лучинка гаснет. Химизм процесса: 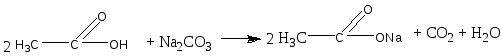 Карбоновые кислоты в водном растворе диссоциируют с образованием карбоксилат-аниона и протона: Протон гидроксида в карбоксильной группе отщепляется легче, чем в спиртах (влияние полярной карбонильной группы). Образование карбоксилат-аниона является причиной увеличения кислотности карбоновых кислот по сравнению со спиртами. На легкость отщепления протона влияет также радикал, связанный с карбоксильной группой. Поэтому карбоновые кислоты дают характерное окрашивание с индикаторами, проводят электрический ток, т. е. являются электролитами. Карбоновые кислоты по сравнению с неорганическими — слабые кислоты. Константа диссоциации у них порядка 10-5. Опыт 2. Образование и гидролиз уксуснокислого железа. Реактивы и материалы: уксуснокислый натрий кристаллический; хлорид железа FeCl3, 0,1 н. раствор. В пробирку помещают несколько кристалликов уксуснокислого натрия, 3 капли воды и 2 капли раствора хлорида железа (III). Раствор окрашивается в желтовато-красный цвет в результате образования железной соли уксусной кислоты. Раствор нагревают до кипения. Тотчас же выпадают хлопья основных солей красно-бурого цвета. Химизм процесса: Уксусная кислота, как и большинство карбоновых кислот,— слабая кислота. Поэтому ее соли легко гидролизуются с образованием основных солей и продуктов водного гидролиза. Опыт 3. Качественная реакция α-оксикислот с хлоридом железа (III) Реактивы и материалы: хлорид железа (III), 0,1 н. раствор; фенол, водный раствор; молочная кислота; уксусная кислота концентрированная. В две пробирки вводят по 1 капле раствора хлорида железа и добавляют по 2 капли раствора фенола. Растворы окрашиваются в фиолетовый цвет. В одну пробирку добавляют 2 капли молочной кислоты, а в другую— столько же капель уксусной кислоты. В пробирке с молочной кислотой появляется зеленовато-желтое окрашивание, в пробирке с уксусной кислотой цвет раствора не изменяется. α-Оксикислоты вытесняют фенол из комплексного фенолята, и фиолетовая окраска раствора переходит в желтую. В присутствии молочной кислоты фиолетовый цвет железного комплекса изменяется на зеленовато-желтый вследствие образования лактата железа (молочнокислого железа): Опыт 4. Цветная реакция салициловой, галловой кислоты и танина с хлоридом железа (Ш) Реактивы и материалы: салициловая кислота, насыщенный раствор; хлорид железа FeCl, 0,1 н. раствор; этиловый спирт 96%-ный; галловая кислота, танин (насыщенные растворы); хлорид железа (III), 0,1 н. раствор. В пробирку вводят 2 капли раствора салициловой кислоты и прибавляют I каплю раствора хлорида железа. Раствор окрашивается в темно-фиолетовый цвет, что указывает на наличие в салициловой кислоте фенольного гидроксила. Добавляют к раствору 4 капли этилового спирта; окраска не исчезает (в отличие от фенола). В одну пробирку вносят 2 капли раствора галловой кислоты, в другую—-2 капли танина,-прибавляют в каж¬дую пробирку по капле раствора хлорида железа. Гал¬ловая кислота с хлоридом железа дает зеленовато-черное окрашивание, а танин — сине-черное. Опыт 5. Разложение муравьиной и щавелевой кислот при нагревании с концентрированной серной кислотой Реактивы и материалы: муравьиная кислота безводная; серная кислота концентрированная (d == 1,84 г/см3); щавелевая кислота кристаллическая; серная кислота (d=l,84 г/см3); баритовая вода, насыщенный раствор. Оборудование: газоотводная трубка. В пробирку приливают 3 капли муравьиной кислоты, 3 капли концентрированной серной кислоты и нагревают смесь в пламени горелки. Бурно выделяется газ. При поджигании газ горит голубоватыми вспышками. Химизм процесса: 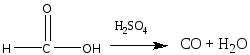 Муравьиная кислота под действием концентрированной серной кислоты разлагается с образованием оксида углерода. Это свойство отличает муравьиную кислоту от остальных карбоновых кислот. В пробирку помещают несколько кристаллов щавелевой кислоты и добавляют 2 капли серной кислоты. Пробирку закрывают пробкой с газоотводной трубкой и нагревают на пламени горелки. Поджигают выделяющийся газ — он горит голубоватыми вспышками. После этого конец газоотводной трубки опускают в баритовую воду. Баритовая вода мутнеет. Химизм процесса:  Под действием концентрированной серной кислоты щавелевая кислота в отличие от других двухосновных кислот разлагается. Опыт 6. Окисление перманганатом калия олеиновой, щавелевой кислот и растительных масел Реактивы и материалы: щавелевая кислота кристаллическая; перманганат калия, 0,1 н. раствор; серная кислота, 0,2 н. раствор; баритовая вода, насыщенный раствор; олеиновая кислота; раствор; карбонат натрия. 0,5 н. раствор. Оборудование: газоотводная трубка. В пробирку помещают несколько кристаллов щавелевой кислоты, добавляют 2 капли перманганата калия и I каплю серной кислоты. Отверстие пробирки закрывают Пробкой с газоотводной трубкой, конец которой опущен и пробирку с баритовой водой. Реакционную смесь нагревают. Розовый раствор перманганата калия обесцвечивается, а в пробирке с баритовой водой появляется белый осадок карбоната. Химизм процесса: В отличие от высших гомологов щавелевая кислота обладает восстановительными свойствами: она количественно окисляется перманганатом калия в кислом растворе. На этой реакции окисления щавелевой кислоты основано ее применение в аналитической химии для установления титра перманганата калия. В пробирку помещают по 2 капли олеиновой кислоты, раствора карбоната натрия и раствора перманганата калия. При встряхивании смеси розовая окраска исчезает. Химизм процесса: 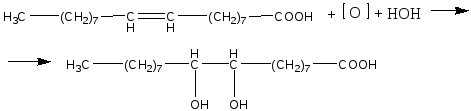 Обесцвечивание бромной воды и раствора перманганата калия указывает на наличие кратной связи в молекуле олеиновой кислоты. Лабораторная работа №13 Сложные эфиры. Жиры. Цель: исследовать химические свойства жиров и сложных эфиров и осуществить качественные реакции на растительные масла. Опыт 1. Окисление растительных масел перманганатом калия Реактивы и материалы: масло растительное; перманганат калия, 0,1 н. раствор; карбонат натрия, 2 н. раствор. В пробирку вводят 2 капли растительного масла (подсолнечного), 2 капли раствора карбоната натрия и 2 капли водного раствора перманганата калия. Встряхивают содержимое пробирки. Малиновая окраска перманганата калия исчезает, что указывает на окисление глицеридов непредельных высших кислот, входящих в состав растительного масла. Химизм процесса: 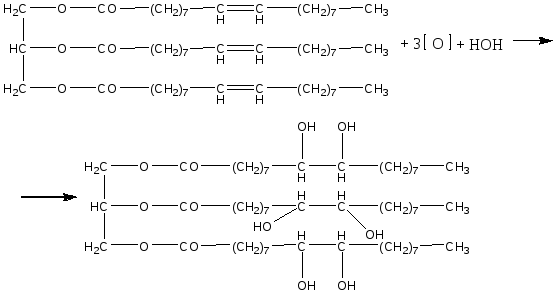 Опыт 2. Получение бензойноэтилового эфира Реактивы и материалы: бензойная кислота, этиловый спирт, серная кислота (d=l,84 г/см3). В пробирку помещают несколько кристаллов бензойной кислоты, прибавляют 4 капли этилового спирта и 2 капли серной кислоты. Содержимое пробирки встряхивают и осторожно нагревают до кипения. Выливают полученную бесцветную жидкость в пробирку с холодной водой. Ощущается характерный запах бензойноэтилового эфира (этилбензоата). Часть бензойной кислоты, не вошедшая в реакцию, выпадает в осадок. Химизм процесса: Опыт 3. Омыление жиров в водно-спиртовом растворе Реактивы и материалы: твердый жир (говяжий, бараний, свиной); едкий натр, 15%-ный спиртовой раствор; хлорид натрия, насыщенный раствор. Оборудование: водяная баня, стеклянная палочка. В широкую пробирку помещают 2 г жира и приливают 6 мл спиртового раствора щелочи. Перемешивают смесь стеклянной палочкой и нагревают на водяной бане до начала кипения. Омыление ведут 3—5 мин, пока жидкость не станет однородной. Для определения конца омыления помещают в пробирку несколько капель полученной смеси, добавляют 4—5 мл воды и нагревают раствор при встряхивании на пламени горелки. Если смесь растворяется в воде нацело, без выделения капель жира, то омыление можно считать законченным. Если выделяются капли жира, то продолжают нагревать смесь на водяной бане еще несколько минут, а затем снова проверяют полноту омыления. К полученной густой жидкости добавляют 6—7 мл насыщенного раствора поваренной соли. Жидкость мутнеет и выделяется слой мыла, всплывающий на поверхность. Дают смеси отстояться, затем охлаждают пробирку холодной водой. Затвердевшее мыло отделяют. Химизм процесса: 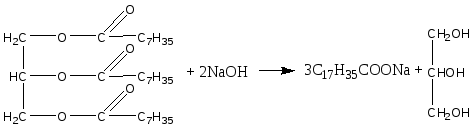 Будучи сложными эфирами, жиры подвергаются гидролизу с образованием глицерина и смеси высших жирных кислот. Большое значение имеет гидролиз жиров, проводимый при нагревании с водой в присутствии едких щелочей. При этом получаются глицерин и смесь солей высших кислот—мыло. Этот процесс называется омылением жиров и применяется в мыловаренном производствею. Опыт 4. Гидролиз спиртового раствора мыла Реактивы и материалы: этиловый спирт; мыло твердое; фенолфталеин, 1 %-ный спиртовой раствор. В сухую пробирку помещают кусочек мыла, 4 капли спирта, энергично взбалтывают и добавляют 1 каплю фенолфталеина. Окраска раствора не меняется. К спиртовому раствору мыла прибавляют по каплям дистиллированную воду. По мере прибавления воды появляется розовое окрашивание. Интенсивность окраски постепенно увеличивается. Химизм процесса: 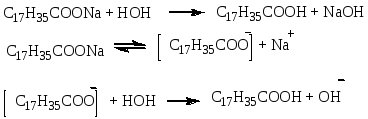 Разбавление спиртового раствора мыла водой вызывает гидролиз мыла. В результате образуются малодиссоциированные жирные кислоты и едкий натр. Розовое окрашивание говорит о появлении в растворе гидроксильных ионов. Реакция водных растворов мыла всегда щелочная. Лабораторная работа №14. Углеводы. Опыт 1. Доказательство наличия гидроксильных групп в глюкозе Реактивы и материалы: глюкоза, 0,5%-ный раствор; едкий нарт, 2 н. раствор; сульфат меди (II), 0,2 н. раствор. В пробирку помещают 1 каплю раствора глюкозы и 5 капель раствора едкого натра. К полученной смеси добавляют 1 каплю раствора сульфата меди (II) и встряхивают содержимое пробирки. Образующийся вначале голубоватый осадок гидроксида меди (II) Сu(ОН)2 мгновенно растворяется, получается прозрачный раствор глюконата меди (II), имеющий слабую синюю окраску:  Моносахариды взаимодействуют с гидроксидами, а также с оксидами тяжелых металлов, подобно многоатомным спиртам. При этом водород гидроксильных групп замещается на металл, и образуются производные моносахаридов типа алкоголятов, называемые сахаратами. Растворение гидроксида меди (II) Сu(ОН)2 доказывает наличие гидроксильных групп в глюкозе. Полученный раствор сохраняют для следующего опыта. Опыт 2. Окисление глюкозы гидроксидом меди (II) в присутствии щелочи. Реактивы и материалы: раствор сахарата меди. К полученному в предыдущем опыте щелочному раствору сахарата меди добавляют 5-6 капель воды (высота слоя жидкости должна быть 10-15 мм). Содержимое пробирки нагревают над пламенем горелки, держа пробирку наклонно, так чтобы нагревалась только верхняя часть раствора, а нижняя оставалась без нагрева (для контроля). При осторожном нагревании до кипения нагретая часть синего раствора окрашивается в оранжево-желтый цвет вследствие образования гидроксида меди (I) СuОН. При более продолжительном нагревании может образоваться красный осадок оксида меди (I) Cu2O Химизм процесса:  Выделяющийся при восстановлении гидроксида меди Сu(ОН)2 кислород идет на окисление глюкозы. Окисление моносахаридов (альдоз и кетоз) в щелочной среде протекает неоднородно и сложно, с разрывом молекулы и образованием более простых молекул, обладающих восстановительными свойствами, например формальдегида, ацетальдегида, муравьиной кислоты и других соединений. Опыт 3. Окисление глюкозы реактивом Фелинга Реактивы и материалы: глюкоза, 0,5%-ный раствор; реактив Фелинга. В пробирку вводят 3 капли раствора глюкозы и каплю реактива Фелинга (щелочного раствора медного алкоголята сегнетовой соли). Держа пробирку наклонно, осторожно нагревают верхнюю часть раствора. При этом нагретая часть раствора окрашивается в оранжево-желтый цвет вследствие образования гидроксида меди (I) СuОН, которая в дальнейшем переходит в красный осадок оксида меди (I) Сu2О. Реактивом Фелинга проводить окисление удобнее, чем гидроксидом меди Сu(ОН)2 в присутствии щелочи, так как при добавлении большего количества сернокислой меди, указано в предыдущем опыте, может пройти побочная реакция образования избытка гидроксида меди (II) Сu(ОН)2 и частично оксида меди (II) СuО черного цвета. При окислении реактивом Фелинга сегнетова соль связывает избыток гидроксида меди (II) Сu(ОН)2 и основная реакция окисления глюкозы протекает быстрее и более четко. Окисление реактивом Фелинга служит качественной реакцией на глюкозу. Опыт 4. Окисление глюкозы аммиачным раствором оксида серебра (реакция «серебряного зеркала») Реактивы и материалы: глюкоза, 0,5%-ный раствор; нитрат серебра, 0,2 н. раствор; аммиак, 2 н. раствор; едкий натр, 2 н. раствор. В пробирку помещают каплю раствора нитрата серебра, 2 капли раствора едкого натра и приливают по каплям раствор аммиака до растворения образовавшегося осадка гидроксида серебра. Затем добавляют 1 каплю раствора глюкозы и слегка подогревают содержимое пробирки над пламенем горелки до начала почернения раствора. Дальше реакция идет без нагревания, и металлическое серебро выделяется на стенках пробирки в виде блестящего зеркального налета. Химизм процесса:  Моносахариды легко окисляются, причем в зависимости от условий получаются разнообразные продукты окисления. При осторожном окислении альдоз в кислой или нейтральной среде образуются альдоновые кислоты(одноосновные многоатомные оксикислоты). Кетозы (например, фруктоза) в этих условиях не окисляются. При окислении моносахаридов в щелочной среде происходит их глубокое расщепление с образованием ряда продуктов, в том числе очень легко окисляющихся. Поэтому моносахариды являются сильными восстановителями. При окислении моносахаридов в щелочном растворе не удается выделить продукты окисления с тем же числом углеродных атомов (как альдоновые кислоты при окисления альцоз в кислой среде). Подобно альдегидам, моносахариды восстанавливают аммиачный раствор оксида серебра с образованием осадка металлического серебра («серебряного зеркала»). Эту реакцию дают как альдозы, так и кетозы. Окисление оксидом серебра в щелочной среде служит качественной реакцией на моносахариды. Примечание. Пробирку для опыта необходимо тщательно вымыть (обезжирить) — прокипятить со щелочью и промыть водой. Если стенки пробирки грязные, то металлическое серебро выделяется в виде черного осадка. Опыт 5. Отсутствие восстанавливающей способности у сахарозы Реактивы и материалы: сахарат меди, раствор. Раствор сахарата меди осторожно нагревают до кипения над пламенем горелки, держа пробирку так, чтобы нагревалась только верхняя часть раствора. Сахароза в этих условиях не окисляется, что указывает на отсутствие в ее молекуле свободной альдегидной группы. |
